Что такое инфекционная иммунология
I
Иммунология (иммун[итет] (Иммунитет) + греч. logos учение)
медико-биологическая наука о защитных свойствах организма, его иммунитете. Изучает молекулярные, клеточные и физиологические реакции организма на Антигены микроорганизмов и продукты животного или растительного происхождения, обладающие антигенными свойствами.
Важнейшими разделами И. являются иммуногенетика (изучает генетическую обусловленность факторов Иммунитета, внутривидовое разнообразие и наследование тканевых антигенов, генетические и популяционные аспекты взаимоотношений макро- и микроорганизма и тканевую несовместимость), иммунохимия (изучает химические основы иммунитета), Иммунопатология. Выделяют также иммунобиологию (теоретическое направление в И., изучающее общебиологические основы иммунитета, его происхождение и эволюцию), И. эмбриогенеза (раздел И. и эмбриологии, исследующий процессы становления анти генной структуры тканей и органов в ходе эмбрионального развития и иммунологические взаимоотношения организма матери и плода), радиационную И. (изучает изменения иммунитета под влиянием ионизирующих излучений), сравнительную И. (исследует иммунный ответ у разных видов животных) и др.
В клинической И. (иммунопатологии) также выделяют ряд разделов и направлений — инфекционную И., неинфекционную И., иммунофармакологию (Иммунофармакология) и др. Иммунология связана с биологией (микробиологией, молекулярной биологией, генетикой, эмбриологией), эндокринологией, патофизиологией, инфекционными болезнями, онкологией, гематологией (иммуногематология), эпидемиологией и другими дисциплинами.
Основные проблемы и направления исследований в И. — Аллергия, Аутоиммунные болезни, И. злокачественных опухолей, трансплантационный иммунитет и иммунологическая толерантность (иммунные реакции реципиента на трансплантат), врожденные и приобретенные формы иммунологической недостаточности, СПИД и др. Клиническая иммунология разрабатывает методы иммунопрофилактики (см. Иммунизация), иммунодиагностики, иммунотерапии (Иммунотерапия).
Иммунологические методы, благодаря их уникальной специфичности и высокой чувствительности, широко применяются в биологии и медицине, в т.ч. при идентификации вирусов и бактерий, при установлении природы аллергенов, при переливании крови, трансплантации органов. В судебной медицине иммунологические методы используют для исследования вещественных доказательств, решения вопросов о спорном отцовстве, материнстве, в антропологии для решения проблем эволюции человеческих рас, их связей и происхождения.
II
Иммунология (Иммуно- + греч. logos учение, наука)
медико-биологическая наука, изучающая реакции организма на антигены, механизмы этих реакций, их проявления, течение и исход в норме и патологии, разрабатывающая методы исследования и лечения, основанные на этих реакциях.
Иммунология инфекционная — раздел И., изучающий иммунный ответ при инфекционных болезнях человека и животных и разрабатывающий методы специфической профилактики, диагностики и лечения этих болезней.
Иммунология молекулярная — раздел И., изучающий молекулярные механизмы иммунного ответа.
Иммунология неинфекционная — совокупность разделов И., изучающих иммунный ответ организма на антигены, не связанные с возбудителями инфекционных и инвазионных болезней, например на изоантигены, опухолевые антигены и пр.
Иммунология радиационная — раздел И., изучающий изменения иммунного ответа под воздействием ионизирующих излучений, разрабатывающий методы их использования для подавления трансплантационного иммунитета, методы восстановления системы иммунитета при лучевых поражениях и т.д.
Иммунология эмбриогенеза — раздел И. и эмбриологии, изучающий процессы становления антигенной структуры тканей и органов в ходе эмбрионального развития и иммунологические взаимоотношения организма матери и плода.
Принято считать, что функция иммунной системы — защита организма от возбудителей заболеваний, чужеродных и потенциально опасных микроорганизмов, проникших в тело человека извне. Однако она также защищает нас изнутри, препятствуя росту опухолей и помогая удалять погибшие клетки. Таким образом, иммунная система постоянно находится в активном режиме. Сбои в ее работе не всегда заметны, но опытный врач обратит внимание на трудноразличимые симптомы и назначит иммунологическое исследование крови, о котором и пойдет речь в нашем обзоре.
Как мы уже говорили, иммунная система защищает человека от опасных микроорганизмов и поддерживает рабочее состояние организма благодаря слаженной работе множества клеток различных типов. К сожалению, в иммунной системе случаются сбои. Они бывают кратковременными, обратимыми, связанными с ослаблением организма, или более серьезными, представляющими угрозу здоровью и требующими лечения.
На основании результатов оценки изменений в клеточном составе и в составе синтезируемых иммунной системой молекул можно выявить заболевание и оперативно начать его лечение.
Что такое иммунологическое исследование и когда оно назначается?
Иммунологическое исследование — комплекс лабораторных анализов, которые позволяют понять, какие нарушения возникли в работе иммунной системы пациента. Оно позволяет оценить сотни показателей. Объектом для изучения обычно является венозная кровь.
Оценка состояния иммунной системы может потребоваться при диагностике и лечении широкого круга заболеваний. А значит — иммунологическое исследование крови могут назначить врачи общей практики, ревматологи, аллергологи, иммунологи, онкологи, гастроэнтерологи.
Причинами назначения анализа могут стать:
- плохое самочувствие;
- утомляемость;
- частые простудные заболевания;
- частые обострения хронических заболеваний и др.
Обычно при неясной клинической картине и неспецифических симптомах (к ним относятся и перечисленные выше) назначается комплексное исследование иммунитета, включающее оценку:
- содержания в крови клеток иммунной системы с различными функциями;
- активности иммунных клеток;
- способности клеток поглощать бактерии и синтезировать антитела.
При подозрении на аллергические заболевания назначается комплекс иммунологических исследований на чувствительность к аллергенам. Набор оцениваемых показателей определится на основании подробного опроса пациента. Если больной замечает, что неприятные симптомы появляются, когда он гуляет за городом в июне, целесообразно провести исследование на чувствительность к пыльце растений. При отсутствии подозрений на причину аллергических реакций, скорее всего, будет назначено исследование на наличие антител к наборам аллергенов (аллергопанели):
- пищевым аллергенам;
- аллергенам, которые вдыхаются с воздухом (пыльца);
- аллергенам, которые окружают человека в его доме (пыль, перо, шерсть животных) и т.д.
Заподозрив у пациента аутоиммунное заболевание, например волчанку, врач немедленно направляет его на иммунологическое исследование на антитела к ядрам собственных клеток в крови.
Как и к любому анализу крови, к иммунологическому исследованию нужна соответствующая подготовка. Некоторые показатели, например, наличие ответа на аллергены, можно оценивать в течение всего дня. Это значит, что прийти в лабораторию и сдать анализы допустимо сразу после визита к врачу. Однако к сдаче крови на описание клеток иммунной системы, оценку ее активности и ряд других показателей нужно подготовиться заранее. За день до сдачи крови избегайте физических нагрузок. Кровь сдается натощак, так что лабораторию придется посетить утром. Чтобы избежать ошибок при подготовке к иммунологическому исследованию, в каждом конкретном случае лучше заранее проконсультироваться у врача, назначившего анализ.
Для иммунологического исследования отбирается кровь из вены. При комплексных исследованиях может понадобиться несколько пробирок.
Срок ожидания бланка с результатами колеблется. Если речь идет об оценке содержания клеток иммунной системы или присутствии антител, результат как правило будет готов через 2–3 дня. Бланк по итогам комплексного исследования на большое количество аллергенов обычно выдается на 10–11 день. При исследовании активности клеток иммунной системы срок ожидания также будет довольно продолжительным — примерно 9 дней.
Самым очевидным показателем состояния иммунной системы является общий уровень лимфоцитов в крови. Его повышение относительно нормы практически говорит о воспалении. Для конкретизации анализа потребуется оценить концентрацию отдельных категорий клеток иммунной системы.
Так, при снижении количества Т-лимфоцитов, вызывающих гибель зараженных вирусом клеток (норма 210–1200 клеток на мл крови), и повышении числа B-лимфоцитов (норма 100–480 клеток на мл), продуцирующих антитела, врач заподозрит аутоиммунное или аллергическое заболевание.
Снижение содержания в крови клеток-регуляторов иммунного ответа — T-хелперов (в норме концентрация 540–1460 на мл) — верный признак иммунодефицита.
Важное диагностическое значение имеет показатель активности иммунных клеток. Если более 20% клеток, отвечающих за уничтожение патогена и регуляцию иммунного ответа, находятся в активированном состоянии, необходимо срочно принимать меры борьбы с восполнением.
В ходе иммунологического исследования также может быть оценена способность клеток к поглощению бактерий. Если 25% клеток теряют ее, речь идет о развитии у взрослого пациента иммунодефицита на фоне тяжелых инфекций, а у ребенка позволяет заподозрить врожденные дефекты.
На основании анализа отдельных показателей достоверный диагноз поставить практически невозможно. Врач принимает во внимание множество факторов. Кроме того, некоторые отклонения от нормы нельзя рассматривать как признак патологии иммунной системы. Например, после тяжелой операции или перенесенной недавно инфекции отклонения от нормальных показателей иммунной системы свидетельствуют об активной работе организма по восстановлению. Все это говорит о том, что самодиагностика на основании результатов в бланках анализа опасна.
Стоимость иммунологического исследования оценивается, исходя из объема работ и применяемого метода. Следует учитывать и цену за взятие крови — в среднем это 200 рублей.
Комплексное исследование крови, позволяющее оценить состояние иммунной системы, обойдется в сумму примерно в 12 000 рублей. При мониторинге лечения обычно назначается скрининговая программа, стоимость которой приблизительно 7500 рублей, или оцениваются отдельные показатели, например лимфоциты, вырабатывающие антитела, что обойдется в сумму около 1300 рублей.
Скрининговое исследование на волчанку стоит порядка 700 рублей, комплексное — около 4000 рублей.
Современная лабораторная диагностика сделала доступным выявление заболеваний еще до развития тяжелых симптомов, хотя сравнительно недавно об этом нельзя было и мечтать. Терапия, назначенная по результатам иммунологических тестов, позволяет если не победить болезнь, то, по крайней мере, предотвратить рецидивы заболевания.

Комплексное иммунологическое исследование обычно называется иммунограммой. Оно позволяет оценить так называемый иммунный статуса пациента. Исследование обычно проводится в комплексе с общим анализом крови. Расшифровать результаты анализов и поставить диагноз может только врач-иммунолог после дополнительного визуального осмотра лимфатических узлов, органов дыхания, слизистых, кожи, оценки состояния суставов и детального изучения анамнеза.
Начало развития иммунологии относится к концу XVIII века и связано с именем Э.Дженнера, впервые применившего на основании лишь практических наблюдений впоследствии обоснованный теоретически метод вакцинации против натуральной оспы.
Открытый Э.Дженнером факт лег в основу дальнейших экспериментов Л.Пастера, завершившихся формулировкой принципа профилактики от инфекционных заболеваний - принцип иммунизации ослабленными или убитыми возбудителями.
Развитие иммунологии долгое время происходило в рамках микробиологической науки и касалось лишь изучения невосприимчивости организма к инфекционным агентам. На этом пути были достигнуты большие успехи в раскрытии причины ряда инфекционных заболеваний. Практическим достижением явилась разработка методов диагностики, профилактики и лечения инфекционных заболеваний в основном путем создания различного рода вакцин и сывороток. Многочисленные попытки выяснения механизмов, обусловливающих устойчивость организма против возбудителя, увенчались созданием двух теорий иммунитета - фагоцитарной, сформулированной в 1887 году И.И.Мечниковым, и гуморальной, выдвинутой в 1901 году П.Эрлихом.
Начало XX века - время возникновения другой ветви иммунологической науки - иммунологии неинфекционной. Как отправной точкой для развития инфекционной иммунологии явились наблюдения Э.Дженнера, так для неинфекционной - обнаружение Ж.Борде и Н.Чистовичем факта выработки антител в организме животного в ответ на введение не только микроорганизмов, а вообще чужеродных агентов. Свое утверждение и развитие неинфекционная иммунология получила в созданном И.И.Мечниковым в 1900 г. учении о цитотоксинах - антителах против определенных тканей организма, в открытии К.Ландштейнером в 1901 году антигенов человеческих эритроцитов.
Результаты работ П.Медавара (1946) расширили рамки и привлекли пристальное внимание к неинфекционной иммунологии, объяснив, что в основе процесса отторжения чужеродных тканей организмом лежат тоже иммунологические механизмы. И именно дальнейшее
расширение исследований в области трансплантационного иммунитета привлекло к открытию в 1953 году явления иммунологической толерантности - неотвечаемости организма на введенную чужеродную ткань.
Стало очевидным, что организм очень точно различает "свое" и "чужое", а в основе реакций, возникающих в нем в ответ на введение чужеродных агентов (вне зависимости от их природы), лежат одни и те же механизмы. Изучение совокупности процессов и механизмов, направленных на сохранение постоянства внутренней среды организма от инфекций и других чужеродных агентов - иммунитета, лежит в основе иммунологической науки (В.Д.Тимаков, 1973 г.).
Вторая половина ХХ века ознаменовалась бурным развитием иммунологии. Именно в эти годы была создана селекционно-клональная теория иммунитета, вскрыты закономерности функционирования различных звеньев лимфоидной системы как единой и целостной системы иммунитета. Одним из важнейших достижений последних лет явилось открытие двух независимо работающих механизмов в специфическом иммунном ответе. Один из них связан с так называемыми В-лимфоцитами, осуществляющими гуморальный ответ (синтез иммуноглобулинов), другой - с системой Т-лимфоцитов (тимусзависимых клеток), следствием деятельности которых является клеточный ответ (накопление высокочувствительных лимфоцитов). Особенно важным является получение доказательств существования взаимодействия этих двух видов лимфоцитов в иммунном ответе.
2) Основные функции Т-системы иммунитета. Антигензависимая и антигеннезависимая дифферинцировка Т-лифоцитов. Строение ТКР.
Основные функции Т-системы иммунитета:
1) Главная функция Т-системы связана с обеспечением клеточной формы иммуного ответа: Т-лимфоциты оказывают цитотоксическое действие на генетически чужеродные клетки (мутантные, опухолевые, и др). Кроме того Т-лимфоциты индуцируют фагоцитарный тип ответа на определенные разновидности антигенов.
2) Т-система играет важную роль в процессе распознавания большинства антигенов и в индукции как клеточного, так и гуморального иммунного ответа.
3) Играет главную роль в регуляции иммунного ответа. Главные Т-хелпер и Т-супрессор.
4) Участвует в формировании и поддержании иммунологической толерантности-спец. Иммунологическая ареактивность.
5) Функция иммунологической памяти
Антигензависимая и антигеннезависимая дифферинцировка Т-лифоцитов.
Антигеннезависимая дифф. Протекает в тимусе, она включает: проникновение предшественников Т-лимфоцитов в тимус, пролиферация тимоцитов, формирование антигенраспознающих рецепторов, положительную и отрицательную селекцию клонов Т-лимфоцитов,формирование различных субпопуляции Т-лимфоцитов.
Антигензависимая дифф. Вышедшие из тимуса функционально незрелые лимфоциты встречаясь с соответсвующим антигеном, распознают его в кооперации с антигенпредставляющими клетками и получив ряд необходимых стимулов, размножаются и дифференцируются в зрелые эффекторные Тлимфоциты.
АГнезависимая дифф.В капсулярную зону тимуса заходят пТ с рецептором СД44, пройдя в кору приобретают они СД2, 3, 4, и ТКР, тут же в этой зоне они подвергаются положительной селекции, некоторые погибают, но некоторые проходят в медуллярную зону, здесь идет взаимодействие с макрофагами и пТ они подвергаются отриццательной селекции идет апоптоз за счет того что срабатывает только один сигнал(чтобы апоптоза не было нужен 2 сигнал) и еще слабые механизмы рецептора Bcl-2 Bcl-XL ведут их к гибел. И только оставяшаяся часть клеток выходит из тимуса наивными лимфоцитами в тимусзависимые зоны перефирических органов иммуной системы.
АГзависимая дифф.
После выхода из тимуса они стречаются на перефирии с селезенкой, регионарными лимфоузлами. Когда АГ попадает в организм их встречает макрофаг,ДК и В-лимфоцит. Вместе с МНС 1 и2 кл они представялют АГ тоесть его эпитоп Т-лимфоцитам. Идет примирование Тлимфоцитов. Первый сигналя получают от ТКР и МНС 1 или 2 кл, а второй сигнал от ИЛ-1, корецептора В-7 АПК, и белка СД28 т-лимфоцита. Те кто не получил погибают. Те кто выжил созревают и могут синтезировать ИЛ-2. А ИЛ-2 стимулирует размножение популяции Т-лимфоцитов. Они становятся зрелыми и могут самостояетльно отвечать на АГ. Часть клеток идут на функцию памяти клеточного иммунитета.
Строение ТКР
Это гетеродимер, состоит из двух полипептидных цепей. Там ковалентная связь. Каждая цепь имеет V вариабельный домен(контакт с АГ) и С постоянный домен. Похож на иммуноглобулины, только ТКР- одновалентнен а имуноглобулины – двухвалент. 2 типа ТКР : 1) гамма и дельта цепи но таких клеток мало всего 5% а вот много 2) альфа бетта цепи их дофига в организме.
3) Дифференцировочные антигены.
На лимфоцитах открыт большой ряд структур, определяющих функциональные различия между лимфоцитами и дающих возможность идентифицировать функционально различные субпопуляции Т- и В- клеток. Эти молекулы, расположенные на поверхностной мембране иммунокомпетентных клеток, названы дифференцировочными антигенами. Дифференцировочные антигены появляются на цитоплазматической мембране клеток в процессе их морфологической дифференцировки. Они маркируют лимфоциты различной степени зрелости. Реально должна существовать возможность выявления дифференцировочных антигенов (маркеров лимфоцитов) с помощью специфических антител. Эта задача решается с помощью получения моноклональных антител, которые реагируют лишь с одним антигеном клеточной мембраны и сгруппированных в кластеры. Гибридонная технология, разработанная Келером и Милштейном в 1975 году, позволила получить большое количество моноклональных антител к поверхностным антигенам лейкоцитов человека. С целью их классификации на международной конференции в Париже в 1982 году была создана единая номенклатура, согласно которой группы антител, обладающих сходными связывающими способностями и распределением в тканях, получили названия кластеров дифференцировки (cluster of differentiation). В дальнейшем, термином CD, стал обозначаться дискретный антиген на мембране клетки, который идентифицируется двумя и более моноклональными антителами.
CD номенклатура, представляет собой хронологически выстроенный список, в котором порядковый номер молекулы в основном характеризует время ее идентификации. Отбор и классификация новых кластеров проходит в рамках номенклатурных комитетов ВОЗ и международного союза иммунологических обществ. Регистрация присвоения соответствующих номеров кластерам, происходит на международных рабочих совещаниях по дифференцировочным антигенам человека.
Антигены Т-лимфоцитов человека .
CD3 –экспрессируются на тимоцитах поздней стадии дифференцировки и практически на всех периферических Т-лимфоцитах. Антитела к антигену оказывают митогенное действие на покоящееся Т-лимфоцитах, индуцируют клональную пролиферацию и секрецию иммуноглобулинов В- лифоцитами, индуцируют секрецию цитокинов( ИЛ 2,интерферон,КСФ).
CD4- маркирует Т-хелперы. Наряду с этим отдельные клоны Т-хелперов
оказывают цитотоксическое действие на клетки-мишени с мембранными антигенамиHLA II класса. Особое значение имеет факт связывания молекулой CD4 оболочечных белков вируса СПИД, что в результате эндоцитоза приводит к проникновению вируса внутрь субпопуляции Т- хелперов.
CD5- антиген маркирует цитотоксические(супрессорные) Т- лимфоциты. Присутствует на всех зрелых Т клетках. К сожалению маркер экспрессируется на определенных стадиях онтогенеза В- клеток. Довольно часто выявляется на клетках больных с В- клеточным типом хронического лимфолейкоза.
CD8 –лимфоциты перефирической крови и тимоциты несут разные формы антигенаCD 8 . Антиген маркирует цитотоксические ( супрессорные) Т-лимфоциты, распознающие антигеныHLA I класса, а отдельные их клоны распознают антигены HLA II класса.
Антигены В- лимфоцитов человека.
CD 20 -экспрессируются практически на всех В - лимфоцитах. Предполагается, что он относится к категории рецепторных структур, воспринимающих 2 сигнал, необходимый для индукции пролиферации В - клеток, или является мостиком для передачи индуцирующего пролиферацию сигнала в цитоплазму клеток.
CD19- Присутствует на всех периферических В клетках, а также на предшественниках В- клеток в костном мозге. Антиген является самым ранним маркером позволяющим отнести лимфоцит к В- клеточному ряду.
CD 10 -Антиген ассоциирован с острым лимфолейкозом. Он четко выражен на пре- В клетках. Имеет значение для идентификации ни Т /ни В лейкозов.
БИЛЕТ
Филогенез. На низших этапах эволюционного развития защитные реакции носят неспецифический характер. У простейших они ограничиваются поглощением и ферментативным расщеплением, у примитивных многоклеточных имеются защитные барьеры и специализированные фагоциты. Лимфоидные клетки, способные к распознаванию антигена и обладающие иммунологической памятью, появляются только у низших хордовых. У высших позвоночных и человека в защите организма принимают участие как гуморальный и клеточный иммунитет, так и факторы неспецифической защиты.
Иммунитет у беспозвоночных — гуморальные и клеточные факторы, фагоцитоз, зачатки специфических иммунных процессов, роль молекул адгезии, лектинов. Зарождение антигенспецифического распознавания и адаптивного иммунного ответа — происхождение суперсемейства иммуноглобулинов, V-генов, антител, антигенраспознающих рецепторов. Формирование процесса презентации антигенов — происхождение молекул главного комплекса гистосовместимости, эволюция процессинга антигенов, системы костимуляции.
Эволюция системы иммунитета у позвоночных — органы и клетки иммунной системы, тимус, сумка Фабриция и другие центральные лимфоидные органы и структуры. Эволюция клеточного и гуморального иммунитета, противоинфекционной и противоопухолевой защиты. Уникальность иммунных процессов и их эволюционные истоки. Формирование факторов антигенспецифического адаптивного иммунитета в эволюции.
Онтогенез.
Лимфоциты на ранних этапах кроветворения образуются в желточном мешке. Затем на 4-5-й неделе внутриутробного развития их основным источником становится печень , а еще позже - костный мозг . В-лимфоциты проходят антигеннезависимую дифференцировку в костном мозге. Здесь на их поверхности появляются IgM . Затем они покидают костный мозг и заселяют периферические органы иммунной системы . Контакт с антигеном стимулирует антигензависимую дифференцировку В-лимфоцитов в плазматические клетки , способные к выработке антител . Плазматические клетки плода начинают секретировать IgM примерно на 10-й, IgG - на 12-й и IgA - на 30-й неделе внутриутробного развития. У новорожденного антитела представлены в основном материнскими IgG, уровни IgM и IgA, если не было внутриутробной инфекции, незначительны. Динамика уровня иммуноглобулинов в сыворотке в зависимости от возраста представлена на рис. 1.2 . Предшественники Т-лимфоцитов на 6-8-й неделе внутриутробного развития заселяют тимус, где происходят рост, антигеннезависимая дифференцировка и гибель Т-лимфоцитов, направленных против собственных антигенов. Активность этих процессов возрастает, становясь максимальной в период полового созревания.
Фагоциты так же, как и лимфоциты, на ранних этапах кроветворения образуются желточном мешке. У двухмесячного плода их немного, и представлены в основном миелоцитами и макрофагами соединительной ткани . На 4-5-м месяце внутриутробного развития в селезенке и лимфоузлах появляются моноциты , количество которых впоследствии возрастает. Нейтрофилы новорожденных , родившихся в срок, проявляют нормальную фагоцитарную активность, нейтрофилы недоношенных фагоцитируют слабее. Способность нейтрофилов и моноцитов новорожденных к хемотаксису выражена слабее, чем у взрослых.
Начало синтеза компонентов комплемента во внутриутробном периоде по времени почти совпадает с началом синтеза иммуноглобулинов. Компоненты комплемента не проникают через плаценту, поэтому их концентрация в крови новорожденного невелика.
Формирование в онтогенезе миелоидных и лимфоидных рядов гемопоэза — роль желточного мешка, печени эмбрионов, тимуса, костного мозга. Миграции клеток иммунной системы в онтогенезе: перемещения стволовых кроветворных клеток, волны заселения тимуса и эмиграции Т-клеток из тимуса. Изменение реакции лимфоцитов на стимуляцию в процессе онтогенеза — соотношение пролиферации и апоптоза, анергии и иммунного ответа.
Иммунные процессы в перинатальном периоде — перестройки в иммунной системе, формирование основных типов иммунных процессов, формирование клеток памяти к основным антигенам среды обитания, автономизация периферического звена иммунной системы. Старение иммунной системы — инволюция тимуса и факторы, ее вызывающие, динамика гормонов тимуса, цитокинов, возрастной дисбаланс Th1/Th2-регуляции иммунных процессов, старческий иммунодефицит и его последствия.
Иммунологические анализы
Общее описание
Иммунологические исследования — диагностические методы, базирующиеся на специфическом взаимодействии антигенов и антител. Широко применяются для лабораторных анализов инфекционных и паразитарных заболеваний, а также достоверного определения групп крови, нарушений гормонального фона, тканевых и опухолевых антигенов, распознавания аллергии и аутоиммунных процессов, видовой принадлежности белка, а также беременности.
 | 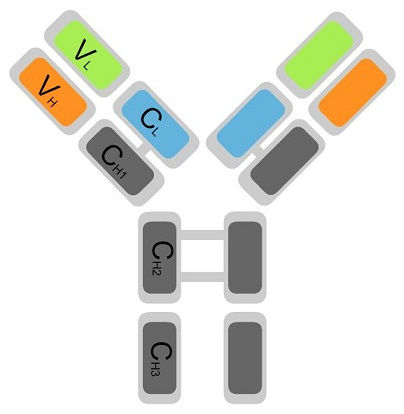 |
| Забор крови для иммунологического исследования | Строение иммуноглобулина |
- врожденные или приобретенные в ходе жизни иммунодефицитные состояния;
- аллергические заболевания, не реагирующие на эффективную терапию;
- инфекционные болезни хронического и вялотекущего типа;
- аутоиммунные и онкологические болезни;
- до и после операции по пересадке органов;
- подготовка к серьезным хирургическим вмешательствам;
- оценка эффективности разработанного лечения и анализа побочных явлений при назначении препаратов, влияющих на иммунитет.
Иммуноглобулин А (IgA) — это антитела, являющиеся защитным фактором слизистых оболочек человеческого организма. Входят в состав фракции б-глобулинов, составляют около 15% от общего количества иммуноглобулинов сыворотки крови. Содержатся в молоке, слюне, слезной жидкости, секретах слизистых оболочек.
- хронические заболевания печени;
- системная красная волчанка;
- ревматоидный артрит;
- миеломная болезнь;
- гломерулонефрит;
- алкогольное поражение внутренних органов.
- физиологическое снижение у детей младше 6 месяцев;
- цирроз печени;
- лучевая болезнь,
- отравления (толуол, бензин, ксилол);
- применение цитостатиков и иммунодепрессантов.
Иммуноглобулин Е (IgE) принимает участие в аллергических реакциях и противопаразитарном иммунитете.
- паразитарные инвазии (аскариды, нематоды, токсоплазма, шистосома, эхинококки, трихинелла, амебы);
- аллергический ринит;
- крапивница;
- сенная лихорадка;
- аллергические заболевания;
- бронхиальная астма.
Иммуноглобулин G (IgG) обеспечивает пассивный иммунитет.
- ревматизм;
- системная красная волчанка;
- ревматоидный артрит;
- миеломная болезнь;
- ВИЧ;
- инфекционный мононуклеоз;
- острые и хронические инфекционные заболевания.
- физиологическое снижение у детей младше 6 месяцев,
- лучевая болезнь,
- лечение цитостатиками и иммунодепрессантами,
- отравления (толуол, бензин, ксилол),
- цирроз печени.
Иммуноглобулин М (IgM) входит в состав фракции у-глобулинов. Первым появляется после введения антигена. К IgM относятся противоинфекционные антитела, антитела групп крови, ревматоидный фактор.
- острые грибковые, паразитарные, вирусные и бактериальные инфекции,
- гепатит и цирроз печени,
- ревматоидный артрит,
- системная красная волчанка,
- кандидоз,
- системные васкулиты.
- физиологическое снижение у детей младше 6 месяцев,
- спленэктомия,
- лучевая болезнь,
- лечение иммунодепрссантами и цитостатиками,
- отравления (толуол, ксилол).
Аллоиммунные антитела — это антитела к клинически наиболее важным эритроцитарным антигенам, в первую очередь, к резус-фактору.
Показания к назначению анализа:
- беременность (профилактика резус-конфликта),
- наблюдение за беременными с отрицательным резус-фактором,
- невынашивание беременности,
- гемолитическая болезнь новорожденных,
- подготовка к переливанию крови.
Антинуклеарный фактор при определении совместно с антителами к ДНК является диагностические критерием системной красной волчанки.
- системная красная волчанка,
- хронический гепатит,
- ревматоидный артрит,
- волчаночный нефрит,
- системные васкулиты.
Антистрептолизин-О — маркер наличия стрептококковой инфекции в организме, является лабораторным критерием ревматизма.
Показания к назначению анализа:
- острый гломерулонефрит,
- ревматизм (уровень повышен у 85%),
- рожистое воспаление,
- скарлатина,
- стрептококковые инфекции (ангина, хронический тонзиллит, пиодермия, остеомиелит).
Антиспермальные антитела (ИФА) — дополнительный тест в диагностике иммунологических причин бесплодия у мужчин и женщин. Антиспермальные антитела обнаруживаются в крови, в слизи шейки матки, семенной плазме, на поверхности сперматозоидов. У мужчин лучше определять антиспермальные антитела в сперме. Сомнительные (близкие к пороговым) значения: 55-60 Ед./мл. В подобных случаях исследование целесообразно повторить через 2 недели.
Показания к назначению анализа:
- необъяснимое бесплодие супружеской пары,
- изменения спермограммы.
Повышение значений: вероятный фактор бесплодия.
MAR-тест (Mixed agglutination reaction) — количественное определение наличия/отсутствия антиспермальных антител класса А с использованием латексных частиц на поверхности сперматозоидов. Тест определяет отношение (процент) нормальных неподвижных сперматозоидов, но покрытых антиспермальными антителами, к общему количеству сперматозоидов.
Показания к назначению анализа:
- бесплодный брак,
- предполагаемое иммунологические бесплодие у мужчин.
- высокая вероятность данной причины мужского бесплодия.
Антитела к тиреоглобулину (АТ-ТГ) — антитела к предшественнику тиреоидных гормонов.
Показания к назначению анализа:
- новорожденные, высокий уровень антител к тиреоглобулину у матери;
- взрослые: хронический тиреоидит Хашимото, диагностика гипотиреоза, зоб, диффузный токсический зоб (болезнь Грейвса).
- хронический тиреоидит Хашимото,
- идиоматический гипотиреоз,
- аутоиммунный тиреоидит,
- диффузный токсический зоб (болезнь Грейвса),
- синдром Дауна (слабо положительный результат),
- синдром Тернера.
Антитела к тиреоидной пероксидазе (AT-ТПО) — антитела к ферменту клеток щитовидной железы, участвующему в синтезе тиреоидных гормонов, их присутствие — показатель агрессии иммунной системы по отношению к собственному организму. Это наиболее чувствительный тест для обнаружения аутоиммунного заболевания щитовидной железы.
Показания к назначению анализа:
- новорожденные: повышенные показатели гормонов щитовидной железы, высокий уровень АТ-Т ПО или болезнь Грейвса у матери;
- взрослые: диагностика нарушений уровня гормонов щитовидной железы, зоб, болезнь Грейвса (диффузный токсический зоб), хронический тиреоидит Хашимото, офтальмопатия: увеличение окологлазных тканей (подозрение на эутиреоидную болезнь Грейвса — при нормальных показателях уровня гормонов щитовидной железы).
- болезнь Грейвса (диффузный токсический зоб),
- узловой токсический зоб,
- подострый тиреоидин (де Кревена),
- послеродовая дисфункция щитовидной железы,
- хронический тиреоидит Хашимото,
- аутоиммунный тиреоидит,
- нетиреоидные аутоиммунные заболевания.
HLA-типирование 2 класса (human leucocyte antigens) — антигены тканевой совместимости (cиноним: MHC — major histocompatibility complex — главный комплекс гистосовместимости). HLA-фенотип определяется методом полимеразной цепной реакции (ПЦР).
Это исследование не является рутинным (массовым) и выполняется для диагностики только в сложных случаях:
- оценка риска развития ряда заболеваний с известной генетической предрасположенностью,
- выяснение причин бесплодия,
- выяснение причин невынашивания беременности (привычных выкидышей),
- выяснение причин иммунологической несовместимости,
- трансплантация органов и тканей,
- оценка риска сахарного диабета 1 типа при семейной отягощенности.
НLА антигены 1 класса представлены на поверхности практически всех клеток организма, в то время как белки тканевой совместимости 2 класса располагаются на клетках иммунной системы, макрофагах, эпителиальных клетках.
Благоприятный прогноз пересадки органа выше при наибольшем сходстве донора и реципиента по антигенам тканевой совместимости.
Нормы
Читайте также:


