Что такое костная аутопластика при эндопротезировании
Костная пластика при эндопротезировании тазобедренного сустава.
В.В.Соколов, А.Л.Логунов, Н.В.Загородний
Применение костных трансплантатов в эндопротезировании тазобедренного сустава всегда было оправдано при наличии дефектов, связанных с дисплазиями вертлужной впадины, лизисом кости при ревматоидном артрите, дефектах, возникших при асептической нестабильности эндопротеза. В таких случаях применяется как структурный, так и измельченный костный материал.
В литературе имеются данные о высоком проценте нестабильности вертлужного компонента (46%) у пациентов, которым был применен крупный структурный трансплантат для покрытия гнезда эндопротеза. Как выражаются сами авторы, данная нестабильность наступает “внезапно и катастрофически” .
Имеются также противоположные данные, демонстрирующие весьма обнадеживающие результаты - от 0 до 5% асептической нестабильности гнезда вертлужной впадины на отдаленных сроках наблюдения.
Первичная протрузия вертлужной впадины при ревматоидном артрите или при других видах остеоартроза весьма успешно восстанавливается при помощи укрепляющих колец с использованием костных трансплантатов в виде стружки или пластин, в зависимости от дефекта. До 82% хороших результатов по данным литературы получены при применении антипротрузионного кольца Мюллера на сроках наблюдения до 8 лет.
Большинство ревизионных операций неизбежно требуют костную пластику либо вертлужной впадины, либо проксимального отдела бедра. До 4% бесцементных вертлужных компонентов эндопротезов требуют ревизионного вмешательства на сроках после 4 лет, что свидетельствует об отличных результатах применения бесцементной фиксации.
Несмотря на данные сообщения, становится ясно, что имеются определенные условия, при которых бесцементные компоненты демонстрируют высокий уровень нестабильности. В таких случаях антипротрузионные кольца в комбинации с костной пластикой могут предотвратить миграцию гнезда впадины и рассматриваться как метод выбора, если так называемая биологическая фиксация компонента оказалась неудовлетворительной.
Успешное применение структурных трансплантатов при восстановлении значительных дефектов вертлужной впадины было описано во многих публикациях.
Применение костной пластики проксимального отдела бедра методом импакции костной стружки, а также кортикальных трансплантатов доказало свою эффективность.
Целью этой статьи является анализ и представление результатов нашего собственного опыта применения техники ауто- и аллопластики при эндопротезировании тазобедренного сустава у разных групп пациентов.
Шестьдесят два пациента (70 тазобедренных суставов) были оперированы по поводу диспластического коксартроза. Все случаи дисплазии относились к первой стадии по классификации Dunn. Пять пациентов были мужчины, 57 - женщины. Максимальные сроки наблюдения составляли 30 месяцев. Средний возраст пациентов - 45 лет. Полная костная интеграция трансплантата наблюдалась у 100 % больных уже после 8 - 12 месяцев.
Во всех случаях применялись цементные эндопротезы фирмы Sulzer Beznoska Biomet.
Структурные аутотрансплантаты (половина головки бедра) использовались для создания необходимой формы покрытия гнезда вертлужной впадины, обеспечивающей адекватную опору. Трансплантат фиксировался одним или двумя винтами, направленными перпендикулярно линии соединения с тазовой костью.
Костные трансплантаты покрывали от 15% до 45% поверхности вертлужного компонента. Отмечалась незначительная резорбция трансплантата в 15% случаев. Оценка проводилась по методике Gerber & Harris. Ни один из трансплантатов не был фрагментирован или сломан.
Четверо пациентов имели послеоперационное осложнение в виде вывиха эндопротеза. Лечение проводилось путем закрытого вправления вывиха у двух больных и у одного было применено открытое вправление в связи с интерпозицией винта в гнездо вертлужной впадины. Один больной имел осложнение в виде глубокой инфекции. Дважды проводилось ревизионное вмешательство, но окончательно был оставлен ложный сустав вследствие неудачных попыток спасти эндопротез.
Сращение костного трансплантата было очевидно даже в случаях значительного остеопороза у пожилых пациентов. Ни один из наблюдаемых больных не нуждался в дополнительной опоре при ходьбе при осмотре их на отдаленных сроках наблюдения.
Семьдесят пациентов (76 тазобедренных суставов; 56 пациентов были женского пола, 20 - мужского) были оперированы по поводу первичной протрузии вертлужной впадины с применением антипротрузионного кольца Мюллера в комбинации с костной пластикой в виде фрагментированной кости (стружки) или костных пластин, закрывающих дефект дна вертлужной впадины. Данная методика позволяет восстановить костную массу дна вертлужной впадины и предотвратить медиальную миграцию вертлужного компонента.. 45 больных страдали ревматоидным артритом, у остальных был выявлен остеоартроз. Средний возраст больных составил 57 лет. После 24 месяцев наблюдения ни одно гнездо вертлужной впадины не отмечало признаков явной или потенциальной нестабильности, на рентгенограммах наблюдалась полная интеграция костных трансплантатов.
Двадцать пациентов с асептической нестабильностью эндопротезов были оперированы с применением костной пластики. 18 из них были женщины и 2 - мужчины. Средний возраст больных составил 61 год.
Для оценки дефицита костной ткани мы пользовались классификацией Paproski для того, чтобы до операции определить необходимость и характер костной пластики, в особенности если костный банк в больнице отсутствует и необходимо заказывать трансплантат в специализированной лаборатории.
Четыре пациента имели 3А тип ацетабулярного дефекта, где костная стружка и пластинчатые трансплантаты были использованы в комбинации с кольцом Мюллера. Последнее фиксировалось 3 - 4 винтами для достижения прочной фиксации всей этой конструкции к материнской кости. 14 случаев были отнесены к 2А типу дефектов, где применялась костная стружка и кольцо Мюллера. Двое больных были отнесены к 2В типу дефектов вертлужной впадины. В этих случаях кольцо Мюллера не применялось, но мощный структурный трансплантат был необходим для формирования верхнего края вертлужной впадины. Один из этих больных был оперирован в нашей клинике два года назад по поводу диспластического коксартроза. Во время первой операции костная пластика крыши вертлужной впадины не проводилась, так как имелся мощный опорный экзостоз. Но через два года этот пациент начал отмечать увеличение хромоты и укорочение оперированной конечности. На рентгенограмме были выявлены перелом экзостоза и краниальная миграция гнезда вертлужной впадины.
У четырех пациентов применялись структурные костные трансплантаты для закрытия дефектов проксимального отдела бедра. Эти случаи имели 2В тип дефекта через 28 лет после операции с применением эндопротеза Сиваша. Оба компонента эндопротеза были нестабильны, но, несмотря на это, крайне трудно было их удалить. У одного пациента гнездо протеза мигрировало более чем на 4 см краниально, но относительно легко было удалено, в то время как ножка эндопротеза была полностью стабильна и ее невозможно было удалить из-за костных мостов, вросших в окно эндопротеза. Боковая стенка бедра была открыта при помощи осцилляторной пилы и костные мосты были разрушены, только после этого ножку удалось удалить.
Мягкие ткани вокруг головок эндопротезов у этих больных были без признаков металлоза. Другие случаи, где производилась ревизия эндопротезов Сиваша, имели измененные ткани вокруг в виде черной импрегнации даже тазовых костей.
У одного пациента имелся значительный дефект проксимального отдела бедра, который был замещен значительных размеров аллотрансплантатом, повторяющим полностью форму дефекта бедра и фиксированным проволочными швами. После 12 месяцев остеоинтеграция отмечалась на контрольной рентгенограмме.
При ревизии бедренных компонентов мы использовали бесцементную ножку Вагнера, прямые ножки Мюллера, СИНКО, ИСКО-РУДН.
Костная пластика в эдопротезировании тазобедренного сустава несомненно является весьма успешным методом, улучшающим результаты лечения.
В случаях дисплазии тазобедренного сустава имеются некоторые альтернативы костной пластике, такие как ввинчивающаяся чашка Zwai-Muller, которая применяется без формирования костного навеса, но по данным некоторых авторов эти чашки при ревизионных случаях демонстрируют слабые результаты. Имеются публикации об успешном применении сверхмалых размеров гнезд вертлужных впадин для достижения полного костного покрытия. Несмотря на некоторые данные о высоком уровне неудач при применении костной пластики верхнелатерального аспекта вертлужной впадины (46%), имеются совершенно противоположные результаты, где отмечаются всего до 5% нестабильностей вертлужного компонента на сроках наблюдения в 4 года. Наши собственные результаты подтверждают последнее со 100% успехом после операции через 2 года.
Преимущества восстановления вертлужной впадины с применением кольца Мюллера описаны во многих клинических публикациях. Как рекомендует сам автор, а также по рекомендации Charnley, полость под антипротрузионным кольцом заполняется костным цементом. Однако последние сообщения доказывают успешность применения костной пластики для заполнения полости под кольцом и результаты весьма обнадеживающие после 4 лет наблюдения.
В нашем исследовании мы получили результаты, соответствующие вышеизложенным, и по отдаленным срокам надеемся представить данные в следующих публикациях.
При ревизионном эндопротезировании с применением цемента имеется высокий процент нестабильностей вертлужного компонента, достигающий 30% после относительно короткого периода наблюдений (4 - 7 лет). Применение костной пластики для восстановления нормального центра вращения сустава и биомеханики конечности позволяет улучшить качество ревизионных операций.
В случаях, когда имеется значительный костный дефект при ревизии нестабильного эндопротеза Сиваша, применение костной пластики в особенности имеет практическое значение. Применение крупных структурных костных трансплантатов вполне оправдано в случаях, если материнская кость не может обеспечить стабильность компонентов.
Некоторые публикации представляют пессимистичные результаты применения крупных костных трансплантатов, в то время как другие авторы доказывают обратное с 97%-ным успешным результатом при наблюдении в течение 6 лет.
В нашей небольшой серии наблюдений за поведением крупных костных трансплантатов, примененных в ревизионном эндопротезировании, отмечается 100%-ная остеоинтеграция через 24 месяца после операции, что является весьма обнадеживающим фактом, позволяющим рекомендовать данный метод для широкого применения в подобных клинических случаях.
По материалам сайта Клиники Ортопедии и Травматологии ГКБ № 13 г. Москвы
Изобретение относится к медицине, а именно к травматологии и ортопедии, и может быть использовано для первичного эндопротезирования тазобедренного сустава при чрезвертельных переломах бедренной кости.
Известен способ костной пластики дефекта медиальной стенки проксимального отдела бедренной кости при ревизионном эндопротезировании тазобедренного сустава (Пат. РФ №2464948 от 26.04.2011), включающий использование в качестве пластического материала аллотрансплантатов в виде костной крошки или чипсов.
Недостатком данного способа является то, что эти аллотрансплантаты могут вызывать ряд осложнений: инфекции, асептический некроз.
Наиболее близким по технической сущности к заявляемому является способ реконструкции проксимального отдела бедренной кости, включающий введение в бедренный канал эндопротеза с заполнением костным материалом зазора между поверхностью канала и эндопротеза (Заявка на изобр. №2002116308 от 17.06.2002). При этом в качестве костного материала используют костный трансплантат, который формируют из медиальной части резецированного проксимального отдела бедренной кости и вводят в бедренный канал с медиальной стороны бедренной кости после введения в него ножки эндопротеза на глубину, не достигающую на 3-4 см установочной глубины посадки, и после введения в него костного материала с усилием досылают эндопротез до заданной глубины, а затем устанавливают на поверхность бедренной кости в месте расположения костного трансплантата кольцевидный фиксатор.
Недостатком способа, выбранного в качестве прототипа, является интрамедуллярное введение костного трансплантата в бедренную кость, что может провоцировать дополнительную травматизацию диафиза бедренной кости и ее дальнейший перелом.
Задачей настоящего изобретения является обеспечение стабильности проксимального отдела бедра и предупреждение развития осложнений в процессе имплантации ножки эндопротеза при чрезвертельных переломах, а также в течение всего послеоперационного периода.
Технический результат поставленной задачи достигается тем, что в способе костной аутопластики проксимального отдела бедра при эндопротезировании чрезвертельных переломов, включающем установку костного аутотрансплантата и дополнительную фиксацию проволочной петлей трансоссально за большой вертел, костный аутотрансплантат моделируют интраоперационно из удаленной головки и медиального отдела шейки бедренной кости.
Новым в предлагаемом способе является устранение костного дефекта заднемедиальной стенки проксимального отдела бедренной кости путем установки отмоделированного интраоперационно из удаленной головки и шейки бедра костного аутотрансплантата. Стабильность ножки эндопротеза в проксимальном отделе обеспечивается за счет воссоздания заднемедиальной части проксимального отдела бедренной кости, на которую распространяется основная осевая нагрузка всей нижней конечности при ходьбе.
Предлагаемый прием также создает условия для консолидации костного трансплантата вокруг бесцементной части ножки эндопротеза в послеоперационном периоде за счет плотного прилежания костного трансплантата к шероховатой поверхности проксимального отдела ножки эндопротеза. Это позволяет избежать раннего расшатывания ножки эндопротеза в послеоперационном периоде.
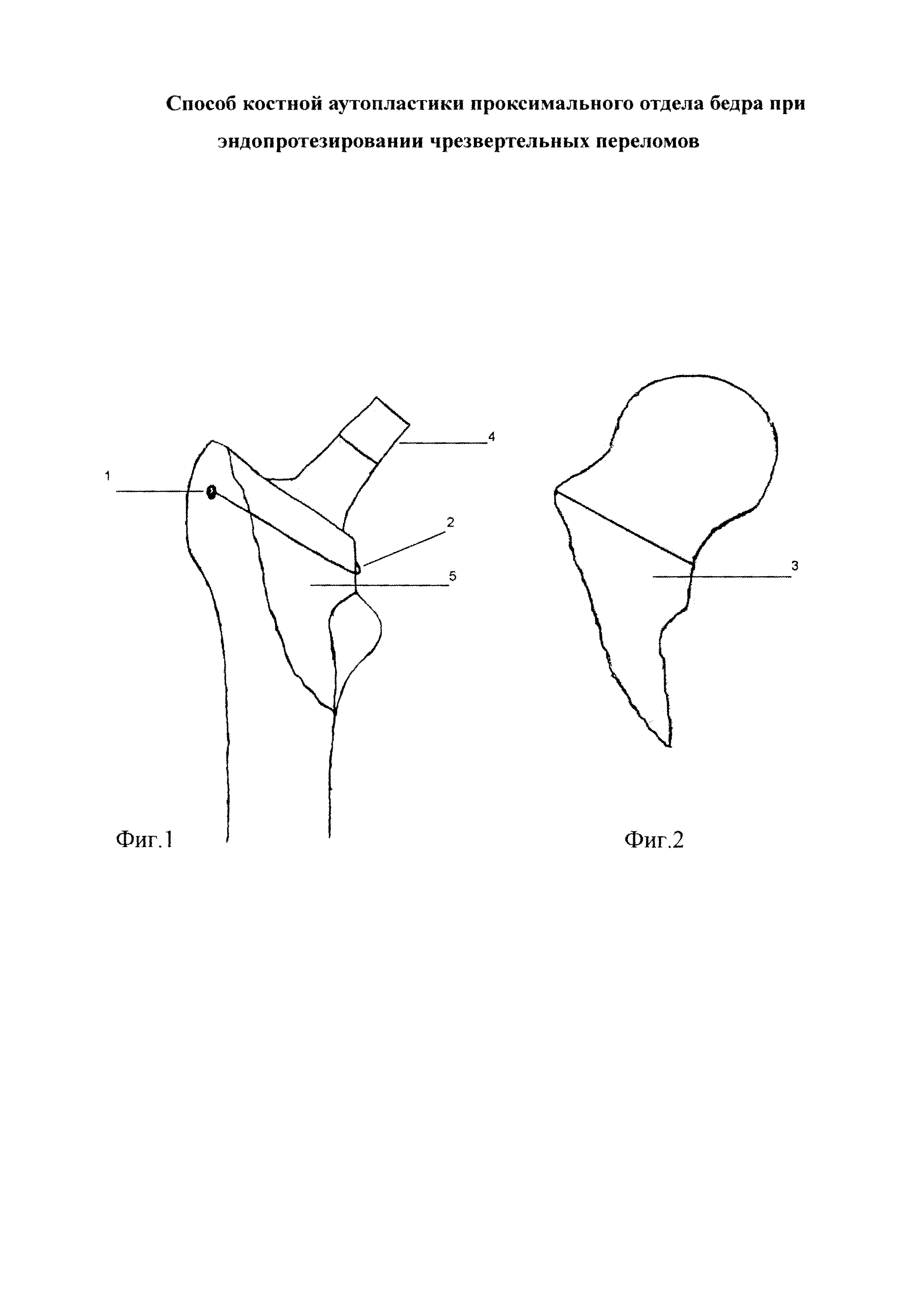
Осуществление заявляемого способа показано на фиг. 1, где изображена воссозданная заднемедиальная стенка проксимального отдела бедренной кости, затянутая серкляжной проволокой, вокруг ножки эндопротеза. На фиг. 2 показана удаленная головка и часть шейки бедра.
После осуществления хирургического доступа к тазобедренному суставу и проксимальному отделу бедренной кости производится остеотомия шейки бедренной кости и удаление головки и части шейки бедра. Затем через отломки большого вертела формируется узкий канал 1 при помощи сверла диаметром не более 2,8 мм. В канал вводится проволочный серкляж 2, затем один конец проволоки огибает заднюю поверхность проксимального отдела бедра и выводится спереди над малым вертелом. Второй конец проволоки выводится на переднюю поверхность бедренной кости. Потом из удаленной части головки и шейки бедра выпиливается дугообразный участок 3 наиболее прочного медиального отдела по размеру и величине дефекта заднемедиальной стенки проксимального отдела бедренной кости. Затем после предварительной подготовки устанавливается ножка 4 эндопротеза (как бесцементной, так и цементной фиксации), а костный аутотрансплантат 5 располагают максимально плотно к ножке эндопротеза и фиксируют проволочным серкляжем 2.
Больная Г., 74 г. поступила в СПб НИИ скорой помощи им. И.И. Джанелидзе в экстренном порядке. Травму получила в результате падения на улице. После клинико-рентгенологического обследования установлен клинический диагноз: закрытый оскольчатый чрезвертельный перелом левой бедренной кости со смещением отломков типа А2.2. Сопутствующие заболевания: ИБС, атеросклеротический кардиосклероз, ГБ II стадии, сахарный диабет 2-го типа компенсированный. По статусу, предшествовавшему травме, пациент был отнесен к группе ASA IV (тяжелые инвалидизирующие заболевания). На 5-е сутки пациентке выполнено тотальное гибридное эндопротезирование левого тазобедренного сустава с реконструкцией заднемедиальной стенки бедренной кости вокруг проксимальной части ножки эндопротеза по заявляемому способу. Осевая нагрузка на оперированную конечность начата со 2-го дня после операции. Через 1 месяц функциональные показатели по шкале Харриса - 86 баллов. Результаты оцениваются как хорошие.
Применение данного способа позволяет устранить костный дефект заднемедиальной стенки проксимального отдела бедренной кости, появляющийся как в результате перелома, так и после удаления головки и шейки бедренной кости в процессе операции. Также данный способ обеспечивает стабильность проксимального отдела бедренной кости при имплантации ножки эндопротеза как бесцементной, так и цементной фиксации и позволяет предотвратить развитие осложнений в послеоперационном периоде: раннее расшатывание ножки эндопротеза, вывихи головки эндопротеза.
Другим преимуществом данного способа является биологическая совместимость костного аутотрансплантата с бесцементной поверхностью ножки эндопротеза, что позволяет добиваться хорошей остеоинтеграции ножки эндопротеза в его проксимальном отделе. Также данный способ позволяет проводить раннюю осевую нагрузку на оперированную нижнюю конечность, что сокращает сроки стационарного и реабилитационного лечения.
Способ костной аутопластики заднемедиальной стенки проксимального отдела бедра при эндопротезировании чрезвертельных переломов, включающий установку костного аутотрансплантата, отличающийся тем, что интраоперационно моделируют дугообразный костный аутотрансплантат по размеру дефекта из удаленной головки и медиального отдела шейки бедренной кости, костный аутотрансплантат располагают максимально плотно к ножке эндопротеза и фиксируют проволочной петлей, наложенной трансоссально за большой вертел.
Аннотация научной статьи по клинической медицине, автор научной работы — Марков Д.А., Зверева К.П., Белоногов В.Н., Бычков А.Е., Трошкин А.Ю.
Похожие темы научных работ по клинической медицине , автор научной работы — Марков Д.А., Зверева К.П., Белоногов В.Н., Бычков А.Е., Трошкин А.Ю.
BONE AUTOPLASTY OF ACETABULAR ROOF IN TOTAL ARTHROPLASTY FOR PATIENTS WITH DYSPLASTIC COXARTHROSIS
Currently, the main method of dysplastic coxarthrosis treatment is total hip replacement (THR). However, the hypoplasticity of the acetabulum and bone defects of the roof significantly decreases the surgical results and increases complications. The most promising method to remove this problem is using of bone grafts for the acetabular roof. Objective to analyze the results of total hip replacement with use of bone autoplasty of the acetabular roof in patients with dysplastic coxarthrosis of the type 1-2 according to Hartofilakidis. Materials and methods. During the period from January 1, 2014 to December 31, 2016, we examined and operated 34 patients with dysplastic coxarthrosis of types 1-2 according to Hartofilakidis. All patients underwent THR, the feature of which was the bone autograft from the femoral head and the installation of the acetabular component of press-fit fixation. The results of treatment were evaluated 1 year after the surgery with use of clinical and X-ray methods, and VAS, Harris Hip Score, SF-36. Statistical processing of the data was carried out with a package of add-ins for Microsoft Excel AtteStat 12.0.5. Results. The results of the clinical examination showed a statistically significant increase in the volume of movements in the operated joint 1 year after the surgery (p dysplastic coxarthrosis of Hartofilakidis 1-2 types is an effective technique that allows increasing the coverage of the acetabular component and improving the results of surgical treatment.
Статья поступила в редакцию 01.03.2018 г.
КОСТНАЯ АУТОПЛАСТИКА КРЫШИ ВЕРТЛУЖНОЙ ВПАДИНЫ ПРИ ТОТАЛЬНОМ ЭНДОПРОТЕЗИРОВАНИИ У ПАЦИЕНТОВ С ДИСПЛАСТИЧЕСКИМ КОКСАРТРОЗОМ
BONE AUTOPLASTY OF ACETABULAR ROOF IN TOTAL ARTHROPLASTY FOR PATIENTS WITH DYSPLASTIC COXARTHROSIS
Марков Д.А. Зверева К.П. Белоногов В.Н.
Бычков А.Е. Трошкин А.Ю.
Саратовский государственный медицинский университет
им. В.И. Разумовского,
Саратовская городская клиническая больница № 9,
г. Саратов, Россия
Markov D.A. Zvereva K.P. Belonogov V.N. Bychkov A.E. Troshkin A.Yu.
Saratov State Medical University named after V.I. Razumovsky,
Saratov City Clinical Hospital N 9, Saratov, Russia
В настоящее время основным методом лечения диспластического коксар-троза является тотальное эндопротезирование. Однако гипопластичность вертлужной впадины и недостаток костного массива в области крыши значительно ухудшают хирургические результаты и увеличивают число осложнений. Наиболее перспективным методом борьбы с данной проблемой является применение костной аутопластики крыши вертлужной впадины.
Цель исследования - провести анализ результатов тотального эндо-протезирования тазобедренного сустава с применением костной аутопластики крыши вертлужной впадины у пациентов с диспластическим коксартрозом 1 и 2 типов по Hartofilakidis.
Результаты. Анализ результатов клинического обследования пациентов показал статистически значимое увеличение объема движений в оперированном суставе через 1 год после вмешательства (р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
В положении пациента на здоровом боку под спинно-мозговой анестезией после трехкратной обработки операционного поля выполняли передне-боковой доступ к тазобедренному суставу по Уот-сон—Джонсону. Рассечение кожи, подкожно-жировой клетчатки и широкой фасции бедра осущест-
вляли по классической методике. Отсечение сухожилия средней ягодичной мышцы выполняли в безопасной зоне, отступив на 2-3 см от места его прикрепления к большому вертелу, для возможности последующего восстановления отводящего механизма. Производили продольное рассечение капсулы сустава и вывихивание головки бедренной кости. Опил головки бедра осуществляли на уровне основания шейки. Расстановкой 4 ре-тракторов Хомана по окружности обеспечивали адекватный доступ к вертлужной впадине. Из опила головки бедренной кости при помощи осцилляторной пилы формировали спонгиозный аутотрансплантат трапециевидной формы (рис. 1).
Вертлужную впадину очищали от рубцовых тканей. При помощи распатора удаляли склерозирован-ные участки в области крыши до кровоточащей костной ткани. На подготовленное ложе укладывали сформированный аутотрансплан-тат и фиксировали его при помощи 2-3 спонгиозных винтов (рис. 2).
Вскрыв костно-мозговой канал бедренной кости окончатым долотом и осуществив его разработку рашпилями до необходимого размера, производили установку фе-морального компонента с углом антеверсии в пределах 10-20°. На примерочной головке выполняли проверку сустава на стабильность и определение объема движений. Производили установку металлической головки и вправление, после чего осуществляли послойное ушивание раны.
Характеристика установленных компонентов эндопротеза в зави-
Аутотрансплантат, приготовленный из опила бедренной кости Figure 1
Bone graft from head of the femur
Рисунок 2 Рисунок 3
Аутотрансплантат, установленный Установленный ацетабулярный
в область крыши вертлужной компонент
впадины Figure 3
Figure 2 Inserted cup
Bone graft in acetabular roof
симости от фирмы-производителя представлена в таблице 1.
Инъекционная послеоперационная терапия включала антибио-тикопрофилактику препаратами широкого спектра действия (цефа-лоспорины 3 поколения), введение низкомолекулярного гепарина для борьбы с тромбообразовани-ем (Клексан) и назначение НПВС (кеторолак, нимесулид) с противовоспалительной и анальгетической целями. Для улучшения консолидации аутотрансплантата рекомендовали двухмесячный прием Са (Кальцемин-адванс). В рамках ограничительного режима запрещали наружную ротацию оперированной конечности и сгибание более 90° в тазобедренном суставе в течение 3 месяцев. В 1-е сутки осуществляли присаживание пациентов и обучение дыхательной гимнастике, со 2-х суток разрешали ходьбу на костылях с дозированной нагрузкой (не более 40 %). Через 1,5 месяца после оперативного вмешательства осуществляли переход на использование трости. Об окончательном отказе от дополнительной опоры говорили при выявлении признаков приращения аутотрансплатата по данным рентгенологического исследования через 3 месяца.
Оценку результатов хирургического лечения осуществляли при помощи клинического и рентгенологического обследований, а также анкет-опросников ВАШ, Харриса и SF-36 через 1 год после вмешательства. Клинически определяли объем движений в оперированном суставе и разницу длин нижних конечностей. Оценку выраженности болевого синдрома проводили, применяя шкалу ВАШ. Анализ качества жизни пациентов осуществляли по стандартизированной шкале SF-36.
По данным рентгенограмм в пе-реднезадней и боковой проекциях, выполняемым через 3, 6 и 12 месяцев, говорили о положении компонентов эндопротеза, состоянии парапротезной костной ткани и приращении интегрированного ау-тотрансплантата. Функциональный результат лечения определяли по модифицированной шкале Харри-
са, соответствовавший следующей градации: отличный — 90-100 баллов, хороший — 80-89 баллов, удовлетворительный — 70-79 баллов, неудовлетворительный — менее 70 баллов.
Статистический анализ был выполнен при помощи пакета надстроек к Microsoft Excel AtteStat 2.5.1. Обработка вариационных
рядов включала вычисление средней арифметической величины, стандартного отклонения и доверительных интервалов. Сравнение средних величин, в связи с опровержением гипотезы о нормальном распределении вариационных рядов, осуществлялось при помощи непараметрического критерия Манна—Уитни. Статистиче-
Характеристика установленных компонентов
Stratification of implanted components
Ацетабулярный компонент Абс. ч. % Феморальный компонент Абс. ч. %
Cup Abs. n. Stem Abs. n.
Smith & Nephew (R3) 27 79 Smith & Nephew (SL) 28 85
De Puy (Pinnacle) 4 12 De Puy (Corail) 3 9
Zimmer (Trilogy) 3 9 Zimmer (Avenir) 2 6
ская гипотеза считалась достоверной при р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Abduction (95% ДИ, от 8.1 до 12.8) (95% ДИ, от 19 до 23)
(95% CI, 8.1-12.8) (95% CI, 19-23)
Наружная ротация 10.1 ± 6.57* 22.4 ± 5.8*
External rotation (95% ДИ, от 7.9 до 12.4) (95% ДИ, от 20.4 до 24.3)
(95% CI, 7.9-12.4) (95% CI, 20.4-24.3)
Внутренняя ротация 21 ± 6.36 21.6 ± 4.39
Internal rotation (95% ДИ, от 18.9 до 23.2) (95% ДИ, от 20.1 до 23.1)
(95% CI, 18.9-23.2) (95% CI, 20.1-23.1)
Примечание: * - статистически значимые различия средних величин р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Assessment of patient's quality of life according to SF-36
Показатель До операции После операции
Index Before surgery After surgery
Физический компонент здоровья 23.7 ± 1.74* 50.4 ± 2.69*
Physical component of health (95% ДИ, 22.5-25) (95% ДИ, 48.29-52.6)
(95% CI, 22.5-25) (95% CI, 48.29-52.6)
Психический компонент здоровья 55.2 ± 0.99 58.1 ± 4.07
Mental component of health (95% ДИ, 54.5-55.9) (95% ДИ, 54.8-61.3)
(95% CI, 54.5-55.9) (95% CI, 54.8-61.3)
Физическое функционирование 16.4 ± 6.27* 89.2 ± 5.85*
Physical functioning (95% ДИ, 11.8-21.1) (95% ДИ, 84.5-93.8)
(95% CI, 11.8-21.1) (95% CI, 84.5-93.8)
Ролевое (физическое) функционирование 14.3 ± 13.36* 66.7 ± 12.91*
Role (physical) functioning (95% ДИ, 4.4-24.2) (95% ДИ, 56.3-76.9)
(95% CI, 4.4-24.2) (95% CI, 56.3-76.9)
Боль 30.3 ± 8.58* 81.7 ± 10.23*
Pain (95% ДИ, 23.9-36.6) (95% ДИ, 73.5-89.9)
(95% CI, 23.9-36.6) (95% CI, 73.5-89.9)
Общее здоровье 79 ± 3.74 87.8 ± 4.92
General health (95% ДИ, 76.2-81.8) (95% ДИ, 83.9-91.8)
(95% CI, 76.2-81.8) (95% CI, 83.9-91.8)
Жизненная активность 74.3 ± 7.32 85.8 ± 2.04
Life activity (95% ДИ, 68.9-79.7) (95% ДИ, 84.2-87.5)
(95% CI, 68.9-79.7) (95% CI, 84.2-87.5)
Социальное функционирование 85 ± 7.22 93.8 ± 6.85
Social functioning (95% ДИ, 79.7-90.4) (95% ДИ, 88.3-99.2)
(95% CI, 79.7-90.4) (95% CI, 88.3-99.2)
Ролевое (эмоциональное) функционирование 90.5 ± 16.3 83.3 ± 16.67
Role (emotional) functioning (95% ДИ, 78.4-102.5) (95% ДИ, 68.7-97.9)
(95% CI, 78.4-102.5) (95% CI, 68.7-97.9)
Психологическое здоровье 84 ± 3.22 90 ± 4.89
Mental health (95% ДИ, 80.4-86.9) (95% ДИ, 86.1-93.9)
(95% CI, 80.4-86.9) (95% CI, 86.1-93.9)
Примечание: * - статистически значимые различия между показателями при р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Трошкин А.Ю., ординатор кафедры травматологии и ортопедии, ФГБОУ ВО СГМУ им. В.И. Разумовского Минздрава России, г. Саратов, Россия.
Адрес для переписки:
Зверева К.П., ул. Григорьева, д. 23/27, кв. 26, г. Саратов, Россия, 410002

По данным литературы, доля заболеваний коленного сустава среди всех случаев дегенеративно-дистрофических заболеваний суставов конечностей составляет от 21,9 до 29%, причем в 86% случаев страдают лица трудоспособного возраста, у которых прогрессирование заболевания в течение 10-15 лет приводит к инвалидности в 6,2-14,6% случаев [1]. Зачастую методом выбора при лечении пациентов с дегенеративно-дистрофическими заболеваниями суставов становится тотальное эндопротезирование. Одной из проблем, которую нужно решить в процессе тотального эндопротезирования сустава, это замещение костных дефектов в ложе эндопротеза. Их доля при заболеваниях коленного сустава составляет от 25 до 31% [2].
Причинами формирования дефектов и, как следствие, грубых деформаций являются:
- асептический некроз мыщелков, который, по данным различных авторов, составляет от 8 до 22% всех дегенеративно-дистрофических заболеваний коленного сустава,
- кистовидная перестройка эпифизов бедренной и большеберцовой костей,
- посттравматическая импрессия суставной поверхности 5.
Существует достаточное количество классификаций костных дефектов при первичном и ревизионном эндопротезировании коленного сустава [7]. Мы используем наиболее удобную, нашедшую широкое клиническое и научное применение классификацию AORI, разработанную G.A. Engh в Anderson Ortopaedic Research Institute (AORI США, 1997) [8]. Классификация основана на дооперационной рентгенологической оценке состояния костей, с помощью предварительно заданных критериев. В соответствии с этой классификацией выделяют четыре типа состояния бедренной или большеберцовой костей:
1 тип – интактная кость;
2А тип – повреждённая губчатая кость, кость противоположного мыщелка остается неизменной;
2В тип – симметричная потеря костной массы с вовлечением обоих мыщелков или плато;
3 тип – повреждение губчатой и кортикальной кости.
Классификация AORI достаточно четко показывает корреляцию наличия и размеров костных дефектов с ростом потребности использовать металлические блоки, клинья и/или структурированные трансплантаты. У данной методики существует лишь один минус. По современным данным, в группах I и IIA дефекты кости до 5 мм в 46% случаев посредством дооперационных рентгенограмм диагностированы не были [9].
При выполнении тотального эндопротезирования коленного сустава (ТЭКС) преследуется основная цель – создание долговременной надежной опоры для компонента эндопротеза. В случае имеющегося костного дефекта она может достигаться такими способами, как:
- резекция по дну дефекта,
- цементная пластика с армированием или без армирования,
- замещение металлическим блоком,
- костная аллопластика 10.
При детальном рассмотрении у каждого метода отмечаются свои преимущества и недостатки. Преимуществом замещения костного дефекта путем выполнения резекции по дну дефекта является простота и быстрота выполнения. Недостатком становится снижение количества ткани большеберцовой кости в дистальном направлении. Не исключена ситуация, что на максимальном вкладыше стабильность сустава не будет достигнута. Кроме того, при возникновении необходимости выполнения реэндопротезирования у этой группы пациентов хирург может столкнуться с такой проблемой, как обширный дефект большеберцовой кости. Таким образом, этот вариант замещения костного дефекта не является методом выбора. Его применение допустимо при неглубоких дефектах [12]. По нашим данным, резекция по дну дефекта выполнена у 5% пациентов с имеющимся костным дефектом.
Замещение костного дефекта путем цементной пластики с армированием или без армирования винтами также отличается простотой и дешевизной. Недостатки метода заключаются в том, что непросто добиться адекватной прессуризации цемента при нарушении целостности кортикальной кости. Изменение объема цемента во время полимеризации может достигать 2%. Неравномерное распределение нагрузки на подлежащую кость при эксцентрически действующих силах может приводить к нарушению прочности фиксации. Этот метод используется для замещения достаточно глубоких дефектов, при условии соблюдения правил прессуризации цемента и планирования вектора нагрузки [12]. По нашим данным, такое замещение выполнено у 82% пациентов с имеющимся костным дефектом.
Преимущество метода замещения костного дефекта путем костной аутопластики заключается в максимальном сохранении костной ткани метаэпифиза. К недостаткам метода относятся: существенные ограничения в выборе размера трансплантата, риск коллапса, если структура трансплантата повреждена патологическим процессом, и риск несращения. Метод применяется при наличии трансплантата с соответствующими характеристиками (размер, плотность). По нашим данным, такое замещение выполнено у 7% пациентов с имеющимся костным дефектом.
Достоинством замещения костного дефекта металлическим блоком или клином следует считать быстрое создание надежной опоры для имплантата, даже в условиях обширных дефектов. К недостаткам метода относятся ограничения по размеру и форме трансплантата, необходимость специальных инструментов и компонентов эндопротеза. Увеличивается общая стоимость имплантата. При наличии специального инструментария и соблюдении правил имплантации метод применим для замещения любых дефектов [12; 13]. По нашим данным, замещение костного дефекта этим методом выполнено у 6% пациентов.
Цель исследования: улучшить результаты первичного эндопротезирования коленного сустава у пациентов, имеющих костный дефект большеберцовой кости до 2А по AORI.
Материал и методы. В Новосибирском НИИТО за 2012-2015 годы выполнено 7096 операций первичного эндопротезирования коленных суставов. В 2157 (30,4%) случаях был диагностирован требующий замещения костный дефект как бедренной, так и большеберцовой кости [14].
С целью восстановления биомеханики коленного сустава и создания долговременной надежной опоры для компонентов эндопротеза у пациентов, имеющих костный дефект большеберцовой кости до 2А по AORI, нами разработан и внедрен в клиническую практику способ аутопластики большеберцовой кости при первичном эндопротезировании коленного сустава.
Данная методика выполняется соответственно стандартным этапам эндопротезирования, но имеет некоторые особенности: после выполнения резекции суставной поверхности большеберцовой кости определяется остаточный костный дефицит мыщелка большеберцовой кости. По классификации AORI для аутопластики допускается дефицит не больше T2А. При формирования межмыщелкового бокса бедренной кости производится одновременный забор аутокости. Производится обработка костного аутотрансплантата до придания ему правильной геометрической формы (рис. 1).
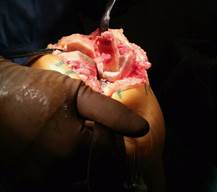
Рис. 1. Забор аутотрансплантата, придание ему правильной геометрической формы
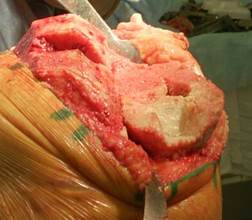
Рис. 2. Обработанный дефект большеберцовой кости со
сформированной опорной площадкой
В последующем аутотрансплантат устанавливается в сформированное ложе и производится импакция до фиксации (рис. 3).
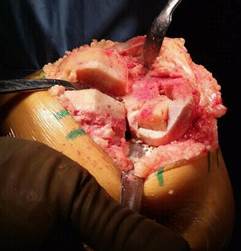
Рис. 3. Импакция аутотрансплантата в сформированном ложе
Дальнейший ход операции соответствует стандартным этапам при первичном эндопротезировании коленного сустава. Восстановительный период не имеет каких-либо особенностей по сравнению со стандартным течением [15].
Клинический пример. Пациент С., 65 лет. Диагноз: левосторонний посттравматический гонартроз 3 степени. Дефект медиального мыщелка левой большеберцовой кости. Варусная деформация левой нижней конечности. Комбинированная контрактура левого коленного сустава. Синдром левосторонней гоналгии (рис. 4).
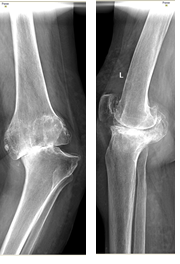
Рис. 4. Рентгенограмма коленного сустава в прямой и боковой проекциях
Пациенту проведено оперативное лечение: эндопротезирование левого коленного сустава с аутопластикой медиального мыщелка большеберцовой кости. Послеоперационный период протекал без особенностей, пациенту была проведена стандартная реабилитация.
На контрольных осмотрах через 6 месяцев, 1 и 2 года после проведенного хирургического лечения пациент отметил хороший результат проведенного лечения, выражающийся в увеличении объема движений в коленном суставе, повышении его стабильности и восстановлении нормальной оси конечности. На контрольной рентгенограмме коленного сустава через 2 года после операции аутотрансплантат состоятелен (рис. 5).
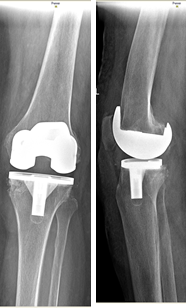
Рис. 5. Контрольная рентгенограмма коленного сустава в прямой и
боковой проекциях через 2 года после операции
Таким образом, у пациентов, имеющих костный дефект большеберцовой кости 2А по AORI, при первичном эндопротезировании коленного сустава выполнение аутопластики по разработанной методике приводит к хорошим результатам, выражающимся в создании долговременной надежной опоры для компонентов эндопротеза, что увеличивает срок его службы за счет нормализации распределения нагрузок в прооперированном коленном суставе.
1. При первичном эндопротезировании коленного сустава максимальное сохранение костной ткани облегчает хирургическую тактику при последующих хирургических вмешательствах, что очень важно у молодых пациентов.
3. Аутопластика должна выполняться при отсутствии противопоказаний.
Читайте также:


