Что такое моноклональные антитела при ревматоидном артрите

Ревматоидный артрит
Если рассматривать существующие воспалительные заболевания в суставах, то однозначно клиническое диагностирование и статистические данные говорят о том, что ревматоидный артрит, наиболее встречаемое заболевание. Это заболевание запускает процесс нарушения функционирования иммунной системы человека и является реактивным состоянием организма. Поражение происходит в мягких тканях суставного аппарата и протекает как хроническое заболевание.
Моноклональные антитела
Существует целый ряд медицинских препаратов, которые направлены на замедление процесса поражения суставов. Ранее в терапии ревматоидного артрита применялись не стероидные противовоспалительные и

моноклональные антитела
глюкокортикоидные препараты. Но учитывая, что в данном случае, иммунная система организма человека реагирует на свою соединительную ткань суставов, вырабатывая при этом антитела. Процесс запускается перенаправленным образом. Антитела провоцируют запуск процесса, при котором начинается поражение суставов. В лечении следует подавлять иммунный ответ, который и будет действовать на причину, которая вызывает прогрессирование воспаления. Для более эффективного лечения данного заболевания в последние годы применяются фармакологические средства, в состав которых входят моноклональные антитела. В отличие от стандартных лекарственных средств, применяемых при лечении ревматоидного артрита, они практически не имеют побочных эффектов, что является одним из преимуществ данного вида лечения. Антитела нейтрализуют аутоиммунный ход реакций. Моноклональные антитела относятся к одному из самых современных подходов лечения и при данном заболевании являются самыми эффективными. Их действие состоит в препятствии дальнейшего разрушения хрящевой ткани. Положительным, является при их использовании и то, что они не токсичны и не снижают и так уже ослабленный иммунитет человека.
Лечение ревматоидного артрита
Учитывая тот факт, что диагностировать ревматоидный артрит достаточно трудно. И сейчас ни один тест или биохимический анализ крови не может дать гарантированного результата, который поможет определить заболевание ревматоидным артритом. Необходимо как можно раньше обращаться за помощью к медицинскому специалисту – ревматологу, т.к.
Над открытием моноклональных антител работали ученые многих стран. Их действие, невозможно сравнить ни с какими другими существующими медицинскими препаратами, применяющиеся при лечении ревматоидного артрита. Их первоначальная роль заключается в определении конкретного антигена. Сами они принадлежат к одному иммуноглобулиновому классу, и, вызывая на себя иммунную реакцию, точно определяют антитела.
Фармакологи постоянно проводят научные исследования для совершенствования методов терапии ревматоидного артрита.
Сейчас вводится в практическое применение вид гуманизированных антител, относящихся к моноклональным, к рецептору интерлейкина-6. При его применении отмечается уменьшение признаков воспалительных процессов в суставах. Возможна комбинация его применения с другими препаратами, которые изменяют течение болезни. Данная группа препаратов приостанавливает разрушающий процесс в суставах. Их действие направлено на измененный реактивный ответ иммунной системы организма.
Учитывая тот факт, что диагностировать ревматоидный артрит достаточно трудно. И сейчас ни один тест или биохимический анализ крови не может дать гарантированного результата, который поможет определить заболевание ревматоидным артритом. Необходимо как можно раньше обращаться за помощью к медицинскому специалисту – ревматологу, т.к. ранняя диагностика выявления ревматоидного артрита помогает более действенно проводить лечение.
Ревматоидный артрит — многофакторное заболевание, против которого создано несколько групп препаратов. Моноклональные антитела (МАТ) — генноинженерные лекарственные средства, являющиеся передовой разработкой современной медицинской науки, эффективно борющиеся с ревматоидным артритом и сопровождающей симптоматикой.

Что это за препараты?
Моноклональные антитела — иммуноглобулины, вырабатываемые клонированными из единой клетки-предшественника иммунными последователями. Все они выявляют специфическую чувствительность только к одному антигену — веществу, чуждому для конкретного организма, выявляющему враждебные свойства в попытках атаковать его ткани. Этот чужеродный ген может иметь белковую, полисахаридную или вирусную природу. МАТ связывают его и обезвреживают.
Механизм образования и работы
Создание моноклональных антител включает следующие этапы:
- Мышей (или других животных, которые подходят для этой процедуры), иммунизирует путем введения чужеродного вещества — антигена.
- Спустя несколько недель, проверяют у них появление иммунного ответа. О нем свидетельствует появление антител к введенному антигену.
- Если результат положительный, у мышей препарируют селезенку и готовят ее к забору клеток. Для этого орган измельчают, предварительно промыв в дистиллированной воде. В специальном аппарате производится встряхивание создавшейся массы для отделения клеток, которые понадобятся в итоге.
- Среди клеточного гомогенизата находят Т- или B-лимфоциты, от которых ожидается продукция нужных антител.
- Эти клетки перемешивают с вытяжкой, содержащей клетки спинного мозга, пораженного опухолью (миеломные). Их способность мутировать активизирует B-лимфоциты.
- В полученную суспензию добавляют ферменты и инкубируют ее в определенных химических реактивах.
- Образовавшиеся гибридные клетки выращивают на питательных средах.
- С помощью иммуноферментного анализа проверяют способность новосозданных клеточных структур выполнять свою функцию.
- Отобранные клоны клеток замораживают. Они готовы к употреблению в лечебных целях.
Менее распространенными методиками приготовления моноклональных антител является их выращивание непосредственно в теле мыши, встраивание частички гена иммунных клеток человека в генотип вируса, поражающего бактерии (бактериофага), и дальнейшие генноинженерные манипуляции. Все МАТ имеют сходные механизмы работы. Заключаются они в поиске конкретных антигенов, вызывающих заболевание и обезвреживании их.
Показания к применению
Моноклональные антитела используются в таких отраслях медицины:
- Гематологии. Для лечения болезней эритроцитарного, тромбоцитарного и лейкоцитарного ростков крови.
- Онкологии.
- Ревматологии. Для излечения ревматоидного артрита и других заболеваний аутоиммунной природы.
- Неврологии. С помощью них терапии подается рассеянный склероз.
- Пульмонологии.
- Дерматологии. Проводится лечение псориаза.
- Трансплантологии. Для торможения реакции отторжения трансплантата.
Механизм действия МАТ при ревматоидном артрите базируется на их способности снижать возможность презентации антигенов, тормозить экспрессию цитокинов — медиаторов, которые передают межклеточные команды, а также вырабатывать автоантитела.
Способ применения моноклональных антител при ревматоидном артрите
Терапевтический курс моноклональными антителами при ревматоидном артрите довольно длительный. Препарат вводится внутривенно, капельно. Дозы моноклональных антител ревматолог определяет после получения результатов анализов антигенного состава синовиальной жидкости воспаленных суставов. Они подбираются индивидуально для каждого пациента. Введение МАТ позволяет прекратить прием нестероидных противовоспалительных препаратов (НПВП), глюкокортикоидов (ГКК), употребление которых имеет множество побочных эффектов.
Классификация лекарств
Моноклональные антитела делятся по принципу принадлежности к Т- или B-клеткам иммунитета:
Самая распространенная классификация моноклональных антител базируется на способах их получения:
- Мышиные. В результате приготовления препарата используется 100% белка клеток этих животных.
- Химерические. Протеиновый, компонент, полученный от мышей, составляет 25% в общей концентрации.
- Гуманизированные. Этот показатель составляет от 5 до 10%, остальные белки принадлежат человеку.
- Человеческие. От людей происходит 100%.
- 4948
- 4,1
- 0
- 5
Моноклональные антитела — новая надежда в лечении ревматических заболеваний.
![]()
Анна Огородник
![]()
Антон Чугунов![]()
Андрей Панов




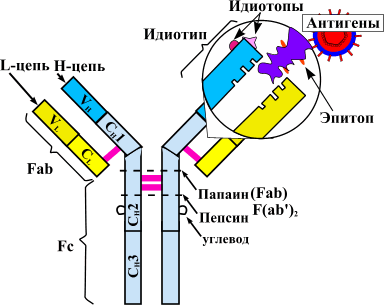
Теорию аутоиммунитета сформулировал еще столетие назад немецкий исследователь Пауль Эрлих. За последующие годы описано множество аутоиммунных заболеваний. К ним относятся ревматоидный артрит, системная красная волчанка (СКВ), системная склеродермия, миопатии, васкулиты и прочие патологии .
Болезни, ассоциированные с аутоиммунным компонентом, — серьезная проблема современного общества . Их распространенность в мировой популяции составляет примерно 5%. Заболевания быстро переходят в хроническую форму, из-за чего снижается качество жизни пациентов. Аутоиммунные патологии часто приводят к инвалидизации больных [1], [4].
Несмотря на многолетний поиск новых путей фармакотерапии, современная медицина не может предложить способов лечения, непосредственно влияющих на причину возникновения аутоиммунитета. Врачи способны лишь замедлить прогрессирование патологии и снизить выраженность клиники — провести патогенетическое и симптоматическое лечение. Для этого разработана базисная терапия, которая применяется уже многие годы. Однако не всегда проверенные препараты работают так, как надо.
Почему необходимо искать новые способы лечения?
Для лечения аутоиммунных заболеваний используют широкий арсенал противоревматических лекарств. Классическая терапия включает нестероидные противовоспалительные средства, глюкокортикоиды, цитостатики. В зависимости от особенностей развития заболевания подбирают препараты из той или иной группы [4].
- Большие иммунодепрессанты:
- глюкокортикоиды (преднизолон, дексаметазон);
- антибиотики (циклоспорин, такролимус);
- антиметаболиты (метотрексат, азатиоприн, меркаптопурин);
- цитостатики (циклофосфан).
- Малые иммунодепрессанты:
- плаквенил, хингамин;
- купренил;
- препараты золота (ауронофин);
- гепарин;
- нестероидные противовоспалительные средства.
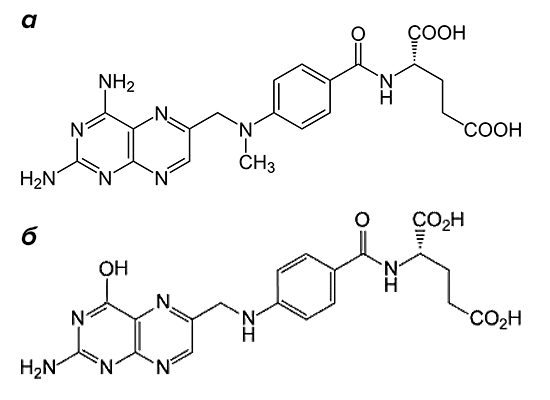
Рисунок 2. Структурные формулы метотрексата и фолиевой кислоты. Препарат (а) по строению похож на фолиевую кислоту (б). Он состоит из птеридиновых групп и парааминобензойной кислоты. Действующий компонент метотрексата отличается от структуры фолата отсутствием гидроксильной группы (–OH) и наличием дополнительного метильного радикала (–CH3).
По механизму действия метотрексат относится к антиметаболитам. Препараты этой группы тормозят физиологические реакции в организме, связываясь с ферментами и выключая их активность. Вещество, которое в норме участвует в реакции, уже не может попасть в биохимический круговорот из-за повышенной конкуренции с компонентами лекарства. Основной мишенью для действия метотрексата является фермент, расщепляющий фолиевую кислоту, — дигидрофолатредуктаза (ДГФ). Этот белок воздействует на поступающий в организм фолат, переводя его в активную форму. При этом образуется тетрагидрофолиевая кислота. Она участвуют в синтезе строительного материала для ДНК — пуриновых оснований и тимидилата.
Метотрексат вклинивается в цепочку реакций благодаря структурному сходству с молекулой фолиевой кислоты (рис. 2). Конкуренция за фермент приводит к тому, что содержание активного фолата в ткани значительно снижается. Нет строительного материала — нет и новых молекул ДНК, без которых клетки не могут размножаться. Повышенной чувствительностью к воздействию лекарства обладают те ткани, структурные элементы которых постоянно делятся. К ним относятся и компоненты костного мозга, из которых формируются будущие иммунные клетки.
Еще один важный момент в работе метотрексата связан с активностью его полиглутамированных метаболитов. Эти молекулы формируются после активации препарата непосредственно в клетках человеческого организма. Они ингибируют другие ферменты, которые взаимодействуют с фолиевой кислотой. В эту группу входят тимидилсинтетаза и АИКАР-трансамилаза. Активность производных метотрексата запускает процесс выработки аденозина. Он оказывает мощное противовоспалительное действие, благодаря чему снижается выраженность симптомов ревматоидного артрита [7].
Метотрексат удобно использовать — он легко дозируется и может назначаться длительными курсами. Кроме того, важное преимущество этого препарата — низкая цена, в сравнении с современными лекарствами импортных фармкомпаний [8]. Несмотря на все достоинства, лечение метотрексатом не всегда приводит к снижению активности заболевания. У многих пациентов использование препарата неэффективно даже в комбинации с другими классическими средствами [5]. Это подтверждается при анализе статистики. Исследования показали, что при проведении лечения метотрексатом и комбинациями базисных препаратов только половина пациентов достигла ремиссии [9], [10].
Несостоятельность классической терапии заставляет ученых искать новые способы лечения ревматоидного артрита. Стоит отметить, что, несмотря на новые разработки, борьбу с заболеванием все же начинают с назначения метотрексата и его аналогов. Дополнительные препараты используют только при высокой активности аутоиммунного процесса. У таких пациентов применение одного лекарства часто бывает неэффективно [7]. В зависимости от особенностей течения патологии подбирают подходящую схему терапии (рис. 3).
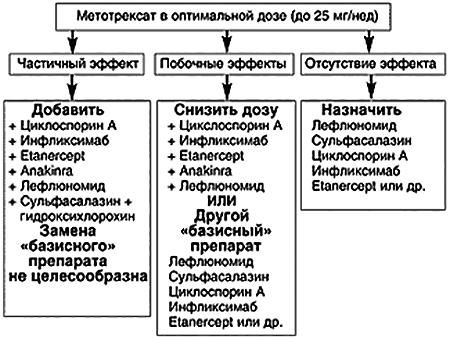
Рисунок 3. Тактика ведения пациента с ревматоидным артритом при неэффективности использования метотрексата.
Неэффективность препаратов базисной терапии встречается не только при ревматоидном артрите, но и при других заболеваниях аутоиммунного происхождения (системной красной волчанке, склеродермии, болезни Бехтерева). Это мотивирует специалистов-ревматологов разрабатывать другие лекарства и подбирать новые схемы терапии.
Генно-инженерные препараты: дополнение к базисной терапии
По-новому взглянуть на лечение аутоиммунных заболеваний позволила разработка терапевтических моноклональных антител [11]. Принципиально новый класс препаратов получен благодаря достижениям генной инженерии. Для понимания механизма действия этих лекарств стоит вспомнить о том, как работают иммунные клетки в норме и при патологии [1], [12].
При аутоиммунных заболеваниях можно подавлять сразу весь сложный механизм иммунитета, что и делают препараты классической терапии. Но это оставляет человека без защиты от вражеских агентов — бактериальных инфекций, вирусов и прочих патогенов. Поэтому предпочтительнее сохранить активность иммунной системы в целом, избавив человека от аутоагрессии определенных ее компонентов. Именно так работают новые препараты — моноклональные антитела.
- Ингибиторы ФНО (фактора некроза опухолей) — инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
- Блокаторы интерлейкиновых рецепторов — тоцилизумаб (ИЛ-6R), канакинумаб (ИЛ-1R), секукинумаб (ИЛ-17R).
- Анти-В-клеточные антитела (антитела к мембранным молекулам CD20) — ритуксимаб, белимумаб [17].
- Анти-Т-клеточные антитела (антитела к молекулам CD80 и CD86) — абатацепт [18].
Ингибиторы фактора некроза опухолей — это первые моноклональные антитела, внедренные в ревматологическую практику. В эту группу входят инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
Фактор некроза опухолей (ФНО) — это провоспалительный цитокин (вещество, которое стимулирует развитие воспалительной реакции). В норме при его выделении происходит пролиферация клеток сосудов, активация макрофагов, лизис опухолевых агентов. Эти эффекты играют важную роль в защите организма от патогенов. Воспаление можно считать ответной реакцией на воздействие повреждающих факторов.
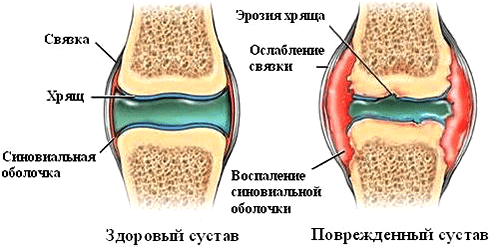
Рисунок 5. Патологические изменения в суставе при ревматоидном артрите. Аутоиммунный процесс вызывает появление эрозий, синовит (воспаление синовиальной оболочки), разрушение суставного хряща.
Такое строение связано с механизмом получения препарата. Первоначально синтезируют антитело к фактору некроза опухолей в организме мыши. Полученный иммуноглобулин специфичен к ФНО и уже может его обезвреживать, но полностью чужеродные белки вводить в организм пациентов, конечно, нельзя. Это вызовет активную иммунную реакцию — выработку антител уже против терапевтических агентов. Поэтому домены мышиного иммуноглобулина заменяют сходными участками человеческих белков. Антитела, имеющие фрагменты разного происхождения, называются химерными. Фактически, они берут лучшие качества своих предшественников. Мышиная часть обеспечивает высокую чувствительность к ФНО, а человеческие фрагменты снижают иммуногенность — вероятность развития иммунного ответа.
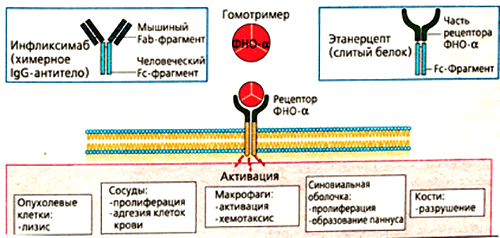
Рисунок 6. Основные эффекты ФНО и блокирующие его моноклональные антитела (инфликсимаб и этанерцепт). Мишенями для моноклональных антител являются свободная и мембраноассоциированная формы фактора некроза опухолей. Лекарства препятствуют связыванию цитокина с рецептором, благодаря чему снижается активность ревматоидного артрита.
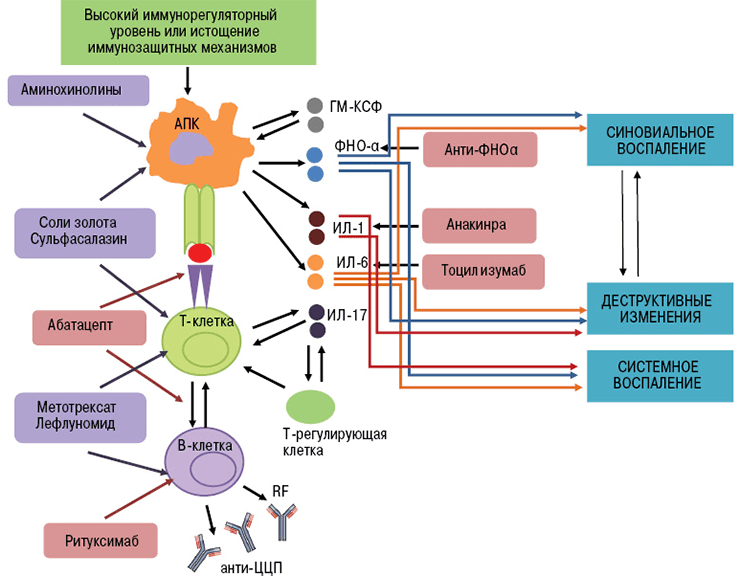
В развитии аутоиммунного воспаления важную роль играют интерлейкины, которые, как и ФНО, относятся к провоспалительным цитокинам (рис. 7). Основными представителями этой группы являются ИЛ-6, ИЛ-1, ИЛ-17. Функция интерлейкинов — это контроль процессов дифференцировки, пролиферации и гибели (апоптоза) иммунных клеток, который осуществляется через соответствующие гены-мишени [20].
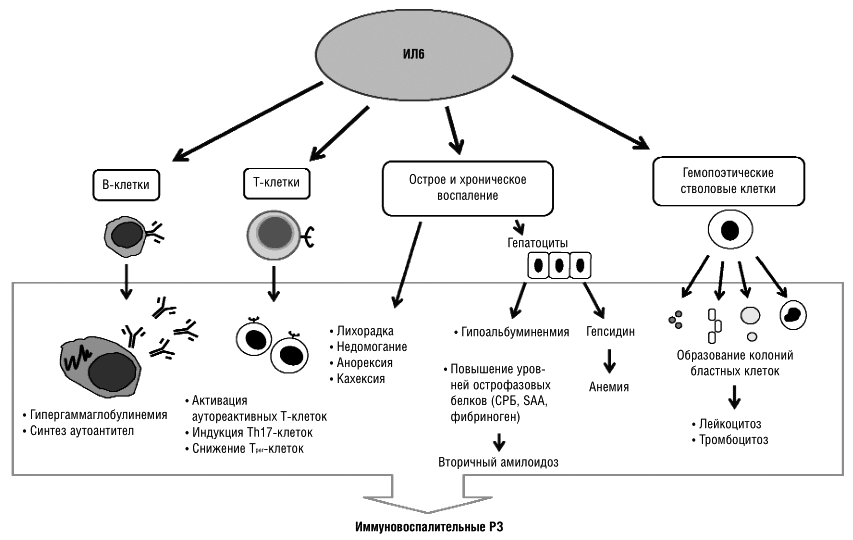
Рисунок 7. Механизм действия интерлейкинов при аутоиммунном воспалении (на примере ИЛ-6). Цитокин влияет на T- и B-лимфоциты, гемопоэтические клетки, гепатоциты. Он стимулирует выработку аутоантител В-клетками, а также формирование аутореактивных Т-клонов, которые непосредственно участвуют в аутоиммунном процессе. Влияние на костный мозг заключается в стимуляции выработки новых клеток крови — повышается число лейкоцитов и тромбоцитов. Воспаление сопровождается ответной реакцией клеток печени, появлением характерных симптомов аутоиммунного заболевания.
Тоцилизумаб — это препарат, который блокирует работу ИЛ-6. Рецептор этого вещества состоит из двух компонентов — мембранного ИЛ-6R (α-цепь) и гликопротеина g130 (β-цепь). Мембранная часть рецептора связывается с ИЛ-6, образуя устойчивый комплекс. Вместе они активируют компонент g130, вызывая изменение его структуры (гомодимеризацию). Образуется рецепторный комплекс из двух молекул g130, который в свою очередь активирует JAK1-киназу. Этот фермент запускает каскад реакций в клетке, который приводит к появлению биологического эффекта цитокина — развитию воспаления. В некоторых случаях ИЛ-6 связывает не мембранная, а растворимая форма α-цепи (рис. 8). Механизм действия рецептора при этом не меняется [21].
В основе работы тоцилизумаба лежит конкуретное ингибирование. Сигнальные молекулы активно связываются с моноклональным антителом. Вакантное место занято — интерлейкин не может образовать комплекс с рецептором, а значит, он не способен активировать процесс воспаления.
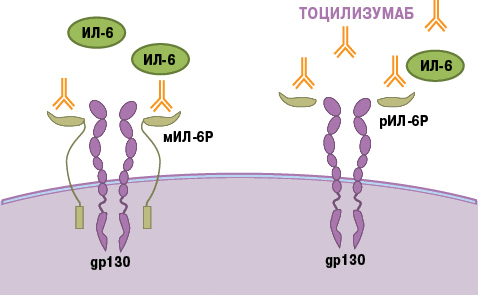
Рисунок 8. Механизм действия тоцилизумаба. Препарат связывает растворимые и мембранные рецепторы ИЛ-6, блокируя передачу сигналов.
Тоцилизумаб считается одним из самых безопасных препаратов, входящих в группу моноклональных антител. Это позволяет применять его при ювенильном идиопатическом артрите, который возникает в возрасте до 16 лет. Дети особенно остро реагируют на токсические воздействия, поэтому препараты, которые используют при их лечении, должны иметь минимальное число побочных реакций. Применение тоцилизумаба позволяет достигнуть необходимого эффекта лечения, не вызвав тяжелых осложнений.
Препараты из группы анти-B-клеточной терапии (ритуксимаб и белимумаб) блокируют активность В-лимфоцитов путем связывания их мембранных молекул CD20. Эти вещества есть только у определенных категорий В-клеток. Они специфичны для пре-В-лимфоцитов и зрелых В-лимфоцитов. CD20 нет у стволовых элементов и про-В-клеток, из которых будут образовываться новые лимфоцитарные элементы. Мембранные молекулы данного типа не содержатся и у плазматических клеток, которые вырабатывают иммуноглобулины [22].
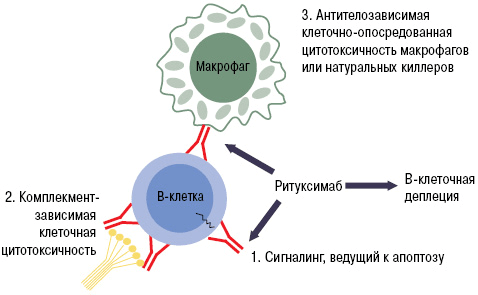
Рисунок 9. Механизм работы ритуксимаба. Fab-фрагмент моноклонального антитела связывается с CD20 на поверхности B-лимфоцита. Это запускает лизис клетки, который может осуществляться несколькими путями: через систему комплемента, программу апоптоза или агрессию натуральных киллеров и макрофагов.
Блокировка действия Т-лимфоцитов возможна благодаря особенностям их активации. Чтобы Т-лимфоцит вступил в аутоиммунный процесс и связался с антигеном, он должен получить два сигнала от антигенпрезентирующих клеток (АПК). Первый сигнал обеспечивает распознавание специфического аутоантигена Т-клеточными рецепторами. Второй сигнал — это неспецифический процесс связывания мембранных молекул CD80 и CD86 на поверхности АПК с рецептором CD28 лимфоцита. Сочетание этих взаимодействий вызывает активацию Т-клеток, которые в свою очередь стимулируют выработку провоспалительных цитокинов. Это и есть основной вклад Т-лимфоцитов в аутоиммунный процесс.
Знания о механизме активации Т-клеток использовали при разработке моноклональных антител. Основной представитель анти-Т-клеточных агентов — это абатацепт. Препарат представляет собой белок, состоящий из двух частей. Специфическая часть образована молекулой CTLA-4 (антиген 4 цитотоксических лимфоцитов). Неспецифическая область — это Fc-фрагмент человеческого иммуноглобулина G1 [23].
Воздействие абатацепта направлено как раз на неспецифический (костимулирующий) сигнал. Компонент CTLA-4 связывает белки CD80 и CD86 на поверхности антигенпрезентирующих клеток. Рецептор лимфоцита CD28 уже не может взаимодействовать с ними, из-за чего активация Т-клетки не завершается (рис. 10).
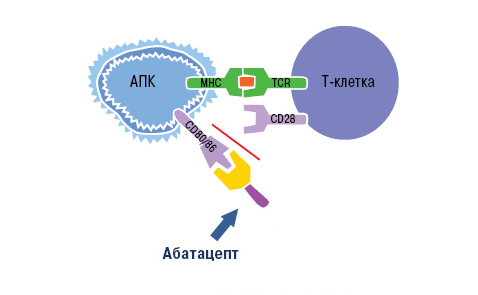
Рисунок 10. Механизм действия абатацепта. Абатацепт модулирует иммунный ответ через связывание с CD80/CD86 на антигенпрезентирующих клетках. Это препятствует связыванию CD80/CD86 с CD28 T-клеток, то есть активация Т-клеток отменяется через блокировку костимуляции.
Не всё так просто: возможные проблемы при использовании моноклональных антител
Например, одна пачка метотрексата стоит примерно 200 рублей. Цена упаковки инфликсимаба — около 43 тыс. рублей. Разница очевидна. За год лечения метотрексатом даже в максимальной дозировке пациент потратит на лекарство 1–2 тыс. рублей (в зависимости от фирмы-производителя, схемы лечения и стоимости препарата в местных аптеках). Цена годовой терапии инфликсимабом составляет примерно 700 тыс. рублей. Понятно, что самостоятельно обеспечить себя этим лекарством сможет только очень ограниченная группа пациентов.
Использование биологических препаратов допустимо в тех случаях, когда к базисным средствам у пациента развивается непереносимость. Больные испытывают тяжелое побочное воздействие лекарства, которое еще сильнее ухудшает их состояние. Применение препаратов с другим механизмом действия, в том числе и моноклональных антител, позволяет минимизировать побочные эффекты [18].
Другая сложность, с которой можно столкнуться при использовании биологических препаратов, — это побочные реакции. Параллельно с накоплением данных об эффективности использования лекарств выявляют все новые нежелательные эффекты от их применения. Большая часть таких реакций связана с процессом иммуносупрессии. Подавляя активность иммунных клеток, моноклональные антитела снижают защитную функцию организма. В первую очередь страдают противоинфекционный и противоопухолевый иммунитеты [18], [24].
Парадоксально, но применение новых лекарств против аутоиммунитета может вызвать острые аутоиммунные реакции. Все биологические препараты представляют собой белковые молекулы, которые в той или иной степени чужеродны для организма. Поэтому при проникновении терапевтических агентов в тело больного иммунитет может распознать их как антигены. Появляется активный иммунный ответ — вырабатываются антитела уже против компонентов препарата.
Несмотря на все возможные сложности, моноклональные антитела прочно вошли в регистр лекарств, применяющихся в ревматологии. Перспектива использования биологических препаратов и их место в ревматологии будет зависеть от результатов многолетних исследований, которые еще предстоит провести. Но даже сейчас можно сказать, что разработка терапевтических моноклональных антител является важным шагом на пути к победе над аутоиммунным воспалением.
Среди множества разновидностей воспалительных заболеваний суставов намного чаще встречается такое заболевание как ревматоидный артрит, являющееся хроническим системным заболеванием, во время развития которого развивается иммунновоспалительный процесс, обычно поражающий ткани суставов. Медицинские исследования не стоят на месте и продолжают находить новые препараты для лечения больных артритом, ибо по статистике заболеваемость растет ежегодно. Новейшим препаратом для лечения ревматоидного артрита считаются моноклональные антитела.

Ревматоидный артрит проявляется часто у людей достигающих возраста 35-40 лет, при этом женщины подвержены более высокому риску заболеваемости, почти в 3 раза чаще, чем мужское население.
Чем вызвано это заболевание наукой до конца не выяснено, но доподлинно известно, что в основе развития заболевания лежит нарушение правильной работы иммунной системы организма. Предшествуют этому такие заболевания как ангина, грипп, переохлаждение и др. Поэтому, разработка новейших препаратов для лечения должна строиться именно на укреплении и поддержании иммунной системы организма. Моноклональные антитела являются составляющей для препаратов, назначаемых при лечении ревматоидного артрита.
Наиболее характерными симптомами заболевания является утренняя скованность в суставах. Также характерно симметричное поражение суставов. В дальнейшем при развитии болезни возможно разрушение сустава, потеря его функциональности и появлением болевого синдрома при подвижности.
На настоящий момент времени нет таких лекарственных препаратов , которые бы полностью излечивали человека от такого тяжелого и часто прогрессирующего заболевания как ревматоидный артрит. Но систематически проводимая терапия позволяет подавить заболевание и остановить ее прогрессирование.
Изначально для лечения ревматоидного артрита применялись противовоспалительные средства нестероидного типа и клюкокортикоиды.
С развитием фармакологии стали появляться более эффективные препараты, которые стали подавлять причину заболевания, то есть иммунный ответ организма. Одним из таких препаратов первого поколения стал метотрексат , но он бывает, эффективен не во всех случаях заболевания. В последних разработках ученых новых препаратов стали использовать моноклональные антитела.
Артрит ревматоидного типа лучше начать лечить на ранних стадиях заболевания, применяя как стандартные методы лечения: НПВС, глюкокортикоиды, иммуносупрессивная терапия, так и альтернативные.
Большие надежды ревматологи возлагают на биопрепараты (моноклональные антитела). Артрит ревматоидного типа, как показали недавно проведенные учеными клинические исследования, можно победить, добившись устойчивой ремиссии у 40 % пациентов, принимавших препарат. Чтобы добиться максимальных результатов, лучше использовать комбинированные методы лечения – это сочетание моноклональных антител и других препаратов, а также санаторно-курортного лечения в сухом теплом климате.
Выработка моноклональных антител
Моноклональные антитела – это полученные из крови животных в лабораторных условиях антитела, выработка которых осуществилась в процессе ответа на введенную синовиальную жидкость пациента. Вероятность побочных эффектов при этом лечении наблюдается на много реже чем при лечении метотрексатом. Кроме этого, такой вид терапии оказывается эффективным, когда другие способы лечения ревматоидного артрита не приводят к ощутимым успехам.
Одним из препаратов на основе моноклональных антител является ритуксимаб. Применяя для комплексного лечения препарат ритуксимаб, сами больные, а та же проводимые диагностические наблюдения отмечают высокую эффективность и переносимость его пациентами с тяжелыми формами реактивного артрита. У этих больных предшествующая терапия в виде метотрексата и других похожих препаратов не дала выраженного эффекта.
Таким образом, применяя новые препараты на основе моноклональных антител с применением других, назначаемых лечащим доктором курсов терапии, а также санаторно-курортного лечения, все это в купе может дать стойкую ремиссию на продолжительный промежуток времени.
Читайте также:





