Демин a a инфекционный эндокардит
ИНФЕКЦИОННЫЕ БОЛЕЗНИ СЕРДЦА
Основные цели и задачи
Координация научных исследований.
Организация научных симпозиумов на федеральных конгрессах.
Участие в подготовке федеральных руководств для врачей.
| Председатель секции | Секретарь секции |
| Демин Александр Аристархович | Дробышева Вера Петровна |
| Члены секции | |||
|---|---|---|---|
| ФИО | Звание | Место работы, должность | Город |
| Н.В. Белобородова | Д.м.н., проф. | Референс-лаборатория по сепсису ДЗ Москвы | Москва |
| В.И. Бурцев | Д.м.н., проф. | ММГУ им. И.М.Сеченова | Москва |
| С.Р. Гиляревский | Д.м.н., проф. | МАПО Росздрава | Москва |
| М. А. Гуревич | Д.м.н., проф. | МОНИКИ Росздрава | Москва |
| А.М. Караськов | Член РАМН | НИИПК МЗ РФ | Новосибирск |
| Е.Н. Николаевский | Д.м.н., проф. | Самарский ВМИ МО РФ | Самара |
| И.И. Резник | Д.м.н., проф. | УГМА Росздрава | Екатеринбург |
| И.И. Скопин | Д.м.н., проф. | НЦССХ им. Н.Н. Бакулева | Москва |
| В.П. Тюрин | Д.м.н., проф. | НМХЦ им. Н.И. Пирогова | Москва |
| Г.Г. Хубулава | Д.м.н., проф. | Российская ВМА МО РФ | Санкт-Петербург |
| Н.А. Шостак | Д.м.н., проф. | РГМУ Росздрава | Москва |
Контакты для сотрудничества
Адрес: Кафедра госпитальной терапии и клинической фармакологии, НГМУ, Красный проспект, 52, Новосибирск, 630091, Россия.
Деятельность в 2011 году
Деятельность на федеральном уровне:
- публикации (федеральные рук-ва) последних лет:
- конференции и выступления:
- подготовка нац. рекомендаций:
- региональные конференции (В.П.Тюрин):
Конференция клинических фармакологов г. Москвы 23 декабря 2011г: Современная антибактериальная терапия инфекционного эндокардита.
Конференция для врачей МСЧ-119 г. Москва: Современная диагностика и лечение инфекционного эндокардита, ноябрь 2011г.
Региональные конференции (И.И.Резник): организация ежемесячных Областных конференций в рамках терапевтического общества Свердловской области.
Деятельность на международном уровне:
Выступление на конгрессе: The role of hemostatic disorders in pathogenesis of kidney disease in infective endocarditis. –A.Demin. Abstr. of 12 th APCN, Seoul, Korea, 2010.
Зарубежные статьи:
Beloborodova N.V., A. Yu. Olenin, A. S. Khodakova. Phenylcarboxylic acids as potential markers for diagnosis of sepsis in cardiac surgery patients // ArchivEuromedica 2011 , №. 1-2, стр. 20-26
Ktsoyan Zh. A, N.V Beloborodova, A.M Sedrakyan, G.A Osipov, Z.A Khachatryan, D.Kelly, G.P Manukyan, K.A Arakelova, A.I Hovhannisyan, A.Y Olenin, A.A Arakelyan, K.Ghazaryan, R. I Aminov. Profiles of microbial fatty acids in the human metabolome are disease-specific. Frontiers in Microbiology Cellular and Infection Microbiology, January 2011, Vol. 1, Article 148.
- сотрудничество с советами и раб. Группами ESC и др. обществ.
- важные публикации в российских журналах:
Тюрин В.П., Белкорей О.С. Инфекционный эндокардит у больных с дисплазией соединительной ткани. Сибирский медицинский журнал, 2011, том 26, № 3, вып. 2, стр. 88-92.
Тюрин В.П., Сидоренко Л.С., Рябов А.Л. и др. Абсцессы селезёнки при инфекционном эндокардите. Вестник Национального медико-хирургического Центра, 2011, № 2, стр. 28-33.
Н.В.Белобородова, И.Т.Байрамов, А.Ю.Оленин, Н.И.Федотчева. Экзометаболиты некоторых анаэробных микроорганизмов микрофлоры человека. Биомедицинская химия, 2011, том 57, вып. 1, с. 95-105.
Черневская Е.А., Дмитриева И.Б., Белобородова Н.В., Диагностическая значимость белка S100B при критических состояниях (обзор). Общая реаниматология 2011. №6 (в печати).
Н.В.Белобородова, И.Т.Байрамов, А.Ю.Оленин, В.В Теплова. Н.И.Федотчева Роль микробных экзометаболитов в гипоксической дисфункции митохондрий при сепсисе. Патогенез. 2011, № 3, с.19.
Виноградова Т.Л. Инфекционный эндокардит: современное течение "Клиницист" 2011, №4, с. 4-8.
Чипигина Н.С. Риск тромбоэмболических осложнений при инфекционном эндокардите Тромбы, кровоточивость и болезни сосудов. 2011, №10, с.13-19.
- выступления с докладами:
Конгресс ВНОК: Перикардиты в терапевтической клинике.
Доклад на секции, посвященной инфекционному эндокардиту, III Всероссийская конференция по некоронарогенной патологии сердца (сентябрь 2011, г. Санкт-Петербург):
- участие в работе редколлегий:
- участие в аттестации специалистов:
член аттестационной комиссии НГМУ по терапии и кардиологии (А.А.Демин)
член Центральных аттестационных комиссий Минздрава по терапии и кардиологии (В.П.Тюрин)
Защита диссертации:
- другие образовательные проекты:
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубеж
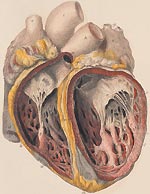
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубежом. По данным различных авторов, сегодня выросла заболеваемость в пожилом и старческом возрасте, а также среди лиц в возрасте до 30 лет, использующих внутривенное введение наркотиков [1, 2].
Известно, что ИЭ представляет собой заболевание инфекционной природы с первичной локализацией возбудителя на клапанах сердца, пристеночном эндокарде, протекающее с проявлениями системной инфекции, сосудистыми осложнениями и иммунной реакцией [3, 4, 5].
В данной работе обобщен опыт диагностики и ведения больных ИЭ на базе общетерапевтического отделения Александровской больницы Санкт-Петербурга за период 1998–2003 гг. Диагностика заболевания осуществлялась в соответствии с критериями Duke [8]. Диагноз ИЭ оценивался как достоверный при наличии двух главных критериев, а именно:
- при выделении типичного для ИЭ возбудителя при посевах крови больного;
- при определении эхокардиографических признаков поражения эндокарда - подвижные вегетации на клапанах сердца, абсцессов в области протеза клапана; образования внутрисердечных фистул и др., в сочетании с тремя или/и пятью вспомогательными критериями, к которым относились сосудистые осложнения (эмболии крупных артерий, септические инфаркты легких, внутричерепные кровоизлияния и др.), иммунологические феномены (гломерулонефрит, узелки Ослера, геморрагический васкулит и др.), а также фебрильная лихорадка, гепато-спленомегалия и другие проявления системной инфекции.
Нами было проведено обследование 105 больных ИЭ, из них у 80 человек в возрасте от 18 до 30 лет (первая группа) основным фактором риска заболевания являлась инъекционная наркомания.
Во второй группе больных (25 чел.) основными предрасполагающими факторами развития ИЭ были врожденные и приобретенные пороки сердца, а также протезированные клапаны.
У лиц старшей возрастной группы дополнительным фактором риска являлись дегенеративно-дистрофические изменения клапанов сердца.
Взаимосвязь характера поражения клапанов сердца и факторов риска ИЭ представлена в таблице 1.
По данным эхокардиографического исследования, у 100% больных первой группы были выявлены подвижные вегетации на створках трикуспидального клапана (ТК), что сопровождалось формированием его недостаточности I—III степени.
Во второй группе больных ИЭ отмечалось поражение левых камер сердца с образованием вегетаций на створках аортального и митрального клапанов. Изолированное поражение митрального клапана наблюдалось у двух человек с ревматическим пороком сердца (митральный стеноз), у одной больной с врожденным дефектом межжелудочковой перегородки и в единственном случае обструктивной формы гипертрофической кардиомиопатии.
Среди лиц пожилого и старческого возраста у девяти человек (36%) определялось изолированное поражение аортального клапана в отсутствии признаков аортального стеноза. Наряду с этим, у пяти больных (20%) в возрасте от 72 до 87 лет ИЭ развился на фоне аортального порока атеросклеротического генеза, причем у всех пятерых было выявлено сочетанное поражение аортального и митрального клапанов. Дегенеративно-дистрофические изменения других клапанов сердца определялись у 100% больных старшей возрастной группы.
Образование вегетаций на створках аортального клапана наблюдалось у двух больных с третичной формой сифилиса на фоне имеющегося аортального порока, связанного со специфическим процессом в аорте.
В двух случаях мы наблюдали развитие эндокардита протезированных клапанов.
При сопоставлении результатов посевов крови в двух группах больных определялись существенные различия как в частоте выделения микробной флоры, так и в видовом составе возбудителей эндокардита. По нашим данным, возбудителем ИЭ у больных-наркоманов в 71,3% наблюдений (57 чел.) являлся золотистый стафилококк, тогда как во второй группе, наряду с кокковой флорой, чаще обнаруживались грамотрицательные микроорганизмы (28%). Отрицательные результаты посевов крови значительно реже наблюдались в первой, чем во второй, группе больных ИЭ: 18,7% и 56% — соответственно. Данные относительно этиологической структуры ИЭ в обследуемых группах больных представлены в таблице 2.
Клиническое течение и характер осложнений инфекционного эндокардита во многом зависят от локализации клапанных вегетаций — в правых или левых камерах сердца, а также степени вирулентности возбудителя заболевания.
Течение ИЭ у больных-наркоманов отличалось особой тяжестью и полисиндромностью. Причиной госпитализации у большинства больных были острые осложнения основного заболевания. Значительная часть больных поступала в реанимационное отделение стационара с клиническими симптомами одно- или двухсторонней многофокусной пневмонии, причиной которой являлась септическая тромбоэмболия ветвей легочной артерии (72% больных). Течение пневмонии сопровождалось тяжелой дыхательной недостаточностью, нередко с развитием респираторного дистресс-синдрома (РДСВ) и очагами деструкции в легких (12%). Проявления вторичной нефропатии, которые обнаруживались у 100% больных в первой группе, иногда ошибочно трактовались как обострение хронического гломеруло- или пиелонефрита, мочекаменной болезни, что служило поводом для госпитализации этих больных в урологическое и нефрологическое отделения.
Во второй группе больных основной причиной госпитализации была длительная фебрильная лихорадка в сочетании с анемией и гепатолиенальным синдромом. Наряду с этим, у пяти человек (20%) поводом для госпитализации послужила прогрессирующая сердечная недостаточность.
Основные клинические синдромы, наблюдаемые у больных ИЭ первой и второй групп, представлены в таблице 3.
По нашим наблюдениям, характерной особенностью клинического течения ИЭ у больных-наркоманов являлась высокая частота септической ТЭЛА с формированием множественных очагов инфильтрации в легких. У многих больных легочные тромбоэмболии носили рецидивирующий характер (31,3% больных) и нередко осложнялись развитием деструктивных очагов в легких.
Образование вегетаций у 100% больных первой группы сопровождалось недостаточностью трехстворчатого клапана I—III степени с формированием потоков регургитации. Вместе с тем, у большинства пациентов не определялось тяжелых нарушений центральной гемодинамики, связанных с дисфункцией ТК. В данной группе больных характерной клинической особенностью был обратимый характер нарушений гемодинамики на фоне проводимой терапии. Острая сердечная недостаточность с дилятацией полостей сердца и снижением фракции выброса до 40% и ниже наблюдалась у 28 больных (35,3%) в связи с присоединением острого миокардита или на фоне сочетанного поражения клапанов сердца.
Вторичная нефропатия являлась одним из самых распространенных синдромов в первой группе больных ИЭ. Острая почечная недостаточность наблюдалась у 16 больных, причем у 10 из них она носила обратимый характер и была связана с острым ДВС-синдромом, а также с острой сердечной недостаточностью с отеками. Инфекционно-токсическая нефропатия регистрировалась в 73,8% наблюдений и сопровождалась мочевым синдромом — гематурией, протеинурией, лейкоцитурией — при достаточном уровне клубочковой фильтрации.
Характерной особенностью ИЭ во второй группе было подострое течение заболевания с длительным периодом лихорадки на догоспитальном этапе, причем в пожилом и старческом возрасте лихорадка носила субфебрильный характер с редкими подъемами температуры до фебрильных цифр.
Большинство больных подострым инфекционным эндокардитом (ПИЭ) поступали в стационар в стадии развернутой клинической картины заболевания с клиническими признаками тромбоэмболии сосудов большого круга кровообращения. В данной группе больных наиболее распространенными следует признать такие осложнения, как церебральные эмболии с развитием ишемических и геморрагических инсультов, эмболии почечных сосудов с болевым синдромом и гематурией, а также формирование острых очаговых изменений в миокарде, связанных с эмболией коронарных сосудов или прикрытием устьев коронарных артерий вегетациями [9].
Септические тромбоэмболии церебральных сосудов нередко сопровождались развитием гнойного менингоэнцефалита с летальным исходом. Вместе с тем, при посевах крови у 56% больных второй группы не получено роста микробной флоры. Обращает на себя внимание тот факт, что септицемия у больных с положительными результатами посевов крови в 28% наблюдений была обусловлена грамотрицательной микрофлорой. В этой категории больных источником бактериемии являлись очаги хронической инфекции в мочеполовой системе, а у двух больных (по данным аутопсии) был выявлен двухсторонний апостематозный нефрит.
У значительного числа больных ПИЭ (62%) определялись признаки острой недостаточности кровообращения с застойными хрипами в легких, легочной гипертензией, увеличением полостей сердца и периферическими отеками.
В этой группе больных чаще, чем в первой, наблюдалась преренальная азотемия и ОПН, связанные с развитием острой недостаточности кровообращения.
Острый диффузный миокардит, типичными проявлениями которого были различные нарушения ритма, диагностирован у 27% больных второй группы.
Анемия со снижением уровня гемоглобина до 80 г/л и менее выявлена у 100% больных второй группы. Значительное увеличение СОЭ (более 45 мм/ч) наблюдалось у 85,8% больных подострым ИЭ.
Кожные изменения в виде геморрагических высыпаний, пурпуры Шенлейн-Геноха, а также другие проявления иммунного воспаления в обеих группах больных встречались нечасто — 6,3 и 4% в первой и второй группах, соответственно.
Консервативная терапия больных ИЭ проводилось с использованием антибиотиков широкого спектра действия в сочетании со средствами дезинтоксикационной, антикоагулянтной и метаболической терапии. В составе антибактериальной терапии больные получали цефалоспорины III-IV поколений в комбинации с аминогликозидами и метронидазолом. Из группы цефалоспоринов назначались: цефтриаксон (лонгацеф) 2 г в сутки внутривенно (в/в), или цефотаксим (тальцеф) 2 г в сутки в/в, или цефепим (максипим) 2 г в сутки в/в в сочетании с аминогликозидами (амикацин в суточной дозе 1,5 г в/в) и метронидазолом по 1,5-2 г в сутки в/в. В случае, если такая терапия оказывалась неэффективной или существовали противопоказания к вышеперечисленным препаратам, применялись антибиотики группы линкозаминов: клиндамицин 1,2 г в сутки в/в или линкомицин 3 г в сутки в/в в сочетании со фторхинолонами (ципрофлоксацин 400 мг в сутки в/в). В условиях отделения реанимации в течение пяти–семи дней проводилась терапия имипинемом (тиенамом) в дозе 2—4 г в сутки в/в или рифампицином в суточной дозе 0,45—0,6 г в/в. Средняя продолжительность курса антибиотикотерапии в обследуемой группе больных составила 28 + 3,5 дней.
Дезинтоксикационная терапия включала в себя внутривенные инфузии реополиглюкина, гемодеза, поляризующих смесей в сочетании с петлевыми диуретиками. Объем вводимой жидкости составлял в среднем 2-2,5 л в сутки. В течение всего периода инфузионной терапии осуществлялся контроль за функциональным состоянием почек, электролитным составом крови, суточным диурезом. В условиях отделения реанимации у всех больных осуществлялся мониторинг ЦВД. Инфузионная терапия проводилась в течение всего острого периода заболевания до купирования проявлений интоксикационного синдрома. Средняя продолжительность курса составила 22 + 4,5 дня.
Развитие легочной эмболии, особенно в сочетании с признаками острого ДВС-синдрома в стадии гиперкоагуляции, служило основанием для назначения антикоагулянтной терапии. Начальная доза гепарина составляла 10 тыс. ЕД внутривенно, струйно, за-тем — по 1000 ЕД в час внутривенно, капельно с переходом на подкожное введение до 30 тыс. ЕД в сутки. Введение гепарина осуществлялось под контролем показателей коагулограммы и времени свертывания крови. Одновременно проводились внутривенные трансфузии свежезамороженной плазмы по 300 мл в сутки с добавлением 2500–5000 ЕД гепарина. Анемия тяжелой степени (Нb менее 80 г/л, Ht ≤25) корригировалась переливаниями эритроцитарной массы (пять–семь доз). При наличии гипопротеинемии использовалось введение растворов аминокислот, альбумина или нативной плазмы. Выявление клинических и рентгенологических признаков отека легких на фоне рецидивирующего течения септической ТЭЛА служило показанием для назначения кортикостероидов (преднизолон от 120 до 200 мг в сутки внутривенно капельно). Терапия антикоагулянтами прямого действия в сочетании с трансфузиями криоплазмы проводилась до стойкого улучшения показателей гемостаза. Критериями нормокоагуляции являлись уровень фибриногена в плазме 3-4 г/л, отсутствие тромбоцитопении, нормализация ВСК, АЧТВ, тромбинового времени, а также отрицательные паракоагуляционные тесты. По нашим данным, купирование проявлений острого ДВС-синдрома на стадии гиперкоагуляции у 75% больных отмечалось на седьмой–десятый день от начала комплексной терапии.
У части больных формировалась резистентность к проводимой антибактериальной терапии, которая характеризовалась нарастанием интоксикации, фебрильной лихорадкой, прогрессирующей анемией, а также высевами из крови возбудителя ИЭ – золотистого стафилококка — в 65% наблюдений. При рентгенологическом обследовании данной категории больных с большой частотой определялись очаги деструкции легочной ткани, а у трех больных гнойный выпот в плевральной полости.
Длительное применение антибиотиков широкого спектра действия у 70,3% больных (38 чел.) сопровождалось развитием побочных эффектов антибактериальной терапии. Кандидоз полости рта глотки, пищевода, а также кишечный дисбактериоз III-IV стадии был выявлен у 36 больных (66,7%). Применение антибиотиков с гепатотоксическими свойствами (цефалоспорины, линкозамины, метронидазол) у двух больных (3,7%) с хроническим гепатитом С и В приводило к прогрессированию печеночной недостаточности, которая сопровождалась высокой ферментемией (АЛТ 1500 ЕД, АСТ 1000 ЕД) и желтухой.
Развитие застойной сердечной недостаточности с появлением акроцианоза, влажных хрипов в базальных отделах легких, периферических отеков в сочетании с кардиомегалией и падением фракции выброса до 50—45% наблюдалось у пяти больных (9,3%) на фоне массивной инфузионной терапии.
Длительная антикоагулянтная терапия в 20,4% (11 чел.) наблюдений сопровождалась повышением толерантности плазмы к гепарину, что клинически выражалось в развитии периферических флеботромбозов, в то время как гепарининдуцированной тромбоцитопении в обследуемой группе больных мы не наблюдали.
Положительные результаты консервативной терапии были получены у 70,2% больных (56 чел.) с поражением ТК и лишь у 32% пациентов (6 чел.) из второй группы. Исходом ИЭ в обеих группах больных являлось формирование недостаточности клапанов сердца.
Госпитальная летальность при ИЭ у наркозависимых лиц составила 29,4% (24 чел.), тогда как у больных с поражением левых камер сердца (вторая группа) уровень смертности составил 68% (19 чел.).
По данным аутопсии, основными причинами смерти больных ИЭ были:
- септикопиемия с формированием гнойных очагов в печени, почках селезенке, головном мозге с развитием полиорганной недостаточности (46,2%);
- сердечная недостаточность на фоне полипозно-язвенного эндокардита с разрушением клапанов сердца, а также острый миокардит с дилятацией полостей сердца (39,4%);
- вторичная нефропатия с развитием почечной недостаточности, отеком легких, отеком головного мозга (14,4%).
Таким образом, характерные особенности ИЭ у лиц с наркотической зависимостью — это острое течение заболевания с поражением правых камер сердца и рецидивами септической ТЭЛА. Возбудителем ИЭ у инъекционных наркоманов в 71,3% является высоковирулентный золотистый стафилококк. Формирование недостаточности трехстворчатого клапана I—III степени стало самым распределенным осложнением ИЭ у наркоманов. При этом у большинства больных не наблюдается тяжелых нарушений центральной гемодинамики, приводящих к развитию острой недостаточности кровообращения.
Подострый ИЭ у больных с предрасполагающими заболеваниями сердца, а также у лиц пожилого и старческого возраста протекает с преимущественным поражением левых камер сердца, причем в старшей возрастной группе преобладает моноклапанное поражение. Наличие сопутствующей патологии у лиц старше 60 лет маскирует течение основного заболевания, чем и обусловлены поздняя диагностика и высокая смертность больных. Для затяжного течения ИЭ характерна низкая высеваемость возбудителя, по сравнению с острыми формами заболевания. Развитие тромбоэмболий сосудов большого круга кровообращения является характерной клинической особенностью подострого ИЭ.
Положительный эффект от проводимой консервативной терапии наблюдается у большинства больных ИЭ с поражением ТК, тогда как при подостром эндокардите левых камер сердца консервативная терапия является малоэффективной у большинства больных.
Госпитальная летальность в обеих группах больных обусловлена диссеминацией возбудителя с формированием гнойных очагов и полиорганной недостаточностью, а также развитием острой недостаточности кровообращения и вторичной нефропатии.
- Буткевич О. М., Виноградова Т. Л. Инфекционный эндокардит. - М., 1997.
- Симоненко В. Б., Колесников С. А. Инфекционный эндокардит: современное течение, диагностика, принципы лечения и профилактики. - Клин. мед., 1999. - 3. - С. 44-49.
- Тазина С. Я., Гуревич М. А. Современный инфекционный эндокардит. - Клин. мед.,1999. - 12. - С. 19-23.
- Bansal R. C. Infective endocarditis. Med Clin North America 1995; 79 (5): 1205-1239.
- Bayer A. S., Bolger A. F., Taubert K. A. et al. Diagnosis and management of infective endocarditis and its complications. Circulation 1998; 98: 2936-2948.
- McKinsey D. S., Ratts T. E., Bisno A. I. Underlying cardiac lesions in adults with infective endocarditis. The changing spectrum. Amer J Med 1987; 82: 681-688.
- Lamas C. C. Eykyn S. J. Suggested modifications to the Duke criteria for the clinical diagnosis of native valve and prosthetic valve endocarditis: analysis of 118 pathologically proven cases. Clin Infect Dis 1997; 25: 713-719.
- Durack D. T., Lukes A. S., Bright D. K. et al. New criteria for diagnosis of Infective Endocarditis Utilization of Specific Echocardiographic Finding. Amer J Med 1994; 96: 200-209.
- Тюрин В. П., Дубинина С. В. Инфекционный эндокардит у лиц пожилого и старческого возраста. - Клин. мед., 2000. - 4. - С. 53-56.
В. И. Уланова
В. И. Мазуров, доктор медицинских наук, профессор
Медицинская академия последипломного образования, Санкт-Петербург
Полный текст:
Baddour L.M., Wilson W.R., Bayer A.S. et al. Infective endocarditis: diagnosis, antimicrobial therapy, and management of complications. Circulation 2005; 111(23): 3167-84.
Baldassarre J.S., Kaye D. Principles and overview of antibiotic therapy. In: Kaye D., editor. Infective endocarditis. New York: Raven Press, 1992; 169-90.
Wilson W.R., Karchmer A.W., Dajani A.S. et al. Antibiotic treatment of adults with infective endocarditis due to Streptococci, Enterococci, Staphylococci and HACEK microorganisms. JAMA 1995; 274 (21): 1706-13.
Francioli P., Ruch W., Stamboulian D. et al. Treatment of streptococcal endocarditis with a single daily dose of ceftriaxone and netylmicin for 14 days: a prospective multicenter study. Clin Infect Dis 1995; 21; 1406-10.
Рациональная антимикробная фармакотерапия. Ред. В.П. Яковлев, С.В. Яковлев. М.: Литтерра, 2003.
Sexton D.J., Tenenbaum M.J., Wilson W.R. et al. Ceftriaxone once daily for four weeks compared with ceftriaxone plus gentamicin once daily for two weeks for treatment of endocarditis due to penicillin-susceptible streptococci. Endocarditis Treatment Consortium Group Clin Infect Dis 1998; 27: 1470-4.
Donzelot E., Kaufmann H., Castel Y. Interet de la cortisone dans traitement des endocarditis infectienses a hemoculture negative. Sem Hop Paris 1952; 28: 1371-4.
Brown M., Griffin G.E. Immune response in endocarditis. Heart 1998; 79 (1): 1-2.
Le Moing V., Lacassin F., Delahousse M. et al. Use of corticosteroids in glomeru-lonephritis related to infective endocarditis: three cases and review. Clin Infect Dis 1999; 28 (5): 1057-62.
Демин А.А., Тростина Н.А. Примене- ние стероидных гормонов при затяжном септическом эндокардите. В кн.: Вопросы иммунопатологии в клинике и эксперименте. М., 1966: 39-46.
Буткевич О.М. Инфекционный эндокардит (клиника, диагностика, лечение). Врач 1996; 6: 2-6.
Виноградова Т.Л., Буткевич О.М., Анохин В.Н. и др. Анализ современного течения и результатов терапии инфекционного эндокардита. Кардиология 1995; 6: 54-7.
Гуревич М.А., Тазина С.Я. Особенности современного инфекционного эндокардита. РМЖ 1998; 6 (16): 1024-35.
Чипигина Н.С., Новиков Ю.И., Гапченко Н.Д. О применении глюкокортикоидов при инфекционном эндокардите. Ревматология 1984; 4: 24-30.
Garner J.L., Touraine J.L., Colon S. Immunology of infective endocarditis. Eur Heart J 1984; 5 (suppl. C): 3-9.
Neugarten J., Gallo G.R., Baldwin D.S. Glomerulonephritis in bacterial endocarditis. Am J Kidney Dis 1984; 3: 371-9.
Stuck A.E., Minder C.E., Frey F.G. Risk of infectious complications in patients taking glucocorticoids. Rev Infect Dis 1989; 11 (6): 954-63.
McGee S., Hirschman J. Use of corticosteroids in treating infectious diseases. Arch Intern Med 2008; 168(10): 1034-46.
Nguyen T.H., Tran T.H., Thwaites G. et al. Dexamethasone in Vietnamese adolescents and adults with bacterial meningitis. N Engl J Med 2007; 357 (24): 2431-40.
Peltola H., Roine I., Fernanndez J. et al. Adjuvant glycerol and/or dexamethasone to inprove the outcomes of chilhood bacterial meningitis: a prospective, randomized, double-blind, placebo-controlled trial. Clin Infect Dis 2007; 45(10): 1277-86.
Confalonieri M., Urbino R., Potena A. et al. Hydrocortisone infusion for severe community-acqured pneumonia:a preliminary randomized study. Am J Respir Crit Care Med 2005; 171(3): 242-8.
Thwaites G.E., Nguyen D.B.,
Nguyen H.D. et al. Dexamethasone for the treatment of tuberculous meningitis in adolescents and adults. N Engl J Med 2004; 351(17): 1741-51.
Strang J.I., Nunn A.J., Johnson D.A. et al. Management of tuberculous constrictive pericarditis and tuberculous pericardial effusion in Transkei: results at 10 years follow-up. QJM 2004; 97(8): 525-35.
Annane D., Sebille V., Charpentier C. et al. Effect of treatment with low doses of hydrocortisone and fludrocortisone on mortality in patients with septic shock. JAMA 2002; 288(7): 862-71.
Буткевич О.М., Виноградова Т.Л. Инфекционный эндокардит: резистентность к терапии и методы ее преодоления. Кардиология 2005; 3: 92-4.
Wilson W., Taubert K.A., Gewitz M. et al. Prevention of infective endocarditis: guidelines from the American Heart Association: a guideline from the American Heart Association Rheumatic Fever, Endocarditis and Kawasaki Disease Committee, Council on Cardiovascular Disease in the Young, and the Council on Clinical Cardiology, Council on Cardiovascular Surgery and Anesthesia, and the Quality of Care and Outcomes Research Interdisciplinary Working Group. Circulation 2007; 116(15): 1736-54.
Белов Б.С. Профилактика инфекционного эндокардита: современные аспекты. Consilium Medicum 2008; 10(1): 79-85.
Horstkotte D., Follath F., Gutschik E. et al. Guidelines on prevention, diagnosis and treatment of infective endocarditis executive summary; the task force on infective endocarditis of the European society of cardiology. Eur Heart J 2004; 25(3): 267-76.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Читайте также:


