Диета при лимбическом энцефалите
Рассмотрены этиопатогенез паранеопластических синдромов (ПНС), способы диагностики, клинические варианты ПНС, подходы к лечению больных. Важную роль в лечении ПНС играет детский невролог, вначале инициируя поиск опухоли, а по окончанию ее терапии корректи
Aetiopathogenesis of paraneoplastic syndromes (PNS) was considered, as well as ways of diagnostics, clinical variations of PNS, approaches to the patients treatment. A children's neurologist plays an important role in PNS treatment, at first initiating the tumor search, and correcting neurological consequences after finishing its therapy.
M. Пранцателли. Паранеопластические синдромы: нераскрытое убийство [5]
Паранеопластические синдромы (ПНС) — это страдание органов, удаленных от места новообразования и его метастазов, не связанное с инфекцией, ишемией или метаболическими нарушениями [1]. Кахексия, гиперкальциемия, синдром Кушинга, синдром Труссо возникают потому, что опухоль секретирует вещества, похожие на гормоны, или вызывает перекрестные аутоиммунные реакции между опухолевой и нормальной тканью. ПНС поражают эндокринные железы, нервную систему, кожу, кровь (табл. 1), изолированно или сочетанно [2].
Наиболее драматичным течением обладают ПНС, поражающие центральную и периферическую нервную систему, нервно-мышечные синапсы и мышцы. Может страдать один отдел (как при лимбическом энцефалите) или один тип клеток (клетки Пуркинье в мозжечке), а может возникать многоуровневое поражение (энцефаломиелополиневропатия). ПНС сопровождают примерно 200 видов опухолей, имеющих разное происхождение и удаленность от неврологического очага, чаще локализующихся в грудной или брюшной полости.
Симптомы ПНС иногда развиваются настолько быстро, что ошибочно трактуются как инсульт. У 50% пациентов ПНС раньше дает о себе знать, чем опухоль. Течение процесса может быть монофазным (симптомы достигают плато, а затем наступает улучшение или стабилизация) или неуклонно прогрессирующим. Описаны случаи, когда опухоль обнаруживают спустя несколько лет после развития неврологических симптомов. Часто именно ПНС заставляют пациента обратиться к врачу. Диагностика осложняется тем, что ПНС не патогномоничны только для опухолей [1].
Клетки опухоли (тимома, мелкоклеточный рак легкого, рак молочной железы и яичников; у детей — нейробластома) экспрессируют онконевральные антигены, которые в норме встречаются в иммунологически привелигированных областях — нервной системе и яичках. Открытие онконевральных антител в 1965 г. привело к широко распространенной в настоящее время гипотезе, что ПНС — иммунологическое расстройство. Предположительно, сходство антигенов опухоли и нервной ткани приводит к потере толерантности и индукции иммунного ответа как против опухоли, так и против нормальных нейронов. Антитела к антигенам опухоли начинают атаковать ядра нейронов, структурные элементы, поверхностные рецепторы, синапсы и ионные каналы [3].
Лучший способ диагностики ПНС — выявление известных антионконевральных белков в сыворотке пациента. Эти антитела специфичны (> 90%) для опухолей, поэтому возможна диагностика рака на доклинической стадии. Например, антитела Tr выявляются только при лимфоме и мозжечковой дегенерации. VGCC-антитела (к мембранным каналам) вырабатываются при миастеническом синдроме Ламберта–Итона [4]. Однако у 30% пациентов антитела не выявляются, а у 5–10% антитела атипичные или обнаруживаются при разных ПНС. Отсутствие антител не исключает ПНС [1].
Являются ли онконевральные антитела причиной лизиса клеток? На животных моделях не удалось воспроизвести неврологические нарушения путем активной иммунизации или пассивной передачи, даже интратекально. В ответ на иммунизацию у животных вырабатываются сывороточные антитела, но неврологические симптомы не появляются. Таким образом, онконевральные антитела, возможно, только указывают на аутоиммунный процесс, но не вызывают его. Существует гипотеза, что важную роль в патогенезе ПНС играют клеточные иммунные механизмы, но ее тоже не удалось воспроизвести на животной модели. Таким образом, аутоиммунную гипотезу ПНС еще предстоит доказать [5].
Паранеопластический энцефаломиелит
Паранеопластический энцефаломиелит характеризуется одновременным поражением различных областей центральной нервной системы (гиппокамп, ствол мозга, спинной мозг, спинно-мозговые ганглии). Клиническая картина соответственно очагам включает: лимбический энцефалит, альтернирующие синдромы, вегетативные нарушения, миелит, мозжечковую дегенерацию, сенсорную невропатию. Реже встречаются паркинсонизм, хорея, оромандибулярная дистония, нейрогенная гиповентиляция. Вегетативные синдромы (ортостатическая гипотензия, сухость во рту, задержка мочи, зрачковые нарушения, импотенция) встречаются в 30% случаев [1–3].
Лимбический энцефалит
Лимбический энцефалит характеризуется подострым началом в виде спутанного сознания с грубым снижением кратковременной памяти. Нередки судороги, которые могут опережать развитие когнитивного дефицита на несколько месяцев. У части пациентов дебютным проявлением служит не эпилепсия с деменцией, а депрессия с тревогой и галлюцинозом. Типичны синдромы поражения гипоталамуса (сонливость, гипертермия, эндокринопатии) и среднего мозга. Лимбический энцефалит вызывают мелкоклеточный рак легкого (50%), опухоли яичка (20%), рак молочной железы (8%). Антитела можно выявить у 50% пациентов. В спинномозговой жидкости выявляется плеоцитоз и повышение содержание белка. Данные магнитно-резонансной томографии (МРТ), как правило, соответствуют норме, но иногда наблюдается изменение сигнала в одной или обеих височных долях медиально. Морфологические изменения в лимбической системе и базальных ганглиях включают: апоптоз нейронов, реактивность микроглии, периваскулярную лимфоцитарную инфильтрацию. Дифференциальный диагноз следует проводить с протекающим более остро герпетическим энцефалитом, в том числе после трансплантации костного мозга, успешно лечащимся в первые часы заболевания [6].
Паранеопластическая мозжечковая дегенерация
Паранеопластическая мозжечковая дегенерация характеризуется быстрым развитием тяжелой атаксии из-за гибели большого числа клеток Пуркинье при относительной сохранности других нейронов мозжечка. Данные компьютерной томографии (КТ) и МРТ-исследования сначала соответствуют норме, а позже выявляют грубую атрофию мозжечка. Дегенерация встречается при разных видах опухолей (рак молочной железы, яичника, лимфома), и при этом могут обнаруживаться различные антитела. Обычно заболевание дебютирует шаткой походкой и дизартрией, затем быстро прогрессирующая мозжечковая атаксия приковывает больного к постели. Смерть наступает от бульбарных нарушений. Патогномоничен нистагм, бьющий вниз. Большинство пациентов жалуются на головокружение, двоение в глазах, дисфагию. Симптоматика, как правило, симметрична. Анализ цереброспинальной жидкости обычно в норме, но его необходимо проводить для исключения метастазов в оболочки мозга, при которых также отмечается шаткость при ходьбе, стабилизирующаяся через несколько месяцев. Лечение неэффективно, даже если резецирована материнская опухоль [7].
Паранеопластический опсоклонус-миоклонус
Паранеопластический опсоклонус-миоклонус наблюдается в трех случаях: 1) у детей с нейробластомой, 2) у взрослых женщин с Ri-антителами и раком молочной железы, 3) у взрослых пациентов без паранеопластических антител с мелкоклеточным раком легких. Симптомы включают опсоклонус (непроизвольные движения глаз), генерализованный миоклонус, мозжечковую атаксию, поведенческие нарушения — раздражительность, нарушения сна. Описано несколько специфических аутоантител, в частности, анти-Ri-антитела (при раке молочной железы, мелкоклеточном раке легкого), антитела к нейрофиламентам у детей с нейробластомой.
Нейробластома — самая частая солидная опухоль у детей. 50% случаев заболевания подвергаются самостоятельному регрессу. Метастазы редки. Морфологические изменения включают апоптоз клеток Пуркинье, атрофию нижних олив, нижних отделов ствола или верхних шейных сегментов мозга. Иногда морфологических изменений не находят. Специфическим паранеопластическим процессом у детей с нейробластомой является опсоклонус-миоклонус. Он остро дебютирует в возрасте до 4 лет — походка становится шаткой, ребенок начинает часто падать, иногда из-за тяжести атаксии даже перестает ходить. Также возникают слюнотечение, опсоклонус, раздражительность, диссомния. Лечение опсоклонуса-миоклонуса — резекция опухоли и иммунотерапия. Если опухоль продолжает расти, неврологические симптомы прогрессируют, несмотря на иммунотерапию. Но даже при успешном лечении нейробластомы большинство детей инвалидизируются из-за нарушений поведения и задержки психоречевого развития. У них сохраняются также диссомния и вспышки агрессии. Существует гипотеза, что развитие опсоклонус-миоклонуса у детей помогает иммунной системе. У многих пациентов выявляют антитела, которые реагируют с поверхностными антигенами нейронов. Известные в настоящее время методы лечения являются неспецифическими и включают нецитостатические и цитотоксические препараты, внутривенные иммуноглобулины, плазмаферез и адсорбцию антител. Также применяют резекцию опухоли и тимэктомию. Сочетание этих методов позволяют снизить дозировку кортикостероидов. Остается проблема оптимизации схемы иммунотерапии [7, 8].
Ниже приведен клинический пример, иллюстрирующий течение заболевания, динамику параклинических исследований и терапию.
Проведенное обследование и лечение приведены в табл. 2 и 3.
В статусе (возраст 4 года 4 месяца): Вес 21,7 кг. Медикаментозный синдром Иценко–Кушинга. Легкое сходящее косоглазие. Мышечный тонус изменен по пластическому типу: в руках D > S, в ногах S > D. Ходит самостоятельно. Походка не нарушена. Сухожильные рефлексы средние S ≥ D. Умеренно выраженный интенционный тремор в левой руке при захвате предметов. Выполняет команды и инструкции, понимает обращенную речь, речь фразовая, отвечает на вопросы в плане заданного, знает основные цвета. (По шкале оценки двигательной функции при опсоклонус-миоклонус синдроме (M. R. Pranzatelli, 2002) — 2 балла, 1-я степень тяжести.)
Миелит и острая некротизирующая миелопатия
Миелит и острая некротизирующая миелопатия быстро прогрессирует. Морфологически выявляют обширный некроз белого и серого вещества, особенно в грудных сегментах [3].
Паранеопластическая ретинопатия при мелкоклеточном раке легкого
Симптомы обычно возникают с двух сторон и отражают одновременное повреждение колбочек и палочек. У пациентов отмечается фотосенситивность, снижение остроты зрения, нарушение цветового восприятия, кольцевые скотомы, никталопия (куриная слепота) и удлинение адаптации к темноте. Офтальмоскопия выявляет сужение артериол и пигментный ретинит, электроретинограмма — ослабление ответа на свет [1, 3].
Паранеопластическая ретинопатия при меланоме
Паранеопластическая ретинопатия при меланоме характеризуется другими симптомами. Острота зрения и цветовое зрение не нарушено, но развиваются внезапные мерцающие фотопсии, куриная слепота и легкое периферическое сужение полей зрения. Симптомы объясняются дисфункцией зрительных нервов, периферическая нервная система не страдает. Типичны антитела к биполярным клеткам сетчатки. Иногда отмечаются увеит, оптическая нейропатия или ретинопатия.
Синдром жесткого человека
Это редкий неврологический синдром, характеризующийся ригидностью мышц, чаще мышц туловища и проксимальных отделов нижних конечностей, которая возникает при совместном сокращении мышц-агонистов и антагонистов. Чувствительные раздражители вызывают болезненные крампи. Болезнь начинается с рук. Электромиография выявляет непрерывную активность двигательных единиц в пораженных мышцах в состоянии покоя. Это заболевание чаще имеет аутоиммунную природу (анти-GAD антитела у 70% больных). Паранеопластический вариант развивается при раке молочной железы, кишечника, легких, болезни Ходжкина, тимоме [1].
Синдромы двигательных нейронов
Сочетание бокового амиотрофического склероза и рака отмечается нередко [4]. Но является ли эта болезнь двигательного нейрона паранеопластическим процессом? На этот вопрос пока нет ответа. Периферическая нервная система часто страдает у онкологических больных, что проявляется моторными, сенсорными, вегетативными и смешанными невропатиями. Этиология полиневропатий при раке не обязательно паранеопластическая, чаще это метаболические, трофические, ятрогенные и токсические факторы. Паранеопластический вариант отличается быстрым нарастанием симптомов и плохим ответом на лечение.
Сенсорная невропатия
Хронические воспалительные демиелинизирующие полиневропатии
Хронические воспалительные демиелинизирующие полиневропатии имеют атипичное течение, резистентны терапии, быстро и драматично прогрессируют.
Паранеопластическая вегетативная невропатия
Данный вид невропатии проявляется панвегетативным синдромом (ортостатическая гипотензия, ангидроз, атония мочевого пузыря, патология зрачков, рвота и тошнота, нарушение саливации и слезоотделения) или псевдообструкцией кишечника.
Хроническая псевдообструкция кишечника
Хроническая псевдообструкция кишечника отмечается у пациентов с тимомой и мелкоклеточным раком легкого. Характерно снижение веса, хронические запоры и метеоризм в результате повреждения нейронов кишечного сплетения. Нарушение моторики пищевода приводит к дисфагии, тошноте и рвоте. Радиологические исследования показывают парез желудка, тонкой или толстой кишки. Манометрия пищевода выявляет спазмы или ахалазию. У некоторых пациентов выявляют антитела к нейронам вегетативных ганглиев, например к рецепторам ацетилхолина [1].
Миастенический синдром Ламберта–Итона
Миастенический синдром Ламберта–Итона является аутоиммунным заболеванием нервно-мышечного синапса, характеризуется слабостью мышц и трофическими нарушениями, преимущественно в нижних конечностях. 60% случаев являются паранеопластическими. В среднем в течение двух лет после установления диагноза выявляют мелкоклеточный рак легкого. На электромиограмме (ЭМГ) отмечается снижение потенциала нервно-мышечного синапса после стимуляции нерва с декрементом при низкой частоте стимуляции (3 Гц) более чем на 10%, прирост после стимуляции высокими частотами (более 20 Гц) более чем на 100%. Серологических маркеров не существует. Антитела присутствуют почти у всех пациентов, как при паранеопластической, так и при непаранеопластический форме. Может сочетаться с мозжечковой дегенерацией [4].
Myasthenia gravis
Myasthenia gravis является самым изученным аутоиммунным заболеванием, протекающим с повреждением постсинаптических рецепторов ацетилхолина в нервно-мышечном синапсе. Примерно в 10–15% случаев миастении выявляется тимома, и наоборот — примерно 30% пациентов с тимомой имеют миастению. Следовательно, миастению можно считать паранеопластическим процессом [5].
Нейромиотония
Нейромиотония — это мышечные спазмы, крампи, ригидность, миокимия. Дифференциальный диагноз проводят с синдромом Шегрена и интоксикацией цисплатином. Морфологически обнаруживают инфильтрацию вокруг нейронов спинномозговых ганглиев. ЭМГ-изменения характерны для миотонии. Заболевание связано с выработкой антител к калиевым каналам [4]. Мышцы при ПНС могут страдать с формированием симптомов полимиозита/дерматомиозита, острой некротизирующей миопатии.
Анализы крови и цереброспинальной жидкости, МРТ, ЭЭГ, ЭМГ редко подтверждают диагноз ПНС. Дифференциальный диагноз проводят с различными структурными повреждениями головного мозга, метастазами оболочек, аутоиммунными заболеваниями, синдромом Шегрена–Ларссона, а также с нейроинфекциями, васкулитами или гранулематозами ЦНС [1, 3].
В цереброспинальной жидкости находят умеренный плеоцитоз, небольшое повышение уровней белка и IgG. Наиболее важный диагностический критерий — специфические антитела в плазме крови и цереброспинальной жидкости, их выявление значительно облегчает поиск опухоли. К сожалению, почти у 50% больных с ПНС нет известных антител, а размеры опухоли могут быть меньше, чем пределы разрешения КТ. Оптимальным методом выявления опухоли в настоящее время является позитронная эмиссионная томография всего тела с фтордезоксиглюкозой.
Отсутствие антител и опухоли не исключает диагноз. Исследования необходимо повторять каждые 6 месяцев до установления диагноза, обычно в течение 2–3 лет. Большинство опухолей диагностируется в течение 4–6 месяцев. Риск выявления рака значительно уменьшается через два года после манифестации ПНС и становится очень низким через четыре года.
Лечение пациентов с ПНС проводят по двум направлениям: 1) резекция опухоли, 2) подавление иммунной реакции. Терапия зависит от вида паранеоплатического синдрома, опухоли и наличия антител. ПНС редко улучшается после иммуномодулирующего лечения, так как в большинстве случаев нейрональные структуры уже необратимо повреждены. Основная цель лечения — регресс опухоли. У некоторых пациентов отмечается улучшение при использовании внутривенных иммуноглобулинов, стероидов, ритуксимаба или плазмафереза [1].
Нервно-мышечные паранеопластические синдромы, особенно синдром Ламберта–Итона, имеют относительно благоприятный прогноз. ПНС с повреждением центральной нервной системы обычно быстро прогрессируют и не корректируются. Иногда состояние пациента улучшается после резекции опухоли. Тем не менее, согласно многочисленным публикациям, у пациентов с ПНС прогноз лучше, чем без него. Предположительно, это является не только результатом ранней диагностики рака, но следствием более сильного иммунного ответа на опухоль [1, 4].
ПНС у детей отличаются тем, что разрушают незрелый и развивающийся мозг. Если опухоль диагностируют, своевременное лечение рака приводит к длительной и стойкой ремиссии, но неврологические осложнения ПНС не всегда обратимы. Важную роль в лечении ПНС играет детский невролог, вначале инициируя поиск опухоли, а по окончанию ее терапии корректируя неврологические последствия [8]. Учитывая редкость данных состояний, эффект лечения маленького пациента зависит не только от эрудиции невролога, но и от его умения работать с клиницистами других специальностей.
Литература
М. Ю. Бобылова* , 1 , кандидат медицинских наук
Е. С. Ильина**
Е. Ст. Ильина***, кандидат медицинских наук
* ИДНЭ им. Свт. Луки,
** ГБОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ,
*** ФГБУ РДКБ МЗ РФ, Москва

Это болезнь головного мозга воспалительного характера.
Классификация энцефалита, его виды, причины возникновения и симптомы:
- Эпидемический (энцефалит Экономо или летаргический, энцефалит А) – причиной возникновения является вирус, которым человек заражается контактным или воздушно-капельным путем. Симптоматика: резкий подъем температуры до 40 градусов, боль и ломота в суставах, повышенная потливость, нарушения сна (у больного может быть бессонница или гиперсомния), путается сознание, зачастую появляются проблемы с психикой (может быть бред или эйфория). Осложнения: диплопия, паралич взора, косоглазие.
- Клещевой – для этого вида характерна сезонность (наибольшая вероятность заболеть в весенне-летний период), возбудителем является клещ, зараженный вирусом. Механизм передачи – через укус насекомого. Первыми признаками энцефалита после укуса клеща являются тошнота и рвота, сильные головные боли, боязнь света, повышенная температура. Также, были зафиксированы судорожные и эпилептические припадки, паралич шеи.
- Комариный (японский или энцефалит В). Переносчики – комары, птицы и инфицированные люди. Болезнь начинается резко: поднимается температура тела, больного сильно знобит, тошнит и тревожат рвотные позывы, отмечается сильная слабость и боли в мышцах. Затем у него путается сознание, могут быть сильные судороги, тремор конечностей, при тяжелом течении поражаются нервные окончания черепа (возникает бульбарный паралич). Смертельный исход, по статистическим данным, составляет 50% и наступает на первой неделе заражения.
- Герпетический – возникает из-за наличия вируса герпеса в организме, которым поражается кора головного мозга и белое вещество. Отмечается длительное и медленное течение заболевания (из-за умения вируса долго сохранятся в организме). При остром течении болезни возникают проблемы с координацией движений, ориентацией в пространстве и времени. При этом присутствует повышенная температура, рвотные рефлексы, сильные головные боли, апраксия и афазия.
- Токсико-геморрагический (гриппозный) – возникает в следствии гриппа. Проявляется в виде основных симптом гриппа, также, характерным является сильная потеря веса, нарушения сна. Могут быть осложнения в виде паралича, эпилепсии или даже комы.
- Энцефаломиелит (коревой энцефалит) – болезнь может возникнуть на 5 день после коревой сыпи, при этом состояние больного сильно ухудшается: до максимума повышается температура, человек становится слишком апатичным и вялым (такое состояние может перерасти в кому). Это типичное течение коревого энцефалита. При атипичном течении больной перевозбужден, может бредить. В редких случаях наблюдаются приступы эпилепсии. Из-за того, что этот вид энцефалита поражает лицевые и зрительные нервы, может развиться атаксия, паралич, хорея, миелит (поперечный).
- Энцефалит, возникший на фоне краснухи/ветрянки – начинается в период с 2-го по 8-ой день ветрянки или краснухи: зараженный человек становится сонливым, нарушается координация движений, начинаются судороги, может настигнуть паралич верхних и нижних конечностей.
Кроме того, причинами возникновения энцефалита могут быть различные токсические, инфекционно-аллергические, аллергические факторы.
- Полисезонный – причины возникновения до сих пор точно не исследованы, при этом виде энцефалита идет поражение отводящего, глазодвигательного, лицевого нервов, возникает помутнение сознания, которое может привести к сопорозному состоянию или впадению в кому. В основном наблюдаются судороги, гиперкинез, различные параличи.
- Токсоплазмозный – отмечается повышение температуры, зачастую протекает с осложнениями в виде пневмонии, фарингита, конъюнктивита, моноцитоза и миокардита.
- Полиэнцефалит – воспалительный процесс протекает в сером веществе головного мозга.
- Лейкоэнцефалит – вирусом поражается белое вещество мозга.
- Панэнцефалит – поражается белое и серое вещества головного мозга.
Энцефалит, как и все заболевания, может протекает в трех формах: острой, подострой и хронической. Следует отметить, что токсоплазмозный энцефалит не может протекать в острой форме.
Полезные продукты при энцефалите
- 1 мясо и рыба нежирных сортов (только в варенном или паренном виде);
- 2 мелкие рассыпчатые каши и вермишель;
- 3 кисломолочные продукты (кефир, творог, простокваша, закваска), сливочное масло и сметана (не высокой жирности);
- 4 напитки: кисели, компоты, минеральная вода, некрепкий чай с лимоном (можно и с молоком), фруктовые соки (не слишком концентрированные);
- 5 хлебобулочные изделия из 2-3 сорта муки, сухари, галетное печенье;
- 6 фрукты и овощи без грубой клетчатки и больших твердых костей.
Нужно пить отвары и настои из мяты, пустырника, мелиссы, барвинка, пиона, корней валерианы и золотого корня, синюхи, байкальского шлемника, шишек хмеля, сенной трухи, плакун-травы, боярышника, пастушьей сумки, мордовника.
Следует комбинировать травы и подбирать сбор (травы) отдельно под каждого больного и взависимости от клинических проявлений (например, больному с сонливостью и вялостью не подойдет мята, валериана, пион, мелисса – они помогают успокоиться и нормализовать сон; а слишком возбужденному больному нельзя давать боярышник, барвинок и золотой корень – они обладают тонизирующим эффектом).
Для приготовления 0,5 литра отвара потребуется 1 столовая ложка травы или сбора. Настаивать нужно пол часа. Полученный отвар принимать трижды в день. Продолжительность лечения должна составлять не менее 14 дней.
Эти травы успокоят нервную систему, снимут болевые и судорожные синдромы, уменьшить интоксикацию организма.
При сильных судорогах полезным будет массаж.
Для того, чтобы больной не потерялся во времени и датах, возле него всегда должны быть часы и календарь.
- острые, копченные, соленные, маринованные, жирные блюда;
- кондитерские изделия;
- сладкие газировки, фаст фуд;
- сдобная выпечка и хлебобулочные изделия из слоеного и песочного теста;
- тяжелые каши: гречка, перловка;
- бобовые культуры;
- грибы;
- овощи и фрукты с грубой клетчаткой и косточками: редька, огурцы, редис, репа, смородина, крыжовник, малина, инжир, финики;
- майонез, соусы, приправы.
Этот список продуктов может привести к еще большей интоксикации организма (она возникает из-за токсинов переносчиков болезни), к нарушению водно-солевого баланса и спровоцировать аллергические реакции, что еще больше усугубит сложившуюся ситуацию.

Энцефалопатия – это заболевание, которое возникает на фоне дефицита мозгового питания. Когда клеткам головного мозга не хватает полезных питательных веществ, они попросту погибают. Происходит это по многим причинам, но все они приводят к изменению кровяного состава, либо к нарушению церебрального кровообращения. А, как известно, все питательные вещества и кислород поступают в мозг именно через кровь.
Питание при энцефалопатии должно содержать те продукты, которые улучшают кровообращение, очищают кровь, обогащают ее, снижают уровень токсинов в организме и оказывают общее антиоксидантное и очищающее действие. При регулярной поддержке такого баланса в организме наблюдается значительное улучшение здоровья, человек становится энергичнее, настроение – позитивным. Психоэмоциональный фон выравнивается, появляется стимул к выздоровлению.
Конечно, немаловажную роль играет отношение близких людей к болезни пациента и их поддержка. Но и питание не стоит игнорировать, потому что диета при энцефалопатии дает отличные результаты.
Основные принципы диетического рациона
В целом, диета при энцефалопатии – это основа правильного питания, о котором люди вспоминают только в период болезни. Принципы такого питания просты:
– Употреблять пищу следует несколько раз в день с интервалом в 2,5-3 часа, но малыми порциями (объем не более 200-250 мл). Благодаря этому организм не зашлаковывается, а значит, и не отравляет собственную кровь. Именно из-за собственного самоотравления нередко наблюдается нейротоксическое действие на мозг, что и приводит к формированию стойкой энцефалопатии.
– Пища должна быть на половину представлена растительными продуктами (зелень, овощи, фрукты). Их можно употреблять в свежем и в тушеном виде, жарить не рекомендуется.
– Перед сном употреблять пищу не желательно, организм к утру должен быть отдохнувшим, а не уставшим. В противном случае депрессивный синдром усугубляется, настроение падает и человек становится более раздражительным.
– Питьевой режим необходимо соблюдать, как и пищевой. Недостаток жидкости в организме приводит к тромбообразованию и сгущению крови. А вот частое ее употребление, напротив, способствует выведению вредного холестерина в организме.
Такого питание при энцефалопатии необходимо придерживаться постоянно, только тогда будут заметны позитивные результаты.
Продукты, полезные при энцефалопатии

Итак, какие же продукты следует включить в рацион при соблюдении диеты при энцефалопатии.
– Овощи и фрукты с витамином С. Это цитрусовые, яблоки, болгарский перец, киви и многое другое, ведь этот витамин содержится во всех видах растительности, только в разном объеме. Аскорбиновая кислота укрепляет сосудистую стенку, обладает антиоксидантным действием, способствует насыщению крови кислородом.
– Зелень любого вида должна всегда присутствовать в питании при энцефалопатии. Ее значимость для организма нередко недооценивается.
– Масла растительного происхождения. Они оказывают благотворное действие на эластичность сосудистой стенки. Рекомендуется отдавать предпочтение оливковому, льняному либо другим видам продукции. Не стоит забывать о норме – 5-10 мл в сутки.
А вот белковые продукты, которые для здорового человека считаются очень полезными, в диету при энцефалопатии лучше не включать, т.к. при данном заболевании из-за этого элемента в крови и в стенках кишечника повышается уровень аммиака.
Более конкретные рекомендации к питанию можно дать после получения результатов анализа крови на биохимический состав. Нередко наблюдаются такие состояния, как гипо- или гиперкалиемия, повышенный уровень билирубина, глюкозы, кальция и других минеральных веществ и элементов. На основании этого и корректируется питание в индивидуальном порядке.
04 сентября 2018
- 3415
- 2,7
- 0
- 5
На изображении видны изменения в метаболизме базальных ганглиев и медиальных височных областей при одном из типов аутоиммунного энцефалита
В настоящее время все больше внимания уделяется тому, как иммунитет влияет на разные процессы в нашем организме. Обнаруженные в новых исследованиях нарушенные иммунные реакции становятся недостающим звеном патогенеза. Это стимулирует поиск новых лекарств и других профилактических и лечебных воздействий. В этом тексте мы обсудим особый иммунный статус мозга — его изолированность от системных процессов иммунитета. Кроме этого поговорим о расстройствах, которые нарушают иммунный суверенитет центральной нервной системы — об аутоиммунных энцефалитах.
Привилегированный орган
Мозг — это орган, примечательный во многих отношениях [1]. Бесконечная сложность устройства, его функциональные возможности и связь нашей жизни с его состоянием приковывают к мозгу внимание исследователей. Взаимоотношения мозга с иммунной системой нашего организма тоже носят особенный характер: мозг является иммуннопривилегированным органом. Иммунные реакции, которые легко развиваются в остальных тканях (клетках печени, мышцах, жировой клетчатке), в мозге возникают редко. Вместе с мозгом в таких особых отношениях с иммунной системой оказались щитовидная железа, яички и некоторые ткани глаза, в частности, роговица.
Длительное время считалось, что основой иммунной привилегии головного мозга является наличие гемато-энцефалического барьера (ГЭБ). ГЭБ — это комплекс клеточных и внеклеточных структур, которые отделяют кровь, текущую в капиллярах, от нейронов паренхимы мозга. Клетки стенок сосудов, базальная мембрана, на которой они лежат, астроциты участвуют в формировании ГЭБ. Иммунная привилегированность частей центральной нервной системы хорошо согласовывалась с распространенностью ГЭБ внутри нее. Паренхима головного мозга надежно защищена ГЭБ, и в ней редко возникают воспалительный процессы (энцефалиты). Хориоидные сплетения, продуцирующие спинномозговую жидкость, и оболочки головного мозга не имеют такого прикрытия, и их воспаление (хориоидит, менингит) встречается гораздо чаще (рис. 1).
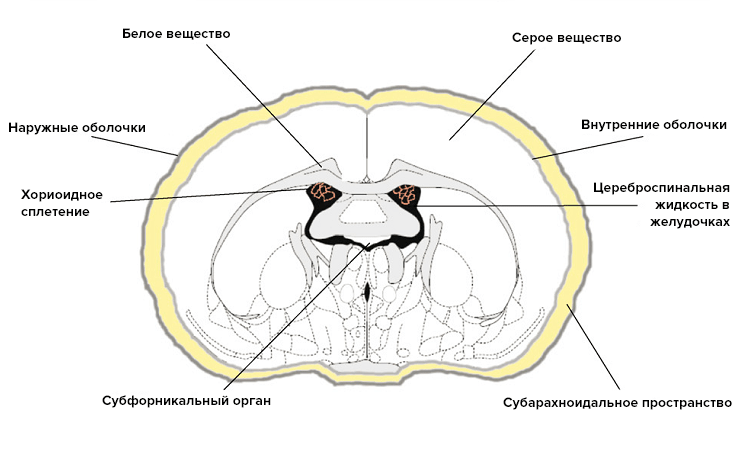
Рисунок 1. Строение центральной нервной системы. К частям, которые хорошо защищены ГЭБ, относятся серое и белое вещества. Другие компоненты не имеют такой защиты.
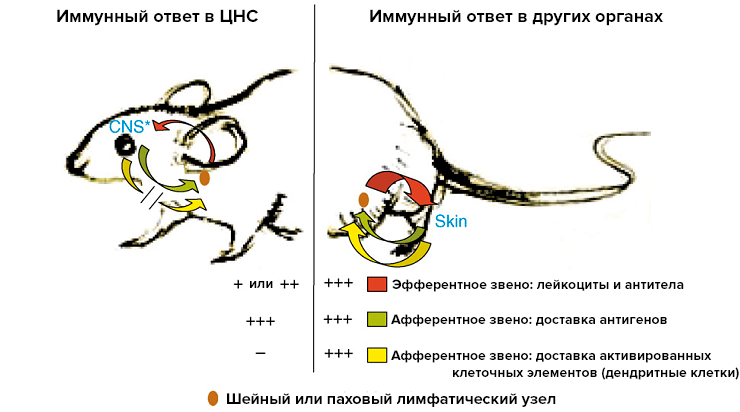
У мозга возникают сложности при доставке активированных клеток иммунитета в шейные лимфатические узлы. За работу с антигенами в головном мозге отвечают дендритные клетки. В других органах они распознают антиген, а затем предоставляют информацию о нем T- и B-лимфоцитам в лимфоузлах. При воспалении в мозге такого процесса не происходит: дендритные клетки не мигрируют в лимфоузлы и не представляют антиген. Иммунный ответ становится локальным, и дендритные клетки регулируют его в паренхиме головного мозга. Если в других органах клеточные элементы иммунитета после презентации антигена устремляются в место проникновения бактерий [6], то при развитии воспаления в паренхиме мозга этого не происходит. Мозгу приходится рассчитывать на самого себя. Подобная локальность иммунного ответа наблюдается в паренхиме, но не в хориодиных сплетениях и оболочках мозга.
Аутоиммунные энцефалиты
После разговора об особом иммунном статусе мозга мы перейдем к теме аутоиммунных энцефалитов — группе заболеваний, которые связаны с поражением мембранных и внутриклеточных структур нейронов собственным иммунитетом организма. В современной практике аутоиммунные энцефалиты диагностируются редко. Это объясняется тем, что первые случаи подробно описали только в 2005 году [10]. Можно предположить, что на самом деле случаев этого заболевания больше, чем регистрируется специалистами. Некоторым пациентам с аутоиммунным энцефалитом могут устанавливать диагноз других расстройств, например, шизофрении или инфекционного энцефалита. Это связано с тем, что врачи мало осведомлены об этом заболевании. Врачи диагностируют только те болезни, которые им известны. Чем больше арсенал диагнозов в запасе у врача, тем точнее диагностика и правильнее лечение.
Аутоиммунные энцефалиты можно разделить на две группы:
- заболевания, вызванные активированными T-клетками (нечто похожее происходит при рассеянном склерозе [11]);
- заболевания, которые возникают при воздействии антител на внутри- и внеклеточные компоненты нейрона, например, ионные каналы.
Для первой группы аутоиммунных энцефалитов характерно повреждение клеток антителами и активированными Т-лимфоцитами [12]. Эти энцефалиты носят более тяжелый характер и требуют интенсивных лечебных вмешательств в отличие от представителей второй группы.
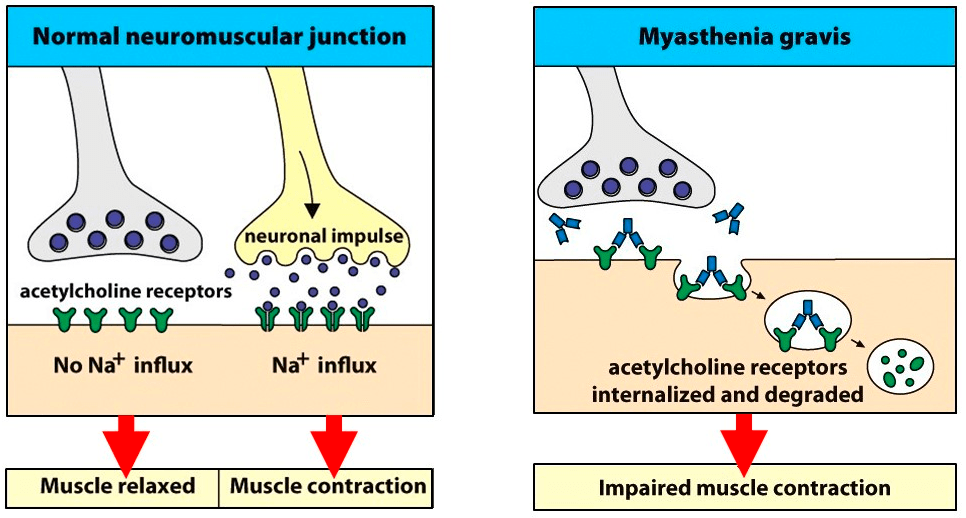
Антитела проникают снаружи, из-за пределов ГЭБ, или производятся проникшими в головной мозг и активированными B-лимфоцитами [15]. В тех случаях, когда антитела направлены против внутриклеточных структур, атаку на нейроны возглавляют цитотоксические T-лимфоциты. При помощи перфорина и гранзима B они повреждают мембрану нейронов, что приводит к их гибели [16], [17]. ГЭБ, о котором мы говорили выше, в этом свете представляется надежной крепостной стеной, защищающей тихий город, который отвык воевать. Если в стене возникнет брешь, то город быстро падет: нервные клетки окажутся слишком чувствительны к воздействию иммунных факторов.
Признаки аутоиммунных энцефалитов очень разнообразны, но можно выделить три типа симптомов.
- Психиатрические симптомы: психозы, агрессивные действия, сексуальная расторможенность, панические атаки, навязчивые действия, чувство эйфории или страха.
- Двигательные симптомы: повышение тонуса мышц и его неравномерность, мышечные подергивания и повторяющиеся движения конечностей.
- Припадки: генерализованные эпилептические припадки, эпилептический статус.
Начальными проявлениями аутоиммунного энцефалита могут быть симптомы психического расстройства: нарушение памяти, галлюцинации или появление бредовых идей. Например, при аутоиммунном поражении глутаматных NMDA-рецепторов у 80% пациентов были выявлены симптомы психических заболеваний, а больше 60% первоначально были госпитализированы в психиатрические отделения [18], [19]. Врачи-психиатры должны уметь выявлять пациентов с аутоиммунными энцефалитами или хотя бы заподозрить это заболевание, чтобы вовремя отправить пациента на соответствующие обследования и консультации к другим врачам.
- Лимфоцитарный плейоцитоз или появление олигоклональных полос при электрофорезе ЦСЖ.
- Эпилептические припадки.
- Фациобрахиальные дистонические припадки.
- Подозрение на злокачественный нейролептический синдром.
- Отклонения на МРТ.
- Отклонения на ЭЭГ.
- Сниженный уровень сознания.
- Нарушение позы и движений.
- Нестабильность вегетативной нервной системы.
- Очаговая неврологическая симптоматика.
- Нарушения речи (афазия и дизартрия).
- Быстрое, несмотря на лечение, прогрессирование психоза.
- Гипонатриемия.
- Кататония.
- Головные боли.
- Наличие других аутоиммунных заболеваний, в том числе тиреоидитов.
Кроме совокупности ранее описанных симптомов, диагноз аутоиммунного энцефалита должен быть подтвержден лабораторными исследованиями и другими диагностическими процедурами [21]. Например, можно выполнить анализ на антитела к конкретным рецепторам. При аутоиммунном энцефалите, поражающем глутаматные NMDA-рецепторы, можно обнаружить повышение титра антител к ним. Интересно, что при энцефалите увеличивается количество иммуноглобулинов класса G, а при шизофрении — классов А и М [22]. В настоящее время установлено соответствие между антителами, поражающими конкретные структуры нейрона, и симптоматикой энцефалита (табл. 1). При проведении магнитно-резонансной томографии (МРТ) могут быть обнаружены изменения в структуре головного мозга, а электроэнцефалографическое исследование (ЭЭГ) в случае аутоиммунного энцефалита может показать нарушение функционирования головного мозга.
| Структура, к которой вырабатывается антитело | Психиатрические симптомы | Другие симптомы | Типичный пациент |
|---|---|---|---|
| NMDA-рецептор | Психоз, шизофреноподобные расстройства, кататония, агрессия | Эпилептические припадки, дискинезия, вегетативная нестабильность, нарушение речи и сознания | Молодые женщины, частая связь с тератомой яичника |
| Caspr2 | Бессонница, панические атаки, депрессия, шизофреноподобные расстройства | Синдром Морвана, нейромиотония, мышечные спазмы, фасцикуляции | Пациенты среднего и старшего возраста, возможна связь с тимомой |
| LGI1 | Амнезия и другие нарушения памяти, спутанность, депрессия | Лимбический энцефалит, фациобрахиальные дистонические припадки, гипонатриемия | Пациенты среднего и старшего возраста, соотношение мужчин и женщин 2:1, возможна связь с тимомой |
| Глициновый рецептор | Поведенческие изменения, шизофреноподобный синдром | Синдром мышечной скованности, прогрессирующий энцефаломиелит с ригидностью, миоклонус, гиперэкплексия | Пациенты среднего и старшего возраста, возможна связь с тимомой и лимфомой |
| Синаптические антигены (GAD) | Шизофреноподобный синдром, аутизм, синдром дефицита внимания и гиперактивности | Лимбический энцефалит, синдром мышечной скованности, припадки, стволовая дисфункция, атаксия | Пациенты среднего и старшего возраста, возможна связь с мелкоклеточным раком легких |
| Онконевральные антигены (Yo, Hu, CV2, Ri, Ma2) | Поведенческие нарушения | Лимбический энцефалит, мозжечковая дегенерация, сенсорная нейропатия | Пожилые пациенты, часто со злокачественными опухолями |
В некоторых случаях аутоиммунное поражение центральной нервной системы вызвано развитием паранеопластического синдрома, который может сопровождать появление в организме злокачественной опухоли. При паранеопластическом синдроме опухоль может начать самостоятельно вырабатывать гормоны и гормоноподобные вещества, нарушая регуляцию различных процессов в организме. Кроме этого паранеопластический синдром может проявляться в виде аутоиммунного заболевания, например, аутоиммунного энцефалита.
По этой причине при диагностике аутоиммунных энцефалитов отдельное внимание уделяется поиску опухоли в организме пациента. Удаление опухоли в случаях паранеопластического генеза аутоиммунного энцефалита приведет к значительному улучшению состояния пациента. Пока же опухоль находится в организме человека, антитела продолжают вырабатываться, а состояние пациента ухудшаться.
Если терапия первой линии не работает, то переходят к использованию ритуксимаба и циклофосфамида. Ритуксимаб — это моноклональные антитела к рецептору CD20, который обнаруживается на поверхности B-лимфоцитов [23]. В-лимфоциты производят самые разные антитела, в том числе и аутоантитела против нервных клеток, и их уничтожение может привести к улучшению состояния. Рецептор CD20 появляется на поверхности нормальных B-лимфоцитов и B-лимфоцитов, которые прошли процесс малигнизации (озлокачествления). Благодаря этому свойству ритуксимаб эффективен при аутоиммунных заболеваниях и B-клеточных лимфомах. Лекарство присоединяется к рецептору CD20 на поверхности лимфоцита и дает возможность другим компонентам иммунной системы уничтожить клетку.
На примере аутоиммунных энцефалитов можно рассмотреть два важнейших тренда в современной медицине. Первый тренд — изучение влияния иммунных процессов на функционирование нервной системы человека и попытки вмешаться в этот процесс при лечении неврологических и психических заболеваний. Сейчас мы близки к пониманию того, что мозг — это не просто электрохимическая лаборатория под черепной коробкой, но и особый иммунный мир со своими правилами. В наших интересах изучить эти правила и начать играть по ним в свою пользу. Второй же тренд — это биологизация психиатрии, поиск конкретных биологических изменений в организме, которые приводят к нарушению психического здоровья. Психиатрия — это часть медицины, большой отрасли, где соединяются теоретические знания и их практическое применение. Без биологической основы медицина перестанет быть научной. Если игнорировать биологические законы и знания внутри одной из медицинских специальностей, то с ней произойдет то же самое. Психиатрия должна становиться биологической, чтобы оставаться научной и выполнять свои медицинские задачи.
В последнее время исследователи и врачи все больше внимания уделяют реакциям врожденного иммунитета при развитии нейродегенеративных заболеваний (болезни Альцгеймера [24], болезни Паркинсона [25], хореи Гентингтона [26]) и психических расстройств [27]. Накопление бета-амилоида, который сам, вероятнее всего, вовлечен в иммунные реакции центральной нервной системы [28], связано с нарушением баланса между его накоплением и элиминацией (удалением). Последний процесс отчасти зависит от того, как экспрессируется толл-подобный рецептор 2 (TLR2) [29]. На мышиных моделях показано: чем ниже уровень экспрессии TLR2, тем хуже удаляется бета-амилоид [30]. Снижение элиминации бета-амилоида приводит к его накоплению в нервных клетках и последующему нарушению их функции и гибели. Изучение внутренних иммунных процессов мозга может стать основой для поиска новых препаратов при нейродегенеративных заболеваниях. Сейчас фармацевтические компании тестируют моноклональные антитела для терапии болезни Альцгеймера, но успехи остаются скромными.
Читайте также:


