Диф диагностика дисбактериоза кишечника
Дифференциальный диагноз между дисбактериозом и смешанными кишечными инфекциями труден. Условно-патогенные бактерии во внешней среде могут находиться в ассоциациях с патогенной флорой, например с шигелламл, ЭПКП и т. д. Инфицирование ребенка может быть одновременным или последовательным.
Смешанные кишечные инфекции характеризуются более тяжелым и затяжным течением.
При бактериологическом обследовании уже в первых анализах кала отмечается выделение энтеробактерий (шигелл, ЭПКП, сальмонелл) и преобладание одного из условно-патогенных микробов, чаще стафилококка.
При серологическом обследовании больного определяется увеличение титра специфических антител к стафилококковому антигену и шигеллам в 4 раза и более.
В этих случаях устанавливается диагноз: смешанная кишечная инфекция (дизентерия Зонне и стафилококковая инфекция), среднетяжелая форма, с затяжным течением.
Исследования, проведенные Т. И. Касаткиной (1976), ставили своей задачей выявление частоты и характера дисбактериоза у детей первых 2 лет жизни (59,1% до 1 года) с бактериологически подтвержденным диагнозом дизентерии Зонне (119 человек), кишечной коли-инфекции, вызванной ЭПКП 1-й группы (68 человек) и стафилококкового энтероколита (84 человека).
У всех больных была упорная диарея с затяжным течением и длительным бактериовыделением указанных возбудителей.
Легкая форма заболевания отмечалась в 53,5%, средней тяжести и тяжелая — в 46,5%. При тщательном обследовании в динамике заболевания у всех 271 детей выявлен кишечный дисбактериоз, который у 71,3% из них характеризовался снижением содержания бифидобактерий и у 40,5% — уменьшением количества кишечных палочек. Качественные признаки нарушения аэробной флоры были разнообразными.
Ведущим признаком дисбактериоза (в 55,2%) было увеличение относительного содержания кокковых форм и обнаружение в 41,5% кишечных палочек с ослабленной ферментативной активностью.
Первичное заселение микробами кишечного тракта ребенка происходит в процессе рождения, первоначально бактериями влагалища матери — палочками Додерлейна, относящимися к молочнокислой флоре. В дальнейшем характер нормальной микрофлоры зависит от питания ребенка. Для детей, находящихся на грудном вскармливании, с 6 — 7-го дня жизни превалирующей является бифидофлора. Бифидобактерии содержатся в количестве 109 — 1010 в 1 г…
Состав кишечной микрофлоры человека зависит от ряда факторов: характера питания, возраста, сезона года и других, однако при всех условиях сохраняется относительное ее постоянство, которое обеспечивает естественную резистентность организма человека. К состоянию дисбактериоза приводит воздействие самых разнообразных причин: заболевания желудочно-кишечного тракта бактериальной и вирусной природы, нарушение питания, применение химиопрепаратов, антибиотиков, гормонов. Особое значение придается нерациональной антибиотикотерапии,…
Для определения степени дисбактериоза можно пользоваться методом Р. Б. Эпштейн-Литвак и Ф. Л. Вильшанской (1969). В основе метода определения характера дисбактериоза лежит подсчет бактерий, обнаруженных в разведениях определенной массы испражнений (1 г). Готовится ряд разведений от 10-2 до 10-11 производится посев на различные питательные среды. Так, бифидобактерии растут в столбиках среды Блоурокка и обнаружение их…
И. Н. Блохина (1981) выделяет 3 степени выраженности дисбактериоза I степень (слабо выраженный дисбактериоз) — анаэробная флора преобладает над аэробной. Бифидои лактобактерии выделяются в разведениях 10-8 — 10-7 или одна из этих форм в разведении 10-10 — 10-9. Условно-патогенные бактерии (не более 2 видов) высеваются в разведениях 10-4 — 10-2. II степень — наблюдается угнетение…
Выявление дисбактериоза не означает, что ребенок болен. У большинства детей нет видимых клинических проявлений, связанных с нарушением состава микрофлоры кишечника. Однако дисбактериоз может осложнять течение ряда заболеваний, вызывая проявление дискинезии кишечника, желчевыводящих путей, аллергические проявления, неустойчивый стул. Установлено, что при всех кишечных инфекциях в 100% выявляется дисбактериоз, особенно выраженный при негладком и затяжном течении основного…

Несмотря на введение в микробиологическую практику новых усовершенствованных методов исследования, до сих пор четкой границы между микробиоценозом кишечного биотопа здоровых и больных лиц так и не выявлено. Каловый микробиоценоз является сложным и динамичным [2], состав его индивидуален для каждого человека, что важно учитывать не только в диагностике дисбиоза, но и в выборе препаратов и способов его профилактики и коррекции.
Внедрение в микробиом кишечника пробиотических микроорганизмов и применение пребиотиков с целью коррекции дисбиозов часто имеет хороший результат [3]. Однако случаи отсутствия положительных эффектов данных способов коррекции наталкивают на мысль об отторжении внесённых эндогенных микроорганизмов-пробиотиков интестинальной иммунной системой, что может усугубить микроэкологический дисбаланс и вызвать усиление аллергизации организма [7].
Цель данного исследования – показать целесообразность комплексного изучения кишечной микробиоты, заключающегося в сочетании микробиологического исследования с оценкой уровня иммунореактивности организма к индигенной микрофлоре (бифидобактериям) по наличию антител против бифидобактерий, выявляемых в копрофильтратах человека с помощью эритроцитарных диагностикумов методом РНГА.
Материалы
и методы исследования
Микробиологические методы. Бактериологический анализ копрологического материала на дисбиоз и определение степени дисбиоза по результатам анализа проводились в соответствии с Отраслевым стандартом 91500.11.0004 – 2003 и методическими рекомендациями МЗ СССР №10-11/4-М. от 1991[6]. Исследовано 314 копрологических образцов.
Получение антигена. В процессе приготовления иммунодиагностикума использовали фракцию клеточных стенок (ФКС) бифидобактерий, получаемую путём дезинтеграции микробных клеток на ультразвуковом дезинтеграторе (SONOPULS HD 2200, Германия). Для дезинтеграции готовили взвеси микробных клеток, выращенных на тиогликолевой среде, по стандарту мутности в концентрации не менее 10 млрд. клеток в 1 мл. Схема дезинтеграции состояла из 3-х идентичных этапов – по 4 мин с максимальной амплитудой ультразвука 100 %. После 3 этапа контрольный мазок показал стопроцентное разрушение клеток. Дезинтегрированную микробную массу суспендировали в 10мл фосфатного буфера (рН 7,2) и центрифугировали в течение 10 мин при
2 000 об/мин (центрифуга К 70D, ГДР) для осаждения возможных не разрушенных микробных клеток. Супернатант повторно центрифугировали в течение 10 мин при 8000 об/мин на лабораторной медицинской центрифуге ОПн-8(Россия). Полученный осадок представлял собой фракцию клеточных стенок (ФКС), используемую для иммунизации животных и при изготовлении тест-системы.
Иммунизация животных. Для контроля иммунодиагностикума использовали сыворотки, полученные от иммунизированных фракцией клеточных стенок бифидобактерий беспородных лабораторных мышей (30 штук, массой около 25 г.). Эксперименты с мышами проводили на базе вивария НИИ Биофизики (ГОУ ВПО Ангарская государственная техническая академия, ветеринарное удостоверение 238 № 0018304 от 07.09.2009). Эксперименты на животных проводились в соответствии с правилами, принятыми Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и иных научных целей (Правила проведения работ c использованием лабораторных животных, Cтpасбypг, 1986). Для иммунизации из ФКС готовили взвесь клеточных стенок бифидобактерий, соответствующую концентрации 10 млрд. клеток в мл. Взвесь вводили по 0,5 мл внутрибрюшинно один раз в неделю в течение 3-х недель. Забор крови производили из сердца через неделю после последней иммунизации, предварительно усыпив животных эфиром.
Результаты исследования
и их обсуждение
Ценность количественного бактериологического анализа фекалий повышается, если он в зависимости от показаний дополняется определением других параметров [1]. В нашем случае – это выявление антител к индигенной микрофлоре (бифидобактериям), в норме колонизирующих кишечник. Эволюционно закрепленное динамическое состояние иммунологической толерантности к антигенам симбионтной микробиоты играет одну из ключевых ролей в нормальном функционировании макроорганизма. Утрата иммунологической толерантности к комменсалам нормальной микрофлоры под воздействием эндогенных и экзогенных факторов, приводит к выработке специфических антител, поступающих не только в кровь, но и в просвет толстой кишки [10]. Наличие в крови высоких титров антител против бифидобактерий может привести к длительной дестабилизации саморегулирующейся кишечной экосистемы, что свидетельствует о срыве иммунологической толерантности к симбионтной микрофлоре [7]. Поэтому коррекция дисбиотических нарушений у детей должна проводиться не только на основании результатов бактериологического обследования, дающего информацию о количественном и качественном изменении в составе микробиоты, но и с учётом иммунной реакции организма на эти изменения.
Проведенные исследования показали, что практически у всех обследованных детей выявлялись отклонения в составе микроорганизмов кишечной микробиоты относительно общефизиологических нормативов [6]. Частота встречаемости дисбиотических нарушений составила 84,3 %. При этом у всех детей, независимо от возраста, в 59,03 % преобладал дисбактериоз I степени, практически у каждого четвертого ребенка (24,0 %) был зарегистрирован дисбактериоз II степени. Дисбактериоз III степени отмечался в младшей возрастной группе у 1,2 % детей, т.е. наиболее значимые изменения в составе нормальной микрофлоры кишечника наблюдались у детей от 1 года до 2-х лет.
Во всех возрастных группах наблюдалось угнетение индигенной флоры (бифидобактерии, лактобациллы, кишечная палочка с нормальной ферментативной активностью) на 1-2 порядка от физиологической нормы. У детей первых двух лет жизни с высокой частотой обнаруживались потенциально патогенные микроорганизмы семейства Enterobacteriaceae (Klebsiella spp., Enterobacter spp.и др.) [9].
Иммунологические исследования копрофильтратов выявили антитела к B.bifidum у 73,7 % лиц в титрах от 1:4 до 1:256. При этом степень дисбактериоза не имела прямой зависимости от величины титров антител, что свидетельствует об индивидуальной реакции организма на изменения в составе микрофлоры и, таким образом, обосновывает необходимость индивидуального подхода к коррекции с учётом особенностей иммунореактивности макроорганизма. На основании полученных результатов нами предлагается методологическая концепция объективной оценки микроэкологического статуса кишечного биотопа, опирающаяся на количественную оценку доминанты кишечного биотопа – бифидобактерий и степени иммунореактивности организма по отношению к ним. Согласно концепции возможны разные варианты коррекции дисбиоза, обусловленного дефицитом бифидобактерий. Данные исследования помогут подобрать более адекватную пробиотическую терапию. В зависимости от результата обследования показана соответствующая тактика коррекции дисбиоза (рисунок).
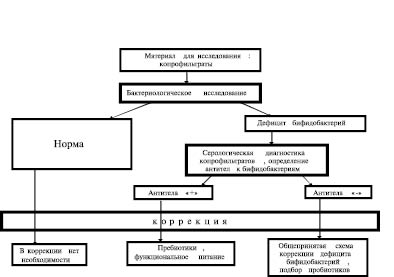
Алгоритм проведения комплексного иммуно-микробиологического обследования пациента и возможных путей коррекции дисбиоза
При отсутствии антител к бифидобактериям в копрофильтратах и наличии дисбиоза коррекция микроэкологических нарушений осуществляется традиционными методами: элиминация патогенов и условных патогенов, введение пробиотических и пребиотических препаратов, диетотерапия, функциональное питание.
Таким образом, выявление антител к бифидобактериям, в комплексе с бактериологическим и молекулярно-генетическим исследованиями копрологического материала позволит дать более полную оценку микробиоценоза пациентов и, следовательно, выбрать наиболее адекватные способы восстановления нормальной микрофлоры кишечника. При этом, несмотря на унифицированность данного алгоритма, подход к каждому проявлению дисбиоза индивидуален.
Что понимают под дисбактериозом? Какие методы диагностики являются современными и достоверными? Какие лекарственные препараты применяются при дисбактериозе? Вкишечнике человека находится свыше 500 различных видов микробов, общее количество которых
Вкишечнике человека находится свыше 500 различных видов микробов, общее количество которых достигает 10 14 , что на порядок выше общей численности клеточного состава человеческого организма. Количество микроорганизмов увеличивается в дистальном направлении, и в толстой кишке в 1 г кала содержится 10 11 бактерий, что составляет 30% сухого остатка кишечного содержимого.
В тощей кишке здоровых людей находится до 10 5 бактерий в 1 мл кишечного содержимого. Основную массу этих бактерий составляют стрептококки, стафилококки, молочнокислые палочки, другие грамположительные аэробные бактерии и грибы. В дистальном отделе подвздошной кишки количество микробов увеличивается до 10 7 –10 8 , в первую очередь за счет энтерококков, кишечной палочки, бактероидов и анаэробных бактерий. Недавно нами было установлено, что концентрация пристеночной микрофлоры тощей кишки на 6 порядков выше, чем в ее полости, и составляет 10 11 кл/мл. Около 50% биомассы пристеночной микрофлоры составляют актиномицеты, примерно 25% — аэробные кокки (стафилококки, стрептококки, энтерококки и коринеформные бактерии), от 20 до 30% приходится на бифидобактерии и лактобациллы.
Количество анаэробов (пептострептококки, бактероиды, клостридии, пропионобактерии) составляет около 10% в тонкой и до 20% в толстой кишке. На долю энтеробактерий приходится 1% от суммарной микрофлоры слизистой оболочки.
До 90-95% микробов в толстой кишке составляют анаэробы (бифидобактерии и бактероиды), и только 5-10% всех бактерий приходится на строгую аэробную и факультативную флору (молочнокислые и кишечные палочки, энтерококки, стафилококки, грибы, протей).
Кишечные палочки, энтерококки, бифидобактерии и ацидофильные палочки обладают выраженными антагонистическими свойствами. В условиях нормально функционирующего кишечника они способны подавлять рост несвойственных нормальной микрофлоре микроорганизмов.
Площадь внутренней поверхности кишечника составляет около 200 м 2 . Она надежно защищена от проникновения пищевых антигенов, микробов и вирусов. Важную роль в организации этой защиты играет иммунная система организма. Около 85% лимфатической ткани человека сосредоточено в стенке кишечника, где продуцируется секреторный IgA. Кишечная микрофлора стимулирует иммунную защиту. Кишечные антигены и токсины кишечных микробов значительно увеличивают секрецию IgA в просвет кишки.
Расщепление непереваренных пищевых веществ в толстой кишке осуществляется ферментами бактерий, при этом образуются разнообразные амины, фенолы, органические кислоты и другие соединения. Токсические продукты микробного метаболизма (кадаверин, гистамин и другие амины) выводятся с мочой и в норме не оказывают влияния на организм. При утилизации микробами неперевариваемых углеводов (клетчатки) образуются короткоцепочечные жирные кислоты. Они обеспечивают клетки кишки энергоносителями и, следовательно, улучшают трофику слизистой оболочки. При дефиците клетчатки может нарушаться проницаемость кишечного барьера вследствие дефицита короткоцепочечных жирных кислот. В результате кишечные микробы могут проникать в кровь.
Под влиянием микробных ферментов в дистальных отделах подвздошной кишки происходит деконъюгация желчных кислот и преобразование первичных желчных кислот во вторичные. В физиологических условиях от 80 до 95% желчных кислот реабсорбируется, остальные выделяются с фекалиями в виде бактериальных метаболитов. Последние способствуют нормальному формированию каловых масс: тормозят всасывание воды и тем самым препятствуют излишней дегидратации кала.
В понятие дисбактериоза кишечника входит избыточное микробное обсеменение тонкой кишки и изменение микробного состава толстой кишки. Нарушение микробиоценоза происходит в той или иной степени у большинства больных с патологией кишечника и других органов пищеварения. Следовательно, дисбактериоз является бактериологическим понятием. Он может рассматриваться как одно из проявлений или осложнение заболевания, но не самостоятельная нозологическая форма.
Крайней степенью дисбактериоза кишечника является появление бактерий желудочно-кишечного тракта в крови (бактериемия) или даже развитие сепсиса.
Состав микрофлоры кишечника нарушается при болезнях кишечника и других органов пищеварения, лечении антибиотиками и иммунодепрессантами, воздействиях вредных факторов внешней среды.
Клинические проявления дисбактериоза зависят от локализации дисбиотических изменений.
При дисбактериозе тонкой кишки численность одних микробов в слизистой оболочке тонкой кишки увеличена, а других уменьшена. Отмечается увеличение Eubacterium (в 30 раз), α-стрептококков (в 25 раз), энтерококков (в 10 раз), кандид (в 15 раз), появление бактерий рода Acinetobacter и вирусов герпеса. Уменьшается от 2 до 30 раз количество большинства анаэробов, актиномицетов, клебсиелл и других микроорганизмов, являющихся естественными обитателями кишечника.
Причиной дисбактериоза могут быть: а) избыточное поступление микроорганизмов в тонкую кишку при ахилии и нарушении функции илеоцекального клапана; б) благоприятные условия для развития патологических микроорганизмов в случаях нарушения кишечного пищеварения и всасывания, развития иммунодефицита и нарушений проходимости кишечника.
Повышенная пролиферация микробов в тонкой кишке приводит к преждевременной деконъюгации желчных кислот и потере их с калом. Избыток желчных кислот усиливает моторику толстой кишки и вызывает диарею и стеаторею, а дефицит желчных кислот приводит к нарушению всасывания жирорастворимых витаминов и развитию желчнокаменной болезни.
Бактериальные токсины и метаболиты, например фенолы и биогенные амины, могут связывать витамин В12.
Некоторые микроорганизмы обладают цитотоксическим действием и повреждают эпителий тонкой кишки. Это ведет к уменьшению высоты ворсинок и углублению крипт. При электронной микроскопии выявляется дегенерация микроворсинок, митохондрий и эндоплазматической сети.
Состав микрофлоры толстой кишки может меняться под влиянием различных факторов и неблагоприятных воздействий, ослабляющих защитные механизмы организма (экстремальные климатогеографические условия, загрязнение биосферы промышленными отходами и различными химическими веществами, инфекционные заболевания, болезни органов пищеварения, неполноценное питание, ионизирующая радиация).
В развитии дисбактериоза толстой кишки большую роль играют ятрогенные факторы: применение антибиотиков и сульфаниламидов, иммунодепрессантов, стероидных гормонов, рентгенотерапия, хирургические вмешательства. Антибактериальные препараты значительно подавляют не только патогенную микробную флору, но и рост нормальной микрофлоры в толстой кишке. В результате размножаются микробы, попавшие извне, или эндогенные виды, устойчивые к лекарственным препаратам (стафилококки, протей, дрожжевые грибы, энтерококки, синегнойная палочка).
Клинические проявления чрезмерного роста микроорганизмов в тонкой кишке могут полностью отсутствовать, выступать в качестве одного из патогенетических факторов хронической рецидивирующей диареи, а при некоторых болезнях, например, дивертикулезе тонкой кишки, частичной кишечной непроходимости или после хирургических операций на желудке и кишечнике, приводить к тяжелой диарее, стеаторее и В 12 -дефицитной анемии.
Особенностей клинического течения заболевания у больных с различными вариантами дисбактериоза толстой кишки, по данным бактериологических анализов кала, в большинстве случаев установить не удается. Можно отметить, что больные хроническими заболеваниями кишечника чаще инфицируются острыми кишечными инфекциями по сравнению со здоровыми. Вероятно, это связано со снижением у них антагонистических свойств нормальной микрофлоры кишечника и, прежде всего, частым отсутствием бифидобактерий.
Особенно большую опасность представляет псевдомембранозный колит, развивающийся у некоторых больных, длительно лечившихся антибиотиками широкого спектра действия. Этот тяжелый вариант дисбактериоза вызывается токсинами, выделяемыми синегнойной палочкой Clostridium difficile, которая размножается в кишечнике при угнетении нормальной микробной флоры.
Очень редко наблюдается молниеносное течение псевдомембранозного колита, напоминающее холеру. Обезвоживание развивается в течение нескольких часов и заканчивается летальным исходом.
Таким образом, оценка клинической значимости дисбиотических изменений должна основываться прежде всего на клинических проявлениях, а не только на результатах исследования микрофлоры кала.
Диагностика дисбактериоза представляет собой сложную и трудоемкую задачу. Для диагностики дисбактериоза тонкой кишки применяют посев сока тонкой кишки, полученного с помощью стерильного зонда. Дисбактериоз толстой кишки выявляют с помощью бактериологических исследований кала.
Микробная флора образует большое количество газов, в том числе водорода. Это явление используют для диагностики дисбактериоза. Концентрация водорода в выдыхаемом воздухе натощак находится в прямой зависимости от выраженности бактериального обсеменения тонкой кишки. У больных с заболеваниями кишечника, протекающими с хронической рецидивирующей диареей и бактериальным обсеменением тонкой кишки, концентрация водорода в выдыхаемом воздухе значительно превышает 15 ppm.
Для диагностики дисбактериоза применяют также нагрузку лактулозой. В норме лактулоза не расщепляется в тонкой кишке и метаболизируется микробной флорой толстой кишки. В результате количество водорода в выдыхаемом воздухе повышается (рис. 1).
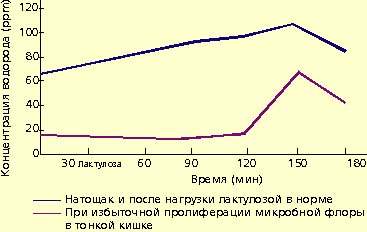 |
| Рисунок 1. Концентрация водорода в выдыхаемом воздухе |
Наиболее частыми бактериологическими признаками дисбактериоза толстой кишки являются отсутствие основных бактериальных симбионтов — бифидобактерий и уменьшение количества молочнокислых палочек. Увеличивается количество кишечных палочек, энтерококков, клостридий, стафилококков, дрожжеподобных грибов и протея. У отдельных бактериальных симбионтов появляются патологические формы. К ним относятся гемолизирующая флора, кишечные палочки со слабо выраженными ферментативными свойствами, энтеропатогенные кишечные палочки и т. д.
Углубленное изучение микробиоценоза показало, что традиционные методы не позволяют получить истинную информацию о состоянии микрофлоры кишечника. Из 500 известных видов микробов в целях диагностики обычно изучаются лишь 10-20 микроорганизмов. Важно, в каком отделе — в тощей, подвздошной или толстой кишках — исследуется микробный состав. Поэтому перспективы разработки клинических проблем дисбактериоза в настоящее время связывают с применением химических методов дифференциации микроорганизмов, позволяющих получить универсальную информацию о состоянии микробиоценоза. Наиболее широко для этих целей используются газовая хроматография (ГХ) и газовая хроматография в сочетании с масс-спектрометрией (ГХ-МС). Этот метод позволяет получить уникальную информацию о составе мономерных химических компонентов микробной клетки и метаболитов. Маркеры такого рода могут быть определены и использованы для детектирования микроорганизмов. Главным преимуществом и принципиальным отличием этого метода от бактериологических является возможность количественного определения более 170 таксонов клинически значимых микроорганизмов в различных средах организма. При этом результаты исследования могут быть получены в течение нескольких часов.
Проведенные нами исследования микробиоценоза в крови и биоптатов слизистой оболочки тонкой и толстой кишок у больных с синдромом раздраженного кишечника позволили обнаружить отклонения от нормы до 30-кратного увеличения или уменьшения многих компонентов. Существует возможность оценки изменений микрофлоры кишечника на основании данных анализа крови методом ГХ-МС-микробных маркеров.
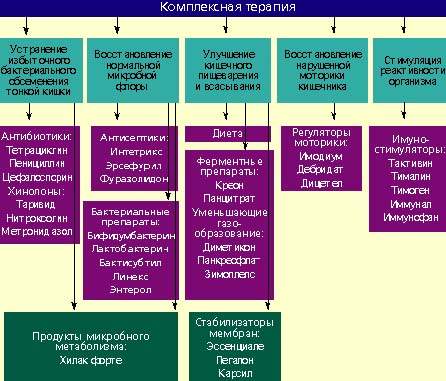 |
Лечение дисбактериоза должно быть комплексным (схема) и включать в себя следующие мероприятия:
- устранение избыточного бактериального обсеменения тонкой кишки;
- восстановление нормальной микробной флоры толстой кишки;
- улучшение кишечного пищеварения и всасывания;
- восстановление нарушенной моторики кишечника;
- стимулирование реактивности организма.
Антибактериальные препараты необходимы в первую очередь для подавления избыточного роста микробной флоры в тонкой кишке. Наиболее широко применяются антибиотики из группы тетрациклинов, пенициллинов, цефалоспорины, хинолоны (таривид, нитроксолин) и метронидазол.
Однако антибиотики широкого спектра действия в значительной степени нарушают эубиоз в толстой кишке. Поэтому они должны применяться только при заболеваниях, сопровождающихся нарушениями всасывания и моторики кишечника, при которых, как правило, отмечается выраженный рост микробной флоры в просвете тонкой кишки.
Антибиотики назначают внутрь в обычных дозах в течение 7–10 дней.
При заболеваниях, сопровождающихся дисбактериозом толстой кишки, лечение лучше проводить препаратами, которые оказывают минимальное влияние на симбионтную микробную флору и подавляют рост протея, стафилококков, дрожжевых грибов и других агрессивных штаммов микробов. К ним относятся антисептики: интетрикс, эрсефурил, нитроксолин, фуразолидон и др.
При тяжелых формах стафилококкового дисбактериоза применяют антибиотики: таривид, палин, метронидазол (трихопол), а также бисептол-480, невиграмон.
Антибактериальные препараты назначают в течение 10–14 дней. В случае появления в кале или кишечном соке грибов показано применение нистатина или леворина.
У всех больных с диареей, ассоциированной с антибиотиками, протекающей с интоксикацией и лейкоцитозом, возникновение острой диареи следует связывать с Cl. difficile.
В этом случае срочно делают посев кала на Cl. difficile и назначают ванкомицин по 125 мг внутрь 4 раза в сутки; при необходимости доза может быть увеличена до 500 мг 4 раза в день. Лечение продолжают в течение 7-10 суток. Эффективен также метронидазол в дозе 500 мг внутрь 2 раза в сутки, бацитрацин по 25 000 МЕ внутрь 4 раза в сутки. Бацитрацин почти не всасывается, в связи с чем в толстой кишке можно создать более высокую концентрацию препарата. При обезвоживании применяют адекватную инфузионную терапию для коррекции водно-электролитного баланса. Для связывания токсина Cl. difficile используют холестирамин (квестран).
Живые культуры нормальной микробной флоры выживают в кишечнике человека от 1 до 10% от общей дозы и способны в какой-то мере выполнять физиологическую функцию нормальной микробной флоры. Бактериальные препараты можно назначать без предварительной антибактериальной терапии или после нее. Применяют бифидумбактерин, бификол, лактобактерин, бактисубтил, линекс, энтерол и др. Курс лечения длится 1-2 месяца.
Возможен еще один способ устранения дисбактериоза — воздействие на патогенную микробную флору продуктами метаболизма нормальных микроорганизмов. К таким препаратам относится хилак форте. Он создан 50 лет назад и до настоящего времени применяется для лечения больных с патологией кишечника. Хилак форте представляет собой стерильный концентрат продуктов обмена веществ нормальной микрофлоры кишечника: молочной кислоты, лактозы, аминокислот и жирных кислот. Эти вещества способствуют восстановлению в кишечнике биологической среды, необходимой для существования нормальной микрофлоры, и подавляют рост патогенных бактерий. Возможно, продукты метаболизма улучшают трофику и функцию эпителиоцитов и колоноцитов. 1 мл препарата соответствует биосинтетическим активным веществам 100 млрд. нормальных микроорганизмов. Хилак форте назначают по 40–60 капель 3 раза в день на срок до 4 недель в сочетании с препаратами антибактериального действия или после их применения.
Совсем недавно появились сообщения о возможности лечения острой диареи, ассоциированной с антибактериальной терапией и Cl. difficile, большими дозами пре- и пробиотиков.
У больных с нарушением полостного пищеварения применяют креон, панцитрат и другие панкреатические ферменты. С целью улучшения функции всасывания назначают эссенциале, легалон или карсил, т. к. они стабилизируют мембраны кишечного эпителия. Пропульсивную функцию кишечника улучшают имодиум (лоперамид) и тримебутин (дебридат).
Для повышения реактивности организма ослабленным больным целесообразно применять тактивин, тималин, тимоген, иммунал, иммунофан и другие иммуностимулирующие средства. Курс лечения должен составлять в среднем 4 недели. Одновременно назначаются витамины.
Первичная профилактика дисбактериоза представляет очень сложную задачу. Ее решение связано с общими профилактическими проблемами: улучшением экологии, рациональным питанием, улучшением благосостояния и прочими многочисленными факторами внешней и внутренней среды.
Вторичная профилактика предполагает рациональное применение антибиотиков и других медикаментов, нарушающих эубиоз, своевременное и оптимальное лечение болезней органов пищеварения, сопровождающихся нарушением микробиоценоза.
ГБОУ ВПО СОГМА
Министерства здравоохранения Российской Федерации
Кафедра внутренних болезней № 4.
Зав. каф. д. м. н . п р о ф е с с о р АСТАХОВА З.Т.
Методические указания для проведения практического занятия
со студентами 6 курса лечебного факультета по теме:
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ПРИ КИШЕЧНОЙ ДИСПЕПСИИ
(продолжительность занятия 8 часов, второе занятие 4 часа)
Владикавказ 2014 – 2015 уч.год
Методические указания для проведения практического занятия со студентами 6 курса лечебного факультета по теме:
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ПРИ КИШЕЧНОЙ ДИСПЕПСИИ. СИНДРОМ РАЗДРАЖЕННОГО КИШЕЧНИКА. ДИСБАКТЕРИОЗ КИШЕЧНИКА.
Цель занятия:в процессе клинического разбора больного повысить уровень (качество) знаний и умения студентов в диагностике (дифференциальной диагностике), формулировке диагноза синдрома раздраженного кишечника и дисбактериоза.
Мотивация актуальности темы:
Болезни тонкой кишки с тяжелыми нарушениями всасывания и воспалительные болезни толстой кишки встречаются относительно редко. Наиболее распространенными формами патологии кишечника являются функциональные заболевания, при которых нарушается моторика кишечника. С помощью абсорбционных тестов у некоторых больных можно выявить нарушения мембранного пищеварения и всасывания, но морфологическая структура слизистой оболочки тонкой и толстой кишок у них не изменена. Поэтому у них никогда не бывает тяжелых расстройств кишечного пищеварения и всасывания. Синдром раздраженного кишечника (СРК) – очень распространенное состояние в гастроэнтерологической практике. Его частота среди населения развитых стран Европы составляет в среднем 15-20%. Не всегда правильно понимаемая природа функциональных расстройств и их подчас ошибочная трактовка как серьезного органического заболевания приводят, порой, к ненужному повторному проведению различных инструментальных исследований, назначению усиленной медикаментозной терапии, часто оказывающейся недостаточно эффективной.
Многие болезни кишечника проявляются характерными симптомами, заметив которые, можно с самого начала выбрать наиболее короткий путь диагнозу. Знакомство с современными функциональными и инструментальными методами исследования показывает, насколько подробно и тщательно можно оформить окончательный диагноз, что является залогом успешного лечения больного.
Определение уровня подготовки студентов:
Второй уровень знаний: методы контроля – письменный опрос (20 мин). Студент должен знать сущность заболевания, определение и классификацию синдрома раздраженного кишечника, этиологию и патогенез синдрома раздраженного кишечника, основные факторы риска, клинические проявления основных вариантов – с преобладанием болей и метеоризма, с преобладанием запоров, с преобладанием диареи, дифференциальную диагностику с воспалительными заболеваниями кишечника; студент должен уметь – владеть пропедевтическими навыками, самостоятельно выделить основные патологические синдромы в энтерологии, поставить предварительный диагноз согласно принятой классификации, определить необходимый объем исследований и уметь интерпретировать данные дополнительных методов исследования (общий анализ крови, б/х анализ крови, копрограмму, анализ кала на дисбактериоз, бак. посев кала, результаты ректоманоскопии, ирригоскопии, колоноскопии).
Доклад студентов кураторов в палате: при докладе больного студенты должны обратить особое внимание на следующие проявления заболевания. СРК – это устойчивая совокупность функциональных расстройств продолжительностью не менее 12 недель на протяжении последних 12 месяцев, проявляющаяся болью и/или дискомфортом в животе, которые проходят после дефекации, сопровождаются изменениями частоты и консистенции стула и сочетаются на протяжении 25% времени заболевания не менее чем с двумя стойкими симптомами нарушения функции кишечника – изменениями частоты стула, консистенции кала, самого акта дефекации (императивные позывы, тенезмы, чувство неполного опорожнения кишечника, дополнительные усилия при дефекации), выделением слизи с калом, метеоризмом.
Общее состояние пациентов с СРК: страдает мало и не соответствует обилию разнообразных соматических жалоб. К характерным клиническим симптомам СРК относятся:
1. Стул реже 3 раз в неделю.
2. Стул чаще 3 раз в сутки.
4. Жидкий или кашицеобразный кал.
5. Напряжение при акте дефекации.
6. Императивные позывы на дефекацию.
7. Ощущение неполного опорожнения кишечника.
8. Выделение слизи при дефекации.
9. Ощущение вздутия и переполнения в животе.
Для варианта СРК с преобладанием диареи характерно сочетание признаков 2, 4, 6 при отсутствии признаков 1, 3, 5. В свою очередь, для варианта СРК с преобладанием запоров характерно сочетание признаков 1, 3, 5 при отсутствии признаков 2, 4, 6.
При варианте с преобладанием запоров у некоторых больных длительное (в течение нескольких дней) отсутствие дефекации сменяется так называемыми запорными поносами с последующей повторной задержкой стула. У других пациентов акт дефекации бывает достаточно регулярным, однако сопровождается чувством неполного опорожнения кишечника, и стул при этом напоминает овечий кал или принимает ленточную форму. Многие больные из-за длительной и систематической задержки стула, которая вызывает тягостное общее состояние, начинают злоупотреблять слабительными препаратами.
Несмотря на такое разнообразие жалоб больных, объективные признаки болезни минимальны.
Микрофлора ТК здорового человека выполняет ряд важных функций в жизнедеятельности человеческого организма, поддержании его гомеостаза. Наиболее существенные из них:
1. Обеспечение колонизационной резистентности макроорганизма благодаря антагонистическим взаимоотношениям между облигатной микрофлорой (в основном бифидо- и лактобактериями) и условно-патогенными микроорганизмами.
2. Выработка веществ с антибиотическими свойствами, а также органических кислот, смещающих уровень рН в кислую сторону (до 5,3–5,8), что препятствует росту и размножению гнилостной и газообразующей микрофлоры.
4. Участие в синтезе витаминов (К и В-комплекса, фолиефой, никотиновой кислот), всасывании витамина D и солей кальция, продукции цитокинов и синтезе аминокислот.
5. Стимуляция лимфатического аппарата с воздействием на различные звенья тканевой и гуморальной иммунной системы, включая синтез иммуноглобулинов, интерферона, а также поддержание функциональной активности неспецифических факторов защиты, что обеспечивает иммунологическую защиту макроорганизма.
6. Выработка биологически активных веществ, стимулирующих метаболические процессы в организме (ферменты, медиаторы, гистамин и др.), участие в рециркуляции желчных кислот холестерина, стероидных гормонов. Под влиянием микробных ферментов в дистальных отделах подвздошной кишки происходит деконъюгация желчных кислот и преобразование первичных желчных кислот во вторичные желчные кислоты. В физиологических условиях от 80 до 95% желчных кислот реабсорбируется. Остальные выделяются с фекалиями в виде бактериальных метаболитов. Последние способствуют нормальному формированию каловых масс: тормозят всасывание воды и тем самым препятствуют излишней дегидратации кала. Избыточное бактериальное обсеменение тонкой кишки ведет к преждевременное деконъюгации желчных кислот и секреторной диарее.
7. Ферментативное расщепление пищевых веществ, не переваренных в тонкой кишке, в том числе пищевых волокон, с образованием аминов, фенолов и т.п.
8. Морфокинетическое (трофическое) действие, усиливающее физиологическую активность пищеварительного тракта. Ни одна из функций толстой кишки не может быть реализована без участия ее резидентной микрофлоры.
Дисбактериоз кишечника – изменение качественного и количественного состава бактериальной флоры, обусловленное динамическим нарушением микроэкологии кишечника в результате срыва адаптации, нарушения защитных и компенсаторных механизмов организма.
Дисбактериоз кишечника очень распространен. Он выявляется в 75-90% случаев острых и хронических гастроэнтерологических заболеваний.
Читайте также:


