Доза ванкомицина при сепсисе вызванном mrsa инфекцией
СЕПСИС
Cогласно современным концепциям, сепсис может представлять собой нозологическую форму или осложнение тяжелой инфекции. Обязательным компонентом сепсиса является генерализованная воспалительная реакция, возникающая в ответ на клинически или бактериологически доказанную инфекцию. Подтверждением генерализованной воспалительной реакции является наличие двух или более симптомов:
- температура тела выше 38 o C или ниже 36 o C;
- тахикардия более 90 уд/мин;
- тахипноэ более 20 в мин или снижение парциального давления СО2 в артериальной крови менее 32 мм рт.ст.;
- число лейкоцитов в периферической крови более 12x10 9 /л или менее 4x10 9 /л или число незрелых форм более 10%.
Выделяют стадийность заболевания: сепсис, тяжелый сепсис и септический шок. Основным отличием сепсиса от тяжелого сепсиса является отсутствие органной дисфункции. При тяжелом сепсисе возникают признаки органной дисфункции, которые при неэффективном лечении прогредиентно нарастают и сопровождаются декомпенсацией. Результатом декомпенсации функции органов является септический шок, который формально отличается от тяжелого сепсиса гипотензией, однако представляет собой полиорганную недостаточность, в основе которой лежит тяжелое распространенное поражение капилляров и связанные с этим грубые метаболические нарушения.
Источники инфекции
Сепсис может развиться у пациентов как во внебольничных условиях, так и во время пребывания в стационаре. Основными источниками являются инфекции НДП (пневмония), МВП, кожи и мягких тканей, органов брюшной полости (кишечник, ЖВП и др.).
Основные возбудители
Основными возбудителями сепсиса являются бактерии, реже сепсис может быть вызван вирусами, риккетсиями, грибами и паразитами. Из грамположительных микроорганизмов наиболее часто сепсис вызывают S.aureus, S.epidermidis, Enterococcus spp., S.pneumoniae. Среди грамотрицательных палочек основными являются E.coli, Pseudomonas spp., Klebsiella spp.
Локализация очага инфекции позволяет определить спектр наиболее вероятных возбудителей. Так, при сепсисе, обусловленном интраабдоминальной инфекцией, возбудителями чаще являются энтеробактерии, анаэробы и, возможно, энтерококки; при ангиогенном сепсисе - S.aureus. При уросепсисе высока вероятность выделения E.coli, Pseudomonas spp., Klebsiella spp. У пациентов с иммунодефицитными состояниями значительную роль в этиологии сепсиса играют нозокомиальные штаммы грамотрицательных и грамположительных бактерий (P.aeruginosa, Acinetobacter spp., K.pneumoniae, E.coli, Enterobacter spp., S.aureus) и грибы.
Выбор антимикробных препаратов
В большинстве случаев антибактериальную терапию при сепсисе назначают эмпирически (табл.), не дожидаясь результата микробиологического исследования. При выборе препаратов необходимо принимать во внимание следующие факторы:
Таблица. Стартовая антимикробная терапия сепсиса
| Предполагаемый источник сепсиса | Препарат |
|---|---|
| Амбулаторные инфекции у пациентов без нейтропении: инфекции МВП другая локализация | Цефалоспорины III поколения, фторхинолоны или антисинегнойные пенициллины Все вышеперечисленные +аминогликозиды II-III поколения Цефалоспорины III поколения + метронидазол.Ингибиторозащищенные пенициллины+аминогликозиды II-III поколения Цефоперазон/сульбактам |
| Нозокомиальные инфекции у пациентов без нейтропении | Цефалоспорины III-IV поколения+метронидазол. Ингибиторозащищенные пенициллины + аминогликозиды II-III поколения Цефоперазон/сульбактам Карбапенемы + аминогликозиды II-III поколения |
| Нозокомиальные инфекции у пациентов с нейтропенией (см. "Нейтропеническая лихорадка") | Пиперациллин/тазобактам, тикарциллин/клавуланат + аминогликозиды II-III поколения. Карбапенемы+аминогликозиды II-III поколения. Цефтазидим + аминогликозиды II-III поколения Цефепим + аминогликозиды II-III поколения |
| Инфекции у пациентов с термическими поражениями не менее 20% поверхности тела | Цефалоспорины III-IV поколения + аминогликозиды II-III поколения Цефоперазон/сульбактам + аминогликозиды II-III поколения Ванкомицин + антисинегнойные пенициллины + аминогликозиды II-III поколения |
| Инфекции у пациентов с в/в катетерами и имплантированными протезами | Ванкомицин + флуконазол |
- тяжесть состояния пациента;
- место возникновения (внебольничные условия или стационар);
- локализацию инфекции;
- состояние иммунного статуса;
- аллергоанамнез;
- функцию почек.
Наиболее часто используется комбинация двух АМП. Объективными аргументами в пользу назначения комбинированной терапии являются:
- невозможность дифференцировать грамположительную или грамотрицательную этиологию инфекции по клинической картине;
- высокая вероятность полимикробной природы сепсиса;
- риск резистентности к одному из АМП.
При эмпирической терапии сепсиса, развившегося в условиях стационара (нозокомиальный сепсис), необходимо учитывать локальные эпидемиологические данные о структуре возбудителей и их чувствительности к АМП. Например, в случае преобладания MRSA, препаратами выбора для проведения эмпирической терапии являются ванкомицин или линезолид. Ввиду высокой резистентности грамотрицательной нозокомиальной микрофлоры к гентамицину необходимо использовать амикацин.
При клинической эффективности антибактериальную терапию продолжают проводить стартовыми препаратами. При отсутствии клинического эффекта в течение 48-72 ч АМП необходимо заменить с учетом результатов микробиологического исследования или, если таких не имеется, на препараты, перекрывающие пробелы в активности стартовых АМП, принимая во внимание возможную резистентность возбудителей.
При сепсисе АМП необходимо вводить только в/в, подбирая максимальные дозы и режимы дозирования по уровню клиренса креатинина. Ограничением к применению препаратов для приема внутрь и в/м введения являются возможное нарушение абсорбции в ЖКТ и нарушение микроциркуляции и лимфотока в мышцах.
Длительность антибактериальной терапии определяется индивидуально. Необходимо добиться устойчивого регресса воспалительных изменений в первичном инфекционном очаге, доказать исчезновение бактериемии и отсутствие новых инфекционных очагов, купировать реакцию системного воспаления. Но даже при очень быстром улучшении самочувствия и получении необходимой позитивной клинико-лабораторной динамики длительность терапии должна составлять не менее 10-14 дней. Как правило, более длительная антибактериальная терапия требуется при стафилококковом сепсисе с бактериемией (особенно вызванном MRSA) и локализации септического очага в костях, эндокарде и лёгких.
Пациентам с иммунодефицитом АМП всегда применяют дольше, чем пациентам с нормальным иммунным статусом. Отмену АМП можно проводить через 4-7 дней после нормализации температуры тела и устранения очага инфекции как источника бактериемии.
ОСОБЕННОСТИ ЛЕЧЕНИЯ СЕПСИСА У ЛЮДЕЙ ПОЖИЛОГО ВОЗРАСТА
При проведении антибактериальной терапии у людей пожилого возраста необходимо учитывать понижение у них функции почек, что может потребовать изменения дозы или интервала введения β-лактамов, аминогликозидов, ванкомицина.
ОСОБЕННОСТИ ЛЕЧЕНИЯ СЕПСИСА ПРИ БЕРЕМЕННОСТИ
При проведении антибактериальной терапии сепсиса у беременных женщин необходимо направить все усилия на сохранение жизни матери. Поэтому можно использовать те АМП, которые противопоказаны в период беременности при неугрожающих жизни инфекциях.
ОСОБЕННОСТИ ЛЕЧЕНИЯ СЕПСИСА У ДЕТЕЙ
Антибактериальная терапия сепсиса должна проводиться с учетом спектра возбудителей и возрастных ограничений для применения отдельных классов АМП. Так, у новорожденных сепсис вызывается преимущественно стрептококками группы В и энтеробактериями (Klebsiella spp., E.сoli и др.). При использовании инвазивных устройств этиологически значимыми являются стафилококки. В некоторых случаях возбудителем может быть L.monocytogenes. Препаратами выбора являются пенициллины в комбинации с аминогликозидами II-III поколения. Цефалоспорины III поколения также могут быть использованы для терапии сепсиса у новорожденных. Однако, учитывая отсутствие у цефалоспоринов активности в отношении листерий и энтерококков, их следует применять в комбинации с ампициллином.
НЕЙТРОПЕНИЧЕСКАЯ ЛИХОРАДКА
Нейтропеническая лихорадка - это повышение температуры тела у пациентов с нейтропенией (количество нейтрофилов менее 0,5 x 10 9 /л), обусловленной заболеванием или проведением химио- или лучевой терапии.
Лихорадка у пациентов с нейтропенией в 80% случаев связана с развитием инфекции. В 40% удается получить микробиологические подтверждения инфекции, в 20% диагноз основан на клинических данных и еще в 20% не исключается возможность инфекционного заболевания.
Определяющим моментом в развитии инфекционных осложнений является не только уровень, но и длительность нейтропении. Признаки локального инфекционного процесса у больных с нейтропенией часто отсутствуют, и единственным симптомом инфекции зачастую является лишь лихорадка: температура тела выше 38 o С, сохраняющаяся в течение 2-3 ч, не связанная с введением пирогенных препаратов или условиями окружающей среды.
Основные возбудители
Наиболее частыми бактериальными возбудителями инфекции у пациентов с нейтропенией являются аэробные грамположительные кокки (S.aureus, S.epidermidis, стрептококки, энтерококки) и грамотрицательные палочки (E.coli, K.pneumoniae, P.aeruginosa). В последние годы основными возбудителями инфекций при нейтропении являются грамположительные микроорганизмы, что связано с использованием в/в устройств, нарушением целостности слизистых оболочек при химиотерапии, проведением антибиотикопрофилактики фторхинолонами и другими АМП. У пациентов, получавших АМП широкого спектра действия, частыми возбудителями вторичных и, в меньшей степени, первичных инфекций являются грибы (Candida spp., Aspergillus spp.).
Выбор антимикробных препаратов
В связи с высоким риском развития угрожающих жизни бактериальных инфекций, всем пациентам с нейтропенией (число нейтрофилов менее 0,5 x 10 9 /л) и лихорадкой следует начинать антибактериальную терапию. Предпочтение отдается бактерицидным АМП широкого спектра действия, которые следует назначать в/в в максимальных терапевтических дозах. Эмпирическую терапию необходимо проводить и пациентам с нейтропенией без лихорадки при наличии симптомов инфекции.
Стартовая антибактериальная терапия нейтропенической лихорадки может включать следующие режимы:
- монотерапия (цефтазидим, цефепим или карбапенемы). Эти АМП не обеспечивают достаточной активности в отношении КНС, MRSA, энтерококков;
- комбинация антисинегнойных β-лактамов; в том числе ингибиторозащищенных (тикарциллин/клавуланат, пиперациллин/тазобактам, цефтазидим, цефоперазон, цефоперазон/сульбактам, цефепим, карбапенемы) и аминогликозидов II-III поколения (амикацин, гентамицин, нетилмицин, тобрамицин). Преимуществами этой комбинированной терапии являются аддитивный или синергидный эффект, антианаэробная активность, уменьшение вероятности селекции резистентных штаммов; основными недостатками - нефро- и ототоксичность, риск развития гипокалиемии;
- комбинация двух β-лактамных антибиотиков (пиперациллин + цефтазидим и др.) характеризуется недостаточной активностью в отношении S.aureus и P.aeruginosa.
В лечебных учреждениях с высокой частотой инфекций, вызванных грамположительными микроорганизмами, в качестве стартовой терапии у пациентов с факторами риска следует назначать комбинацию ванкомицина и цефтазидима. К факторам риска относятся:
- симптомы катетер-ассоциированной инфекции;
- выраженное повреждение слизистых оболочек (мукозит) в результате химиотерапии;
- предшествующая антибиотикопрофилактика фторхинолонами;
- установленная колонизация MRSA, пенициллино- и цефалоспоринорезистентными S.pneumoniae;
- гипотензия или другие симптомы сердечно-сосудистой недостаточности.
Указанная комбинация обеспечивает активность в отношении широкого спектра микроорганизмов и отличается более высокой безопасностью. Эмпирическую терапию ванкомицином следует прекратить через 3-4 дня, если микробиологическое исследование не выявило грамположительных бактерий. Это связано с тем, что избыточное использование ванкомицина приводит к селекции резистентных микроорганизмов, прежде всего энтерококков.
Эффективность проводимой антибактериальной терапии оценивают через 3 дня на основании сохранения или исчезновения лихорадки.
При исчезновении лихорадки и идентификации возбудителя режим антибиотикотерапии можно изменить для обеспечения наиболее оптимальной терапии с минимальным риском развития НР и наименьшей стоимостью. Антибактериальную терапию продолжают до 7 дней или до эрадикации возбудителя, а также исчезновения симптомов инфекции. Желательно, чтобы к моменту отмены антибиотиков число нейтрофилов превышало 0,5х10 9 /л.
При отрицательных результатах микробиологических исследований стартовую антибактериальную терапию следует продолжить до 7 дней. У комплаентных пациентов без явных признаков инфекции и при отрицательных культурах крови можно через 2 дня перейти к пероральной терапии (амоксициллин/клавуланат + ципрофлоксацин).
Сохранение лихорадки более 3 дней на фоне антибактериальной терапии может указывать на:
- небактериальную инфекцию;
- наличие антибиотикорезистентных микроорганизмов;
- развитие вторичной инфекции;
- недостаточные концентрации антибиотиков в сыворотке крови и тканях;
- лекарственную лихорадку.
В некоторых случаях исчезновение лихорадки даже при оптимальной антибактериальной терапии происходит на 4-5-й день, поэтому следует провести тщательное обследование пациента.
При сохранении лихорадки на 4-7-й день и отсутствии указаний на вышеперечисленные причины неэффективности стартового режима возможны следующие альтернативы:
| 1) | продолжить стартовую терапию; |
| 2) | отменить или добавить антибактериальные препараты; |
| 3) | добавить противогрибковый препарат (амфотерицин В, флюконазол) с изменением или без изменения режима стартовой антибиотикотерапии. |
Если состояние пациента не ухудшилось целесообразно продолжить предшествующую терапию. При прогрессировании заболевания следует изменить стартовый режим. Так, при выделении КНС, MRSA, Corynebacterium spp., энтерококков или стрептококков, а также при появлении признаков угрожающего жизни сепсиса, целесообразно добавить ванкомицин. Пациенту с выраженной нейтропенией и лихорадкой в течение 1 нед несмотря на использование антибиотиков широкого спектра действия в адекватных дозах, следует применять противогрибковый препарат.
[youtube.player]Cогласно современным концепциям, сепсис может представлять собой нозологическую форму или осложнение тяжелой инфекции. Обязательным компонентом сепсиса является генерализованная воспалительная реакция, возникающая в ответ на клинически или бактериологически доказанную инфекцию. Подтверждением генерализованной воспалительной реакции является наличие двух или более симптомов:
- температура тела выше 38 o C или ниже 36 o C;
- тахикардия более 90 уд/мин;
- тахипноэ более 20 в мин или снижение парциального давления СО2 в артериальной крови менее 32 мм рт.ст.;
- число лейкоцитов в периферической крови более 12×10 9 /л или менее 4×10 9 /л или число незрелых форм более 10%.
Выделяют стадийность заболевания: сепсис, тяжелый сепсис и септический шок. Основным отличием сепсиса от тяжелого сепсиса является отсутствие органной дисфункции. При тяжелом сепсисе возникают признаки органной дисфункции, которые при неэффективном лечении прогредиентно нарастают и сопровождаются декомпенсацией. Результатом декомпенсации функции органов является септический шок, который формально отличается от тяжелого сепсиса гипотензией, однако представляет собой полиорганную недостаточность, в основе которой лежит тяжелое распространенное поражение капилляров и связанные с этим грубые метаболические нарушения.
Сепсис может развиться у пациентов как во внебольничных условиях, так и во время пребывания в стационаре. Основными источниками являются инфекции НДП (пневмония), МВП, кожи и мягких тканей, органов брюшной полости (кишечник, ЖВП и др.).
Основными возбудителями сепсиса являются бактерии, реже сепсис может быть вызван вирусами, риккетсиями, грибами и паразитами. Из грамположительных микроорганизмов наиболее часто сепсис вызывают S.aureus, S.epidermidis, Enterococcus spp., S.pneumoniae. Среди грамотрицательных палочек основными являются E.coli, Pseudomonas spp., Klebsiella spp.
Локализация очага инфекции позволяет определить спектр наиболее вероятных возбудителей. Так, при сепсисе, обусловленном интраабдоминальной инфекцией, возбудителями чаще являются энтеробактерии, анаэробы и, возможно, энтерококки; при ангиогенном сепсисе — S.aureus. При уросепсисе высока вероятность выделения E.coli, Pseudomonas spp., Klebsiella spp. У пациентов с иммунодефицитными состояниями значительную роль в этиологии сепсиса играют нозокомиальные штаммы грамотрицательных и грамположительных бактерий (P.aeruginosa, Acinetobacter spp., K.pneumoniae, E.coli, Enterobacter spp., S.aureus) и грибы.
В большинстве случаев антибактериальную терапию при сепсисе назначают эмпирически (табл.), не дожидаясь результата микробиологического исследования. При выборе препаратов необходимо принимать во внимание следующие факторы:
Предполагаемый источник сепсиса
Амбулаторные инфекции у пациентов без нейтропении: инфекции МВП другая локализация
Нозокомиальные инфекции у пациентов без нейтропении
Инфекции у пациентов с термическими поражениями не менее 20% поверхности тела
Инфекции у пациентов с в/в катетерами и имплантированными протезами
- тяжесть состояния пациента;
- место возникновения (внебольничные условия или стационар);
- локализацию инфекции;
- состояние иммунного статуса;
- аллергоанамнез;
- функцию почек.
Наиболее часто используется комбинация двух АМП. Объективными аргументами в пользу назначения комбинированной терапии являются:
- невозможность дифференцировать грамположительную или грамотрицательную этиологию инфекции по клинической картине;
- высокая вероятность полимикробной природы сепсиса;
- риск резистентности к одному из АМП.
При эмпирической терапии сепсиса, развившегося в условиях стационара (нозокомиальный сепсис), необходимо учитывать локальные эпидемиологические данные о структуре возбудителей и их чувствительности к АМП. Например, в случае преобладания MRSA, препаратами выбора для проведения эмпирической терапии являются ванкомицин или линезолид. Ввиду высокой резистентности грамотрицательной нозокомиальной микрофлоры к гентамицину необходимо использовать амикацин.
При клинической эффективности антибактериальную терапию продолжают проводить стартовыми препаратами. При отсутствии клинического эффекта в течение 48-72 ч АМП необходимо заменить с учетом результатов микробиологического исследования или, если таких не имеется, на препараты, перекрывающие пробелы в активности стартовых АМП, принимая во внимание возможную резистентность возбудителей.
При сепсисе АМП необходимо вводить только в/в, подбирая максимальные дозы и режимы дозирования по уровню клиренса креатинина. Ограничением к применению препаратов для приема внутрь и в/м введения являются возможное нарушение абсорбции в ЖКТ и нарушение микроциркуляции и лимфотока в мышцах.
Длительность антибактериальной терапии определяется индивидуально. Необходимо добиться устойчивого регресса воспалительных изменений в первичном инфекционном очаге, доказать исчезновение бактериемии и отсутствие новых инфекционных очагов, купировать реакцию системного воспаления. Но даже при очень быстром улучшении самочувствия и получении необходимой позитивной клинико-лабораторной динамики длительность терапии должна составлять не менее 10-14 дней. Как правило, более длительная антибактериальная терапия требуется при стафилококковом сепсисе с бактериемией (особенно вызванном MRSA) и локализации септического очага в костях, эндокарде и лёгких.
Пациентам с иммунодефицитом АМП всегда применяют дольше, чем пациентам с нормальным иммунным статусом. Отмену АМП можно проводить через 4-7 дней после нормализации температуры тела и устранения очага инфекции как источника бактериемии.
При проведении антибактериальной терапии у людей пожилого возраста необходимо учитывать понижение у них функции почек, что может потребовать изменения дозы или интервала введения β-лактамов, аминогликозидов, ванкомицина.
При проведении антибактериальной терапии сепсиса у беременных женщин необходимо направить все усилия на сохранение жизни матери. Поэтому можно использовать те АМП, которые противопоказаны в период беременности при неугрожающих жизни инфекциях.
[youtube.player]В статье рассмотрим, что это такое - MRSA инфекция.
При выраженных симптомах гнойного поражения кожи у взрослого и ребенка врачи не исключают стафилококк, который требуется в срочном порядке лечить. Эта опасная инфекция может стать основной причиной многих заболеваний внутренних органов и систем. При возникновении главного вопроса, как избавиться от недуга, требуется обратиться к компетентному специалисту. В противном случае в патологический процесс будет вовлечено все больше и больше здоровых тканей.
Стафилококк является бактерией, которая может жить в носу и на коже человека, не причиняя ему вреда. Его носителями может быть практически треть населения. В некоторых случаях из-за стафилококка появляются разные инфекции.
Что это?
Метициллин-резистентный золотистый стафилококк (то есть MRSA) – это обозначение любого его штамма, устойчивого к большому количеству антибиотиков – бета-лактамов. В них входят цефалоспорины и пенициллины. Поэтому такие инфекции могут нуждаться в длительном лечении.
В случае MRSA (methicillin resistant staphylococcus aureus) в основном идет речь о носительстве микроба, бактерии при нем живут в человеческом организме наряду с другими микробами, и патология возникает нечасто. В большей степени инфекции появляются у тех людей, которые уже имеют определенные проблемы со здоровьем, к примеру, у лиц, пребывающих на стационарном лечении при тяжелых болезнях.
Не все знают, что это такое - MRSA инфекция.
Бактерия может спровоцировать патологии у пациентов, которые только что перенесли хирургическое вмешательство, химиотерапию, имеют раны на коже или которым установили искусственный сердечный клапан, катетер мочевого пузыря, суставной протез или венозную канюлю.
Клинические проявления
Рассмотрим клинические проявления золотистого стафилококка.
Особенно часто он персистирует в верхних отделах дыхательных путей и носовых ходах, в мочевыводящих путях и открытых ранах. У здоровых людей болезнь может проходить без симптомов не просто несколько недель, а даже много лет. Если у пациентов значительно нарушена иммунная система, они больше подвергаются симптоматической инфекции.
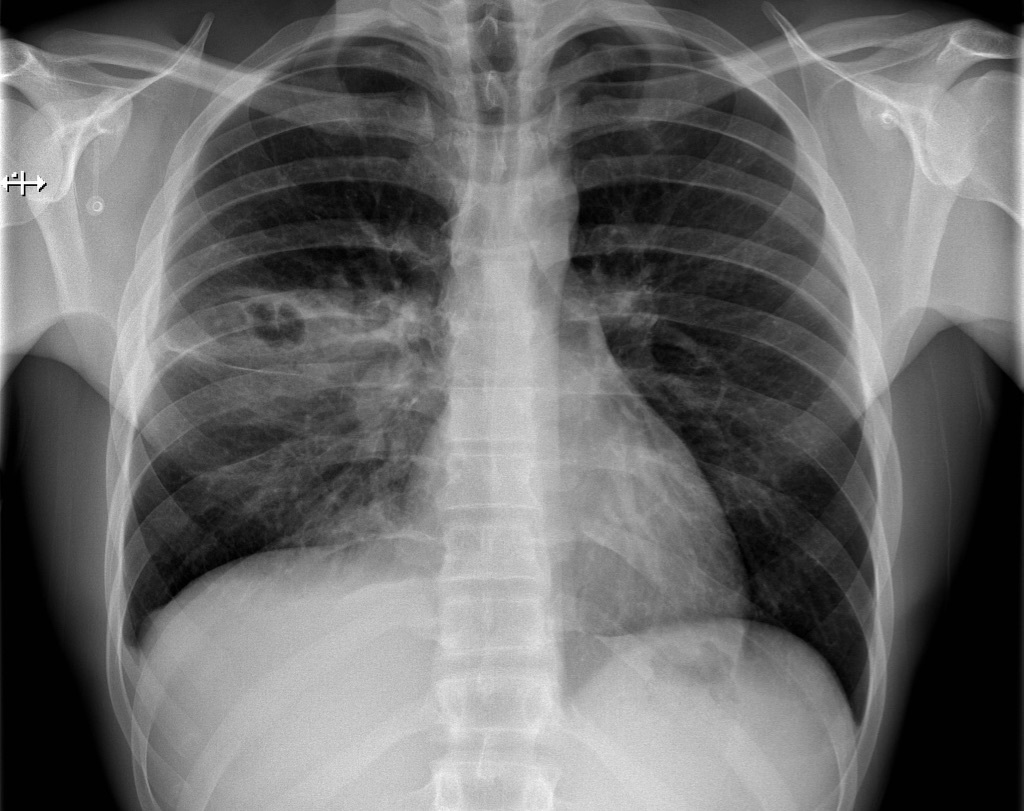
Принимаются дополнительные санитарные меры для людей, которые контактируют с инфицированными пациентами: медицинский персонал, родственники. Они признаются эффективными для сведения к минимуму инфекционного распространения в больницах Дании, Соединенных Штатов, Нидерландов и Финляндии.
Существенное прогрессирование процесса инфекции наблюдается на протяжении 1-2 суток после первичной актуальной симптоматики. Когда проходит трое суток, бактерии могут попасть в ткани организма и стать устойчивыми к влиянию лекарственных веществ. Вначале возникают небольшие красные шишки, напоминающие укусы пауков, прыщи, что может сопровождаться лихорадкой, а в некоторых случаях – сыпью. Шишки через несколько дней увеличиваются, становятся более болезненными и могут заполняться гноем. Примерно 75 % стафилококков метициллин-резистентных локализуются на мягких тканях, коже, могут эффективно лечиться. Но штаммы обладают высокой вирулентностью и провоцируют более серьезные заболевания, чем традиционные стафилококковые инфекции. Они могут воздействовать на жизненно необходимые органы и вызывать сепсис (обширное распространение инфекции), некротическую пневмонию и синдром токсического шока. Считается, что связано это с токсинами штаммов. Не установлено, почему у некоторых здоровых людей формируются инфекции кожи, поддающиеся лечению, а у других пациентов с тем же штаммом возникает тяжелая инфекция, способная привести к летальному исходу.
Самыми распространенными проявлениями инфекции, вызванной MRSA, становятся инфекции кожи, пиомиозит, некротический фасциит, инфекционный эндокардит (воздействует на сердечные клапаны), некротические пневмонии. Инфекция часто приводит к формированию абсцессов, которые нуждаются во вмешательстве хирурга.
Группы риска
В группу высокого риска входят:
- люди со слабой иммунной системой (пациенты со СПИД/ВИЧ-инфекцией, после пересадки органов, больные раком, тяжелые астматики и др.);
- пациенты с сахарным диабетом;
- дети;
- пациенты, которые принимают антибиотики хинолоны;
- люди, использующие наркотические инъекции;
- пожилые пациенты;
- студенты, которые живут в общежитиях;
- люди, работающие или пребывающие в медицинских учреждениях на протяжении длительного периода времени;
- лица, которые проводят время на пляжах и в прибрежных водах;
- люди, проводящие время с другими людьми в замкнутом пространстве, в том числе спортсмены, солдаты, заключенные.
Инфекции, вызванные золотистым стафилококком, в основном наблюдаются в медицинских учреждениях и больницах, в домах престарелых. Но нужно отметить, что инфекция может находиться и вне больниц, например, в закрытых учреждениях, таких, как тюрьмы, если постоянно принимаются новые заключенные с плохим состоянием здоровья, не придерживающиеся правил личной гигиены. Количество случаев инфицирования повышается в животноводстве – заболевают чаще всего свиньи, птица и крупный рогатый скот, от них возможна передача возбудителя людям.
Например, в США увеличилось количество сообщений об инфекционных вспышках, когда возбудитель передавался через кожу в спортивных залах и раздевалках, даже среди здоровых людей. Кроме того, проблемой в области педиатрии является MRSA инфекция. Что это такое, интересно многим.
Далее выясним, какова диагностика таких патологий.
Диагностический тест на выявление MRSA
Определение вспышек метициллин-резистентной стафилококковой инфекции осуществляется диагностическими референтными и микробиологическими лабораториями. Есть экспресс-методы, которые позволяют установить тип и описать штамм возбудителя. Например, такие методы, как количественная ПЦР или ПЦР в реальном времени, все чаще используются в клинических лабораториях для скорейшего выявления и идентификации штаммов метициллин-резистентного стафилококка.
Еще один лабораторный тест, нашедший широкое применение, - это тест латекс-агглютинации, который позволяет диагностировать PBP2a (β-лактам-резистентный пенициллин-связывающий белок), придающий устойчивость стафилококку к оксациллину и метициллину.
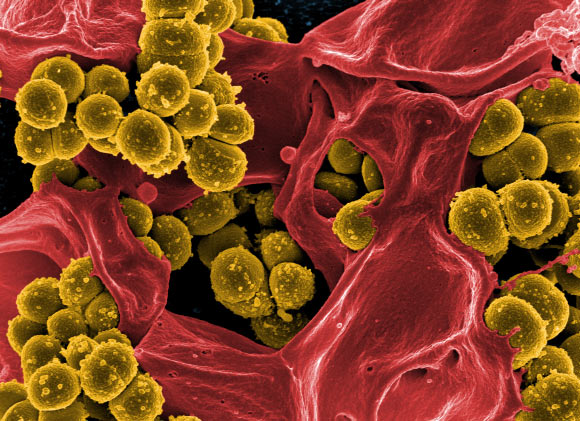
Лечение MRSA инфекции
Носитель лечится с помощью ликвидации с тела бактерий MRSA. Терапевтический курс назначается лечащим врачом. Обычно выписывается антисептическое средство для гигиены головы и тела, мазь, содержащая антибиотики, для смазывания носа внутри, так как бактерии преимущественно располагаются там. Дополнительно к этому нужно менять одежду и постельное белье ежедневно. Стирка одежды и белья производится как минимум при 60 градусах Цельсия. Если бактерии были найдены в горле, то нужно его полоскать средством, назначенным врачом, по утрам и вечерам.
Лечебный курс полностью продолжается от пяти до десяти суток. После завершения лечения через одну, две и три недели берут контрольные пробы. Рекомендуется сдавать пробы повторно через три месяца, полгода и год. В некоторых случаях требуется повторное проведение лечения до полного избавления от бактерий.
Гигиена рук
Лучшим способом предотвращения распространения штаммов MRSA и в домашних условиях, и в больнице является тщательная гигиена рук. Руки нужно вымыть водой с мылом либо протереть их специальным антисептиком. Антисептик для рук представляет собой раствор, в котором содержится спирт, и он примерно в течение тридцати секунд справляется с большей частью микробов. Руки нужно протирать этим средством и дать им высохнуть, не вытирая и не смывая его.
Способы предотвращения бактериального распространения в домашних условиях
При здоровой коже носительство MRSA – это не помеха для общения с другими людьми. Можно посещать магазины, сауны, бассейны. Избегать совместного использования с посторонними одежды, гигиенических средств, полотенец и т. д. Регулярно нужно менять постельное и нижнее белье, полотенца, стирать их разрешается при высокой температуре, соблюдая инструкции, указанные на этикетке. Отдельно стирать белье людей с носительством MRSA нет необходимости. Следует придерживаться правил личной гигиены.
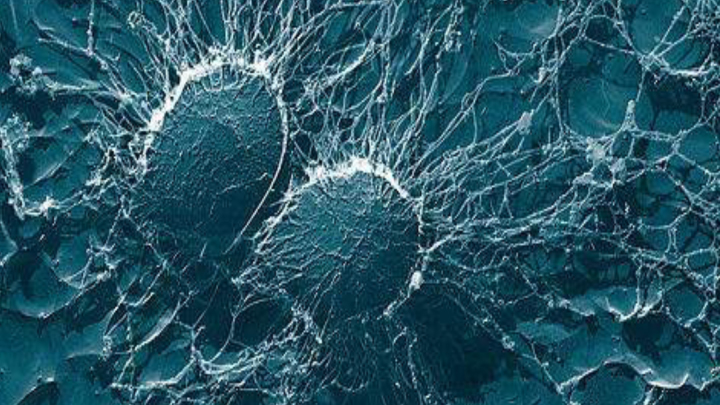
Если есть кожные раны или воспаление, нельзя посещать общественные сауны и бани. Дома нужно поддерживать чистоту, во время уборки хватает применения обычных чистящих средств. Среди дезинфицирующих средств нужно выбирать вещества, которые уничтожают стафилококк. Обычно спектр влияния дезинфицирующих растворов указывается на этикетке.
Рекомендации членам семьи
Если кто-то из домочадцев, вместе с которым живут люди, работает в животноводстве или здравоохранительной сфере, либо собирается лечь в дом инвалидов/больницу, то ему нужно провериться на MRSA. При назначении лечения рекомендуется в первую очередь пройти обследование всем тем, кто проживает вместе с инфицированным. Если кто-либо из членов семьи тоже является носителем, можно заразиться повторно. Именно поэтому всем членам семьи с обнаруженным MRSA нужно одновременно проходить лечение.
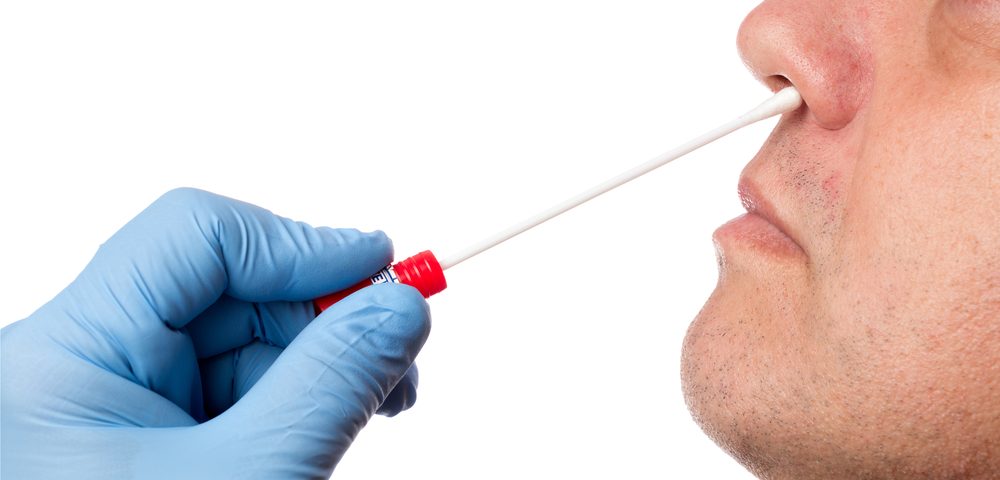
Есть ли ограничения по работе?
Человек может работать, исключая те случаи, когда он собирается в сферу здравоохранения (дома инвалидов и больницы) или заниматься животноводством. Он не обязан сообщать ни работодателю, ни в детском саду, ни в школе (исключая сферы труда в животноводстве/домах инвалидов/больницах) о том, что является носителем стафилококка. Такие пациенты могут спокойно социально взаимодействовать с другими людьми.
Мы рассмотрели, что это такое - MRSA инфекция.
[youtube.player]Читайте также:


