Электрод ассоциированный инфекционный эндокардит
Ю.Л.Шевченко, Ю.И. Гороховатский, В.Г. Гудымович, В.С. Кучеренко, С.В. Королев
Инфекционный эндокардит (ИЭ) ассоциированный с электродами электрокардиостимулятора (ЭКС) правых камер сердца представляет собой особую форму эндокардита. В связи с прогрессом кардиохирургии эта форма ИЭ встречается все чаще. Частота встречаемости его составляет 0.5% - 0.7% среди пациентов с установленным ЭКС [Klug D., 2004].
Годичная заболеваемость ИЭ, связанного с ЭКС, составляет 390 пациентов/миллион носителей ЭКС или 1,83 пациентов/миллион жителей старше 15 лет[Duval X. и др., 2004]. Причиной развития ИЭ чаще всего являются местные факторы: эрозия кожи в месте стояния электрода и инфицирование ложа генератора. ИЭ может развиться в разные сроки после имплантации кардиостимулятора: и через сутки, и спустя много лет, но в среднем через 2 года [Bartoli C]. Основной этиологический фактор ИЭ кардиостимулятора - стафилококки, преимущественно коагулазонегативные, выделяемые в 66,7-93,5%. [Konwousis N. 2003].
Различают ИЭ электродный, когда вегетации находятся на электроде изолированно или в сочетании с поражением клапанов (как правых, так и левых отделов сердца) и ИЭ у лиц с имплантированным кардиостимулятором, при котором поражается только клапан или эндокард, а электрод не вовлечен в инфекционный процесс. Мы представляем клиническую демонстрацию хирургического лечения ИЭ связанным с электродами ЭКС.
Пациент А. 59 лет поступил 11.08.2010 года в отделение с жалобами на ежедневное повышение температуры тела до 39°С с ознобом в дневные часы, кашель с небольшим кол-вом мокроты. Из анамнеза известно, что в 2000 году выполнена имплантация ЭКС по поводу синдрома слабости синусового узла. В 2007 году в связи с истощением батареи выполнена замена ЭКС, которая осложнилась гнойным воспалением его ложа. В дальнейшем проводились оперативные вмешательства в области ложа установленного ЭКС в сочетании с антибактериальной терапией, которые не имели успеха.
В этой связи выполнена переустановка ЭКС слева направо, после чего признаки инфекционного процесса купировались. В феврале 2010 года появилась лихорадка до 39°С с ознобом в связи, с чем госпитализирован в городской стационар. Заподозрен инфекционный эндокардит, в посевах крови выделен эпидермальный стафилококк. Проводилась антибактериальная и симптоматическая терапия, после нормализации температуры пациент был выписан. Через 3 недели после выписки вернулась прежняя лихорадка. В июле 2010 г. обратился в НМХЦ им. Н.И.Пирогова и был госпитализирован.
При поступлении общее состояние средней степени тяжести. Сознание ясное. Кожный покров и видимые слизистые нормальной окраски, чистые, нормальной влажности. Температура тела 37.8°С. Локально в левой и правой подключичных областях определяются послеоперационные рубцы, без признаков воспаления. Справа пальпируется ЭКС. Послеоперационный рубец после холецистэктомии (1999 год), без признаков воспаления. Периферических отеков нет. Дыхание ритмичное, ЧДД 17 в мин, без участия вспомогательной мускулатуры. При перкуссии определяется ясный легочный звук, аускультативно дыхание жесткое, проводится во все отделы. Сердечные тоны приглушены, аритмичные пульс 70-76удмин., с дефицитом в 15-20 сокращений в мин., АД 130/70 мм. рт. ст. Пульсация на артериях нижних конечностей удовлетворительная. Язык влажный, у корня обложен белым налетом.
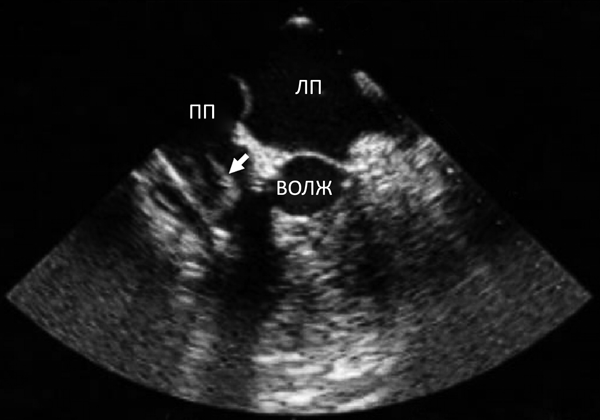
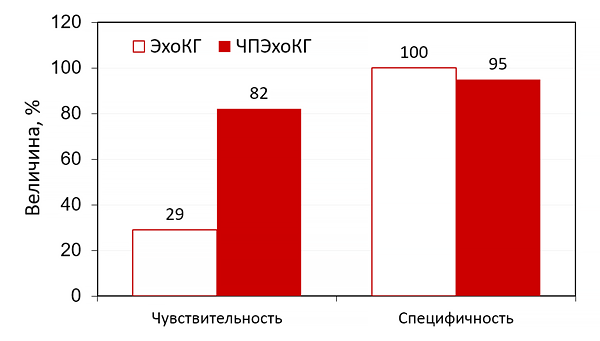
Живот при пальпации мягкий, безболезненный. Печень не пальпируется. Симптом Пастернацкого отрицательный. Дизурии нет. Очаговой неврологической симптоматики на момент осмотра не выявлено. Инструментальные данные исследования. ЭКГ фибрилляция предсердий с ЧСС 90-100удмин (рис 1). Рентгенограмма органов грудной клетки: В легких без очаговых и инфильтративных изменений. В полости сердца определяется три электрода ЭКС – два в правом желудочке, один в проекции ушка правого предсердия. Якорная часть четвертого электрода проецируется на верхнюю полую вену (рис 2). ЧП ЭХО-КГ: в проекции ТК лоцируется округлое подвижное изоэхогенное образование размерами до 15 мм, возможно, фиксированное к электродам ЭКС (рис 3).
Компьютерная томография органов грудной клетки: картина полисегментарной двусторонней пневмонии (рис 4., указано стрелками). Выставлен диагноз: Септическая стадия хронического электродного инфекционного эндокардита с массивными вегетациями на электродах. Множественные тромбоэмболии ветвей легочной артерии. Полисегментарная двухсторонняя пневмония. Полиорганная недостаточность.
Массивная антибактериальная терапия безуспешна! Удаление инфицированных электродов и санация правых камер сердца в условиях искусственного кровообращения ввиду тяжелой ПОЛИОРГАННОЙ недостаточности непереносима!Решено по жизненным показаниям выполнить вмешательство на открытом сердце без искусственного кровообращения. 24 августа 2010 выполнена операция (просмотреть видео).
Удаление эндокардиальных электродов, санация правых камер сердца без искусственного кровообращения на работающем сердце с умеренной гипотермией головного мозга. Последующая имплантация эпикардиального электрода для постоянного ЭКС к правому желудочку.
Интраоперационно: Доступ к сердцу - щадящая правосторонняя переднебоковая торакотомия. После вскрытия перикард, взяты на турникеты полые вены, аорта и легочная артерия вместе. Строчный кисетный шов на стенку правого предсердия. После окклюзии перечисленных сосудов открыто правое предсердие. Удалены 3 электрода с массивными на них вегетациями (рис. 5,6,7).
Трикуспидальный клапан состоятелен. Срочная санация правых камер сердца раствором этилового спирта. Затянут кисетный шов на правом предсердии. Последовательно освобождены от турникетов аорта и легочный ствол, полые вены. Время остановки кровообращения составило 2 минуты.
Эпикардиальный электрод для постоянной ЭКС подшит к передней поверхности правого желудочка. Порог стимуляции 0,5 Вольта. Ложе для аппарата ЭКС сформировано в апоневрозе прямой мышце живота. Аппарат ЭКС подключен к эпикардиальному электроду и уложен в ложе.
Послойное ушивание раны. Тотчас после операции восстановилась нормотермия. В течение трех дней наступил регресс инфекционного процесса и нормализация лабораторных показателей. Пациент выписался в удовлетворительном состоянии.
В данном сообщении представлено, впервые в мире успешное оперативное вмешательство на открытом сердце без применения искусственного кровообращения на работающем сердце по поводу инфекционного эндокардита ассоциированного с электродами ЭКС.
Справочник болезней

Инфекционного эндокардита
• Ревматическая болезнь сердца.
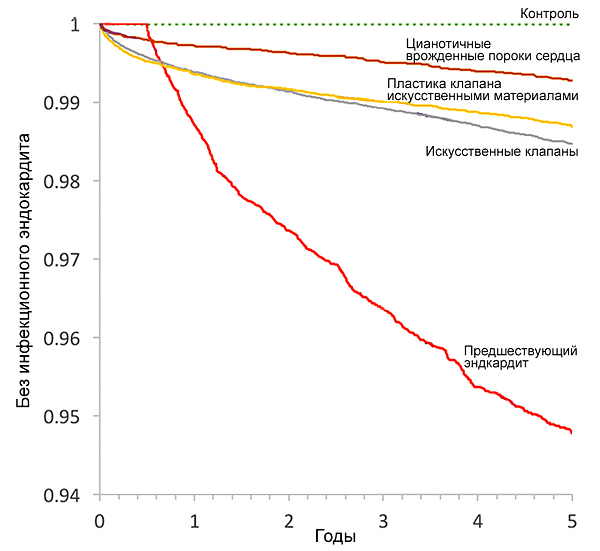
• Врожденные (цианотичные) пороки сердца.
• Искусственные клапаны сердца.
• Гемодиализ.
• Венозные катетеры.
• Внутривенное введение препаратов.
• Иммунодепрессанты.
• Пожилой и старческий возраст.
Тромбоэмболий
• Вегетации >10 мм (Mohananey D, et al, 2018).
• Флотирующие вегетации.
• Поражение митрального клапана.
• Инфекция Staph. aureus.
БОЛЬШИЕ КРИТЕРИИ
1. Положительная культура крови
1.1. Типичные микробы в 2 пробах крови:
• Str. viridans, Str. gallolyticus (bovis), Staph. aureus, HACEK группа.
• Внебольничные Enterococci без первичного очага.
1.2. Повторные культуры крови, характерные для ИЭ:
• ≥2 культур крови с интервалом >12 ч.
• Все 3 культуры крови или большинство из ≥4 проб.
1.3. Культура Coxiella burnetti или IgG в титре >1:800.
2. Визуальные признаки
2.1. Эхокардиографические признаки:
• Вегетация,
• Абсцесс, псевдоаневризма, интракардиальная фистула.
• Перфорация или аневризма клапана.
• Новое частичное раскрытие искусственного клапана.
2.2. Аномальная активность возле искусственного клапана по 18Ф-ФДГ ПЭТ/КТ (имплантация >3 мес) или СПЕКТ/КТ сцинтиграфии с меченными лейкоцитами.
2.3. Паравальвулярное повреждение по КТ сердца.
МАЛЫЕ КРИТЕРИИ
1. Предрасполагающие заболевания сердца, инъекции.
2. Лихорадка >38°С.
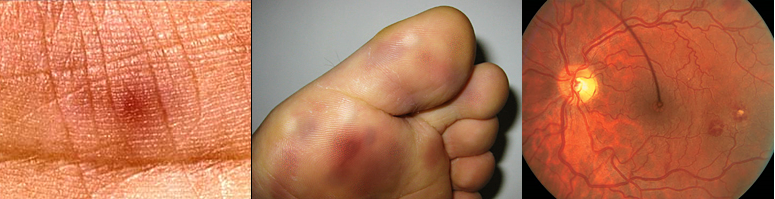
3. Сосудистые феномены: эмболии крупных артерий, септические инфаркты легких, микотические аневризмы, внутричерепные кровоизлияния, кровоизлияния в конъюнктиву, повреждения Джейуэя.
4. Иммунные нарушения: гломерулонефрит, узелки Ослера, пятна Рота, ревматоидный фактор.
5. Культура крови, не соответствующая большим критериям, или серологические признаки активной инфекции микробом, способным вызвать ИЭ.
Определенный ИЭ = 2 больших, или 1 большой + 3 малых, или 5 малых.
Вероятный ИЭ = 1 большой + 1 малый или 3 малых.
Ds: Инфекционный эндокардит митрального клапана с умеренной регургитацией и лабильной вегетацией (2х0.5 см), активный. Фибрилляция предсердий. ХСН II ФК. [I33.0]
Ds: Инфекционный эндокардит аортального клапана с тяжелой регургитацией, излеченный, пресинкопе, ХСН III ФК, 2б. [I33.0]
Осложнения: Инфаркт миокарда (2011), инфаркт правой почки.
Ds: Инфекционный эндокардит искусственного аортального клапана, активный, поздний. [I33.0]
Сопутствующий Ds: Желудочное кровотечение, вызванное варфарином (12.10.2016).
Ds: Инфекционный эндокардит трехстворчатого клапана с умеренной недостаточностью, повторный. Острая сердечная недостаточность. [I33.0]
Осложнения: Рецидивирующая легочная эмболия, пневмония.
Ds: Инфекционный эндокардит трехстворчатого клапана с выраженной регургитацией, ассоциированный с наркотиками, активный. Сердечная недостаточность, декомпенсация. [I33.0]
Лечение острого ИЭ до выявления микроба
• Ампициллин + Оксациллин по 12 г/сут в 4 приема в/в + Гентамицин 3 мг/кг однократно в/в, в/м.
• Ванкомицин 30 мг/кг/сут в 2 приема в/в + Гентамицин 3 мг/кг однократно в/в, в/м.
• Ванкомицин 30 мг/кг/сут в 2 приема в/в + Гентамицин 3 мг/кг однократно в/в, в/м + Рифампин 900–1200 мг в 2 приема в/в, per os при нозокомиальном или раннем эндокардите искусственного клапана.
Стрептококк, чувствительный к пенициллину
• Цефтриаксон 2 г однократно или Амоксициллин 100–200 мг/кг/сут в 4 приема в/в [4 нед].
• Цефтриаксон 2 г однократно или Амоксициллин 100–200 мг/кг/сут в 4 приема в/в + Гентамицин 3 мг/кг однократно в/в, в/м [2 нед].
• Ванкомицин 30 мг/кг/сут в 2 приема в/в [4 нед].
Стрептококк, относительно нечувствительный к пенициллину
• Цефтриаксон 2 г однократно или Амоксициллин 200 мг/кг/сут в 4 приема в/в [4 нед] + Гентамицин 3 мг/кг однократно в/в, в/м [2 нед].
• Ванкомицин 30 мг/кг/сут в 2 приема в/в [4 нед] + Гентамицин 3 мг/кг однократно в/в, в/м [2 нед].
• Терапия 6 вместо 4 нед при эндокардите искусственного клапана.
Стафилококк, чувствительный к метициллину
• Оксациллин 12 г/сут в 4 приема в/в [4–6 нед].
• Оксациллин 12 г/сут в 4 приема в/в + Рифампин 900–1200 мг в 2 приема в/в, per os [≥6 нед] + Гентамицин 3 мг/кг однократно в/в, в/м [2 нед] при искусственном клапане.
Стафилококк, нечувствительный к метициллину
• Ванкомицин 30–60 мг/кг/сут в 2 приема в/в [4–6 нед].
• Даптомицин 10 мг/кг однократно в/в [4–6 нед].
• Ванкомицин 30–60 мг/кг/сут в 2 приема в/в + Рифампин 900–1200 мг в 2 приема в/в, per os [≥6 нед] + Гентамицин 3 мг/кг однократно в/в, в/м [2 нед] при искусственном клапане.
Сердечная недостаточность
• Выраженная регургитация или обструкция с симптомами СН или эхокардиографическими признаками нарушенной гемодинамики.
• Отек легких или кардиогенный шок.
Неконтролируемая инфекция
• Локальная: абсцесс, ложная аневризма, фистула, растущие вегетации.
• Инфекция грибами или мультирезистентными микроорганизмами.
• Персистирующая позитивная культура крови, несмотря на адекватную антибиотикотерапию и контроль септических метастатических очагов.
• Эндокардит искусственных клапанов, вызванный стафилококками или не-HACEK грамотрицательными бактериями.
Профилактика эмболий
• Эндокардит аортального или митрального клапанов с персистирующими вегетациями >10 мм после ≥1 эмболического эпизода, несмотря на адекватную антибиотикотерапию.
• Эндокардит аортального или митрального клапанов с изолированными вегетациями >30 мм.
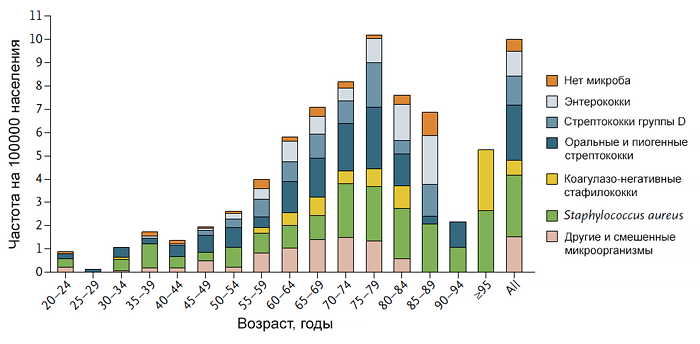
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубеж
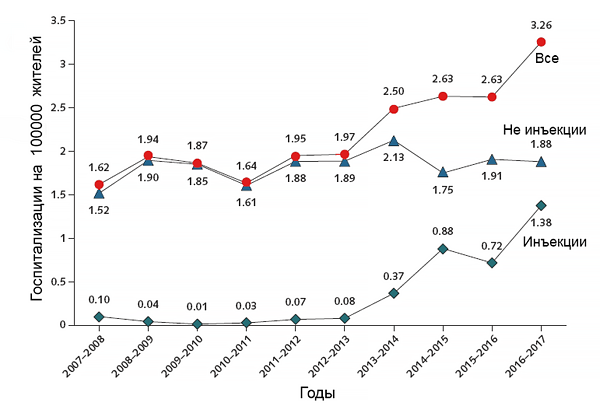
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубежом. По данным различных авторов, сегодня выросла заболеваемость в пожилом и старческом возрасте, а также среди лиц в возрасте до 30 лет, использующих внутривенное введение наркотиков [1, 2].
Известно, что ИЭ представляет собой заболевание инфекционной природы с первичной локализацией возбудителя на клапанах сердца, пристеночном эндокарде, протекающее с проявлениями системной инфекции, сосудистыми осложнениями и иммунной реакцией [3, 4, 5].
В данной работе обобщен опыт диагностики и ведения больных ИЭ на базе общетерапевтического отделения Александровской больницы Санкт-Петербурга за период 1998–2003 гг. Диагностика заболевания осуществлялась в соответствии с критериями Duke [8]. Диагноз ИЭ оценивался как достоверный при наличии двух главных критериев, а именно:
- при выделении типичного для ИЭ возбудителя при посевах крови больного;
- при определении эхокардиографических признаков поражения эндокарда - подвижные вегетации на клапанах сердца, абсцессов в области протеза клапана; образования внутрисердечных фистул и др., в сочетании с тремя или/и пятью вспомогательными критериями, к которым относились сосудистые осложнения (эмболии крупных артерий, септические инфаркты легких, внутричерепные кровоизлияния и др.), иммунологические феномены (гломерулонефрит, узелки Ослера, геморрагический васкулит и др.), а также фебрильная лихорадка, гепато-спленомегалия и другие проявления системной инфекции.
Нами было проведено обследование 105 больных ИЭ, из них у 80 человек в возрасте от 18 до 30 лет (первая группа) основным фактором риска заболевания являлась инъекционная наркомания.
Во второй группе больных (25 чел.) основными предрасполагающими факторами развития ИЭ были врожденные и приобретенные пороки сердца, а также протезированные клапаны.
У лиц старшей возрастной группы дополнительным фактором риска являлись дегенеративно-дистрофические изменения клапанов сердца.
Взаимосвязь характера поражения клапанов сердца и факторов риска ИЭ представлена в таблице 1.
По данным эхокардиографического исследования, у 100% больных первой группы были выявлены подвижные вегетации на створках трикуспидального клапана (ТК), что сопровождалось формированием его недостаточности I—III степени.
Во второй группе больных ИЭ отмечалось поражение левых камер сердца с образованием вегетаций на створках аортального и митрального клапанов. Изолированное поражение митрального клапана наблюдалось у двух человек с ревматическим пороком сердца (митральный стеноз), у одной больной с врожденным дефектом межжелудочковой перегородки и в единственном случае обструктивной формы гипертрофической кардиомиопатии.
Среди лиц пожилого и старческого возраста у девяти человек (36%) определялось изолированное поражение аортального клапана в отсутствии признаков аортального стеноза. Наряду с этим, у пяти больных (20%) в возрасте от 72 до 87 лет ИЭ развился на фоне аортального порока атеросклеротического генеза, причем у всех пятерых было выявлено сочетанное поражение аортального и митрального клапанов. Дегенеративно-дистрофические изменения других клапанов сердца определялись у 100% больных старшей возрастной группы.
Образование вегетаций на створках аортального клапана наблюдалось у двух больных с третичной формой сифилиса на фоне имеющегося аортального порока, связанного со специфическим процессом в аорте.
В двух случаях мы наблюдали развитие эндокардита протезированных клапанов.
При сопоставлении результатов посевов крови в двух группах больных определялись существенные различия как в частоте выделения микробной флоры, так и в видовом составе возбудителей эндокардита. По нашим данным, возбудителем ИЭ у больных-наркоманов в 71,3% наблюдений (57 чел.) являлся золотистый стафилококк, тогда как во второй группе, наряду с кокковой флорой, чаще обнаруживались грамотрицательные микроорганизмы (28%). Отрицательные результаты посевов крови значительно реже наблюдались в первой, чем во второй, группе больных ИЭ: 18,7% и 56% — соответственно. Данные относительно этиологической структуры ИЭ в обследуемых группах больных представлены в таблице 2.
Клиническое течение и характер осложнений инфекционного эндокардита во многом зависят от локализации клапанных вегетаций — в правых или левых камерах сердца, а также степени вирулентности возбудителя заболевания.
Течение ИЭ у больных-наркоманов отличалось особой тяжестью и полисиндромностью. Причиной госпитализации у большинства больных были острые осложнения основного заболевания. Значительная часть больных поступала в реанимационное отделение стационара с клиническими симптомами одно- или двухсторонней многофокусной пневмонии, причиной которой являлась септическая тромбоэмболия ветвей легочной артерии (72% больных). Течение пневмонии сопровождалось тяжелой дыхательной недостаточностью, нередко с развитием респираторного дистресс-синдрома (РДСВ) и очагами деструкции в легких (12%). Проявления вторичной нефропатии, которые обнаруживались у 100% больных в первой группе, иногда ошибочно трактовались как обострение хронического гломеруло- или пиелонефрита, мочекаменной болезни, что служило поводом для госпитализации этих больных в урологическое и нефрологическое отделения.
Во второй группе больных основной причиной госпитализации была длительная фебрильная лихорадка в сочетании с анемией и гепатолиенальным синдромом. Наряду с этим, у пяти человек (20%) поводом для госпитализации послужила прогрессирующая сердечная недостаточность.
Основные клинические синдромы, наблюдаемые у больных ИЭ первой и второй групп, представлены в таблице 3.
По нашим наблюдениям, характерной особенностью клинического течения ИЭ у больных-наркоманов являлась высокая частота септической ТЭЛА с формированием множественных очагов инфильтрации в легких. У многих больных легочные тромбоэмболии носили рецидивирующий характер (31,3% больных) и нередко осложнялись развитием деструктивных очагов в легких.
Образование вегетаций у 100% больных первой группы сопровождалось недостаточностью трехстворчатого клапана I—III степени с формированием потоков регургитации. Вместе с тем, у большинства пациентов не определялось тяжелых нарушений центральной гемодинамики, связанных с дисфункцией ТК. В данной группе больных характерной клинической особенностью был обратимый характер нарушений гемодинамики на фоне проводимой терапии. Острая сердечная недостаточность с дилятацией полостей сердца и снижением фракции выброса до 40% и ниже наблюдалась у 28 больных (35,3%) в связи с присоединением острого миокардита или на фоне сочетанного поражения клапанов сердца.
Вторичная нефропатия являлась одним из самых распространенных синдромов в первой группе больных ИЭ. Острая почечная недостаточность наблюдалась у 16 больных, причем у 10 из них она носила обратимый характер и была связана с острым ДВС-синдромом, а также с острой сердечной недостаточностью с отеками. Инфекционно-токсическая нефропатия регистрировалась в 73,8% наблюдений и сопровождалась мочевым синдромом — гематурией, протеинурией, лейкоцитурией — при достаточном уровне клубочковой фильтрации.
Характерной особенностью ИЭ во второй группе было подострое течение заболевания с длительным периодом лихорадки на догоспитальном этапе, причем в пожилом и старческом возрасте лихорадка носила субфебрильный характер с редкими подъемами температуры до фебрильных цифр.
Большинство больных подострым инфекционным эндокардитом (ПИЭ) поступали в стационар в стадии развернутой клинической картины заболевания с клиническими признаками тромбоэмболии сосудов большого круга кровообращения. В данной группе больных наиболее распространенными следует признать такие осложнения, как церебральные эмболии с развитием ишемических и геморрагических инсультов, эмболии почечных сосудов с болевым синдромом и гематурией, а также формирование острых очаговых изменений в миокарде, связанных с эмболией коронарных сосудов или прикрытием устьев коронарных артерий вегетациями [9].
Септические тромбоэмболии церебральных сосудов нередко сопровождались развитием гнойного менингоэнцефалита с летальным исходом. Вместе с тем, при посевах крови у 56% больных второй группы не получено роста микробной флоры. Обращает на себя внимание тот факт, что септицемия у больных с положительными результатами посевов крови в 28% наблюдений была обусловлена грамотрицательной микрофлорой. В этой категории больных источником бактериемии являлись очаги хронической инфекции в мочеполовой системе, а у двух больных (по данным аутопсии) был выявлен двухсторонний апостематозный нефрит.
У значительного числа больных ПИЭ (62%) определялись признаки острой недостаточности кровообращения с застойными хрипами в легких, легочной гипертензией, увеличением полостей сердца и периферическими отеками.
В этой группе больных чаще, чем в первой, наблюдалась преренальная азотемия и ОПН, связанные с развитием острой недостаточности кровообращения.
Острый диффузный миокардит, типичными проявлениями которого были различные нарушения ритма, диагностирован у 27% больных второй группы.
Анемия со снижением уровня гемоглобина до 80 г/л и менее выявлена у 100% больных второй группы. Значительное увеличение СОЭ (более 45 мм/ч) наблюдалось у 85,8% больных подострым ИЭ.
Кожные изменения в виде геморрагических высыпаний, пурпуры Шенлейн-Геноха, а также другие проявления иммунного воспаления в обеих группах больных встречались нечасто — 6,3 и 4% в первой и второй группах, соответственно.
Консервативная терапия больных ИЭ проводилось с использованием антибиотиков широкого спектра действия в сочетании со средствами дезинтоксикационной, антикоагулянтной и метаболической терапии. В составе антибактериальной терапии больные получали цефалоспорины III-IV поколений в комбинации с аминогликозидами и метронидазолом. Из группы цефалоспоринов назначались: цефтриаксон (лонгацеф) 2 г в сутки внутривенно (в/в), или цефотаксим (тальцеф) 2 г в сутки в/в, или цефепим (максипим) 2 г в сутки в/в в сочетании с аминогликозидами (амикацин в суточной дозе 1,5 г в/в) и метронидазолом по 1,5-2 г в сутки в/в. В случае, если такая терапия оказывалась неэффективной или существовали противопоказания к вышеперечисленным препаратам, применялись антибиотики группы линкозаминов: клиндамицин 1,2 г в сутки в/в или линкомицин 3 г в сутки в/в в сочетании со фторхинолонами (ципрофлоксацин 400 мг в сутки в/в). В условиях отделения реанимации в течение пяти–семи дней проводилась терапия имипинемом (тиенамом) в дозе 2—4 г в сутки в/в или рифампицином в суточной дозе 0,45—0,6 г в/в. Средняя продолжительность курса антибиотикотерапии в обследуемой группе больных составила 28 + 3,5 дней.
Дезинтоксикационная терапия включала в себя внутривенные инфузии реополиглюкина, гемодеза, поляризующих смесей в сочетании с петлевыми диуретиками. Объем вводимой жидкости составлял в среднем 2-2,5 л в сутки. В течение всего периода инфузионной терапии осуществлялся контроль за функциональным состоянием почек, электролитным составом крови, суточным диурезом. В условиях отделения реанимации у всех больных осуществлялся мониторинг ЦВД. Инфузионная терапия проводилась в течение всего острого периода заболевания до купирования проявлений интоксикационного синдрома. Средняя продолжительность курса составила 22 + 4,5 дня.
Развитие легочной эмболии, особенно в сочетании с признаками острого ДВС-синдрома в стадии гиперкоагуляции, служило основанием для назначения антикоагулянтной терапии. Начальная доза гепарина составляла 10 тыс. ЕД внутривенно, струйно, за-тем — по 1000 ЕД в час внутривенно, капельно с переходом на подкожное введение до 30 тыс. ЕД в сутки. Введение гепарина осуществлялось под контролем показателей коагулограммы и времени свертывания крови. Одновременно проводились внутривенные трансфузии свежезамороженной плазмы по 300 мл в сутки с добавлением 2500–5000 ЕД гепарина. Анемия тяжелой степени (Нb менее 80 г/л, Ht ≤25) корригировалась переливаниями эритроцитарной массы (пять–семь доз). При наличии гипопротеинемии использовалось введение растворов аминокислот, альбумина или нативной плазмы. Выявление клинических и рентгенологических признаков отека легких на фоне рецидивирующего течения септической ТЭЛА служило показанием для назначения кортикостероидов (преднизолон от 120 до 200 мг в сутки внутривенно капельно). Терапия антикоагулянтами прямого действия в сочетании с трансфузиями криоплазмы проводилась до стойкого улучшения показателей гемостаза. Критериями нормокоагуляции являлись уровень фибриногена в плазме 3-4 г/л, отсутствие тромбоцитопении, нормализация ВСК, АЧТВ, тромбинового времени, а также отрицательные паракоагуляционные тесты. По нашим данным, купирование проявлений острого ДВС-синдрома на стадии гиперкоагуляции у 75% больных отмечалось на седьмой–десятый день от начала комплексной терапии.
У части больных формировалась резистентность к проводимой антибактериальной терапии, которая характеризовалась нарастанием интоксикации, фебрильной лихорадкой, прогрессирующей анемией, а также высевами из крови возбудителя ИЭ – золотистого стафилококка — в 65% наблюдений. При рентгенологическом обследовании данной категории больных с большой частотой определялись очаги деструкции легочной ткани, а у трех больных гнойный выпот в плевральной полости.
Длительное применение антибиотиков широкого спектра действия у 70,3% больных (38 чел.) сопровождалось развитием побочных эффектов антибактериальной терапии. Кандидоз полости рта глотки, пищевода, а также кишечный дисбактериоз III-IV стадии был выявлен у 36 больных (66,7%). Применение антибиотиков с гепатотоксическими свойствами (цефалоспорины, линкозамины, метронидазол) у двух больных (3,7%) с хроническим гепатитом С и В приводило к прогрессированию печеночной недостаточности, которая сопровождалась высокой ферментемией (АЛТ 1500 ЕД, АСТ 1000 ЕД) и желтухой.
Развитие застойной сердечной недостаточности с появлением акроцианоза, влажных хрипов в базальных отделах легких, периферических отеков в сочетании с кардиомегалией и падением фракции выброса до 50—45% наблюдалось у пяти больных (9,3%) на фоне массивной инфузионной терапии.
Длительная антикоагулянтная терапия в 20,4% (11 чел.) наблюдений сопровождалась повышением толерантности плазмы к гепарину, что клинически выражалось в развитии периферических флеботромбозов, в то время как гепарининдуцированной тромбоцитопении в обследуемой группе больных мы не наблюдали.
Положительные результаты консервативной терапии были получены у 70,2% больных (56 чел.) с поражением ТК и лишь у 32% пациентов (6 чел.) из второй группы. Исходом ИЭ в обеих группах больных являлось формирование недостаточности клапанов сердца.
Госпитальная летальность при ИЭ у наркозависимых лиц составила 29,4% (24 чел.), тогда как у больных с поражением левых камер сердца (вторая группа) уровень смертности составил 68% (19 чел.).
По данным аутопсии, основными причинами смерти больных ИЭ были:
- септикопиемия с формированием гнойных очагов в печени, почках селезенке, головном мозге с развитием полиорганной недостаточности (46,2%);
- сердечная недостаточность на фоне полипозно-язвенного эндокардита с разрушением клапанов сердца, а также острый миокардит с дилятацией полостей сердца (39,4%);
- вторичная нефропатия с развитием почечной недостаточности, отеком легких, отеком головного мозга (14,4%).
Таким образом, характерные особенности ИЭ у лиц с наркотической зависимостью — это острое течение заболевания с поражением правых камер сердца и рецидивами септической ТЭЛА. Возбудителем ИЭ у инъекционных наркоманов в 71,3% является высоковирулентный золотистый стафилококк. Формирование недостаточности трехстворчатого клапана I—III степени стало самым распределенным осложнением ИЭ у наркоманов. При этом у большинства больных не наблюдается тяжелых нарушений центральной гемодинамики, приводящих к развитию острой недостаточности кровообращения.
Подострый ИЭ у больных с предрасполагающими заболеваниями сердца, а также у лиц пожилого и старческого возраста протекает с преимущественным поражением левых камер сердца, причем в старшей возрастной группе преобладает моноклапанное поражение. Наличие сопутствующей патологии у лиц старше 60 лет маскирует течение основного заболевания, чем и обусловлены поздняя диагностика и высокая смертность больных. Для затяжного течения ИЭ характерна низкая высеваемость возбудителя, по сравнению с острыми формами заболевания. Развитие тромбоэмболий сосудов большого круга кровообращения является характерной клинической особенностью подострого ИЭ.
Положительный эффект от проводимой консервативной терапии наблюдается у большинства больных ИЭ с поражением ТК, тогда как при подостром эндокардите левых камер сердца консервативная терапия является малоэффективной у большинства больных.
Госпитальная летальность в обеих группах больных обусловлена диссеминацией возбудителя с формированием гнойных очагов и полиорганной недостаточностью, а также развитием острой недостаточности кровообращения и вторичной нефропатии.
- Буткевич О. М., Виноградова Т. Л. Инфекционный эндокардит. - М., 1997.
- Симоненко В. Б., Колесников С. А. Инфекционный эндокардит: современное течение, диагностика, принципы лечения и профилактики. - Клин. мед., 1999. - 3. - С. 44-49.
- Тазина С. Я., Гуревич М. А. Современный инфекционный эндокардит. - Клин. мед.,1999. - 12. - С. 19-23.
- Bansal R. C. Infective endocarditis. Med Clin North America 1995; 79 (5): 1205-1239.
- Bayer A. S., Bolger A. F., Taubert K. A. et al. Diagnosis and management of infective endocarditis and its complications. Circulation 1998; 98: 2936-2948.
- McKinsey D. S., Ratts T. E., Bisno A. I. Underlying cardiac lesions in adults with infective endocarditis. The changing spectrum. Amer J Med 1987; 82: 681-688.
- Lamas C. C. Eykyn S. J. Suggested modifications to the Duke criteria for the clinical diagnosis of native valve and prosthetic valve endocarditis: analysis of 118 pathologically proven cases. Clin Infect Dis 1997; 25: 713-719.
- Durack D. T., Lukes A. S., Bright D. K. et al. New criteria for diagnosis of Infective Endocarditis Utilization of Specific Echocardiographic Finding. Amer J Med 1994; 96: 200-209.
- Тюрин В. П., Дубинина С. В. Инфекционный эндокардит у лиц пожилого и старческого возраста. - Клин. мед., 2000. - 4. - С. 53-56.
В. И. Уланова
В. И. Мазуров, доктор медицинских наук, профессор
Медицинская академия последипломного образования, Санкт-Петербург
Читайте также:


