Энцефалит бикерстафа гийена барре
Версия: Клинические рекомендации РФ (Россия)
Общая информация
Союз педиатров России
Год утверждения (частота пересмотра): 2016 (пересмотр каждые 3 года)


Классификация
G61.0 – Синдром Гийена-Барре
• Острая краниальная полинейропатия
Этиология и патогенез
При этом Campylobacter jejuni является причинно-значимым инфекционным агентом у трети пациентов, а молекулярная мимикрия между ганглиозидами и липосахаридами (эпитопы GM1, GM1b, GD1a, GQ1b, GalNAc-GD1a) данного микроорганизма способствует выработке антиганглиозидных антител. Высокие титры антиганглиозидных антител классов IgM, IgG и IgA, вступающие в реакции с эпитопами аксоплазматического отдела аксонов и миелиновой оболочки, обнаруживаются в сыворотке крови у 40% больных с СГБ.
В ходе генетических исследований выявлена связь между антигенами HLA-54, HLA-CW1, HLA-DQB*3 и СГБ. Обнаружена положительная корреляция между острой воспалительной демиелинизирующей полинейропатией и аллелем DQB1*0603 с уникальным эпитопом DQβED, а также отрицательная корреляции – с аллелями AQB1*0503, DQB1*0601, DQB1*0602 и DQB1*0603, характеризуемыми эпитопом RDP. Считается, что класс HLA является определяющим при различных вариантах СГБ, а сама болезнь представляет комплексное генетическое нарушение, на исход которого оказывают влияние генетические факторы и окружение.
Болезнь вызывается аномальным Т-клеточным ответом, индуцированным инфекционным процессом. Возникает воспалительная нейропатия с перекрестной реактивностью между антителами к инфекционным агентам и антителами к нейроантигенам, поскольку липоолигосахариды в клеточной стенке бактерий напоминают ганглиозиды, а антиганглиозидные антитела формируются в ответ острые инфекции.
Обнаружение дезоксирибонуклеиновой кислоты (ДНК) Campylobacter jejuni в миеломоноцитарных клетках позволяет предполагать представление нейритогенных антигенов Т-клеткам комплексом HLA класса II.
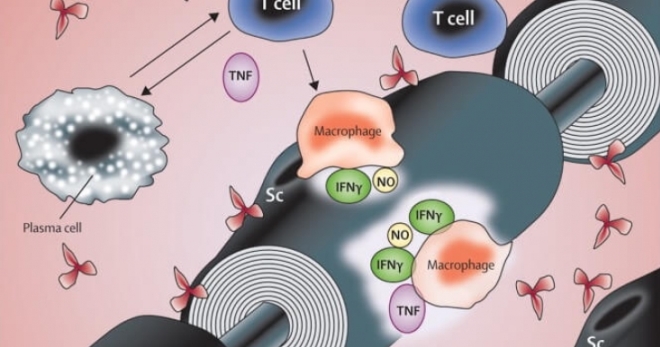
Начальным этапом в иммунопатогенезе болезни является представление антигена наивным Т-клеткам с их последующей активацией, циркуляцией по кровотоку и привязыванием к венулярному эндотелию периферических нервов. Затем Т-клетки пересекают гематоэнцефалический барьер, мигрируют через эндотелиальный слой в периваскулярную область и направляются в эндоневрий, задействуя механизмы молекул адгезии (селектины, лейкоцитарные интегрины и их контрарецепторы). Заключительным этапом в патогенезе СГБ является вхождение Т-клеток и аутоантител в эндоневрий вместе с макрофагами, где при помощи антительных и Т-клеточных механизмов идентифицируются аутоантигены на аксональных или шванновских клетках. Описываемый процесс приводит к выраженному повреждению тканей, чему способствует акивный фагоцитоз клеток моноцитарно-макрофагальной линии.
При классической форме СГБ (острая воспалительная демиелинизирующая полинейропатия) происходит поражение волокон двигательных и чувствительных нейронов. При этом основными структурами, подвергающимися патологическому воздействию, являются преимущественно корни мотонейронов и смежные проксимальные сплетения. Характерен феномен выраженной сегментарной воспалительной демиелинизации, сопровождающейся очаговой и диффузной инфильтрацией Т-лимфоидными и моноцитарно-макрофагальными клетками на всех уровнях периферической нервной системы. Воспалительные клетки аккумулируются вокруг мелких сосудов эндоневрия/эпиневрия. Комплемент-опосредованное связывание антител с эпитопами, расположенных на поверхностной мембране шванновских клеток, предшествует Т-клеточной инфильтрации. Клинические проявления болезни являются прямым следствием нарушения сальтаторной проводимости по миелинизированным волокнам (возникает блок проведения).
Считалось, что энцефалит ствола мозга Бикерстаффа (BBE), синдром Миллера Фишера (MFS) и синдром Гийена-Барре (GBS) формируют непрерывный клинический спектр. Был предложен синдром анти-GQ1b-антител, лежащий в основе общей патофизиологии для трех расстройств; однако в других исследованиях был обнаружен положительный анти-GM1 вместо анти-GQ1b-антитела.
Здесь мы сообщаем о 20-летнем пациенте-мужчине с перекрывающимися BBE, MFS и GBS. У пациента была положительная семейная история бронхиальной астмы и он страдал от этого состояния более 15 лет. Он развил симптомы BBE через девять дней после обострения астмы. В течение болезни у него были значительно повышенные уровни IgE как в сыворотке, так и в спинномозговой жидкости. Серологический анализ антител против комплексов ганглиозидов (анти-GDIa, анти-GDIb, анти-GM1, анти-GM2, анти-GM3, анти-GQIb и антитела против GTIb) показал отрицательные результаты.
Поскольку астма недавно была связана с аутоиммунным заболеванием, наш случай поддерживает аутоиммунный механизм, лежащий в основе клинического спектра, состоящего из BBE, MFS и GBS. Однако, вопреки предполагаемому синдрому анти-GQ1b-антитела, мы предположили бы, что патогенез этого клинического спектра не ограничивается антителами против ганглиозида.
Пациенты с перекрывающимся энцефалитом мозга Бикерстаффа (BBE), синдромом Миллера Фишера (MFS) и синдромом Гийена-Барре (GBS) редко сообщались за пределами Японии. Три расстройства считаются частью клинического спектра, однако общая патофизиология все еще изучается [1]. Предложен синдром анти-GQ1b-антитела для связывания BBE, MFS, GBS и других подобных состояний [2]. Несмотря на этот предложенный синдром против GQ1b, положительное анти-GM1-антитело также было продемонстрировано в перекрывающемся случае BBE, MFS и GBS, а не ожидаемом анти-GQ1b [3]. Здесь мы сообщаем случай перекрывающегося BBE, MFS и GBS, в котором все тестируемые ганглиозные нуклеозидные антитела были отрицательными, сывороточный IgE показал значительное повышение, и был отмечен положительный семейный анамнез бронхиальной астмы. Совсем недавно исследования показали, что астма имеет аутоиммунный патогенез, подобный различным аутоиммунным заболеваниям [4]. Пациент показал BBE, MFS и GBS как непрерывный клинический курс, связанный с аутоиммунным ответом. Поскольку для астмы были предложены различные аутоиммунные механизмы [5], клинический синдром, состоящий из BBE, MFS и GBS, может иметь более широкую иммунологическую основу, а не один аутоантител-опосредованный ответ против комплекса ганглиозидов.
20-летний мужчина, страдающий от кашля, ринореи, хрипов и одышки после воздействия дождливых условий окружающей среды. В детстве ему был поставлен диагноз астма. Положительная семейная история астмы включала его мать и трех старших сестер. После лечения ингаляционными кортикостероидами симптомы исчезли в течение следующих трех дней. Через девять дней после начала обострения астмы у него развилась неустойчивая походка (1 день). Симптомы сохранялись, и на третий день у него развилось помутнение зрения, головокружение и тошнота. На 12-й день он стал периодически сонливым, однако он мог быть вызван ядовитой стимуляцией. Шесть дней спустя (18-й день) он испытал эпизод тонико-клонических припадков. Этот эпизод привлек его внимание неврологической команды. На неврологическом обследовании он был полностью осознан, имел широкую походку и не мог стоять на одной ноге. Наблюдались ограничения бокового взгляда в левом глазу и вертикальный взгляд в обоих глазах. Моторные и сенсорные функции были неповрежденными. Исследование компьютерной томографии (КТ) и цереброспинальной жидкости (CSF) показало отсутствие аномалий. Электроэнцефалография (ЭЭГ) имела диффузную картину медленной волны 4-6 циклов в секунду, а форма волны 22-26 циклов в секунду преимущественно над центропаратной зоной на двусторонней основе (рис. 1). Энцефалит головного мозга был предварительно диагностирован, и пациенту был дан внутривенный дексаметазон (10 мг в день) для лечения. Несмотря на лечение, симптомы пациента ухудшались, его уровень сознания варьировался от случайной сонливости до летаргии, а на 21-й день у него развилась квадриплегия. В шкале медицинских исследований (MRC) его мышечная сила была первой для всех конечностей. Сокращения трицепсов брахии и бицепса брахии уменьшались на двусторонней основе, а брахиорадиальные рефлексы отсутствовали на двусторонней основе. Паталлярные и ахиллерные рефлексы также отсутствовали на двусторонней основе. Подошвенные рефлексы были двусмысленными. Обследование CSF показало альбуминоцитологическую диссоциацию с белком 64 мг / мл и 2 / мкл клетками. Серологические и CSF-скрининги для IgM-антител против цитомегаловируса (CMV), вируса простого герпеса I (HSV-I), вируса Коксаки (CV), вируса кори (MV), вируса Эпштейна-Барра (EBV), а также вирусного капсидного антигена EBV (VCA) IgA были отрицательными. Серологический анализ антител против комплексов ганглиозидов (анти-GDIa, анти-GDIb, анти-GM1, анти-GM2, анти-GM3, анти-GQIb и антитела против GTIb) были отрицательными. Исследование сыворотки и CSF показало достоверно повышенные уровни IgE в сыворотке (14,4 мг / л, нормальный диапазон: 0,1-0,9 мг / л) и CSF (0,046 мг / л, нормальный диапазон: неопределяемый), тогда как IgA, IgM и IgG находились в нормальном диапазоне. Исследование нервной проводимости (NCS) выявило аномалии периферических нервов, характеризующиеся повреждением аксонами (рис. 2). Как скорость движения, так и скорость сенсорной проводимости были нормальными в четырех конечностях. Исследование моторной нервной проводимости показало переменную уменьшенную амплитуду на срединном, локтевом, большеберцовом и перинеальном нервах с обеих сторон. Правый малоберцовый нерв показал слегка продолжительную латентность. Исследование сенсорной нервной проводимости регистрировало уменьшение амплитуды левого большеберцового нерва, но правый суровой нерв, правый срединный нерв и левый локтевой нерв были относительно спасены. Левая медианная F-волна не могла быть вызвана, но H-волна была вызвана нормально. В целом, результаты NCS были согласуются с диагнозом GBS с преобладающим аксональным повреждением.
Модель электроэнцефалографии у 20-летнего пациента с перекрывающимся энцефалитом ствола мозга Бикерстаффа, синдромом Миллера Фишера и синдромом Гийена-Барре. На всех электродах наблюдается диффузная модель медленной волны ЭЭГ с 4-6 циклами в секунду. От двух до двадцати шести циклов в секунду преобладает над центропаретальной зоной на двусторонней основе. Альфа-ритм над затылочными электродами отсутствовал. К моменту обследования уровень сознания пациента демонстрировал прерывистую сонливость, предполагая диагноз энцефалита.
Изображение данных исследования нервной проводимости. Исследование моторной нервной проводимости показало нормальную скорость в четырех конечностях, но с измененной уменьшенной амплитудой на срединном, локтевом, большеберцовом и перинеальном нервах с обеих сторон. Правый малоберцовый нерв показал слегка продолжительную латентность. Исследование сенсорной нервной проводимости было в противном случае нормальным, за исключением уменьшенной амплитуды левого большеберцового нерва. Левая медианная F-волна не могла быть вызвана, но H-волна была вызвана нормально.
Пациенту был поставлен диагноз BBE и одновременная MFS и GBS. Пациент находился в гиперчувствительном состоянии, о чем свидетельствуют его повышенные уровни IgE сыворотки и CSF и выпадение симптомов астмы, таким образом, был использован внутривенный дексаметазон (20 мг в день). Дозу дексаметазона уменьшали наполовину пять дней спустя, затем через пять дней перешли на пероральный преднизон и сужали. Пациент постепенно улучшался; к 37-му дню он мог говорить хрипло и прокормить себя. Его глазных движений было достаточно, но продемонстрировал горизонтальный нистагм. Симметричная слабость лимб зарегистрирована 2-3 в руках и 1-2 в ногах по шкале MRC. Сухожильные рефлексы присутствовали, но уменьшались во всех 4 членах. Последующий визит по телефону, на день 132, заставил пациента все еще выздоравливать. Его нистагм и атаксия исчезли, мышечная сила его рук оправилась, он мог ходить с поддержкой, и единственной проблемой оставалась двусторонняя слабость ноги.
Считается, что BBE, MFS и GBS образуют непрерывный клинический спектр с участием центральной нервной системы (ЦНС) и периферической нервной системы (ПНС). Диагностика каждого заболевания зависит прежде всего от клинического проявления и физического обследования (таблица 1). Согласно диагностическим критериям, предложенным Odaka et al. [2], BBE представляет собой клиническое состояние, характеризующееся острой офтальмоплегией, атаксией, нарушением сознания или оживленными рефлексами. Аномальные поражения на МРТ были обнаружены у примерно 30% пациентов, и ЭЭГ показала медленную активность в диапазоне от θ до δ, указывающую на участие ЦНС. Часто регистрируют альбуминоцитологическую диссоциацию в CSF и анти-GQ1b IgG-антителе в сыворотке крови. GBS — это острая демиелинизирующая полинейропатия, проявляющаяся как прогрессирующая и симметричная слабость конечностей на протяжении четырех недель, сопровождающаяся потерей глубоких сухожильных рефлексов. Поддерживающие доказательства включают относительно мягкую сенсорную потерю, черепную невропатию и нейрофизиологические изменения, связанные с демиелинизацией или аксональным повреждением периферических нервов и спинальных корней [6]. MFS — редкий вариант GBS, который представлен клинической триадой офтальмоплегии, атаксии и isflexia. Альбуминоцитологическая диссоциация присутствует в большинстве случаев GBS и MFS [7].
Диагностические критерии для энцефалита мозга Бикерстаффа (BBE), синдрома Миллера Фишера (MFS) и синдрома Гийена-Барре (GBS)
ЦНС спинномозговой жидкости; Магнитно-резонансная томография МРТ; Электромиограмма ЭМГ; Электроэнцефалограмма ЭЭГ.
Odaka и его коллеги [8] рассмотрели клинические профили и лабораторные данные в 62 случаях BBE и обнаружили высокую долю (37 из 62, 60%) пациентов с одновременным GBS. Эти синдромы GBS были преимущественно охарактеризованы аксональным повреждением. У некоторых пациентов была дополнительная MFS, предполагающая, что три условия тесно связаны. У нашего пациента вначале появились атаксия и офтальмоплегия, а затем развились нарушения сознания. По мере прогрессирования болезни его глубокие сухожильные рефлексы уменьшались до isflexia, и он развивал квадриплегию. В это время CSF начал проявлять альбуминоцитологическую диссоциацию. Основываясь на курсе болезни, пациент подходит для диагностики комбинированного синдрома BBE, MFS и GBS. Аксональная форма GBS, выявленная электромиограммой (ЭМГ) у нашего пациента, подтверждает идею о том, что значительное число пациентов с ВВЭ имеют синдром синдрома Гийена-Барре [8].
До появления BBE у нашего пациента был кашель и ринорея. Эти симптомы быстро сопровождались хрипами и одышкой, диагностированными как эпизод бронхиальной астмы. Дальнейшие исследования ЦМВ, HSV-I, CV, MV и EBV в сыворотке и CSF показали отрицательные результаты, а сывороточные антитела против комплексов ганглиозидов также были отрицательными. Наши результаты не подтверждают ни предложения BBE, MFS и GBS, ни синдрома против GQ1b [2], ни идеи анти-GM1-опосредованного процесса для этого клинического спектра [3]. Особым явлением, связанным с нашим пациентом, является его прошлая история бронхиальной астмы и положительной семейной истории. Через двадцать один день после появления BBE его сыворотка и иммуноглобулин CSF показали нормальные концентрации IgA, IgM и IgG, но значительно повышали уровни IgE. Пятнадцатикратное увеличение уровня IgE в сыворотке у пациента свидетельствует о том, что эпизод астмы ускорил комбинированный синдром BBE, MFS и GBS. На самом деле, пациенты с астмой обычно имеют более высокий уровень IgE в сыворотке крови на стадии ремиссии по сравнению со здоровыми людьми [9], а аутоаллергичность, опосредованная IgE, связана с различными аутоиммунными нарушениями, такими как ревматоидный артрит, буллезный пемфигоид и хроническая спонтанная крапивница [10,11 ]. Совсем недавно Каленофф сообщил, что дегрануляция маточных клеток, опосредованная IgE, возможно, связана с патогенезом рассеянного склероза — хорошо известного аутоиммунного заболевания ЦНС [12]. Связь астмы с BBE у нашего пациента косвенно подтверждалась его ответом на лечение стероидами.
Недавно интригующим развитием в области астмы является его связь с аутоиммунным заболеванием. Астма давно считалась классическим расстройством аллергии, которое считалось механистическим, отчетливо отличающимся от аутоиммунных заболеваний. Однако в течение последних нескольких лет в нескольких исследованиях сообщалось о высокой доле пациентов с астмой с сосуществующими аутоиммунными заболеваниями: чаще всего сообщалось о диабете 1-го типа, ревматоидном артрите, болезни Крона и болезни Аддисона [13]. На основании этих данных был предложен общий патогенетический эффекторный путь, и тучные клетки, Т-клетки и цитокины являются потенциальными кандидатами в качестве ключевых регуляторов иммунного ответа как при астме, так и в аутоиммунных условиях [4].
Вероятно, аутоиммунный механизм связан с патогенезом астмы, и в данном случае клинический спектр, состоящий из BBE, MFS и GBS, также связан с аутоиммунным механизмом [2]. Недавно у пациентов с астмой было обнаружено увеличение числа антиядерных антител и аутоантител против бронхиальных эпителиальных или эндотелиальных антигенов, таких как аутоантитела против цитокератина-18, альфа-энолазы и IgE [14,15]. Было обнаружено, что общие локусы однонуклеотидных полиморфизмов (SNP) изменяют риск развития астмы, диабета 1 типа, первичного билиарного цирроза и болезни Крона [5]. Поэтому, хотя сывороточные антитела против комплексов ганглиозидов были отрицательными у нашего пациента, существует вероятность того, что другие опосредованные антителом аутоиммунные реакции или SNP способствовали восприимчивости и вызывали постоянную заболеваемость BBE, MFS и GBS.
Письменное информированное согласие было получено от пациента для публикации настоящего отчета по делу и любых сопроводительных изображений. Копия письменного согласия доступна для рассмотрения Главным редактором этого журнала.
BBE, энцефалит ствола мозга Бикерстаффа; MFS, синдром Миллера Фишера; GBS, синдром Гийена-Барре; КТ, компьютерная томография; CSF, Цереброспинальная жидкость; ЭЭГ, электроэнцефалография; MRC, Совет медицинских исследований; ЦМВ, цитомегаловирус; HSV-I, вирус простого герпеса I; CV, вирус Коксаки; MV, вирус кори; EBV, вирус Эпштейна-Барра; VCA, вирусный капсидный антиген; NCS, исследование проводимости нерва; ЦНС, Центральная нервная система; PNS, периферическая нервная система; ЭМГ, электромиография; МРТ, магнитно-резонансная томография; SNP, однонуклеотидные полиморфизмы.
Авторы заявляют, что у них нет конкурирующих интересов.
CH внес существенный вклад в тематическое исследование и сбор данных. YW также внес существенный вклад в исследование путем анализа данных, составления рукописи и пересмотра. JJ и XJ предоставили свои знания в области проектирования и оформления рукописей. VF и YD помогли в критической оценке контента и в языковой коррекции. WS помог проанализировать и интерпретировать электрофизиологические данные пациента. JX помог собрать и обрезать данные исследования проводимости нерва. YXS отвечал за все исследование, включая анализ случаев, организацию обучения и составление рукописи. Все авторы прочитали и утвердили окончательный вариант рукописи.
Юань Ван как первый автор.
Отчет о болезни был предоставлен Отделом неврологии, больницей Anmen.
Синдром Гийена-Барре (СГБ) — острая воспалительная демиелинизирующая полирадикулоневропатия аутоиммунной этиологии. Характерный признак заболевания — периферические параличи и белково-клеточная диссоциация в ликворе (в большинстве случаев). Диагноз синдрома Гийена-Барре устанавливается при наличии нарастающей слабости и арефлексии в более чем 1 конечности. При этом следует исключить другие неврологические заболевания, сопровождающиеся периферическими парезами: полиомиелит, острый период стволового инсульта, токсические поражения ЦНС и др. Лечение пациентов с синдромом Гийена-Барре проводится в стационаре, т. к. больному может потребоваться ИВЛ.
МКБ-10
Общие сведения
Синдром Гийена-Барре (СГБ) — острая демиелинизирующая воспалительная полиневропатия аутоиммунной этиологии. Характерный признак заболевания — периферические параличи и белково-клеточная диссоциация в ликворе (в большинстве случаев). В настоящее время в рамках СГБ выделяют четыре основных клинических варианта:
- классическая форма СГБ — острая воспалительная демиелинизирующая полирадикулоневропатия (до 90% случаев)
- аксональная форма СГБ — острая моторная аксональная невропатия. Характерный признак данной формы СГБ — изолированное поражение двигательных волокон. При острой моторно-сенсорной аксональной невропатии поражаются как двигательные, так и чувствительные волокна (до 15%)
- синдром Миллера-Фишера — форма СГБ, характеризующаяся офтальмоплегией, мозжечовой атаксией и арефлексией при слабовыраженных парезах (до 3%)
Помимо вышеуказанных форм синдрома Гийена-Барре, в последнее время выделяют еще несколько атипичных форм заболевания — острую сенсорную невропатию, острую пандизавтономию, острую краниальную полиневропатию, встречающиеся довольно редко.
Клиническая картина синдрома Гийена-Барре
Первыми проявлениями синдрома Гийена-Барре являются, как правило, мышечная слабость и/или сенсорные расстройства (чувство онемения, парестезии) в нижних конечностях, которые, спустя несколько часов (суток) распространяются на верхние конечности. В некоторых случаях заболевание манифестирует болями в мышцах конечностей и пояснично-крестцовой области. Очень редко первым проявлением становятся поражения ЧН (глазодвигательные расстройства, нарушение фонации и глотания). Степень двигательных нарушений при синдроме Гийена-Барре значительно варьируется — от минимальной мышечной слабости до тетраплегии. Парезы, как правило, симметричные и больше выражены в нижних конечностях.
Типична гипотония и существенное снижение (либо полное отсутствие) сухожильных рефлексов. В 30% случаев развивается дыхательная недостаточность. Расстройства поверхностной чувствительности проявляются в виде легкой или умеренной гипо- или гиперкинезии по полиневритическому типу. Приблизительно у половины пациентов наблюдаются расстройства глубокой чувствительности (иногда вплоть до полной ее утраты). Поражения ЧН, выявляемые у большинства больных, проявляются парезом мимических мышц и бульбарными нарушениями. Из вегетативных нарушений наиболее часто наблюдаются сердечные аритмии, артериальная гипертензия, расстройство потоотделения, нарушение функций ЖКТ и тазовых органов (задержка мочи).
Диагноз синдрома Гийена-Барре
При сборе анамнеза необходимо обратить внимание на наличие провоцирующих факторов, так как более чем в 80% случаев развитию СГБ предшествуют те или иные заболевания и состояния (перенесенные инфекции ЖКТ, верхних дыхательных путей, вакцинация, оперативные вмешательства, интоксикация, опухоль). Неврологическое обследование направлено на выявление и оценку выраженности основных симптомов синдрома Гийена-Барре — чувствительных, двигательных и вегетативных расстройств.
Необходимо проведение общеклинических исследований (общий анализ мочи, общий анализ крови), биохимического анализа крови (газовый состав крови, концентрация электролитов сыворотки), исследования ликвора, серологических исследований (при подозрении на инфекционную этиологию заболевания), а также электромиографию, результаты которой имеют принципиальное значение для подтверждения диагноза и определения формы СГБ. В тяжелых случаях заболевания (быстрое прогрессирование, бульбарные нарушения) следует проводить суточное мониторирование АД, ЭКГ, пульсовую оксиметрию и исследование функции внешнего дыхания (спирометрия, пикфлоуметрия).
Дифференциальный диагноз
В первую очередь синдром Гийена-Барре невролог дифференцирует от иных заболеваний, которые также проявляются периферическими парезами (полиомиелит), а также других полиневропатий. Полиневропатия при острой перемежающейся порфирии может напоминать синдром Гийена-Барре, но, как правило, сопровождается разнообразной психопатологической симптоматикой (галлюцинации, бред) и выраженными абдоминальными болями. Симптоматика, схожая с признаками СГБ, возможна при обширных инсультах ствола головного мозга с развитием тетрапареза, который в острый период принимает черты периферического. Основные отличия миастении от СГБ — вариабельность симптоматики, отсутствие чувствительных расстройств, характерные изменения сухожильных рефлексов.
Лечение синдрома Гийена-Барре
В тяжелых случаях с выраженными парезами особое значение для предупреждения осложнений, связанных с длительной обездвиженностью пациента (инфекции, пролежни, тромбоэмболии легочной артерии), имеет правильный уход. Необходима периодическая (не менее одного раза в 2 часа) смена положения пациента, уход за кожей, контроль над функциями мочевого пузыря и кишечника, пассивная гимнастика, профилактика аспирации. При стойкой брадикардии с угрозой развития асистолии может потребоваться установка временного электрокардиостимулятора.
В качестве специфической терапии синдрома Гийена-Барре, направленной на купирование аутоиммунного процесса, в настоящее время применяют пульс-терапию иммуноглобулинами класса G и плазмаферез. Эффективность каждого из методов сравнительно одинакова, поэтому их одновременное применение считается нецелесообразным. Мембранный плазмаферез значительно уменьшает выраженность парезов и продолжительность ИВЛ. Проводят, как правило, 4-6 сеансов с интервалом в один день. В качестве замещающих сред используют 0,9% раствор натрия хлорида или декстран .
Следует помнить о противопоказаниях к проведению плазмафереза (инфекции, нарушения свертываемости крови, печеночная недостаточность), а также о возможных осложнениях (нарушение электролитного состава, гемолиз, аллергические реакции). Иммуноглобулин класса G, как и плазмаферез, уменьшает продолжительность пребывания на ИВЛ; его вводят внутривенно ежедневно в течение 5 дней в дозе 0,4 г/кг. Возможные побочные эффекты: тошнота, головные и мышечные боли, лихорадка.
Симптоматическая терапия при синдроме Гийена-Барре проводится для коррекции нарушений кислотно-основного и водно-электролитного баланса, коррекции уровня артериального давления, профилактики тромбоза глубоких вен и тромбоэмболии. Оперативное вмешательство может понадобиться для трахеостомии в случае продолжительной ИВЛ (более 10 суток), а также гастростомии при тяжелых и длительных бульбарных нарушениях.
Прогноз при синдроме Гийена-Барре
Специфических методов профилактики синдрома Гийена-Барре не существует. Однако следует уведомить пациента о запрете на прививки в течение первого года от дебюта заболевания, так как любая прививка способна вызвать рецидив заболевания. Дальнейшая иммунизация разрешена, при этом должна быть обоснована ее необходимость. Кроме того, развившийся в течение 6 месяцев после какой-либо вакцинации синдром Гийена-Барре — сам по себе является противопоказанием к применению данной вакцины в будущем.
Заболевания центральной нервной системы настолько многочисленны, что зачастую имеют схожую симптоматику. Дифференцировать их сложно. Одним из таких заболеваний является синдром Гийена-Барре, который сопровождается глубоким поражением оболочек нервных волокон.
Синдром Гийена-Барре – что это за болезнь?
Аутоиммунное заболевание синдром Гийена-Барре (СГБ) представляет собой патологию, при которой собственная иммунная система человека поражает определенную часть периферической нервной системы. Этот участок ответственен за контроль движения мышечных волокон, а также передачу болевых, температурных и осязательных ощущений. Подробные изменения обуславливают особенности клинической картины заболевания: мышечную слабость и потерю чувствительности в ногах и руках.
Стоит отметить, что синдром Гийена-Барре относится к редким заболеваниям. По статистике, патология чаще встречается у взрослых и преимущественно у мужчин. Диагноз ставится на основании клинической картины и результатов обследования. Патология может иметь тяжелое течение, с нарушением процесса дыхания, что требует проведения реанимационных мероприятий.
Как утверждают специалисты, полинейропатия, синдром Гийена-Барре, развивается в результате метаболических нарушений. Началу заболевания предшествуют изменения в системе простаноидов и перекисного окисления липидов. В результате в кровяном русле наблюдается изменение соотношения между про- и антиоксидантами.
Наблюдается повышение концентрации малонового диальдегида. Активация окисления липидов приводит к их разрушению, в итоге повышается концентрация общего пула простаноидов: простагландинов, тромбоксана А, простациклина. Все это усиливает димиелинизирующие реакции, повышая проницаемость барьера между кровью и периферическими нервами.

Даже после длительного изучения заболевания специалистам не удалось выделить конкретные факторы, провоцирующие синдром Гийена-Барре, причины которого зачастую связывают с инфекцией. По наблюдениям врачей, в большинстве случаев развитию патологии предшествуют инфекционные процессы вирусной или бактериальной природы. Существует мнение, что толчком к развитию синдрома может стать вакцинация или проведенная хирургическая операция. Синдром Гийена-Барре после прививки регистрировался неоднократно.
Анализируя анамнез пациентов с синдромом, врачи установили, что 2/3 больных накануне перенесли инфекционное заболевание. У некоторых со дня выздоровления прошло 5 суток, у других – 3 недели. Среди возбудителей, ставших пусковым механизмом для развития синдрома:
Синдром Гийена-Барре – симптомы
Специалистам зачастую удается на ранней стадии заподозрить синдром Гийена-Барре, признаки заболевания очевидны. Начинается патология с поражения проксимальных мышц и нарушения чувствительности. Мышечная слабость начинает распространяться с ног, поражая руки. Симптомы нарастают постепенно и достигают максимума к 3-4-й неделе болезни. Наблюдается полное выпадение глубоких сухожильных рефлексов. На фоне данных изменений может развиваться дегидратация. В 5-10 % случаев отмечается паралич дыхательных мышц, что требует проведения искусственной вентиляции легких.
В зависимости от особенностей течения заболевания, первичного поражения (оболочка нерва или аксональный стержень), клинических проявлений выделяют отдельные формы синдрома Гийена-Барре. В подавляющем большинстве случаев фиксируется острая воспалительная демиелинизирующая полиневропатия (ОВДП), которая достигает 70-80% от всех случаев. При этой форме наблюдается поражение миелиновой оболочки нерва.
Второе место по распространению занимают аксональные формы. К ним относятся острая моторная и моторно-сенсорная форма синдрома Гийена-Барре. При данном типе заболевания наблюдается поражение периферических нервов с вовлечением или интактностью чувствительных волокон. Данные формы встречаются редко и в совокупности не превышают 1-3% случаев:
- синдром Миллера-Фишера;
- фаринго-цервико-брахиальная;
- острая пандизавтономия;
- парапаретическая;
- стволовой энцефалит Бикерстаффа.
Синдром Гийена-Барре – диагностика
При подозрении на синдром Гийена-Барре анализы могут и не потребоваться. Заболевание диагностируется на основании возникающих симптомов и клинической картины. К таковым относятся:
- прогрессирующая мышечная слабость в конечностях;
- угасание сухожильных рефлексов;
- симметричность поражения.
К данным признакам присоединяется и ряд других симптомов, подтверждающих развитие патологии:
- тахикардия;
- аритмия;
- вазомоторные нарушения;
- гипертензия
- отсутствие лихорадки в начале заболевания.
Синдром Гийена-Барре – лечение
Синдром Гийена-Барре относят к неотложным состояниям, требующим постоянного мониторинга и поддержания жизненно важных функций. Решение о том, как лечить синдром Гийена-Барре в конкретном случае, принимается индивидуально.
- Врачи регулярно проводят измерение форсированной жизненной емкости легких, при необходимости начинают респираторную поддержку.
- Для нормализации работы иммунной системы и очистки крови назначают терапию с помощью иммуноглобулинов и плазмафереза.
- При невозможности приема жидкости перорально назначают инфузионную терапию. При этом стараются поддерживать суточный диурез не уровне 1-1,5 л/день.
- При соблюдении больным постельного режима исключают сдавление ног и рук пациента.
Правильное и своевременное лечение синдрома Гийена-Барре позволяет полностью избавиться от болезни. При этом специфических лекарственных средств от данного нарушения не существует, однако симптоматическая терапия помогает ослабить симптомы, сократить продолжительность и выраженность болезни.
С учетом аутоиммунного характера важное значение в лечении имеет иммунотерапия. Она предполагает внутривенное введение иммуноглобулина. Эффективность лечения с помощью данного средства наблюдается в первые 7-14 дней с момента появления первых симптомов. В связи с этим важное значение имеет своевременное обнаружение синдрома Гийена-Барре.
По наблюдениям специалистов, 70% больных синдромом полностью выздоравливают. Однако в 3-10 % случаев может развиваться воспалительная демиелинизирующая полинейропатия. В таком случае важное значение приобретает восстановительная интенсивная терапия. При диагнозе синдром Гийена-Барре рекомендации, выдаваемые врачами, касаются своевременной и правильной симптоматической терапии:
- При развитии у пациента проблем с дыханием обязательно проведение оксигенации.
- Многим могут потребоваться программы по реабилитации и восстановлению двигательной активности.

Лечение СГБ осуществляется в стационаре в отделении интенсивной терапии. За пациентом устанавливается непрерывное наблюдение. Медики постоянно контролируют степень насыщения крови кислородом, оценивают дыхательную деятельность для предотвращения развития осложнений. В качестве основного препарата используются иммуноглобулины. Исследования показали, что раннее назначение IVIG в дозе 400 мг/кг, который вводят внутривенно 1 раз в день на протяжении 5 суток, дает хорошие результаты и помогает поскорее выздороветь.
Высокую эффективность на ранних этапах заболевания показывает и плазмаферез. Он помогает очистить кровь, что сокращает период болезни, снижает риск развития стойкого паралича и летального исхода. Чтобы не снизить эффект от проводимой терапии, плазмаферез иммуноглобулинами проводят на 2-3-е сутки после первого приема названых средств.
Синдром Гийена-Барре – реабилитация
Острая воспалительная полирадикулоневропатия зачастую выступает в качестве последствия перенесенного синдрома Гийена-Барре. После нормализации общего состояния, снятия симптоматики воспаления пациентам с данным диагнозом рекомендуют проведение соответствующей реабилитации. Данный комплекс мер направлен на полное восстановление двигательной активности и улучшение чувствительности. С этой целью назначается ряд физиотерапевтических процедур:
- массаж;
- ЛФК;
- лечебные ванны;
- грязевые аппликации.
На каждом этапе восстановительной терапии важное значение имеет усиленное витаминное питание, дополняемое созданием психологического комфорта, поддержкой близких. Процесс лечения может растягиваться, однако в большинстве случаев длится от нескольких недель до нескольких месяцев. Многое зависит от точного выполнения врачебных назначений.
Последствия синдрома Гийена-Барре
Синдром относят к сложной нейропатологии, способной спровоцировать поражение периферических нервов, привести к параличу. Исход во многом зависит от своевременного обращения и правильности проведения лечения. Стоит отметить, что осложнения могут возникнуть и в отдаленном восстановительном периоде болезни. В 40% случаев у пациентов наблюдаются остаточные двигательные нарушения. Парез выраженной степени и острая воспалительная полирадикулоневропатия с глубоким тетрапарезом (поражение верхних и нижних конечностей) относятся к редким и тяжелым осложнениям.
Синдром Гийена-Барре – прогноз
Заболевание синдром Гийена-Барре заканчивается летальным исходом не чаще, чем в 2% случаев. У 30% пациентов резидуальная слабость может сохраняться в течение 3-х лет. Остаточные явления у некоторых пациентов могут потребовать профессиональной переподготовки, ортопедической коррекции или оперативного вмешательства. После первичного улучшения остается риск развития хронической воспалительной демиелинизирующей полиневропатии (у 3-5% пациентов).
Читайте также:


