Европейские рекомендации по лечению аутоиммунного энцефалита
04 сентября 2018
- 3397
- 2,7
- 0
- 5
На изображении видны изменения в метаболизме базальных ганглиев и медиальных височных областей при одном из типов аутоиммунного энцефалита
В настоящее время все больше внимания уделяется тому, как иммунитет влияет на разные процессы в нашем организме. Обнаруженные в новых исследованиях нарушенные иммунные реакции становятся недостающим звеном патогенеза. Это стимулирует поиск новых лекарств и других профилактических и лечебных воздействий. В этом тексте мы обсудим особый иммунный статус мозга — его изолированность от системных процессов иммунитета. Кроме этого поговорим о расстройствах, которые нарушают иммунный суверенитет центральной нервной системы — об аутоиммунных энцефалитах.
Привилегированный орган
Мозг — это орган, примечательный во многих отношениях [1]. Бесконечная сложность устройства, его функциональные возможности и связь нашей жизни с его состоянием приковывают к мозгу внимание исследователей. Взаимоотношения мозга с иммунной системой нашего организма тоже носят особенный характер: мозг является иммуннопривилегированным органом. Иммунные реакции, которые легко развиваются в остальных тканях (клетках печени, мышцах, жировой клетчатке), в мозге возникают редко. Вместе с мозгом в таких особых отношениях с иммунной системой оказались щитовидная железа, яички и некоторые ткани глаза, в частности, роговица.
Длительное время считалось, что основой иммунной привилегии головного мозга является наличие гемато-энцефалического барьера (ГЭБ). ГЭБ — это комплекс клеточных и внеклеточных структур, которые отделяют кровь, текущую в капиллярах, от нейронов паренхимы мозга. Клетки стенок сосудов, базальная мембрана, на которой они лежат, астроциты участвуют в формировании ГЭБ. Иммунная привилегированность частей центральной нервной системы хорошо согласовывалась с распространенностью ГЭБ внутри нее. Паренхима головного мозга надежно защищена ГЭБ, и в ней редко возникают воспалительный процессы (энцефалиты). Хориоидные сплетения, продуцирующие спинномозговую жидкость, и оболочки головного мозга не имеют такого прикрытия, и их воспаление (хориоидит, менингит) встречается гораздо чаще (рис. 1).
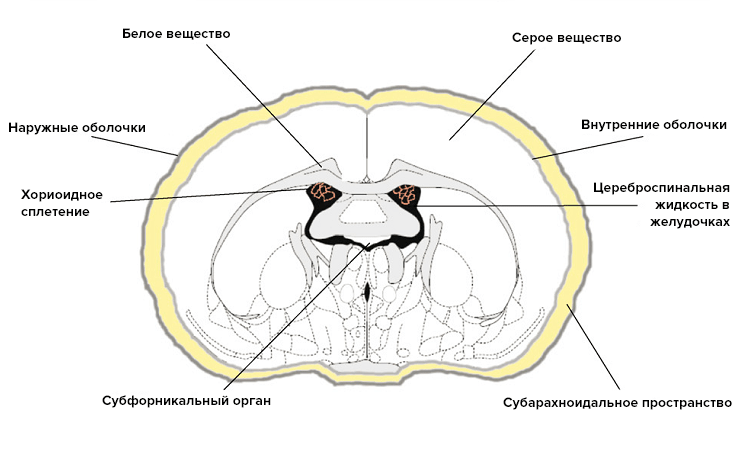
Рисунок 1. Строение центральной нервной системы. К частям, которые хорошо защищены ГЭБ, относятся серое и белое вещества. Другие компоненты не имеют такой защиты.
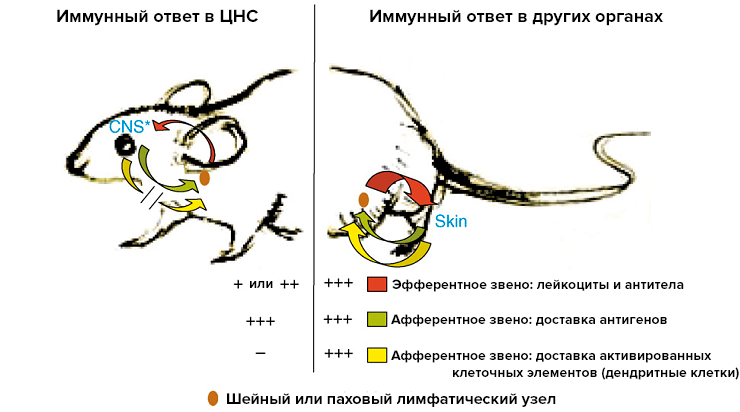
У мозга возникают сложности при доставке активированных клеток иммунитета в шейные лимфатические узлы. За работу с антигенами в головном мозге отвечают дендритные клетки. В других органах они распознают антиген, а затем предоставляют информацию о нем T- и B-лимфоцитам в лимфоузлах. При воспалении в мозге такого процесса не происходит: дендритные клетки не мигрируют в лимфоузлы и не представляют антиген. Иммунный ответ становится локальным, и дендритные клетки регулируют его в паренхиме головного мозга. Если в других органах клеточные элементы иммунитета после презентации антигена устремляются в место проникновения бактерий [6], то при развитии воспаления в паренхиме мозга этого не происходит. Мозгу приходится рассчитывать на самого себя. Подобная локальность иммунного ответа наблюдается в паренхиме, но не в хориодиных сплетениях и оболочках мозга.
Аутоиммунные энцефалиты
После разговора об особом иммунном статусе мозга мы перейдем к теме аутоиммунных энцефалитов — группе заболеваний, которые связаны с поражением мембранных и внутриклеточных структур нейронов собственным иммунитетом организма. В современной практике аутоиммунные энцефалиты диагностируются редко. Это объясняется тем, что первые случаи подробно описали только в 2005 году [10]. Можно предположить, что на самом деле случаев этого заболевания больше, чем регистрируется специалистами. Некоторым пациентам с аутоиммунным энцефалитом могут устанавливать диагноз других расстройств, например, шизофрении или инфекционного энцефалита. Это связано с тем, что врачи мало осведомлены об этом заболевании. Врачи диагностируют только те болезни, которые им известны. Чем больше арсенал диагнозов в запасе у врача, тем точнее диагностика и правильнее лечение.
Аутоиммунные энцефалиты можно разделить на две группы:
- заболевания, вызванные активированными T-клетками (нечто похожее происходит при рассеянном склерозе [11]);
- заболевания, которые возникают при воздействии антител на внутри- и внеклеточные компоненты нейрона, например, ионные каналы.
Для первой группы аутоиммунных энцефалитов характерно повреждение клеток антителами и активированными Т-лимфоцитами [12]. Эти энцефалиты носят более тяжелый характер и требуют интенсивных лечебных вмешательств в отличие от представителей второй группы.
Антитела проникают снаружи, из-за пределов ГЭБ, или производятся проникшими в головной мозг и активированными B-лимфоцитами [15]. В тех случаях, когда антитела направлены против внутриклеточных структур, атаку на нейроны возглавляют цитотоксические T-лимфоциты. При помощи перфорина и гранзима B они повреждают мембрану нейронов, что приводит к их гибели [16], [17]. ГЭБ, о котором мы говорили выше, в этом свете представляется надежной крепостной стеной, защищающей тихий город, который отвык воевать. Если в стене возникнет брешь, то город быстро падет: нервные клетки окажутся слишком чувствительны к воздействию иммунных факторов.
Признаки аутоиммунных энцефалитов очень разнообразны, но можно выделить три типа симптомов.
- Психиатрические симптомы: психозы, агрессивные действия, сексуальная расторможенность, панические атаки, навязчивые действия, чувство эйфории или страха.
- Двигательные симптомы: повышение тонуса мышц и его неравномерность, мышечные подергивания и повторяющиеся движения конечностей.
- Припадки: генерализованные эпилептические припадки, эпилептический статус.
Начальными проявлениями аутоиммунного энцефалита могут быть симптомы психического расстройства: нарушение памяти, галлюцинации или появление бредовых идей. Например, при аутоиммунном поражении глутаматных NMDA-рецепторов у 80% пациентов были выявлены симптомы психических заболеваний, а больше 60% первоначально были госпитализированы в психиатрические отделения [18], [19]. Врачи-психиатры должны уметь выявлять пациентов с аутоиммунными энцефалитами или хотя бы заподозрить это заболевание, чтобы вовремя отправить пациента на соответствующие обследования и консультации к другим врачам.
- Лимфоцитарный плейоцитоз или появление олигоклональных полос при электрофорезе ЦСЖ.
- Эпилептические припадки.
- Фациобрахиальные дистонические припадки.
- Подозрение на злокачественный нейролептический синдром.
- Отклонения на МРТ.
- Отклонения на ЭЭГ.
- Сниженный уровень сознания.
- Нарушение позы и движений.
- Нестабильность вегетативной нервной системы.
- Очаговая неврологическая симптоматика.
- Нарушения речи (афазия и дизартрия).
- Быстрое, несмотря на лечение, прогрессирование психоза.
- Гипонатриемия.
- Кататония.
- Головные боли.
- Наличие других аутоиммунных заболеваний, в том числе тиреоидитов.
Кроме совокупности ранее описанных симптомов, диагноз аутоиммунного энцефалита должен быть подтвержден лабораторными исследованиями и другими диагностическими процедурами [21]. Например, можно выполнить анализ на антитела к конкретным рецепторам. При аутоиммунном энцефалите, поражающем глутаматные NMDA-рецепторы, можно обнаружить повышение титра антител к ним. Интересно, что при энцефалите увеличивается количество иммуноглобулинов класса G, а при шизофрении — классов А и М [22]. В настоящее время установлено соответствие между антителами, поражающими конкретные структуры нейрона, и симптоматикой энцефалита (табл. 1). При проведении магнитно-резонансной томографии (МРТ) могут быть обнаружены изменения в структуре головного мозга, а электроэнцефалографическое исследование (ЭЭГ) в случае аутоиммунного энцефалита может показать нарушение функционирования головного мозга.
| Структура, к которой вырабатывается антитело | Психиатрические симптомы | Другие симптомы | Типичный пациент |
|---|---|---|---|
| NMDA-рецептор | Психоз, шизофреноподобные расстройства, кататония, агрессия | Эпилептические припадки, дискинезия, вегетативная нестабильность, нарушение речи и сознания | Молодые женщины, частая связь с тератомой яичника |
| Caspr2 | Бессонница, панические атаки, депрессия, шизофреноподобные расстройства | Синдром Морвана, нейромиотония, мышечные спазмы, фасцикуляции | Пациенты среднего и старшего возраста, возможна связь с тимомой |
| LGI1 | Амнезия и другие нарушения памяти, спутанность, депрессия | Лимбический энцефалит, фациобрахиальные дистонические припадки, гипонатриемия | Пациенты среднего и старшего возраста, соотношение мужчин и женщин 2:1, возможна связь с тимомой |
| Глициновый рецептор | Поведенческие изменения, шизофреноподобный синдром | Синдром мышечной скованности, прогрессирующий энцефаломиелит с ригидностью, миоклонус, гиперэкплексия | Пациенты среднего и старшего возраста, возможна связь с тимомой и лимфомой |
| Синаптические антигены (GAD) | Шизофреноподобный синдром, аутизм, синдром дефицита внимания и гиперактивности | Лимбический энцефалит, синдром мышечной скованности, припадки, стволовая дисфункция, атаксия | Пациенты среднего и старшего возраста, возможна связь с мелкоклеточным раком легких |
| Онконевральные антигены (Yo, Hu, CV2, Ri, Ma2) | Поведенческие нарушения | Лимбический энцефалит, мозжечковая дегенерация, сенсорная нейропатия | Пожилые пациенты, часто со злокачественными опухолями |
В некоторых случаях аутоиммунное поражение центральной нервной системы вызвано развитием паранеопластического синдрома, который может сопровождать появление в организме злокачественной опухоли. При паранеопластическом синдроме опухоль может начать самостоятельно вырабатывать гормоны и гормоноподобные вещества, нарушая регуляцию различных процессов в организме. Кроме этого паранеопластический синдром может проявляться в виде аутоиммунного заболевания, например, аутоиммунного энцефалита.
По этой причине при диагностике аутоиммунных энцефалитов отдельное внимание уделяется поиску опухоли в организме пациента. Удаление опухоли в случаях паранеопластического генеза аутоиммунного энцефалита приведет к значительному улучшению состояния пациента. Пока же опухоль находится в организме человека, антитела продолжают вырабатываться, а состояние пациента ухудшаться.
Если терапия первой линии не работает, то переходят к использованию ритуксимаба и циклофосфамида. Ритуксимаб — это моноклональные антитела к рецептору CD20, который обнаруживается на поверхности B-лимфоцитов [23]. В-лимфоциты производят самые разные антитела, в том числе и аутоантитела против нервных клеток, и их уничтожение может привести к улучшению состояния. Рецептор CD20 появляется на поверхности нормальных B-лимфоцитов и B-лимфоцитов, которые прошли процесс малигнизации (озлокачествления). Благодаря этому свойству ритуксимаб эффективен при аутоиммунных заболеваниях и B-клеточных лимфомах. Лекарство присоединяется к рецептору CD20 на поверхности лимфоцита и дает возможность другим компонентам иммунной системы уничтожить клетку.
На примере аутоиммунных энцефалитов можно рассмотреть два важнейших тренда в современной медицине. Первый тренд — изучение влияния иммунных процессов на функционирование нервной системы человека и попытки вмешаться в этот процесс при лечении неврологических и психических заболеваний. Сейчас мы близки к пониманию того, что мозг — это не просто электрохимическая лаборатория под черепной коробкой, но и особый иммунный мир со своими правилами. В наших интересах изучить эти правила и начать играть по ним в свою пользу. Второй же тренд — это биологизация психиатрии, поиск конкретных биологических изменений в организме, которые приводят к нарушению психического здоровья. Психиатрия — это часть медицины, большой отрасли, где соединяются теоретические знания и их практическое применение. Без биологической основы медицина перестанет быть научной. Если игнорировать биологические законы и знания внутри одной из медицинских специальностей, то с ней произойдет то же самое. Психиатрия должна становиться биологической, чтобы оставаться научной и выполнять свои медицинские задачи.
В последнее время исследователи и врачи все больше внимания уделяют реакциям врожденного иммунитета при развитии нейродегенеративных заболеваний (болезни Альцгеймера [24], болезни Паркинсона [25], хореи Гентингтона [26]) и психических расстройств [27]. Накопление бета-амилоида, который сам, вероятнее всего, вовлечен в иммунные реакции центральной нервной системы [28], связано с нарушением баланса между его накоплением и элиминацией (удалением). Последний процесс отчасти зависит от того, как экспрессируется толл-подобный рецептор 2 (TLR2) [29]. На мышиных моделях показано: чем ниже уровень экспрессии TLR2, тем хуже удаляется бета-амилоид [30]. Снижение элиминации бета-амилоида приводит к его накоплению в нервных клетках и последующему нарушению их функции и гибели. Изучение внутренних иммунных процессов мозга может стать основой для поиска новых препаратов при нейродегенеративных заболеваниях. Сейчас фармацевтические компании тестируют моноклональные антитела для терапии болезни Альцгеймера, но успехи остаются скромными.
[youtube.player]Будесонид является глюкокортикостероидом 2-го поколения с высоким сродством к глюкокортикоидным рецепторам и минимальным системным действием. Он рассматривается как перспективный агент в терапии аутоиммунного гепатита, в особенности у пациентов с побочным
Budisonide is a 2nd generation glucocorticosteroid with high affinity to glucocorticoid receptors and minimum systemic effect. It is considered as a promising agent in therapy of autoimmune hepatitis, in particular, in patients with side effects for prednisolone.
Эффективное лечение аутоиммунного гепатита (АИГ), основанное на комбинации преднизолона с азатиоприном, было разработано почти полвека назад [1] и привело к существенному увеличению продолжительности жизни больных, которая в настоящее время сравнялась с популяционной [2].
В то же время не утихают дискуссии по поводу применения других, альтернативных схем терапии. Это обусловлено тем, что терапия АИГ является продолжительной: согласно недавним рекомендациям Европейской ассоциации по изучению печени (European Association for the Study of the Liver, EASL) она назначается на 3 года или по меньшей мере на 2 года после полной нормализации лабораторных показателей [3]. Кроме того, лечение часто является пожизненным, поскольку в достаточно небольшом проценте случаев удается достичь безмедикаментозного сохранения ремиссии. В то же время существующие режимы терапии, включающие преднизолон, приводят к большому количеству побочных эффектов, обусловленных его системным действием [3].
К сожалению, вероятно в связи с хорошей эффективностью существующей терапии, фактически не проводилось рандомизированных клинических исследований (РКИ) по применению альтернативных иммуносупрессоров при АИГ. Их действие подтверждается преимущественно описанием серий случаев и открытыми исследованиями. Исключение составляет будесонид, по применению которого существуют не только наблюдательные данные, но и результаты мультицентрового РКИ [4]. Будесонид является глюкокортикостероидом (ГКС) 2-го поколения, сродство которого к глюкокортикоидным рецепторам в 15–20 раз выше, чем у преднизолона. Кроме того, при пероральном приеме 90% его метаболизируются в печени при ее первом прохождении [4].
В проведенном M. P. Manns c соавт. в 2010 г. многоцентровом проспективном двойном слепом активно контролируемом РКИ назначение будесонида (в дозе 9 мг/сут) в комбинации с азатиоприном достоверно чаще (в 60,0% против 38,8% случаев) позволяло достичь биохимической ремиссии АИГ через 6 месяцев лечения, чем стандартная терапия преднизолоном (40 мг с последующим снижением до 10 мг) и азатиоприном. При этом системные побочные эффекты отсутствовали у 72,0% пациентов (в сравнении с 46,6% получавших преднизолон). В дальнейшем все пациенты принимали будесонид в открытом режиме. Среди пациентов, которые первоначально получали преднизолон, стероидные побочные эффекты снизились с 44,8% до 26,4% [5]. Недостатками работы M. P. Manns c соавт. является отсутствие гистологической верификации ремиссии и оценки отдаленных результатов. Но на основании полученных данных авторы сделали вывод о большей эффективности будесонида по сравнению с преднизолоном при АИГ. Этот тезис подвергался определенной критике с точки зрения эквивалентности сравниваемых доз. Существуют противоположные данные, что у части больных будесонид является менее эффективным в достижении ремиссии по сравнению с преднизолоном [6], это может быть обусловлено отсутствием возможности наращивания дозы и мальабсорбцией перорального препарата.
Однако исследование M. P. Manns c соавт. однозначно доказало следующее:
а) будесонид может использоваться при индукции ремиссии АИГ;
б) будесонид реже приводит к системным побочным эффектам, чем преднизолон;
в) пациенты, достигшие ремиссии путем назначения преднизолона, для снижения побочных эффектов ГКС могут быть переведены на терапию будесонидом с сохранением ремиссии.
Эти результаты способствовали более частому назначению будесонида при АИГ в ряде стран. Так, по данным израильского эпидемиологического исследования [7] будесонид (в качестве монотерапии или в комбинации с азатиоприном) получают 16% пациентов с установленным диагнозом АИГ. Показано, что будесонид может безопасно и эффективно применяться для индукции и поддержания ремиссии не только у взрослых, но и у детей [6].
Ограничением к применению будесонида при АИГ является стадия цирроза печени, так как в этом случае наличие портокавальных шунтов увеличивает системную концентрацию препарата, и, кроме того, растет риск тромбозов, в особенности в зоне портального кровотока [8–10].
Широкому применению будесонида при лечении АИГ препятствует ограниченное количество данных по долговременному применению препарата (возможность продолжительного поддержания ремиссии) и оптимальному варианту снижения дозы. Однако в последние годы ряд гепатологических ассоциаций выпустили рекомендации по лечению АИГ, включающие применение схем с будесонидом.
Отдельную проблему составляет лечение так называемых перекрестных (или вариантных) синдромов, наиболее распространенным из которых является комбинация АИГ и первичного билиарного цирроза (АИГ/ПБЦ).
Следует отметить, что согласно мнению части экспертов Европейской ассоциации по изучению печени [14] неконтролируемое течение ПБЦ само по себе является показанием для назначения будесонида. Этот тезис повторен в отечественных рекомендациях по лечению холестатических заболеваний, согласно которым у пациентов на доцирротических стадиях заболевания с субоптимальным биохимическим ответом на терапию урсодезоксихолевой кислотой (УДХК) предлагается использовать комбинацию ее с будесонидом (6–9 мг/день) [15]. Положительный эффект будесонида на течение ПБЦ при назначении на I-II cтадиях заболевания был показан в ряде проспективных исследований, в том числе в 3-летнем открытом РКИ H. Rautiainen с соавт. (2005) и 2-летнем двойном слепом РКИ M. Leuschner с соавт. (1999), где его назначение в сочетании с УДХК приводило к улучшению гистологической картины [16–17].
При лечении перекрестного синдрома АИГ/ПБЦ ведущие ассоциации и рабочие группы [3, 14] предлагают применять комбинацию УДХК и ГКС. Ранее обсуждалось назначение в этих случаях монотерапии УДХК, с последующим присоединением ГКС при неэффективности монотерапии [18]. Недавние рекомендации Европейской ассоциации по изучению печени подчеркивают обязательность иммуносупрессивной терапии, а при преобладании признаков АИГ рекомендуют начинать с иммуносупрессоров с последующим добавлением УДХК [3]. Проблема выработки однозначных рекомендаций по лечению АИГ/ПБЦ также связана с отсутствием клинических исследований с хорошим дизайном. В то же время применение преднизолона при ПБЦ приводит к резкому снижению минеральной плотности костной ткани, а также повышает риск развития других неблагоприятных явлений [19]. В этой ситуации предпочтительным может являться назначение будесонида.
Позволим представить собственный опыт применения будесонида при АИГ.
Ответ на терапию при АИГ оценивался как ремиссия, или неэффективное лечение, или неполный ответ [13]. Дополнительно выделялись полная (нормализация аланиновой (АЛТ) и аспаргиновой (АСТ) аминотрансфераз, а также IgG) и неполная ремиссия (снижение АСТ и АЛТ до уровня, менее чем в 2 раза превышающего верхний предел референтных значений, либо нормализация АЛТ и АСТ без полной нормализации IgG) [25]. Ответ на терапию при АИГ/ПБЦ рассматривался согласно критериям ответа на АИГ, а также парижским и барселонским критериям ответа на УДХК [26, 27].
Ретроспективный анализ выявил следующие показания к назначению будесонида:
В 17 случаях будесонид назначался для индукции ремиссии АИГ у первичных пациентов либо у пациентов, имевших рецидив заболевания на фоне отмены терапии или снижения доз ГКС. У 7 пациентов будесонид использовался для поддержания ремиссии после стандартного индукционного курса преднизолона (с достижением критериев полной либо неполной лабораторной ремиссии).
При АИГ в 5 случаях использовалась монотерапия будесонидом в дозе 9 мг (у этих пациентов имелись противопоказания к назначению азатиоприна — цитопения), а в 6 случаях назначалась комбинация будесонида 9 мг/сут и азатиоприна 50–100 мг/сут. При АИГ/ПБЦ в 9 случаях использовалось сочетание будесонида 9 мг/сут с УДХК (13–15 мг/кг/сут), а 4-м пациентам также назначался азатиоприн 50 мг/сут. Средняя продолжительность терапии на момент проведения анализа составила 20,3 ± 11,1 месяца (максимальная продолжительность — 36 месяцев). Результаты лечения представлены в табл.
У 15 пациентов (88,2% случаев) терапия будесонидом (в сочетании с азатиоприном и без него) позволила обеспечить ремиссию АИГ в течение первого года лечения. При этом достижение ремиссии наблюдалось в среднем через 8,3 ± 3,4 месяца от начала терапии. Побочных эффектов от приема будесонида в данной группе не отмечалось. В дальнейшем этим пациентам была продолжена поддерживающая терапия будесонидом с устойчивым сохранением ремиссии. У 10 пациентов при этом через год от начала лечения доза будесонида была снижена до 6 мг/сут.
Отсутствие клинико-лабораторного улучшения отмечалось у одного пациента с АИГ и одного с АИГ/ПБЦ. Была произведена замена будесонида на преднизолон в стандартной дозе, что также не привело к улучшению лабораторных показателей. У пациентки с АИГ/ПБЦ неполная лабораторная ремиссия позже была достигнута назначением метотрексата.
В результате у 4 пациентов весь период наблюдения сохранялась полная/неполная ремиссия, в том числе при дальнейшем снижении суточной дозы будесонида до 6 мг, а уровень лабораторных показателей соответствовал ранее наблюдавшемуся на терапии преднизолоном. У 3 пациентов ремиссия сохранялась при приеме будесонида в дозе 9 мг/сут, а рецидив АИГ возник после снижения до 3 мг/сут (1 пациент) и 6 мг/сут (2 пациента). Срок возникновения рецидива после изменения дозы составлял от 4 до 13 месяцев.
В настоящее время целью лечения АИГ является достижение ремиссии и последующее ее сохранение на минимальной поддерживающей дозе иммуносупрессоров [3]. Наши данные показывают высокую эффективность будесонида в индукции и поддержании ремиссии при АИГ и его вариантной форме и совпадают с результатами других авторов [4, 28–30]. При этом частота достижения ремиссии при ее индукции будесонидом соответствовала данным, приводимым для системных ГКС [3] при минимуме побочных эффектов. В случаях неэффективности будесонида в дальнейшем при лечении преднизолоном также наблюдалась гормонорезистентность.
При терапии АИГ/ПБЦ комбинацией УДХК с будесонидом (+/- азатиоприн) у всех пациентов наблюдалось улучшение лабораторного профиля, а ремиссия АИГ была достигнута в 77,8% случаев.
Будесонид был эффективен и при поддержании ремиссии, индуцированной ранее преднизолоном. Важно, что отдельные больные в нашем исследовании получали терапию будесонидом в течение 3 лет с сохранением его эффективности, что свидетельствует о возможности его длительного применения. В то же время при снижении поддерживающей дозы у 3 пациентов наблюдался рецидив заболевания. Именно вопросы снижения дозы при терапии будесонидом являются наименее разработанными и, несомненно, требуют проведения клинических исследований для выработки оптимальной тактики.
По нашему мнению, будесонид следует активно использовать в лечении АИГ и его вариантных форм у нецирротических больных без выраженных системных проявлений заболевания, особенно в группах риска развития стероидных осложнений.
Будесонид является эффективным препаратом для индукции и поддержания ремиссии при АИГ, а также он может быть успешно использован в терапии АИГ/ПБЦ.
Литература
К. Л. Райхельсон* , 1 , доктор медицинских наук, профессор
М. К. Прашнова*
Н. В. Марченко*, кандидат медицинских наук
С. Н. Мехтиев**, доктор медицинских наук, профессор
Е. Н. Зиновьева***, кандидат медицинских наук
Аутоиммунный энцефалит – это неврологическое заболевание. Оно опасно для человека, так как достигнуть полного выздоровления невозможно. Врачи применяют симптоматическую терапию, направленную на облегчение страданий пациента. Болезнь проявляется выработкой антител (клеток иммунной системы), которые направлены не против чужеродных микроорганизмов, а на собственные структуры тела (в данном случае нервную ткань).
Патогенез (механизм развития)
В результате воздействия повреждающего фактора, которым часто является вирус, иммунная система начинает вырабатывать Т-киллеры (клетки, уничтожающие вирусы и инфекции). Если их производится слишком много, иммунный ответ становится агрессивным, он начинает действовать против собственных клеток.
При уничтожении клеток серого и белого вещества головного мозга (ГМ), происходит уменьшение органа. В нем начинаются процессы атрофии (уменьшение питания сосудами, снижение функции). Болезнь затрагивает одно из полушарий. При некрозе астроцитов (отростков нервных клеток), связь между нейронами нарушается. Сигнал не передается, поэтому информация из внешнего мира не доходит до человека.
Уничтожение нейронов – это необратимый процесс, поэтому заболевание не излечивается. Так как головной мозг отвечает за функциональность всех систем организма, симптоматика аутоиммунного энцефалита ярко выражена, врач заподозрит ее по клиническим проявлениям и подтвердит с помощью лабораторных и инструментальных анализов.
Причины развития патологии
Точных причин развития аутоиммунного энцефалита не установлено. Это связанно с тем, что мозг плохо изучен. Выделяют факторы, которые влияют на образование аутоиммунных антител:
- повторные заболевания головного мозга (воспаление, травмы, кисты);
- врожденные и приобретенные нарушения иммунитета (иммунодефицит);
- аутоиммунные заболевания других органов (системная красная волчанка, артериит, ревматоидный артрит);
- частые вирусные болезни (эпидемический паротит, вирусный гепатит, ВИЧ);
- раковые заболевания головного мозга;
- генетические нарушения;
- дегенеративные нарушения мозга, которые характеризуются снижением передачи импульсов по нервным клеткам, их некрозом;
- попадание инфекции через гемоэнцефалический барьер (сеть кровеносных сосудов и лимфоузлов, которая у здорового человека не дает чужеродным агентам пройти к органу);
- отравление тяжелыми металлами, ядами.
Классификация
Для каждого типа аутоиммунного энцефалита характерна своя симптоматика и место повреждения нейронов. Поэтому выделяют несколько видов заболевания.
Аутоиммунный лимбический энцефалит
Характеризуется уменьшением интеллектуальных способностей личности. Больной перестает узнавать людей, путает слова, то есть уменьшается когнитивная функция. Невралгические симптомы развиваются в виде головных болей, приступов эпилепсии, дискинезии (неспособности управлять мышечными движениями, они становятся резкими). Если поврежден участок мозга, ответственный за функцию эндокринной системы (гипофиз), произойдут гормональные сбои.
Так как заболевание не излечимо, оно проходит в двух формах, которые сменяют друг друга (острая и хроническая). Аутоиммунный рецепторный энцефалит является вариантом лимбической формы. Образуется у женщин с новообразованиями яичников. Проявляется психическими нарушениями (галлюцинации, агрессия, паранойя). Человеку трудно дышать из-за нарушений дыхательного центра, сознание нарушается, появляются судороги. Пациент впадает в вегетативное состояние.
Аутоиммунный стволовой энцефалит
Развивается при попадании иммунных комплексов в ствол головного мозга. Характеризуется поражением глаз (веко опускается, появляется непроизвольное движение глазных яблок). Утрачивается функция вкусовых рецепторов языка. Работа вестибулярного аппарата утрачивается, человек не держит равновесие. Аутоиммунный энцефалит ствола мозга нарушает функцию слуха (полностью или частично).
Энцефалит Шильдера
Проявляется дегенеративными процессами (состояние, характеризующееся потерей функции нейронов различных отделов головного мозга) белого вещества, моста и мозжечка. Ткань этих структур воспаляется. Болезнь начинает развиваться с 4 лет и достигает пика к 15 годам. Симптоматика схожа с другими воспалительными и раковыми поражениями ГМ, поэтому диагностика затруднена. У детей быстро утрачиваются умственные способности, появляется тремор (дрожь) конечностей, судороги, головные боли. Со временем ребенок перестает узнавать людей. Лечение не разработано.
Энцефалит Расмуссена
Опасное заболевание, которое не поддается терапии. Причины до конца не ясны. Появляется в подростковом возрасте из-за нестабильности иммунной и других систем. Прогрессирует быстро. Распространяется на одно или оба полушария мозга. Одно из них полностью атрофируется. Этот вид энцефалита характеризуется эпилептическими припадками, которые не купируются лекарственными средствами.
Симптомы
Симптоматика аутоиммунного энцефалита ярко выражена. По ней врач заподозрит наличие заболевание, которое подтверждается с помощью анализов.
- Мышцы начинают непроизвольно сокращаться, из-за этого дергаются конечности, человек падает при ходьбе. У некоторых пациентов появляются судороги языка, что затрудняет речь или полностью ее купирует.
- С возрастом сигнал из головного мозга перестает доходить до ног, поэтому они теряют чувствительность. Это постепенно приводит к параличу.
- Походка на ранних стадиях шаткая, неуверенная, движения не координированы (размашистые, не четкие).
- Когнитивные функции (интеллектуальные, направленные на общение) постепенно ослабевают. У пациента спутано сознание, слабо развита речь, он перестает узнавать близких людей. Память ухудшается, развивается слабоумие.
- Наблюдаются расстройства речи. Афазия — человек путает слова, не может их произнести, меняет буквы местами.
- Развиваются апраксические расстройства, то есть не способность делать произвольные движения.
- Постоянно меняется настроение. Человек бывает агрессивным, подавленным или счастливым, не зависимо от окружающей обстановки.

В симптомокомплекс также входят следующие состояния:
- судороги, припадки, схожие на эпилептические;
- температура тела периодически достигает 38°;
- головная боль, головокружения;
- рвота без причины, тошнота;
- нарушение зрения (появляется при поражении височной доли): функция утрачивается полностью или частично (при нарушении части зрительного нерва), перед глазами появляются искры;
- нистагм — это состояние, проявляющееся непроизвольным движением глаз (из стороны в сторону или по кругу);
- светобоязнь, резь в глазах;
- диплопия — раздваивание в глазах;
- птоз — опущение верхнего века;
- утрата чувства собственного тела (пациент уверен, что у него появилось больше пальцев или нет ноги);
- усталость, сонливость (человек спит по несколько дней с небольшими перерывами на бодрствование).
Диагностика
Первый этап диагностики аутоиммунного энцефалита основывается на сборе анамнеза. Это опрос жалоб, поиск симптомов. Если пациент не может говорить, опрашиваются его родственники или опекуны.
По выявленным симптомам врач дает направления на лабораторные и инструментальные исследования. Так как у больных аутоиммунным энцефалитом выражены неврологические признаки, терапевт направит пациента к неврологу. Он смотрит на следующие симптомы:
- степень сознания (полное или его отсутствие);
- способность к мышлению, интеллект;
- качество речи;
- степень развития рефлексов;
- зрение и движение глаз.
Проводится исключение неврологической симптоматики: судороги, тремор, головная боль, нечленораздельная речь. После этого назначаются лабораторные анализы, позволяющие оценить состояние организма и исключить некоторые заболевания:
- Общий анализ крови, биохимия (оценка состояния крови, выявление С-реактивного белка, количество гемоглобина, число лейкоцитов, скорость оседания эритроцитов, позволяющая выявить воспаление).
- Общий анализ мочи (проводится для постановки на учет).
- МРТ или КТ головного мозга (проводится только одно из исследований, чтобы уменьшить радиоактивный эффект) выявляет строение ГМ, очаги атрофии, воспаления, демиелинизации волокон (отсутствие миелиновой защитной оболочки), новообразования, кровотечения.
- Люмбальная пункция — метод изъятия спинномозговой жидкости, осуществляется с помощью пункции между позвонками, позволяет выявить воспаление, инфекцию, грибы.
Важно! Постановка такого сложного диагноза, как аутоиммунный энцефалит, возможна только при осуществлении всех методов, так как, основываясь только на одном из них, можно спутать диагнозы.
Дифференциальный диагноз
Дифдиагноз проводится на основе методов диагностики. Необходимо исключить инфекцию, микозы, травмы, опухоли, вирусы, которые вызывают такие же признаки невралгии, как и аутоиммунный энцефалит. Схожей симптоматикой обладают наследственные нарушения структур ГМ, аутоиммунные заболевания других органов, воспаления сосудов (васкулит) мозга, склерозирующие состояния ГМ.

Главной отличительной чертой аутоиммунного энцефалита является наличие воспаления в крови, спинномозговой жидкости, лейкоцитоз (повышение лейкоцитов), отсутствие бактериального очага. Других данных по лабораторным признакам не выявляется. На КТ и МРТ видны очаги воспаления мозга на ранних стадиях, атрофия одного из полушария — на поздних. С возрастом добавляется характерная симптоматика неврологического расстройства.
Лечение
Лечение аутоиммунного энцефалита сводится к улучшению качества жизни, снижению тремора, болевых ощущений. Полного излечения нет.
Применяют следующие принципы терапии:
- Постельный режим.
- Прогулки на свежем воздухе.
- Обильное питье.
- Жаропонижающие препараты при повышении температуры тела свыше 38°.
- Обезболивающие анальгетики (при сильных судорогах появляются боли мышц).
- Противоэпилептические средства.
- Диета, содержащая много жирных кислот и уменьшенное количество белков и углеводов.
- Очищение крови от иммунных комплексов с помощью плазмафереза (жидкость из сосудов переливается в специальный препарат, очищается, возвращается обратно пациенту через катетер).
- Лекарства, улучшающие качество сосудистой стенки (ангиопротекторы).
- Улучшение питания ГМ с помощью ноотропных средств (чем больше крови поступает в орган, тем более эффективно он работает, риск атрофии уменьшается).
- Гормональная терапия (при поражении гипофиза).
- Препараты, ингибирующие (подавляющие) иммунитет.
- Кортикостероиды.
Осложнения
Последствия аутоиммунного энцефалита возникают всегда. Но при отсутствии терапии появляются раньше. К ним относят:
- короткие или долгосрочные потери сознания;
- вегетативное состояние организма (человек без сознания, подключен к искусственной вентиляции легких);
- снижение интеллекта;
- грубые неврологические расстройства (отсутствие чувствительности ног, тремор рук, нистагм);
- летальный исход.
При появлении одного из симптомов неврологического расстройства, необходимо немедленно обратиться к врачу. Своевременная терапия позволит улучшить качество жизни пациента, предотвратит летальный эффект в раннем возрасте. Самолечение не допустимо, пациент должен строго придерживаться терапии, назначенной лечащим врачом. Она должна осуществляться на протяжении жизни, прекращение приема препаратов чревато осложнениями и гибелью. Прогноз аутоиммунного энцефалита не утешителен. Пациенты на поздних стадиях не могут ходить, впадают в вегетативное состояние, после этого наступает смерть.
[youtube.player]
Читайте также:


