Фибриноидный некроз при ревматоидном артрите
Фибриноидный некроз — это некроз, сопровождающийся пропитыванием пораженных тканей фибрином. Он характеризуется тотальным разрушением соединительной ткани. Обычно вокруг очагов некроза, выражена реакция макрофагов, с последующим замещением некротизированного очага рубцовой соединительной тканью. Данный вид некроза возникает при ревматических болезнях, фибриноидном набухании, когда нарушаются и снижаются функции органа, развивается острая почечная недостаточность при злокачественной гипертонии.
Все эти процессы сопровождаются некрозом артериол и капилляров почечной ткани.
В результате фибриноидного некроза появляется склероз или гиалиноз, изменяются функции клапанов сердца (пороки сердца). Наблюдается неподвижность суставов, сужение просвета и потеря эластичности стенок сосудов, развивается гипоксия, атрофия и склероз органов. Гистохимические изменения определяются притоком ионов кальция в клетку, это тесно связано с необратимым повреждением и появлением признаков некроза.
Одним из важных признаков некроза клетки является изменение структуры ядра. Хроматин мертвой клетки преобразуется в крупные глыбки. Происходит уменьшение ядра в объеме, сморщивание, увеличивается плотность и базофильность (темно-синий цвет). После того как клетка подверглась некрозу цитоплазма её становится гомогенной и ярко ацидофильной, определяются изменения её цитоплазмы.
В первую очередь исчезают специализированные органеллы клетки, имеет место набухание митохондрий и деструкция мембран органелл, что вызывает вакуолизацию цитоплазмы. Далее можно определить лизис клетки, так называемый аутолиз. Все это означает, что в цитоплазме происходит свертывание или сгущение (коагуляция) белков вместо расплавления и разжижения масс сухого некроза.
При изменении межклеточного вещества меняются и межуточное вещество, и волокнистые структуры. Это характерно для фибриноидного некроза. Стойкая артериальная гипертония, приобретающая прогрессирующий характер, хотя при своевременно начатом лечении такое случается редко, сопровождается изменениями глазного дна, такими как кровоизлияния, отек диска зрительного нерва, наполнение жидкостью клетчатки.
Фибриноидный некроз соединительной ткани стенок сосудов может быть следствием фибриноидого набухания при аллергическом некрозе.
Фибриноидные изменения интимы артерий способствуют тромбозу и непрямому некрозу частей органов. При атеросклерозе примечательны длительные спазмы артериол и внезапные повышения артериального давления. При этом создаются условия для пропитывания фибриногена, фибрина, форменных элементов крови. Преобразования иммунных комплексов с фиксацией группы белков циркулирующих в крови способствует нарастанию пропитывания и развитию фибриноидного некроза.
Можно наблюдать деструктивные процессы выраженные дистрофией и гибелью мышечных клеток с последующим их лизисом. Массивное проникание плазменных белков, соединение их с веществом базальных мембран приводит к тому, что накапливается тропоколлаген, происходит пролиферация эндотелиальных и гладкомышечных клеток и их гибель. Эти все изменения происходят в результате острого фибриноидного некроза.
При глубокой деструкции сосудистых стенок возникает периваскулярный выход плазмы из кровеносного русла, кровоизлияния, образование аневризм и разрывов. Фибриноидный некроз в начале развития захватывает среднюю оболочку артериальных сосудов (медиа), а затем распространяется очагами на все стенки сосудов. Во время этого процесса появляются клеточные инфильтраты, с преобладающими в них нейтрофилами.
Далее патологические изменения сосудов заканчиваются образованием стенозов и аневризм. Чаще всего поражению поддаются почки, сердце, иногда периферическая нервная система, желудочно-кишечный тракт, кожа. Уязвимыми могут быть центральная нервная система, печень, селезенка, надпочечники, яички и легкие. Вовремя назначенный преднизон и циклофосфамид уменьшают выраженность симптомов и снижают летальный исход заболевания.
При отсутствии поражения почек прогноз благоприятнее. Прогноз лечения запущенных стадий в целом, конечно же, неблагоприятный, в случае поражения нескольких органов развитие патологии происходит быстро, после установления диагноза, в большинстве случаев, люди умирают в течение трех месяцев.

Эксперт-редактор: Мочалов Павел Александрович | д. м. н. терапевт
Образование: Московский медицинский институт им. И. М. Сеченова, специальность - "Лечебное дело" в 1991 году, в 1993 году "Профессиональные болезни", в 1996 году "Терапия".
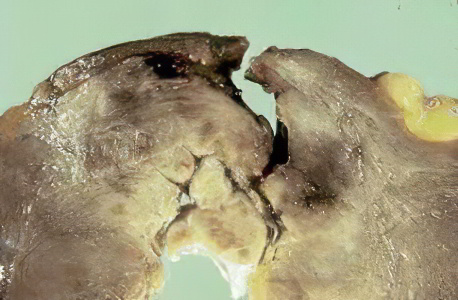
Макропрепарат ИНФАРКТ МИОКАРДА.
В стенке левого желудочка сердца участок неправильной формы, западающий на разрезе, цвет участка желтоватый с темно-красным венчиком вокруг зоны некроза.
(Э) Микропрепарат N49 ИНФАРКТ МИОКАРДА (окраска гематоксилином и эозином).
Некротические измененные кардиомиоциты по периферии зоны некроза – демаркационное воспаление (расширенные полнокровные сосуды, инфильтрация нейтрофилами)
Макропрепарат КАРДИОСКЛЕРОЗ.
В левом желудочке участок неправильной формы белого цвета, плотной консистенции, стенка миокарда вокруг рубца утолщена, гипертрофирована.
(Э) Микропрепарат N49а ПОСТИНФАРКТНЫЙ КАРДИОСКЛЕРОЗ (окраска пикрофуксином).
В миокарде имеется крупное рубцовое образование, представленное зрелой волокнистой соединительной тканью. Мышечные волокна, вокруг рубца увеличены в размерах, ядра крупные, гиперхромные. Пучки коллагеновых волокон окрашивается фуксином в красный цвет, а мышечные волокна в желтый цвет.
ЦЕРЕБРОВАСКУЛЯРНЫЕ БОЛЕЗНИ
Макропрепарат ИНФАРКТ ГОЛОВНОГО МОЗГА.
В области подкорковых ядер головного мозга виден очаг неправильной формы, представленный массами серого цвета.
Макропрепарат КРОВОИЗЛИЯНИЕ В МОЗГ (геморрагический инсульт).

В ткани мозга – скопление свернувшейся крови буровато-красного цвета, в области кровоизлияния вещество мозга разрушено (гематомы).
(Э) Микропрепарат N 35 ДИАПЕДЕЗНЫЕ КРОВОИЗЛИЯНИЯ В ГОЛОВНОЙ МОЗГ (окраска гематоксилином и эозином).
Отметить расширение и полнокровие мелких сосудов, стазы в капиллярах и венулах. Указать механизм кровоизлияния.
В ткани головного мозга вокруг каппиляров скопление эритроцитов. Сосуды расширены, полнокровны, имеются стазы.

(Э) Микропрепарат N 35-а КРОВОИЗЛИЯНИЕ В ГОЛОВНОЙ МОЗГ (окраска гематоксилином и эозином
В ткани мозга скопление гемолизированных и частично сохранившихся эритроцитов. Вещество мозга в центре гематомы разрушено, за пределами отечно. В области гематомы видна артериола с утолщенными гиалинизированными стенками и признаками плазморрагии.

РЕВМАТИЗМ
(Э) Микропрепарат N 180 МУКОИДНОЕ НАБУХАНИЕ ПОДЭНДОКАРДИАЛЬНОЙ
СОЕДИНИТЕЛЬНОЙ ТКАНИ (окраска альциановым голубым).
Участки в которых развилось мукоидной набухание эректильно окрашены в сиреневый/голубой цвет.
Электронограмма ФИБРИНОИДНЫЕ ИЗМЕНЕНИЯ ЭНДОКАРДА ПРИ РЕВМАТИЗМЕ (атлас, рис.8.21).
При электронно-микроскопическом исследовании в зоне фибриноидного набухания коллагеновые фибриллы разрушены.

Микропрепарат No 85 РЕВМАТИЧЕСКАЯ ГРАНУЛЕМА (окраска гематоксилином и эозином).
Определяются расположенные цепочкой гранулемы, состоящие из макрофагов, лимфоцитов. В центре очага фибриноидный некроз.
Макропрепарат ВОЗВРАТНЫЙ БОРОДАВЧАТЫЙ ЭНДОКАРДИТ.
Микропрепарат No 85а ВОЗВРАТНЫЙ БОРОДАВЧАТЫЙ ЭНДОКАРДИТ (окраска гематоксилином и эозином).
Клапан утолщен, склерозирован и гиалинизирован, в нем виднеются фокусы фибриноидного некроза. Над зоной некроза эндотелий разрушен, прикреплен смешанный тромб. В толще клапана диффузный лимфомакрофагальный инфильтрат.
Макропрепарат ФИБРИНОЗНЫЙ ПЕРИКАРДИТ ("волосатое сердце").

Эпикард тусклый, покрыт серовато-желтыми шероховатыми наложениями в виде нитей (нити фибрина) и напоминает волосяной покров. Наложения легко сжимаются.
РЕВМАТОИДНЫЙ АРТРИТ
Микропрепарат No 190 РЕВМАТОИДНЫЕ УЗЕЛКИ ПРИ РЕВМАТОИДНОМ
АРТРИТЕ (окраска гематоксилином и эозином).
В синовиальной оболочке разрастание соединительной ткани в виде сосочков с явлениями склероза. Соединительная ткань с явлениями очагового и диффузного набухания.

УЗЕЛКОВЫЙ ПЕРИАРТЕРИИТ
Микропрепарат No 161 ГОЛОВНОЙ МОЗГ ПРИ УЗЕЛКОВОМ ПЕРИАРТЕРИИТЕ
(окраска гематоксилином и эозином).
Определяются сосуды с фибриноидным некрозом. Инфильтрат из макрофагов и лимфоцитов, тромб в просвете сосуда.

СИСТЕМНАЯ КРАСНАЯ ВОЛЧАНКА
Микропрепарат No 193 ПОЧКА ПРИ СИСТЕМНОЙ КРАСНОЙ ВОЛЧАНКЕ (окраска гематоксилином и эозином).
ВРОЖДЕННЫЕ И ПРИОБРЕТЕННЫЕ ПОРОКИ СЕРДЦА
Просмотреть набор макропрепаратов ПРИОБРЕТЕН-НЫХ И ВРОЖДЕННЫХ ПОРОКОВ СЕРДЦА. Описать СОЧЕТАННЫЙ МИТРАЛЬНЫЙ ПОРОК СЕРДЦА (с преобладанием стеноза).
КРУПОЗНАЯ ПНЕВМОНИЯ
Макропрепарат КРУПОЗНАЯ ПНЕВМОНИЯ (в стадии серого опеченения).

Пораженная доля увеличена, плотная, на разерезе зернистая, однородного вида, серого цвета.
(Э) Микропрепарат N 45 КРУПОЗНАЯ ПНЕВМОНИЯ (в стадии серого опеченения) (окраска гематоксилином и эозином).
Капилляры запустевают, в альвеолярном экссудате – фибрин, лейкоциты, макрофаги.
Электронограмма РЕЗОРБЦИЯ ФИБРИНА ПРИ КРУПОЗ-НОЙ ПНЕВМОНИИ (атлас, рис.11.2).
При электронно-микроскопическом исследовании в участках скопления полиморфно-ядерных лейкоцитов фибрин расплавлен, в цитоплазме лейкоцитов, количество лизосом уменьшено.
Просмотреть макропрепараты, иллюстрирующие легочные осложнения крупозной пневмонии: КАРНИФИКАЦИЯ, АБСЦЕСС, ГАНГРЕНА ЛЕГКОГО.
Карнификация легкого при крупозной пневмоний -ткань доли легкого при крупозной пневмонии.

Хронический абсцесс легкого – в средней доле легкого легкого видны округлая полость с хорошо выраженной беловато-серой стенкой, в полости – зеленовато-серое густой содержимое. В окружающей ткани имеются сливающиеся сероватые очаги зернистого вида.
Воспаление суставов: причины артрита
Наиболее часто встречаемым хроническим воспалительным заболеванием является ревматоидный артрит, которым страдают около 70 млн. человек.
Ревматоидный артрит (РА) характеризуется болями в пораженных суставах и постепенным нарушением двигательной функции, что приводит к ухудшению качества жизни пациентов, наступлению стойкой утраты трудоспособности.
Как показывают статистические данные, почти половина заболевших ревматоидным артритом в течение 5 лет становятся инвалидами, а каждый десятый пациент получает инвалидность спустя 1,5 – 2 года от начала заболевания.
Протекание в организме хронического воспалительного процесса повышает вероятность возникновения и других патологий, которые называют сопутствующими (снижение иммунитета, остеопороз, атеросклероз и др.).
Помимо этого лечение РА нередко приводит к различным осложнениям со стороны желудочно-кишечного тракта, почек, свертывающей системы крови.

У 65% пациентов с РА болезнь медленно прогрессирует, течение заболевания характеризуется неполными ремиссиями и частыми обострениями.
У 25% больных РА имеет место злокачественное течение, при котором возникают множественные поражения суставного аппарата, нарушаются функции внутренних органов.
РА имеет сходный прогноз с лимфогранулематозом, инсулинозависимым сахарным диабетом. У пациентов с РА продолжительность жизни сокращается на 7 – 10 лет. Все это позволяет причислять РА к тяжелым хроническим заболеваниям.
В развитии РА играют роль множество факторов, что дает полное основание относить данную патологию к группе мультифакторальных болезней. В основе патологического механизма возникновения РА лежит обусловленное действием иммунной системы генерализированное воспаление (аутоиммунное воспаление).
Это воспаление затрагивает многие внутренние органы, но в большей степени синовиальные оболочки суставов . Воспалительный процесс приводит к разрастанию (гиперплазии) синовиальной ткани, разрушению гиалинового хряща и лежащего под ним субхондрального слоя кости.
Сегодня в патогенезе РА ученые отводят значительную роль действию фактора некроза опухоли - альфа (ФНО-α). Данный фактор представляет собой особый белок, название которого произошло от способности данного вещества вызывать геморрагический некроз (омертвение) опухолей.
Ранее считалось, что ФНО-α выполняет в организме человека только одну функции – защищает от возникновения опухолей . По мере изучения белка было обнаружено, что ФНО способен не только вызывать некроз клеток опухолей, но и выполнять другие биологические функции.
Однократное инъекционное введение препарата ФНО вызывало у подопытных животных повышение температуры тела, которое проходило с выраженным ознобом, диареей, снижением аппетита.
Если же ФНО-α вводился курсом, то у подобных животных развивалась кахексия (крайнее истощение организма).
В настоящее время установлено, что ФНО-α играет важную роль во многих физиологических и патологических процессах, протекающих в организме, в том числе в патологическом механизме развития РА. ФНО-α задействован в развитии воспаления, а также обладает иммуномодулирующим действием.
Как показали результаты исследований, ФНО-α:
- участвует в проявлении признаков воспаления (лихорадка, боль, потеря костной и мышечной массы);
- определяет миграцию белых клеток крови (лейкоцитов) в полость пораженного сустава за счет индуцирования экспрессии молекул адгезии; оказывает стимулирующее воздействие на синтез медиаторов воспаления (фактор активации тромбоцитов, простагландинов, желатиназы, коллагеназы, стромелизина), которые вызывают повреждения гиалинового хряща и кости;
- оказывает стимулирующее действие на рост новых кровеносных сосудов в зоне воспаления (неоангиогенез), а также способствует пролиферации (размножению) фибробластов, что приводит к разрастанию синовиальной оболочки и образованию ревматоидного паннуса (выросты синовиальной оболочки в подлежащие ткани – костную, хрящевую).
Неоднократные клинические исследования позволили установить, что в сыворотке крови, синовиальной жидкости и синовиальных тканях пациентов с РА отмечается повышенное содержание ФНО-α.
При этом уровень ФНО-α в сыворотке крови коррелирует (взаимосвязан) с активностью воспалительного процесса , определяемой по клиническим признакам.
Учитывая все сказанное выше, можно предположить, что основным медиатором воспаления при РА является ФНО-α и ему же принадлежит ведущая роль в патогенезе заболевания.
За последние десятилетия в терапии РА были достигнуты хорошие результаты. Сегодня в широкую клиническую практику внедрены ингибиторы ФНО-α – препараты, которые подавляют активность ФНО.
У нас возникла мысль провести у женщин корреляцию клинических проявлений ревматоидного артрита, обостряющегося полимиозитом и крепитирующим тендоваги-нитом, с развитием в матке доброкачественных эпителиальных и мезенхимальных опу-холей.
Разрастания в матке лейомиом чаще всего наблюдается после 40 лет, при этом у 32,8% женщин прослеживается семейная предрасположенность к лейомиоматозу матки при наличии дисбаланса эстрогнена/прогестерона [Сидорова И.С. Миома матки. М; ИИА, 2005; ]. Профессор А.Л.Тихомиров высказал суждение, что лейомиоматоз матки – это не истинно опухолевой процесс в миометрии, а гормонально поддреживаемый дисрегенераторный пролиферат [Тихомиров А.Л., Казанцева И.А., Лубнин Д.М. Пато-генетическое обоснование ранней диагностики и лечения миомы матки. // Акушерство и Гинекология, 1998 № 2, стр. 3-5].
Работы 90-х голов прошлого века по гистогенезу лейомиом матки показали, что зачатками этих гладкомышечных хорошо васкуляризо-ванных узлов являются клетки-предшественники миофибробластов, которые группи-руются вокруг тонкостенных сосудов в миометрии.
В матке, вокруг лейомиоматозных узлов не образуется капсула. Электронно-микроскопические исследования показали, что сначала возникают расстройства кровообращения на уровне микроциркуляции: пе-роначально пролиферации лейомиоцитов предшествует тканевая гипоксия. Если в этот момент в крови женщины нарушается соотношение фракций эстрогенов с возрастанием содержания прогестерона, тогда вокруг тонкостенных сосудов происходит гиперплазия и гипертрофия лейомиоцитов, содержащих больше рецепторов к прогестерону и эстродиолу, чем окружающий миометрий.
При ревматоидном артрите, полимиозите пролиферативно-деструктивный васкулит развивается наиболее часто в мышечной и соединительной тканях. Он имеет склон-ность к рецидивам, обострениям после повторно перенесенных вирусных, грибковых и других инфекций. У женщин с ревматоидным артритом, полимиозитом с крепитирующим тендовагинитом в климактерическом периоде - периоде стойкого дисбаланса эстрогенов и прогестерона – могут создаться длительные предпосылки к нарушению кровообращения в миометрии с развитием очагов гипоксии на уровне микроциркуляторного русла, а в стенка артериол и артерий происходят фибриноидные изменения вплоть до очагов фибриноидного некроза.
4.Собственные данные: трудности до-операционной диагностики
К пониманию морфогенеза маточных кровотечений при миоматозе матки и обострени-ях ревматоидного артрита, полимиозита с крепитирующим тендовагинитом у 70-летней женщины нас привело скрупулезное морфологическое изучения матки и яичников, удаленных в городском онкологическом диспансере. Кровотечение возникло у пациентки после 20-летный менопаузы. Онкологи полагали, что причиной этого маточного кровотечения был рак матки. Обострение у этой пациентки ревматического заболевания вызвало у клиницистов необходимость проведения тщательной предоперационной подготовки, благодаря чему, несмотря на 30-дневную прорывную метроррагию, операция экстирпации матки и яичников и послеоперационный период прошли хорошо.
Пациентка, будучи патологоанатомом, сама заинтересованно и скрупулёзно просмотрела препараты удалённых органов и обнаружила неожиданную для клиницистов картину морфогенеза маточного кровотечения, которая была описана в статье, опубликованной в 2008 году [Гамиянц С.А., Яхяева В.К., Вашурина Т.П., Рахимова Л.Ш. Симптомные лейомиоматозные узлы матки при ревматических болезнях. // Медицинский Журнал Узбекистана. 2008, 2, стр. 56-58].
Для того чтобы выяснить, из каких отделов матки было кровотечение, было прове-дено описание с микрофотосъёмкой препаратов из шейки и тела матки, устьев труб, других отделов труб и яичников. Микроскопическое изучение показало, что маточное кровотечение у этой пациентки не было вызвано канцероматозом: у неё не было рако-вой опухоли ни в шейке или теле матки, ни в трубах или яичниках. Однако имелись множественные доброкачественные неоплазии, что, к сожалению, не редкость у жен-щин с ревматоидным артритом, полимиозитом и крепитирующим тендовагинитом. Ниже приводим описание микропрепаратов, представленных на микрофотографиях, начиная с шейки матки и эндоцервикса.
Ревматоидный артрит (синонимы: инфекционный полиартрит, инфект-артрит) - хроническое ревматическое заболевание, основу которого составляет прогрессирующая дезорганизация соединительной ткани оболочек и хряща суставов, ведущая к их деформации.
Этиология и патогенез. В возникновении заболевания допускается роль бактерий (р-гемолитический стрептококк группы В), вирусов, микоплазмы. Большое значение придается генетическим факторам. Известно, что заболевают ревматоидным артритом преимущественно женщины - носители антигена гистосовместимости HLA/B27 и D/DR4. В генезе тканевых повреждений - как локальных, так и системных - при ревматоидном артрите важная роль принадлежит высокомолекулярным иммунным комплексам. Эти комплексы содержат в качестве антигена IgG, а в качестве антитела - иммуноглобулины различных классов (IgM, IgG, IgA), которые называют ревматоидным фактором.
Ревматоидный фактор продуцируется как всиновиальнойоболочке (его находят в синовиальной жидкости, синовиоцитах и в клетках, инфильтрирующих ткани сустава), так и в лимфатических узлах (ревматоидный фактор циркулирующих в крови иммунных комплексов). Изменения тканей суставов в значительной мере связаны с синтезируемым местно, в синовиальной оболочке, ревматоидным фактором, относящимся преимущественно к IgG. Он связывается с Fc-фрагментом иммуноглобулина-антигена, что ведет к образованию иммунных комплексов, активирующих комплемент и хемотаксис нейтрофилов. Эти же комплексы реагируют с моноцитами и макрофагами, активируют синтез простагландинов и интерлейкина I, которые стимулируют выброс клетками синовиальной оболочки коллагеназы, усиливая повреждение тканей.
Иммунные комплексы, содержащие ревматоидный фактор и циркулирующие в крови, осаждаясь на базальных мембранах сосудов, в клетках и тканях, фиксируют активированный комплемент и вызывают воспаление. Оно касается прежде всего сосудов микроциркуляции (васкулит). Помимо гуморальных иммунных реакций, при ревматоидном артрите имеют значение и реакции гиперчувствительности замедленного типа, проявляющиеся наиболее ярко в синовиальной оболочке.
Патологическая анатомия. Изменения возникают в тканях суставов, а также в соединительной ткани других органов.
В суставах процессы дезорганизации соединительной ткани определяются в околосуставной ткани и в капсуле мелких суставов кистей рук и стоп, обычно симметрично захватывая как верхние, так и нижние конечности. Деформация наступает сначала в мелких, а затем в крупных, обычно в коленных, суставах.
В околосуставной соединительной ткани первоначально наблюдаются мукоидное набухание, артериолиты и артерииты. Далее наступает фибриноидный некроз, вокруг очагов фибриноидного некроза появляются клеточные реакции: скопления крупных гистиоцитов, макрофагов, гигантских клеток рассасывания. В итоге на месте дезорганизации соединительной ткани развивается зрелая волокнистая соединительная ткань с толстостенными сосудами. При обострении заболевания те же изменения возникают в очагах склероза. Описанные очаги фибриноидного некроза носят название ревматоидных узлов. Они появляются обычно около крупных суставов в виде плотных образований размером до лесного ореха. Весь цикл их развития от начала возникновения мукоидного набухания до образования рубца занимает 3-5 мес.
В синовиальной оболочке воспаление появляется в самые ранние сроки заболевания. Возникает си но вит -важнейшее морфологическое проявление болезни, в развитии которого выделяют три стадии.
В первой стадии синовита в полости сустава скапливается мутноватая жидкость; синовиальная оболочка набухает, становится полнокровной, тусклой. Суставной хрящ сохранен, хотя в нем могут появляться поля, лишенные клеток, и мелкие трещины. Ворсины отечные, в их строме - участки мукоидного и фибриноидного набухания, вплоть до некроза некоторых ворсин. Такие ворсины отделяются в полость сустава и из них образуются плотные слепки - так назы- ваемые рисовые тельца. Сосуды микроциркуляторного русла полнокровны, окружены макрофагами, лимфоцитами, нейтрофилами, плазматическими клетками; местами появляются кровоизлияния. В стенке фибриноидно-измененных артериол обнаруживают иммуноглобулины. В ряде ворсин определяется пролиферация синовиоцитов. В цитоплазме плазматических клеток обнаруживается ревматоидный фактор. В синовиальной жидкости увеличивается содержание нейтрофилов, причем в цитоплазме некоторых из них также обнаруживается ревматоидный фактор. Такие нейтрофилы названы рагоцитами (от греч. ragos - гроздь винограда). Их образование сопровождается активацией ферментов лизосом, выделяющих медиаторы воспаления и тем самым способствующих его прогрессированию. Первая стадия синовита иногда растягивается на несколько лет.
Во второй стадии синовита наблюдается разрастание ворсин и разрушение хряща. По краям суставных концов костей постепенно возникают островки грануляционной ткани, которая в виде пласта - паннуса (от лат. pannus - лоскут) наползает на синовиальную оболочку и на суставной хрящ. Этот процесс особенно ярко выражен в мелких суставах кистей рук и стоп. Межфаланговые и пястно-пальцевые суставы легко подвергаются вывиху или подвывиху с типичным отклонением пальцев в наружную (ульнарную) сторону, что придает кистям вид плавников моржа. Аналогичные изменения наблюдаются в суставах и костях пальцев нижних конечностей. В крупных суставах в этой стадии отмечаются ограничение подвижности, сужение суставной щели и остеопороз эпифизов костей. Наблюдается утолщение капсулы мелких суставов, ее внутренняя поверхность неровная, неравномерно полнокровная, хрящевая поверхность тусклая, в хряще видны узуры, трещины. В крупных суставах отмечается срастание соприкасающихся поверхностей синовиальной оболочки.
При микроскопическом исследовании местами виден фиброз синовиальной оболочки, местами - очаги фибриноида. Часть ворсин сохранена и разрастается, строма их пронизана лимфоцитами и плазматическими клетками. Местами в утолщенных ворсинах формируются очаговые лимфоидные скопления в виде фолликулов с зародышевыми центрами - синовиальная оболочка становится органом иммуногенеза. Б плазматических клетках фолликулов выявляется ревматоидный фактор. Среди ворсин встречаются поля грануляционной ткани, богатой сосудами и состоящей из нейтрофилов, плазматических клеток, лимфоциов и макрофагов. Грануляционная ткань разрушает и замещает ворсинки, нарастает на поверхность хряща и проникает в его толщу через небольшие трещины. Гиалиновый хрящ под влиянием грануля¬ций постепенно истончается, расплавляется; костная поверхность эпифиза обнажается. Стенки сосудов синовиальной оболочки утолщены и гиалинизированы.
Третья стадия ревматоидного синовита, которая развивается иногда через 20-30 лет от начала заболевания, характеризуется появлением фиброзно-костного анкилоза. Наличие различных фаз созревания грануляционной ткани в полости сустава (от свежих до рубцовых) и масс фибриноида свидетельствует о том, что в любой стадии болезни, иногда даже при многолетнем ее течении, процесс сохраняет свою активность и неуклонно прогрессирует, что приводит к тяжелой инвалидизации больного.
Висцеральные проявления ревматоидного артрита обычно выражены незначительно. Они проявляются изменениями соединительной ткани и сосудов микроциркуляторного русла серозных оболочек, сердца, легких, иммунокомпетент-ной системы и других органов. Довольно часто возникают васкулиты и полисерозит, поражение почек в виде гломерулонефрита, пиелонефрита, амилоидоза. Реже встречаются ревматоидные узлы и участки склероза в миокарде и легких.
Изменения иммунокомпетентной системы характеризуются гиперплазией лимфатических узлов, селезенки, костного мозга; выявляется плазмоклеточная трансформация лимфоидной ткани, причем имеется прямая зависимость между выраженностью гиперплазии плазматических клеток и степенью активности воспалительного процесса. Осложнения.
Осложнениями ревматоидного артрита являются подвывихи и вывихи мелких суставов, ограничение подвижности, фиброзные и костные анкилозы, остеопороз. Самое грозное и частое осложнение - нефропатический амилоидоз.
Смерть больных ревматоидным артритом наступает часто от почечной недостаточности в связи с амилоидозом или от ряда сопутствующих заболеваний - пневмонии, туберкулеза и др.
К коагуляционному некрозу относят:
— инфаркт — разновидность сосудистого (ишемического) некроза внутренних органов (кроме мозга - инсульт). Это самый частый вид некроза.
— казеозный (творожистый) некроз развивается и при туберкулезе, сифилисе, лепре, а также при лимфогранулематозе. Его еще называют специфическим, поскольку чаще всего встречается при специфических инфекционных гранулемах. Во внутренних органах выявляется ограниченный участок ткани сухой, крошащийся, беловато-желтого цвета. В сифилитических гранулемах очень часто такие участки не крошащиеся, а пастообразные, напоминают аравийский клей. Это смешанный (то есть экстра- и интрацеллюлярный) тип некроза, при котором одновременно гибнет и паренхима, и строма (и клетки, и волокна). Микроскопически такой участок ткани бесструктурный, гомогенный, окрашен гематоксилином и эозином в розовый цвет, хорошо видны глыбки хроматина ядер (кариорексис).
— восковидный, или ценкеровский некроз (некроз мышц, чаще передней брюшной стенки и бедра, при тяжелых инфекциях - брюшном и сыпном тифах, холере);
— фибриноидный некроз — тип некроза соединительной ткани, который уже изучен как исход фибриноидного набухания, наиболее часто он наблюдается при аллергических и аутоиммунных болезнях (например, ревматизме, ревматоидном артрите и системной красной волчанке). Наиболее сильно повреждаются коллагеновые волокна и гладкая мускулатура средней оболочки кровеносных сосудов. Фибриноидный некроз артериол наблюдается при злокачественной гипертензии. Фибриноидный некроз характеризуется потерей нормальной структуры и накоплением гомогенного, ярко-розового некротического материала, который похож микроскопически на фибрин. Обратите внимание, что понятие "фибриноидный" отличается от понятия "фибринозный", так как последнее обозначает накопление фибрина, например, при свертывании крови или при воспалении. Участки фибриноидного некроза содержат различное количество иммуноглобулинов и комплемента, альбуминов, продуктов распада коллагена и фибрина.
— жировой некроз:
1. Ферментный жировой некроз: жировой некроз наиболее часто происходит при остром панкреатите и повреждениях поджелудочной железы, когда панкреатические ферменты выходят из протоков в окружающие ткани. Панкреатическая липаза действует на триглицериды в жировых клетках, расщепляя их на глицерин и жирные кислоты, которые, взаимодействуя с плазменными ионами кальция, образуют мыла кальция. При этом в жировой ткани, окружающей поджелудочную железу, появляются непрозрачные, белые (как мел) бляшки и узелки (стеатонекроз).
При панкреатитах возможно попадание липазы в кровоток с последующим широким распространением, что является причиной жирового некроза во многих участках организма. Наиболее часто повреждаются подкожная жировая клетчатка и костный мозг.
2. Неферментный жировой некроз: неферментный жировой некроз наблюдается в молочной железе, подкожной жировой ткани и в брюшной полости. Большинство пациентов имеют в анамнезе травмы. Неферментный жировой некроз называют также травматическим жировым некрозом, даже если травма не определена как основная причина. Неферментный жировой некроз вызывает воспалительный ответ, характеризуемый наличием многочисленных макрофагов с пенистой цитоплазмой, нейтрофилов и лимфоцитов. Затем следует фиброзирование, при этом данный процесс бывает трудно отличить от опухоли.
— гангрена (от греч. gangraina — пожар): это некроз тканей, сообщающихся с внешней средой и изменяющихся под ее воздействием. Термин "гангрена" широко используется для обозначения клинико-морфологического состояния, при котором некроз ткани зачастую осложняется вторичной бактериальной инфекцией различной степени выраженности либо, находясь в соприкосновении с внешней средой, претерпевает вторичные изменения. Различают сухую, влажную, газовую гангрены и пролежни.
1.Сухая гангрена— это некроз тканей, соприкасающихся с внешней средой, протекающий без участия микроорганизмов. Сухая гангрена наиболее часто возникает на конечностях в результате ишемического коагуляционного некроза тканей. Некротизированные ткани кажутся черными, сухими, они четко отграничены от смежной жизнеспособной ткани. На границе со здоровыми тканями возникает демаркационное воспаление. Изменение цвета обусловлено превращением гемоглобиногенных пигментов в присутствии сероводорода в сульфид железа. Примерами может служить сухая гангрена:
— конечности при атеросклерозе и тромбозе ее артерий (атеросклеротическая гангрена), облитерирующем эндартериите;
— при отморожении или ожоге;
— пальцев при болезни Рейно или вибрационной болезни;
— кожи при сыпном тифе и др. инфекциях.
Лечение состоит в хирургическом удалении мертвой ткани, ориентиром при этом служит демаркационная линия.
2.Влажная гангрена: развивается в результате наслоения на некротические изменения ткани тяжелой бактериальной инфекции. Под действием ферментов микроорганизмов возникает вторичная колликвация. Лизис клетки ферментами, которые возникают не в самой клетке, а проникают извне, называется гетеролизисом. Тип микроорганизмов зависит от локализации гангрены. Влажная гангрена развивается обычно в тканях, богатых влагой. Она может встречаться на конечностях, но чаще — во внутренних органах, например, в кишечнике при непроходимости брыжеечных артерий (тромбоз, эмболия), в легких как осложнение пневмонии (грипп, корь). У ослабленных инфекционным заболеванием (чаще корью) детей может развиться влажная гангрена мягких тканей щек, промежности, которую называют номой (от греч. nome - водяной рак). Острое воспаление и рост бактерий являются причиной того, что некротическая область становится отечной и красно-черной, с обширным разжижением мертвой ткани. При влажной гангрене может возникнуть распространяющееся некротизирующее воспаление, которое не четко ограничено от смежной здоровой ткани и, таким образом, трудно поддается хирургическому лечению. В результате жизнедеятельности бактерий возникает специфический запах. Очень высок процент летальности.
3.Газовая гангрена: газовая гангрена возникает при инфицировании раны анаэробной флорой, например, Clostridium perfringens и другими микроорганизмами этой группы. Она характеризуется обширным некрозом ткани и образованием газов в результате ферментативной активности бактерий. Основные проявления сходны с влажной гангреной, но с дополнительным присутствием газа в тканях. Крепитация (феномен потрескивания при пальпации) - частый клинический симптом при газовой гангрене. Процент летальности также очень высок.
4. Пролежень (decubitus): как разновидность гангрены выделяют пролежни - омертвение поверхностных участков тела (кожа, мягкие ткани), подвергающихся сдавлению между постелью и костью. Поэтому пролежни чаще появляются в области крестца, остистых отростков позвонков, большого вертела бедренной кости. По своему генезу это трофоневротический некроз, так как сдавливаются сосуды и нервы, что усугубляет нарушения трофики тканей у тяжелобольных, страдающих сердечно-сосудистыми, онкологическими, инфекционными или нервными болезнями.
B. Колликвационный (влажный) некроз: характеризуется расплавлением мертвой ткани. Он развивается в тканях, относительно бедных белками и богатых жидкостью, где имеются благоприятные условия для гидролитических процессов. Лизис клеток происходит в результате действия собственных ферментов (аутолиз). Типичным примером влажного колликвационного некроза является очаг серого размягчения (ишемический инфаркт) головного мозга.
Инфаркт мозга часто называют размягчением, так как основным макроскопическим признаком является понижение упругости ткани мозга в очаге поражения во все сроки. В течение первых суток он представлен нечетко ограниченным участком синюшного оттенка, мягковатого на ощупь. К концу первых суток очаг становится более четким и бледнеет. В последующие дни вещество мозга в этой зоне становится еще более дряблым, цвет его становится желтоватым или даже с зеленоватым оттенком. В первые недели объем мозга несколько увеличивается из-за отека его. Через 1-1.5 мес. на месте инфаркта образуется довольно четко ограниченная полость, содержащая мутную жидкость и детрит. Определение точных сроков инфаркта весьма затруднительно не только по внешнему виду его, но и по гистологической картине.
Микроскопически ткань мозга гомогенная, бесструктурная, слабо розового цвета при окраске гематоксилином и эозином. Рассасывание мертвых тканей осуществляется макрофагами, которые имеют вид жиро-зернистых шаров.
Клинические проявления некроза
Системные проявления: при некрозе обычно появляется лихорадка (вследствие выхода пирогенных веществ из некротизированных клеток и тканей) и нейтрофильный лейкоцитоз (вследствие наличия острой воспалительной реакции — демаркационного воспаления). Высвобождение содержимого некротических клеток: высвобождающиеся компоненты цитоплазматического содержимого некротизированных клеток (например, ферменты) поступают в кровоток, где их присутствие имеет диагностическое значение для определения локализации некроза. Эти ферменты могут быть обнаружены различными лабораторными методами. Специфичность появления ферментов зависит от преимущественной локализации фермента в различных тканях организма; например, повышение уровня МВ-изофермента креатинкиназы характерно для некроза миокарда, потому что этот фермент найден только в миокардиальных клетках. Повышение уровня аспартатаминотрансферазы (АСТ) менее специфично, так как этот фермент найден не только в миокарде, но также в печени и других тканях. Появление трансаминаз характерно для некроза печеночных клеток.
Читайте также:


