Иммунитет при гнойном инфекции
Различные методы лечения или наследственная патология иммунной системы могут способствовать развитию инфекционного заболевания, обусловленного слабовирулентными штаммами микроорганизмов, или возникновению тяжёлых инфекций, связанных с патогенными возбудителями.
Недостаточность иммунной системы обычно возникает в результате воздействия нескольких факторов. Например, при нейтропении, развивающейся у пациентов, перенёсших пересадку костного мозга, повышена восприимчивость организма к бактериальным инфекциям, в то время как внутривенная катетеризация способствует развитию инфекции, вызванной Staphylococcus epidermidis.
Медицинские манипуляции часто нарушают физические барьеры на пути инфекции (например, катетеризация).
Гранулоцитопению обычно наблюдают при острой лейкемии или её лечении. Риск развития инфекции зависит от длительности и тяжести нейтропении. Бактериемию у таких больных обнаруживают в 40—70% случаев. Наиболее часто выделяют гра-мотрицательные бациллы (бактерии семейства Enterobacteriaceae и рода Pseudomonas). Они распространяются по организму в результате повреждения кишечника противоопухолевыми препаратами и облучением.
Кроме того, в этиологии сепсиса важную роль играют фамположительные микроорганизмы (S. epidermidis, S. mitis, S. oralis, S. aureus, Corynebacterium jeikeium и представители рода Enterococcus).
Несмотря на то что в большинстве случаев развитие кандидоза обусловлено приёмом антибактериальных препаратов, у пациентов с нейтропенией грибковые инфекции могут возникать de novo. В последнее время всё чаше сообщают о микозах, вызванных дрожжевыми грибами, такими как Candida krusei (характерна природная устойчивость к действию противогрибковых средств), различными видами родов Aspergillus (вызывают инвазивные заболевания) и Fusarium, а также Pseudallescheria boydii и Trichosporon beigelii.
Лечение лихорадки у пациентов с нейтропенией. Эмпирическая терапия включает карбапенем (или цефтазидим) и амикацин. Если лихорадка не исчезает, то дополнительно назначают гликопептидный антибиотик. Позже, если лихорадка сохраняется, высока вероятность развития микозов, поэтому для лечения используют амфотерицин В и итраконазол.
Профилактика инфекции у пациентов с нейтропенией. Вероятность развития инфекции у пациентов с нейтропенией заметно снижается, если в больнице их помещают в индивидуальный бокс и снабжают стерилизованной пищей и водой. Большое значение имеет соблюдение стерильного режима не только медицинским персоналом (мытьё рук и использование одноразовых резиновых перчаток), но и посетителями (ношение халатов и масок). Воздух, поступающий в палату, необходимо пропускать сквозь фильтр специальной очищающей от грибковых спор системы.
Приём нистатина и амфотерицина В внутрь позволяет снизить вероятность развития грибковой инфекции. Достаточно эффективные препараты — флуконазол и итраконазол. В некоторых медицинских центрах применяют профилактическую терапию 4-фторхинолонами, действие которых направлено против факультативных анаэробов кишечника (при сохранении анаэробной флоры).
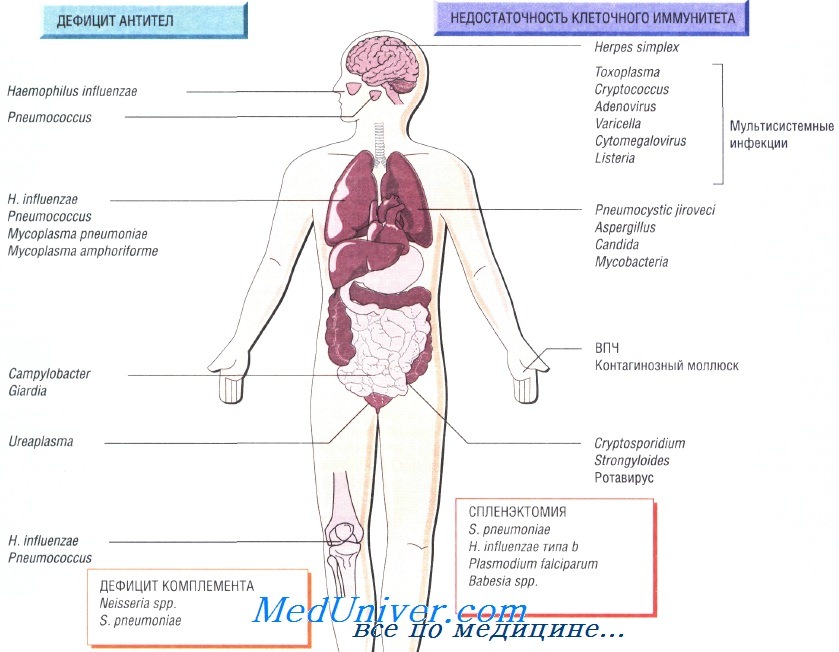
Причины инфекций при иммунодефиците
Недостаточность Т-клеточного иммунитета может быть обусловлена ВИЧ-инфекцией, противоопухолевой химиотерапией, приёмом глюкокортикоидных препаратов или трансплантацией органов. Врождённый дефицит обнаруживают достаточно редко. Он может быть связан только с недостаточностью функции Т-лимфоцитов или сопровождаться гипогаммаглобулинемией.
Возбудители инфекции при недостаточности Т-клеточного иммунитета. Основные возбудители — внутриклеточные патогенные микроорганизмы и паразиты:
• Toxoplasma gondii, Strongyloides stercoralis;
• Mycobacterium tuberculosis, M. avium-intracellulare;
• Listeria monocytogenes, Cryptococcus neoformans, Pneumocystis jiroveci;
• вирусы простого герпеса, цитомегаловирус, вирус опоясывающего герпеса и кори.
При осложнении кори гигантоклеточной пневмонией и энцефалитом у таких больных заболевание может приобрести угрожающий жизни характер.
Диагностика инфекции при недостаточности Т-клеточного иммунитета. Для диагностики инфекционных заболеваний применяют различные методы исследования. Для посева у пациентов отбирают не менее, чем два образца крови, взятых из разных мест.
Пациенты, страдающие сцепленной с Х-хромосомой агамма-глобулинемией, входят в группу повышенного риска заражения различными инфекциями в первые 6 мес своей жизни, в то время как люди с другим иммунодефицитом имеют повышенный риск на протяжении всей жизни. Функциональная гипогаммаглобулинемия возникает у больных с множественной миеломой.
Возбудителями рецидивирующих респираторных заболеваний у таких людей считают Streptococcus pneumoniae, недавно открытую Mycoplasma amphoriforme и не имеющего капсулы Haemophilus influenzae (вызывает бронхоэктазию). Персистирующие инфекции вызывают представители родов Giardia, Cryptosporidium и Campylobacter. Снизить частоту возникновения рецидивирующих инфекций помогает внутривенное введение иммуноглобулина.
Врождённую недостаточность комплемента наблюдают достаточно редко. Недостаточность последних компонентов системы комплемента (С7—С9) вызывает потерю способности лизировать грамотрицательные бактерии, в связи с чем повышается восприимчивость пациента к рецидивирующим инфекциям, вызванным микроорганизмами рода Neisseria. Недостаточность альтернативного пути системы комплемента приводит к развитию тяжёлых стрептококковых инфекций (S. pneumoniae), например менингита.
Приобретённая недостаточность системы комплемента часто возникает при системной красной волчанке.
Маннозасвязывающий лектин путь активации комплемента. Широкий спектр бактерий, грибов, вирусов и простейших прикрепляются к клеткам организма хозяина посредством маннозасвязывающего лектина. Есть данные, что при некоторых видах его недостаточности именно эти микроорганизмы вызывают наиболее частые и тяжёлые заболевания у людей с определёнными генотипами.
Ежегодно после удаления селезёнки в 1% случаев наблюдают развитие тяжёлого сепсиса, при этом чаще всего заболевание возникает у младенцев и детей. Самую высокую смертность отмечают после спленэктомии, выполненной по поводу лимфомы и талассемии. У пациентов с серповидно-клеточной анемией развивается функциональная аспления. Риск развития сепсиса может со временем снизиться, но никогда не исчезнет окончательно.
Наиболее распространённый возбудитель инфекций (две трети всех случаев) — Streptococcus pneumoniae, но Н. influenzae и Е. coli также играют важную роль в этиологии инфекционных заболеваний у таких пациентов. Кроме того, спленэктомия повышает восприимчивость организма к инфекции, вызванной Capnocytophaga canimorsis (особенно после укусов собак). Малярия также может протекать крайне неблагоприятно (фульминантная форма).
Профилактика инфекции после спленэктомии. После удаления селезёнки всем пациентам необходимо провести вакцинацию, направленную против S. pneumoniae, менингококков и Н. influenzae типа В. Более эффективна иммунизация с использованием белковых конъюгированных вакцин. В некоторых случаях для профилактики применяют пенициллин V (в низких дозах).
Пациентов следует предупреждать о том, чтобы они сообщали своему лечащему врачу о любых признаках лихорадки, а также проинструктировать их относительно приёма антибиотиков (во избежание задержки лечения).

Каждый человек в жизни сталкивается с заболеваниями. Однако одни люди страдают недугами редко, а другие постоянно. Первые относительно легко переносят болезнь, а вторые получают проблемы и даже осложнения. Почему же так происходит?
Дело в том, что сила инфекции и вопрос соблюдения личной гигиены играет важную роль. Однако самое главное заключается в силе иммунной системы. Именно она определяет защиту организма от проникновения и развития болезнетворной микрофлоры.
Главные вопросы
Иммунная система
- Центральные органы представлены тимусом и костным мозгом. Здесь происходит формирование защитных элементов организма. Длительное время ученые разгадывали загадки выработки лейкоцитов. Теперь практически все тайны открыты Миру.
- Периферические органы иммунной системы позволяют элементам защиты обезвреживать вредоносные вирусы. Сюда относят селезенку, лимфатические узлы, а также ряд других органов и тканей. Только взаимосвязь первой и второй группы органов дает общую систему, способную эффективно выполнять свою функцию.
Интересен факт: селезенка является самым большим органом, формирующим иммунную систему. Поэтому не зря врачи обращают внимание на состояние данного органа. От него зависит функционирования организма и, в частности, создание его защитных функций.
Стадии инфекции
Прежде чем понять, как организм справляется с проникающими в него патогенными бактериями, важно рассмотреть основные понятия. Так, инфекция – угроза, представленная грибками, микроскопическими простейшими, а также вирусами и бактериями, способными развиваться. В результате происходит отравление организма их токсинами и разрушение клеток. Какие же стадии наблюдаются у инфекционных заболеваний?
Вообще, инфекция и иммунитет являются двумя противоположностями: первая поражает организм, а вторая исцеляет.
Виды инфекций
Важно знать: в зависимости от способа проникновения и особенностей происходит данная классификация. Итак, рассмотри основные виды:
Как видно, видов инфекций достаточно много. Все зависит от способа их проникновения и особенностей воздействия на организм. Поэтому инфекция и иммунитет должны рассматриваться вместе, когда речь идет о заболевании.
Защита
Итак, как только в организм проникает вирус и начинает разрушать клетки, то Т-лимфоциты начинают посылаться иммунной системой. Они уничтожают вирус. Успех дела зависит от целого ряда факторов. Так, своевременное лечение, соблюдение режима и хорошее питание – вот основные факторы, влияющие на развитие защитных функций.
Особое понятие
Особая тема
Заболевания, поражающие иммунную систему, являются самыми опасными: они разрушают лейкоциты и те вещества, что активно участвуют в борьбе с вирусными инфекциями. Выделяют целый спектр таких заболеваний. Среди них самой печально известной является ВИЧ-инфекция. Коварный вирус не дает знать о себе в течение нескольких месяцев. Происходит внедрение в клетки его вирусных элементов. Поэтому инфекция и иммунитет в данном случае сливаются в одно целое: ведь вирус внедряется в полезные вещества и клетки, постепенно разрушая их; это страшный процесс. Со времени ВИЧ вызывает СПИД. Люди погибают не от этого заболевания в прямом понимании слова, а от любого недуга: СПИД вызывает снижение и даже полное отсутствие защитных функций организма. В связи с этим даже небольшая простуда может стать смертным приговором.
Интересен (если корректно так выразиться в данном случае) факт: не всегда ВИЧ-инфекция губит человека. Около 10 процентов белого населения Земного шара имеет защиту. Дело в том, что это обуславливается мутацией лейкоцитов. Они просто не позволяют вирусу проникать в клетки. Поэтому данная инфекция гибнет.
Также различные разновидности гепатита негативно сказываются на здоровье, поражая иммунную систему. С ними можно бороться. Важно следовать инструкциям и советам лечащего врача. Только при таком подходе можно судить о выздоровлении.
Советы
Если температура не превышает отметку в 37,5 градусов, то желательно не использовать лекарственные препараты. Лучше налегать на фрукты и обильное потребление жидкости: вода, травяной чай. Хорошо кушать куриный бульон. Хорошим способом запустить работу иммунной системы на высшем уровне выступает простое одеяло: стоит закутаться, чтобы пропотеть. Это верный способ быстро прогнать болезнь.
Важно не забывать о том, что вызов врача является неотъемлемым шагом на пути к выздоровлению. Ведь важно точно поставить диагноз, чтобы назначить рационально подобранное лечение. Вообще, антибиотики разрушают микрофлору кишечника, что отрицательно сказывается на иммунитете. Однако иногда не бывает другого выхода. Поэтому после курса подобных препаратов, стоит пропить лекарства, восстанавливающие микрофлору кишечника. Это поможет повысить иммунитет после перенесенной болезни и принятых антибиотиков.
Известно: хорошее пищеварение является залогом высокого иммунитета. После перенесенного инфекционного заболевания особенно важно позаботиться о своём иммунитете. Начать стоит с налаживания пищеварения. Разумеется, сразу давать физическую нагрузку на организм нельзя! Нужно постепенно заниматься спортом, осторожно дозируя нагрузку. Важно позаботиться о витаминных и минеральных комплексах, которые стоит употреблять в соответствии с инструкцией. Все это благотворно складывается на здоровье людей. Каждая деталь важна.
Стоит понимать: инфекция и иммунитет являются неразрывными понятиями. Иммунная система всегда защищает организм человека. Часто вирусы не способны развиваться, благодаря лимфоцитам. Однако бывает, что вирус начинает размножаться и даже эволюционировать. Важно помочь организму. Для этого принимают лекарства, в число которых входят антибиотики. Немаловажное значение в вопросе исцеления играет режим отдыха и питания. Больше витаминов, меньше вредной пищи. Тогда иммунная система сможет функционировать на должном уровне. В этом смогли убедиться многие люди.
Иммунитет можно поднимать, следя за своим рационом и физической нагрузкой. Неплохо пить витаминные комплексы, следуя четким инструкциям и рекомендациям. Иммунная система, работающая на должном уровне, всегда предотвращает возникновение заболеваний. Если же оно появилось, то хороший иммунитет сможет справиться оперативно с болезнью, позволив избежать осложнений. Иммунная система всегда стоит на страже здоровья. После инфекции, с которой она справилась, важно дать определенное время на восстановление организма. После проявится постинфекционный иммунитет.
К настоящему времени научная литература располагает большим объемом информации, касающейся состояния иммунобиологической защиты детей с гнойными заболеваниями. Практически всеми авторами признается ведущая роль нарушений системы имунных реакций в патогенезе гнойно-септических процессов.
Известна роль дефектов различных факторов неспецифической резистентности организма в развитии гнойного заболевания. Так, у детей с хирургической инфекцией, как правило, наблюдается снижение уровня комплемента в сыворотке крови, рассматриваемое рядом авторов как результат срыва иммунологической компенсации.
Высокое содержание комплемента в крови считается благоприятным фактором, и наоборот, снижение его является отрицательным критерием. Однако некоторые авторы отмечают нормальные показатели сывороточного комплемента у детей с сепсисом.
Т.Г.Нестерова (1983) обнаружила повышение концентраций компонентов (С3; С4; С3-активатора) комплемента при локальных гнойных инфекциях. Генерализация процесса сопровождалась снижением уровней С3 и С4. При неблагоприятном течении сепсиса наблюдалось резкое снижение указанных компонентов комплемента.
Комплемент оказывает существенное влияние на течение воспалительного процесса путем активации ряда медиаторов воспаления (ИЛ-1, фактора активации тромбоцитов, простагландина Е2, лейкотриена В4, тромбокса-на и др.) и фагоцитарной функции клеток. Показано участие комплемента в неиммунной защите организма от экспериментальной септицемии.
Другой важный фактор системы имунной реактивности — лизоцим, основным источником которого являются макрофаги и лизосомы ней-трофильных лейкоцитов, а также клетки эпителия слизистых оболочек. Присутствуя почти во всех жидкостях и тканях организма, лизоцим служит барьером на пути проникновения микроба в организм.
Действие лизоцима связано с расщеплением гликопротеидов бактериальной стенки. Отмечена способность лизоцима активизировать клеточный и гуморальный иммунитет. Он способен стимулировать продукцию антител и активизировать фагоцитоз. Лизоцим участвует в индукции гиперчувствительности замедленного типа. Известно, что под действием микробных токсинов происходит повышение проницаемости лизосомальных мембран, что способствует повышенному выходу лизоцима из клетки.
Ряд исследователей обнаружили при сепсисе у детей увеличение уровня лизоцима в сыворотке крови. Другие авторы отмечали низкий уровень лизоцима в крови у таких больных. В период хронизации воспалительного процесса при ОГО уровень лизоцима нередко остается высоким, что позволило некоторым авторам использовать это как прогностический критерий.
Важнейшим компонентом неспецифической резистентности организма являются интерфероны. Это группы термостабильных низкомолекулярных белков, синтезируемых лейкоцитами, активируемыми вирусами, бактериями или веществами, называемыми интерфероногенами (полисахаридами, белками, у-глобулинами). Интерферон принимает участие в регуляции иммунного ответа, распознавании антигенов, переносе иммунологической информации.
Способность клеток организма синтезировать интерферон рассматривают как один из показателей иммунологической зрелости организма, напряженности иммунитета. Важнейшим иммуномодулятором является у-ин-терферон, который участвует в активации нейтрофилов и макрофагов, усиливает функции клеток иммунной системы, усиливает продукцию колониестимулирующего фактора, регулирующего образование зрелых моноцитов и макрофагов.
При сепсисе у новорожденных отмечается снижение способности лейкоцитов крови к интерфероногенезу в разгар заболевания, причем минимальные титры лейкоцитарного интерферона были обнаружены при септическом шоке. Недостаточность интерферона обнаружена также при затяжном течении заболевания. Отмечена высокая информативность исходного уровня интерферона в прогнозе септического процесса.
Изучение интерферона в динамике дает представление о тяжести течения болезни.
С.Я. Долецкий и соавт. (1988) при исследовании системы интерферона обнаружили низкий интерфероновый ответ у новорожденных с гнойными заболеваниями. Это послужило показанием к включению в комплексную терапию концентрированного интерферона, вводимого интраректально (так как он разрушается в печени) в сочетании с инъекциями антиоксиданта — витамина Е.

Представление о том, что инфекция — процесс, полностью зависимый от микроорганизма, еще доминирует в сознании врачей. Серьезные нарушения в системе иммунитета организма, предшествующие болезни, игнорируются. Отсюда стремление докторов всеми способами
уничтожить микроорганизм. В результате появляются все более резистентные его варианты, а они индуцируют дисбиозы и хронические формы иммунопатологии.
После того как был открыт пенициллин и показана его результативность при лечении инфекций, ассоциированных с бактериями, в медицине окончательно утвердилась концепция, что основное средство против инфекции — противомикробные препараты.
Однако сегодня накапливается все больше данных об их неэффективности и угрожающе нарастающей резистентности к ним микробов. Требуется новая стратегия борьбы.
Инфекция (инфекционный процесс) — патологический процесс, возникающий вследствие взаимодействия патогенных микроорганизмов и клеток с тканями неиммунного, чувствительного макроорганизма. Это сопровождается размножением и изменением реактивности макроорганизма, повреждением тканей. Инфекция — одно из возможных следствий взаимодействия микро- и макроорганизма. Другой, более частый исход — естественная резистентность, вмешательство иммунитета или его усиление.
Облигатно-патогенные бактерии (особо опасных инфекций — чумы, сибирской язвы и др.) обладают высокой вирулентностью, умеют подавлять и преодолевать естественные барьеры иммунитета нормального, но неиммунного к ним организма, когда имеется относительный иммунодефицит (ИД). Для защиты требуется предварительная активация, например, вакцинация — индукция антител и/или иммунных Т-клеток, т. е. создание иммунитета, тогда эти бактерии преодолеть его не смогут.
Относительный или абсолютный иммунодефицит — основная причина инфекций, поскольку при повышении, стимуляции иммунитета вакцинацией возникает резистентность к конкретным, даже высоковирулентным возбудителям. Благодаря вакцинации удалось ликвидировать оспу, уносившую миллионы жизней; индуцируется невосприимчивость к кори, полиомиелиту, гриппу, гепатиту В, клещевым энцефалитам,
желтой лихорадке и иным инфекциям. Это говорит о том, что устойчивость организма, иммунитет, а не вирулентность возбудителя — определяющий фактор сопротивления любой инфекции.
Инфекционные болезни следует рассматривать как иммунодефицитные инфекционные. Основой стратегии их профилактики и лечения должна стать активация иммунитета восприимчивого организма.
Инфекционная болезнь — прежде всего иммунодефицитная болезнь (ИДБ) у человека, когда патогенность проникшего инфекта больше иммунитетных возможностей в момент заражения
С этих позиций антимикробная терапия (противовирусная, противобактериальная), с одной стороны, способ уменьшить инфицирующую дозу возбудителя, приблизить ее к относительно недостаточному иммунитетному барьеру, а с другой — средство получения антигенов и липополисахаридов разрушенных микробов, стимулирующих иммунитет и повышающих этот барьер.
Следовательно, без ИД нет инфекции, сама по себе она — клиническое проявление ИДБ.
Иммунодефицитная болезнь — врожденная, генетическая или приобретенная структурная и/или функциональная недостаточность звена в системе иммунитета, которая клинически проявляется рецидивами инфекции, вызванной вирусами, бактериями, грибами либо паразитами.
Абсолютный ИД — генетический и/или лабораторный признак дефекта (недостаточности) звена иммунитета, с клиническими проявлениями или без них; относительный ИД — недостаточность иммунитета нормального, но неиммунного организма к высоковирулентным возбудителям.
- острый, рецидивирующий, хронический инфекционный процесс любой локализации;
- выявление вирусов, условно-патогенных бактерий и/или грибов в очаге поражения;
- клинические — стигмы, характерные для первичных иммунодефицитов у детей;
- наличие причин (иммуносупрессивных факторов), вызвавших приобретенную, вторичную ИДБ;
- лабораторные маркеры ИД, подтвержденные в динамике;
- эффективность иммунокорригирующей терапии.
Для постановки диагноза достаточно двух первых признаков; остальные (вспомогательные) важны в конкретных ситуациях.
Основной клинический признак ИДБ — инфекционный синдром в виде конкретных клинических форм: рецидивы и обострения инфекций, вызываемых патогенными или условно-патогенными микроорганизмами (вирусами, бактериями, грибами, паразитами).
Инфекционные синдромы могут сочетаться с синдромами гиперактивации системы иммунитета (СИ) — аллергическими и аутоиммунными. Сыпь при инфекциях — проявление аллергии на антигены микроорганизмов.
Различают первичные и вторичные ИД и, соответственно, ИДБ, которые, как и инфекции, имеют острое, подострое или хроническое течение.
Первичные ИД — это генетические аномалии, они обычно клинически манифестируются у детей, но иногда только у взрослых (например, дефицит секреторного IgA). Идентифицировано свыше 250 генетических дефектов иммунитета, но их во много раз больше — по числу молекул и рецепторов в СИ. Известно, что дефект IgA встречается с частотой 1:700–1:1000. В Беларуси не менее 10 тысяч человек только с этим дефектом.
Вторичные ИД возникают у здоровых людей под влиянием различных причин, хотя у многих уже имеется генетическая предрасположенность к развитию ИДБ.
Причины вторичных ИДБ:
Среди первичных и вторичных ИД наблюдаются структурные и функциональные. Структурные могут быть органными — при отсутствии или недостаточности иммунитета органа (аплазия тимуса, аспления, вторичные постспленэктомический и посттонзиллэктомический синдромы); клеточными — при отсутствии или неполноценности клеток СИ; молекулярными — при отсутствии или неполноценности рецепторов, цитокинов; генными точечными, приводящими к изменению последовательности или замене отдельных аминокислот в рецепторах или цитокинах.
Функциональные ИД могут быть функционально-генетическими (возникают в связи с изменением активности генов цитокинов или клеточных рецепторов); клеточными (появляются из-за нарушений взаимодействий клеток иммунитета); органными и межсистемными (развиваются из-за нарушений регуляции между различными органами иммунитета, нервной и эндокринной системами).
- воспаление кожи и слизистых оболочек (фурункулезы, дерматиты, бронхолегочные, желудочно-кишечные, урогенитальные инфекции);
- поражение клеток СИ (лимфоаденопатии, СПИД, лимфомиелопролиферативные болезни и др.);
- комбинированные синдромы.
При В-клеточных ИДБ беспокоят повторные пиогенные инфекции, гнойно-септические заболевания, персистирующая гиперплазия лимфатических узлов кишечника.
При фагоцитарных ИДБ наблюдаются рецидивирующие абсцессы, локальные бактериальные инфекции.
Клинико-лабораторными признаками ИДБ могут быть:
- снижение числа лейкоцитов всех типов (лимфоцитов, гранулоцитов, моноцитов), иногда лейкоцитоз некоторых из них (эозинофилия, моноцитоз и др.);
- уменьшение общего уровня комплемента (С50), гипо(а)гаммаглобулинемия при электрофорезе сыворотки крови;
- отсутствие тени вилочковой железы или ее малый размер при рентгенографии у детей;
- микроорганизмы в экссудатах, крови.
Так, например, наличие Haemophilus influence указывает на дефект IgA+IgG2 (отиты, хронические бронхиты); Str. pneumonia — на неуничтожение бактерий фагоцитами; Staph. aureus — на недостаточность фагоцитоза, антител или С3-компонента комплемента; Salmonella (носительство) — на дефект sIgA; БЦЖ (диссеминация) — на нарушение клеточного иммунитета.
Гнойные инфекции барьерных тканей — кожи и слизистых оболочек обычно возникают при дефектах факторов местного иммунитета.
Инфекционные поражения слизистых оболочек носа, пазух, носоглотки, бронхов, кишечника, половых органов — наиболее распространенные клинические синдромы ИДБ.
Простуда издревле считается одной из основных причин ассоциированных с ней заболеваний. Однако развитие последних предопределено синдромом гипотермии. Он вызывает снижение/недостаточность по-движности липопротеидных мембран, хемотаксиса и метаболизма макрофагов и нейтрофилов слизистых оболочек, которые обеспечивают защиту от микроорганизмов. Когда этого не происходит, они свободно размножаются.
Возникшая ИДБ с клиникой инфекции сопровождается дальнейшим угнетением иммунитета. Примером могут служить ИДБ с клиникой хирургической инфекции, для нее характерны признаки общей вариабельной ИДБ, когда отмечаются различные, обычно комбинированные дефекты иммунитета — фагоцитоза, гуморального и клеточного звеньев иммунитета, цитокиновой сети.
Недостаточность гуморальных и клеточных факторов естественного врожденного иммунитета — первого барьера на пути бактерий — частая причина развития гнойной инфекции. Дефициты лизоцима, СРБ, маннан-связывающего белка, опсонинов, факторов комплемента, гистатинов и других бактерицидных веществ — основа возникновения такого состояния.
Некоторые формы гнойной инфекции развиваются на фоне гиперреактивности — аллергии к бактериальным и другим антигенам: острый аппендицит, острые панкреатит, холецистит и др.
Для лабораторной диагностики используются методы оценки иммунного статуса, включающие характеристику клеточных и гуморальных звеньев системы иммунитета. Наиболее проста диагностика агамма(гипо)глобулинемий — дефектов иммуноглобулинов системы комплемента. Однако и их в Беларуси часто не выявляют. Количественное определение IgG, IgM и IgA позволяет обнаружить дефицит иммуноглобулинов — гипо- или агаммаглобулинемию. Только в текущем году при консультации больных в различных отделениях больниц Витебска доценты кафедры клинической иммунологии и аллергологии ВГМУ О. В. Смирнова и В. В. Янченко выявили без тотальных эпидисследований 5 пациентов с этими дефектами.
Для диагностики по показаниям определяют ферменты, отсутствующие при первичных ИДБ (аденозиндезаминазу, пуриннуклеозидфосфорилазу, альфа-фетопротеин при атаксии; гранулы лейкоцитов при гранулематозной болезни). Генодиа-гностика возможна в спецлабораториях.
Лечение первичных тяжелых ИДБ и синдромов после уточнения диагноза надо проводить в специализированных центрах, соблюдая общие принципы лечения ИДБ и обосновывая адекватную терапию.
Лечение включает: а) устранение причин вторичных ИДБ; б) ликвидацию клинических синдромов, в т. ч. инфекционных; в) коррекцию самого иммунодефицита; профилактику рецидивов и осложнений.
Каждое направление требует своих методов и подходов, схемы лечения ИДБ — комплекс медикаментозных и немедикаментозных мероприятий.
Наиболее эффективна заместительная иммунотерапия агаммаглобулинемий (введением в/в и п/к препаратов внутривенных иммуноглобулинов). Уровень последних нужно контролировать, т. к. при снижении до 4 г/л и меньше инфекции возвращаются. Инъекции повторяют.
Терапия инфекционных осложнений. Поскольку ИДБ проявляются инфекционными осложнениями, главное в лечении — противомикробная терапия. Выбор препаратов зависит от вида микрофлоры и иммунодефицита. Часто необходим комплексный подход из-за наличия ассоциаций микроорганизмов. Антибактериальная по существу может быть иммуностимулирующей. Бактерии, разрушаемые антибиотиками, выделяют большое количество липополисахаридов (ЛПС) клеточной стенки (мощные иммуностимуляторы).
Реконструктивная иммунотерапия. Восстанавливает иммунитет у больных с генетическими дефектами трансплантация жизнеспособных стволовых клеток СИ донора или генная терапия. Материалом для этого могут служить полипотентные гемопоэтические стволовые клетки крови, костного мозга или эмбриональной печени.
Нормальный ген переносится вектором в клетки больного.
Применение иммуномодуляторов при первичных ИД. При большинстве средне- и тяжелых первичных ИД обычные иммуномодуляторы неэффективны — нужна пересадка костного мозга или заместительная терапия иммуноглобулинами. Однако в некоторых случаях они могут быть полезны как средства, усиливающие компенсаторные возможности СИ. На их фоне удается уменьшить антибактериальную терапию, получить более длительную ремиссию. Отмечено увеличение количества лейкоцитов, лимфоцитов, фагоцитоза.
Принципы лечения вторичных ИДБ:
I. Этап иммунокорригирующей терапии (острый период):
1) вирус-индуцированные Т-клеточные ИДБ:
противовирусные препараты, ингибиторы репликации,
интерфероны (, ),
Т-миметики (тактивин, тималин и др.),
Т-цитокины (ронколейкин и др.);
2) В-клеточные, ассоциированные с бактериальными инфекциями ИДБ:
антибактериальные (противогрибковые) препараты,
иммуноглобулины (антитела) при тяжелом течении внутривенно,
В-миметики (миелопид и др.),
иммунокорректоры широкого спектра, комплекс цитокинов;
3) фагоцитарные ИДБ:
антибактериальные (противогрибковые) препараты,
иммуностимуляторы широкого спектра, цитокины,
интерфероны,
витамины (С и др.), микроэлементы.
II. Этап противорецидивной иммунореабилитации (при ремиссии):
2) иммуностимуляторы растительного происхождения (эхинацея и др.);
3) санаторно-курортное лечение;
4) физиотерапия (КВЧ, ультразвук и др.) на органы иммунитета;
5) иммуностимулирующие вакцины широкого спектра (ликопид, рибомунил и др.).
Нужна ранняя диагностика ИД, поскольку наиболее эффективно лечение начальных форм.
Сочетание местной и общей иммунокорригирующей терапии имеет лучший клинический эффект. Комбинированная иммунокоррекция может включать совокупность 3–4 средств и способов различного воздействия, влияющих на разные звенья системы иммунитета.
В период ремиссии надо проводить противорецидивную иммунопрофилактику. Она включает весь арсенал иммунотерапевтических средств, по существу это иммунореабилитация.
Первоочередные мероприятия в Беларуси по диагностике и лечению ИДБ:
- совершенствование иммуноаллергологической службы: подготовка врачей, начиная с преподавания клинической иммунологии во всех университетах (как это делается в ВГМУ), создание соответствующих кабинетов в областных центрах;
- внедрение обязательного определения IgG, IgM, IgA в сыворотке крови у больных с рецидивами инфекций;
- полное обеспечение пациентов с (а)гипогаммаглобулинемией препаратами внутривенных иммуноглобулинов (это намного выгоднее, чем лечение неэффективными методами);
- разрешение клиническим иммунологам при некоторых ИДБ (по показаниям) назначать, а станциям переливания крови проводить прямое переливание крови от здоровых доноров, в т. ч. родственников, что поможет восстановить систему иммунитета.
Главная стратегия борьбы с инфекциями как следствием иммунодефицитов — иммунопрофилактическое повышение защитных сил у людей.
Случай и з практики
Состояние удовлетворительное. Кожа и видимые слизистые без патологии. Лимфоузлы не пальпируются. Аускультативно в легких дыхание везикулярное, хрипов нет. Тоны сердца ясные, ритмичные. Пульс 76 в мин. АД 120/70 мм рт. ст. Живот мягкий, безболезненный. Отеков нет. Стул, диурез в норме. Общий анализ крови: ЭР 5,071012/л, лейкоциты 9,3109/л, п — 1%, с — 73%, э — 3%, м — 4%, л
— 19%, гемоглобин — 142 г/л, СОЭ — 4 мм/час.
IgG 2,3 г/л, IgA 0,5 г/л, IgM 0 г/л; ИК 8 ед.; субпопуляции лимфоцитов, показатели фагоцитоза не отличались от референтных значений. ЭКГ: ритм синусовый, ЧСС 79 в минуту. Электрическая ось сердца типа SI SII SIII. Рентгенография ОГК: немного деформированный легочной рисунок в нижних отделах справа и слева. Корни умеренно тяжисты. Органы средостения расположены обычно. Кожные диагностические пробы с бытовыми, эпидермальными и пыльцевыми аллергенами сенсибилизации не выявили. Спирография: значительное снижение проходимости на уровне трахеи, умеренная на уровне крупных, средних бронхов на фоне небольшого снижения ЖЕЛ. После пробы с физической нагрузкой значительно уменьшается проходимость на уровне крупных, средних и мелких бронхов, умеренно снижена на уровне трахеи. Снижение ОФВ на 26%.
Поставлен диагноз: общая вариабельная иммунодефицитная болезнь с клиникой рецидивирующих бронхитов и пневмоний. Бронхиальная астма, неспецифическая форма, легкое персистирующее течение, ДН0.
Назначена заместительная терапия внутривенными иммуноглобулинами. Состояние улучшилось.
***
Пациент В., 39 лет. Поступил в аллергологическое отделение ВОКБ с жалобами на кашель, одышку при нагрузке, боли в лучезапястных, плечевых, коленных суставах. Объективно: состояние удовлетворительное. Кожа и видимые слизистые без патологии. Лимфоузлы не пальпируются. Коленные суставы отечны, без гипере-мии. Аускультативно в легких дыхание везикулярное, сухие хрипы на вдохе и выдохе с обеих сторон. Тоны сердца ясные, ритмичные. Пульс 66 в мин. АД 120/80 мм рт. ст. Живот мягкий, безболезненный. Стул, диурез в норме. Общий анализ крови: ЭР 4,431012/л, лейкоциты 5,5109/л, п — 3%, с — 74%, э — 2%, м — 8%, л — 13%, гемоглобин — 146 г/л, СОЭ — 2 мм/час.
IgG 4,2 г/л, IgA 0,2 г/л, IgM 0,4 г/л; ИК 3 ед.; ФИ — 75%; ФЧ 8, субпопуляции
лимфоцитов не отличались от референтных значений. Антитела к ДНК отрицательны, как и РФ. Биохимические показатели в пределах референтных значений.
ЭКГ: ритм синусовый, ЧСС 62 в мин. Нормальная электрическая ось сердца. Рентгенография ОГК: легочные поля эмфизематозны, без инфильтративных теней. Легочной рисунок немного усилен, деформирован с обеих сторон. Корни умеренно тяжисты. Синусы свободны. Удлинена дуга левого желудочка. Спирография: умеренное смешанное нарушение проходимости на уровне трахеи
крупных бронхов, значительное снижение на уровне мелких.
За 2 года перенес 5 пневмоний. Два месяца назад лечился по поводу полисегментарной левосторонней пневмонии. Тогда же выполнена иммунограмма, на которой отсутствовали IgA, IgM, а IgG — 2 г/л.
Пациента проконсультировал сотрудник кафедры клинической
иммунологии и аллергологии ВГМУ и порекомендовал заместительную терапию внутривенными иммуноглобулинами. В. выписали в удовле-творительном состоянии. В анамнезе — лейкопения до 15 лет, состоял на учете у гематолога. Двое детей. У младшего сына также лейкопения.
Диагноз, поставленный в ВОКБ: общая вариабельная иммунодефицитная болезнь с клиникой рецидивирующих бронхитов и пневмоний. После лечения внутривенными иммуноглобулинами выписан с улучшением.
Дмитрий Новиков, доктор мед. наук, профессор РАЕН и РАМТН, заведующий кафедрой клинической иммунологии и аллергологии ВГМУ
Читайте также:


