Иммунологические нарушения при инфекционных заболеваниях

Болезни иммунной системы включают в себя патологические состояния, развивающиеся на фоне изменения эффекторных механизмов иммунитета. Болезни иммунной системы классифицируются с учетом активности иммунных реакций: в случае гиперреакции на внешние аллергены развиваются аллергические болезни, при извращенной реакции на собственные (эндогенные) тканевые антигены – аутоиммунные заболевания. При гипореактивности иммунной системы возникают иммунодефицитные состояния, при которых организм становится уязвимым к различного рода инфекциям. Основными органами иммунной системы являются костный мозг, тимус, селезенка, миндалины, лимфатические узлы, а также лимфоидная ткань слизистых оболочек.
Иммунные болезни
Болезни иммунной системы включают в себя патологические состояния, развивающиеся на фоне изменения эффекторных механизмов иммунитета. Болезни иммунной системы классифицируются с учетом активности иммунных реакций: в случае гиперреакции на внешние аллергены развиваются аллергические болезни, при извращенной реакции на собственные (эндогенные) тканевые антигены – аутоиммунные заболевания. При гипореактивности иммунной системы возникают иммунодефицитные состояния, при которых организм становится уязвимым к различного рода инфекциям. Основными органами иммунной системы являются костный мозг, тимус, селезенка, миндалины, лимфатические узлы, а также лимфоидная ткань слизистых оболочек.
Диагностикой и лечением болезней иммунной системы занимаются врачи различных специальностей: аллергическая патология и иммунная недостаточность находятся в поле зрения аллергологов-иммунологов, аутоиммунные заболевания (в зависимости от ведущего синдрома) – в компетенции специалистов-ревматологов, эндокринологов, неврологов, гастроэнтерологов, кардиологов и др. Вместе с тем, в возникновении аллергической, иммунодефицитной и аутоиммунной патологии прослеживается тесная взаимосвязь. Например, при дефиците секреторного иммуноглобулина A вначале могут развиваться хронические инфекционные поражения кожи, осложняющиеся в дальнейшем аутоиммунными заболеваниями (дерматомиозитом, ревматоидным артритом, СКВ и бронхиальной астмой.
Болезни иммунной системы, при которых развивается состояние иммунодефицита, могут быть первичными – врожденными или наследственными и вторичными – приобретенными. К первой группе относятся агаммаглобулинемия, лимфоцитарная дисгенезия, синдром Луи-Бар, синдром Вискотта–Олдрича и др. Вторичные иммунодефициты могут развиваться на фоне инфекционных, лимфопролиферативных, метаболических заболеваний, интоксикации, облучения, приема лекарственных препаратов (иммунодепрессантов, кортикостероидов). При них может повреждаться клеточное или/и гуморальное звено иммунитета, система фагоцитоза. Самой известной формой вторичного иммунодефицита является СПИД (ВИЧ-инфекция).
Общими проявлениями, сопровождающими различные иммунодефициты, служат рецидивирующие инфекции - пневмонии, инфекции мочевыводящих путей, менингит, генерализованный кандидоз, герпес, фурункулез и др. Иммунодефицитные состоянии часто сочетаются с аллергическими болезнями - экземой, отеком Квинке. На сегодняшний день доказано, что врожденные дефекты или приобретенный дефицит каких-либо иммунных факторов играют ведущую роль в развитии многих онкологических заболеваний. Пациенты с выраженной иммунной недостаточностью часто погибают от оппортунистических инфекций.
Для выявления или подтверждения иммунодефицита необходимо специальное лабораторное исследование иммунного статуса: определение численности и морфологии лимфоцитов, содержания иммуноглобулинов в сыворотке крови, исследование системы комплемента, определение специфических антител и др. Может быть показано проведение биопсии лимфатических узлов, рентгенографии органов грудной клетки, УЗИ тимуса и селезенки. Лечение болезней иммунной системы, протекающих с иммунологической недостаточностью, предусматривает заместительную терапию (введение иммуноглобулинов, сывороток, трансплантацию костного мозга), иммунокоррекцию, иммуномодуляцию.
Особую категорию болезней иммунной системы составляют аутоиммунные нарушения. При данной группе заболеваний клетки иммунной системы проявляют аутоагрессию по отношению к тканям собственного организма. Распространенность аутоиммунных заболеваний чрезвычайно высока – ими страдает около 5-7% населения планеты. Болезни иммунной системы с аутоаллергическим механизмом делятся на органоспецифические – при них аутоантитела направлены против конкретного органа-мишени (аутоиммунный гастрит, аутоиммунный тиреоидит, аутоиммунный гепатит и др.), неорганоспецифические – в этом случае аутоантитела могут атаковать разные органы и ткани (склеродермия, СКВ, ревматоидный артрит и др.) и смешанные.
Триггерами, запускающими каскад иммунопатологических реакций, могут выступать бактериально-вирусные инфекции, радиационное воздействие, лекарственные и токсические вещества, стресс. Ряд аутоиммунных заболеваний обусловлен наследственными факторами. Для многих болезней иммунной системы данной группы характерны боли в суставах и мышцах, кожная сыпь, набор или потеря веса, утомляемость, повышенная кровоточивость или склонность к тромбозам, лихорадка, мышечная слабость. Большинство аутоиммунных заболеваний имеет неуклонно прогрессирующее течение, и без соответствующего лечения они могут привести к тяжелой инвалидизации.
Наиболее ценными методами диагностики болезней аутоиммунного характера являются лабораторные исследования, направленные на выявление в крови аутоантител к различным тканям, циркулирующих иммунных комплексов, острофазовых белков, компонентов системы комплемента, генетических маркеров. Поскольку многие антитела не являются специфичными для той или иной патологии, а обнаруживаются при целом ряде болезней иммунной системы, лабораторная диагностика всегда дополняется инструментальными методами (рентгенографией, УЗИ, эндоскопией, сцинтиграфией, биопсией и др.). В последние годы достигнут заметный прогресс в лечении болезней иммунной системы. Традиционный подход включает проведение иммуносупрессорной терапии, противовоспалительной терапии кортикостероидами, эфферентной терапии (гемодиализ, плазмаферез, гемосорбция). По показаниям выполняется хирургическое лечение (спленэктомия при гемолитической анемии, перикардэктомия при аутоиммунном перикардите, тиреоидэктомия при аутоиммунном тиреоидите и т. д.). Очень обнадеживающие перспективы открывает трансплантация CD34+ аутологичных стволовых гемопоэтических клеток.
[youtube.player]
Иммунный статус – это совокупность количественных и функциональных показателей, отражающих состояние иммунной системы человека в данный момент времени.
Иммунологический анамнез
Первым этапом специфической иммунологической диагностики является иммунологический анамнез. Это очень важная часть общего анамнеза больного, независимо от основного заболевания, позволяет выяснить наличие заболеваний в прошлом, установить или заподозрить иммунологическую причину заболевания или направление поиска иммунологических нарушений.
В результате сбора анамнеза следует сразу выяснить тип вероятного иммунопатологического синдрома. Существуют различные точки зрения на количество и проявления иммунопатологических синдромов.
На современном этапе, на наш взгляд, следует выделять 6 иммунопатологических синдромов. Эта точка зрения освещена также и Е.И.Соколовим (1998).
Иммунологические синдромы
Иммунологические синдромыИтак, выделяется 6 иммунопатологических синдромов:
1. Инфекционный синдром.
2. Аллергический синдром.
3. Аутоиммунный синдром.
4. Первичный иммунодефицит.
5. Вторичный иммунодефицит.
6.Имунопролиферативний синдром.
Инфекционный синдром – для него наиболее характерны:
1. длительный субфебрилитет, лихорадка нечеткой этиологии;
2. хронические инфекции ЛОР– органов (синуситы, отиты), лимфадениты;
3. хронические заболевания дыхательных путей, которые часто повторяются;
4. высокая частота острых респираторных вирусных заболеваний (у взрослых более чем 4 раза, у детей – более 6 раз в год);
5. бактериальные поражения кожи и подкожной клетчатки (пиодермии, фурункулез, абсцессы, флегмоны, рецидивирующие парапроктиты у взрослых);
6. грибковые поражения кожи, слизистых оболочек и ногтей;
7. паразитарные инфекции;
8. афтозные стоматиты, заболевания пародонта, кариес;
9. рецидивирующие гнойные конъюнктивиты;
10. рецидивирующий герпес различной локализации;
11. повторные лимфадениты;
12. хронические урогенитальные инфекции (хронический гнойный вульвит, уретрит, рецидивирующий цистит и пиелонефрит);
13. дисбактериоз кишечника, хроническая гастроэнтеропатия с диареей неизвестного генеза;
14. генерализованные инфекции.
Наиболее характерными его проявлениями являются:
1. аллергические заболевания кожи (атопiчний и контактный дерматит, крапивница, отек Квинке, феномен Артюса, экзема);
2. аллергические заболевания ЛОР – органов (полiноз, хронический аллергический ринит и риносусит);
3. бронхиальная астма;
4. признаки пищевой аллергии (непереносимость пищевых продуктов);
5. признаки лекарственной аллергии;
6. признаки непереносимости химических соединений.
1. воспалительные заболевания опорно – двигательного аппарата (ревматоидный артрит);
2. системная красная волчанка, дерматомиозит, склеродермия;
3. системные васкулиты (гранулематоз Вегенера, узловатый периартериит и др.);
4. гломерулонефриты;
5. патология щитовидной железы, инсулинозависимый сахарный диабет, болезнь Аддисона, синдром Шегрена и другие гормональные нарушения);
6. неврологические заболевания (рассеянный склероз, миастения Гравис и др..)
7. неспецифический язвенный колит;
8. аутоиммунные заболевания печени;
9. аутоиммунные формы бесплодия, патология беременности, тяжелые формы течения климактерического синдрома;
10. некоторые виды психопатологии (шизофрения).
1. Синдром Луи – Бар – атаксия в сочетании с телеангиэктазии, пятнами гипер – и депигментации;
2. Синдром Вискота – Олдрича – геморрагический симптомокомплекс в сочетании с экземой и тромбоцитопенией у мальчиков;
3. синдром Ди–Джорджи – судорожный синдром с гипокальциемией, пороками развития лицевого скелета и сердечно – сосудистой системы, гипоплазией тимуса;
4. наследственные ангионевротический отек различной локализации (недостаточность ингибитора С1 компонента комплемента).
1. все виды инфекционного синдрома в случае длительного торпидного к терапии лечения, тенденции к генерализации процесса;
2. алопеция, де– и гиперпигментация кожи;
3. СПИД;
4.другие случаи приобретенной иммунной недостаточности.
1. опухоли в иммунной системе (лимфолейкозы, лимфосаркомы, болезнь Ходжкина, лимфомы, саркома Капоши);
2. Х – сжатых рецессивный лимфопролиферативный синдром у детей;
3. гиперплазия всех групп лимфатических узлов с воспалительными процессами в них в сочетании с частыми бактериальными инфекциями другой локализации;
4. спленомегалия;
5. мононуклеоз в анамнезе.
Таким образом, после опроса больного, мы можем заподозрить вероятный иммунологический синдром и направить больного для дальнейшего лабораторного исследования с определенным перечнем иммунологических тестов.
Диагностика иммунных нарушений
Сейчас для диагностики иммунных нарушений используется большое количество различных тестов, которые проводятся по разным методикам, и в зависимости от этого по разному интерпретируются. Р.В.Петров предложил комплекс унифицированных тестов, которые распределены на тесты 1 уровня (ориентировочные) и тесты 2 уровня (уточняющие). Их использование и интерпретация достаточные (в совокупности с предварительной информации, полученной при клинико – анамнестических обследовании) для установки основной массы иммунологических диагнозов.
К тестам 1 уровня относят:
1. Определение общего количества лейкоцитов (абсолютного и относительного количества), по данным лейкограммы.
2. Определение абсолютного и относительного количества Т – и В– лимфоцитов.
3. Определение концентрации основных классов сывороточных иммуноглобулинов (Ig A, Ig M, Ig G).
4. Определение фагоцитарной активности лейкоцитов.
5. Определение титра комплемента.
После анализа результатов тестов 1 уровня врач может сделать вывод, нужно ли дальнейшее обследование больного. Тесты 1 уровня дают возможность подтвердить или опровергнуть предположение о нарушении функционирования иммунной системы. При необходимости проводят тесты 2 уровня (аналитические). На третьем этапе идентифицируют поражения той или звенья иммунной системы.
Аналитические тесты рекомендуется применять для углубленного анализа состояния иммунной системы, определения уровня и глубины нарушений в иммунной системе.
Тесты 2 уровня включают:
1. Определение основных регуляторных субпопуляций Т – лимфоцитов.
2. Тест ингибиции миграции лимфоцитов (ИМЛ).
3. Оценка пролиферативной активности Т – и В– лимфоцитов на митогены. Антигены, аллогенные клетки (РБТЛ).
4. Определение циркулирующих иммунных комплексов (ЦИК).
5. Определение различных компонентов комплемента.
6. Определение естественных антител (гетерофильных агглютининов).
Тесты третьего уровня включают:
1. Тесты, которые проявляют медиаторы иммунной системы, в том числе и продукцию интерлейкинов.
2. Определение общего и специфического IgE.
3.Определение уровня кислородно –зависимого метаболизма фагоцитирующих клеток (НСТ– тест).
4. Определение антигенспецифичних антител.
5. Определение активности ферментов (аденозиндезаминазы, пуриннуклеозидфосфарилазы).
II. Другие тесты, характеризующие состояние иммунной системы
Особой сложностью является интерпретация иммунограммы. На наш взгляд, иммунограмму должен уметь растолковать врач общей практики. Он должен опираться на данные анамнеза, объективного исследования. А проводить интерпретацию только иммунограммы, без учета других сведений о пациенте, неправомерно, ибо отклонения на иммунограмма для многих патологических процессов однотипные, зависят от фазы заболевания, генетических и многих других особенностей, и учесть абсолютно все это может только врач– клиницист.
Методы определения лимфоцитов
1. Абсолютное содержание лимфоцитов в периферической крови
Вычеты абсолютного содержания лимфоцитов в периферической крови проводится после определения обычного процентного содержания белой крови и общего числа лейкоцитов. У практически здоровых лиц абсолютное содержание лимфоцитов составляет 1,7 – 2,0 г / л, что рассматривается как нормальный уровень показателя. Примерное (1,7 – 1,5 г / л) и значительное (1,5 г / л и менее) является основой для углубленного изучения иммунного статуса.
Прогрессивными считаются иммунофлюоресцентные и иммуноферментные методы, позволяющие с помощью наборов моноклональных антител к различным CD антигенов идентифицировать практически любые поверхностные структуры лимфоцитов. На поверхности Т – лимфоцитов находятся антигены CD3 +. После выяснения относительного количества Т – лимфоцитов с помощью несложных расчетов определяется абсолютное содержание этих клеток. В среднем он составляет 0,7 – 0,9 г / л.
Повышение абсолютного и относительного количества Т – лимфоцитов отмечается при лимфопролиферативных заболеваниях, в период рековалесценции и у больных туберкулезом (может быть на начальных стадиях заболевания).
Уменьшение количества Т – лимфоцитов наблюдается при бактеральних и вирусных острых и хронических инфекциях, иммунодефицитах, опухолях, туберкулезе, травматических поражениях, ожогах, стрессе, кровоизлияниях, инфаркте.
3. Определение субпопуляционного состав Т – лимфоцитов
Определение количества Т – лимфоцитов, которые выполняют хелперную и супрессорную функции, происходит в реакции спонтанного розеткообразования с добавлением в реакцию теофиллина, и основывается на том, что рецепторы к чужеродным эритроцитов на клетках, которые выполняют супрессорную функцию, чувствительны к теофиллина и блокируются ним, при добавлении в реакцию. Таким образом мы обнаруживаем теофилинчутливих розеткоутворювальни клетки (Е ТФЧ – РУК), которые выполняют супрессорную функцию, и теофилинрезистентних (Е ТФР – РУК), которые выполняют хелперную функцию.
С помощью моноклональных антител мы можем точнее выяснить субпопуляционный состав. Так, Т – лимфоциты, которые выполняют хелперную функцию, имеют на поверхности антигены CD4 +, а Т – лимфоциты, которые выполняют супрессорную функцию – антигены CD8 +.
Очень важно нормальное соотношение Т – лимфоцитов, которые выполняют хелперную и супрессорные функции. При применении различных методик исследования это соотношение остается постоянным и называется иммунорегуляторного индекса (ИРИ) и равен 1,7 – 2,5.
Снижение этого индекса происходит при:
1. СКВ с поражением почек;
2. острой цитомегаловирусной инфекции;
3. СПИДе;
4. герпетической инфекции;
5. инфекциии, вызванной вирусом Эпштейна – Барр (инфекционном мононуклеозе);
6. инсоляции, или длительном облучении ультрафиолетовыми лучами;
7. у новорожденных;
8. пересадке костного мозга.
Повышение индекса отмечается при:
1. ревматоидном артрите;
2. сахарном диабете 1 типа;
3. СКВ без поражения почек;
4. первичном билиарном циррозе;
5. атопическом дерматите;
6. поллинозе;
7. атопической бронхиальной астме;
8. псориазе;
9. хроническом аутоиммунном гепатите.
4. Определение функциональной активности Т – лимфоцитов происходит посредством реакции бластной трансформации с фитогемагглютинином (ФГА) или лимфоцитарным митогеном (ПМ). Она основывается на том, что специфические митогены вызывают пролиферацию и трансформацию.
Людмила ОСИПОВА
доцент кафедры клинической иммунологии и аллергологии НМАПО им. П.Л.Шупика
Различные методы лечения или наследственная патология иммунной системы могут способствовать развитию инфекционного заболевания, обусловленного слабовирулентными штаммами микроорганизмов, или возникновению тяжёлых инфекций, связанных с патогенными возбудителями.
Недостаточность иммунной системы обычно возникает в результате воздействия нескольких факторов. Например, при нейтропении, развивающейся у пациентов, перенёсших пересадку костного мозга, повышена восприимчивость организма к бактериальным инфекциям, в то время как внутривенная катетеризация способствует развитию инфекции, вызванной Staphylococcus epidermidis.
Медицинские манипуляции часто нарушают физические барьеры на пути инфекции (например, катетеризация).
Гранулоцитопению обычно наблюдают при острой лейкемии или её лечении. Риск развития инфекции зависит от длительности и тяжести нейтропении. Бактериемию у таких больных обнаруживают в 40—70% случаев. Наиболее часто выделяют гра-мотрицательные бациллы (бактерии семейства Enterobacteriaceae и рода Pseudomonas). Они распространяются по организму в результате повреждения кишечника противоопухолевыми препаратами и облучением.
Кроме того, в этиологии сепсиса важную роль играют фамположительные микроорганизмы (S. epidermidis, S. mitis, S. oralis, S. aureus, Corynebacterium jeikeium и представители рода Enterococcus).
Несмотря на то что в большинстве случаев развитие кандидоза обусловлено приёмом антибактериальных препаратов, у пациентов с нейтропенией грибковые инфекции могут возникать de novo. В последнее время всё чаше сообщают о микозах, вызванных дрожжевыми грибами, такими как Candida krusei (характерна природная устойчивость к действию противогрибковых средств), различными видами родов Aspergillus (вызывают инвазивные заболевания) и Fusarium, а также Pseudallescheria boydii и Trichosporon beigelii.
Лечение лихорадки у пациентов с нейтропенией. Эмпирическая терапия включает карбапенем (или цефтазидим) и амикацин. Если лихорадка не исчезает, то дополнительно назначают гликопептидный антибиотик. Позже, если лихорадка сохраняется, высока вероятность развития микозов, поэтому для лечения используют амфотерицин В и итраконазол.
Профилактика инфекции у пациентов с нейтропенией. Вероятность развития инфекции у пациентов с нейтропенией заметно снижается, если в больнице их помещают в индивидуальный бокс и снабжают стерилизованной пищей и водой. Большое значение имеет соблюдение стерильного режима не только медицинским персоналом (мытьё рук и использование одноразовых резиновых перчаток), но и посетителями (ношение халатов и масок). Воздух, поступающий в палату, необходимо пропускать сквозь фильтр специальной очищающей от грибковых спор системы.
Приём нистатина и амфотерицина В внутрь позволяет снизить вероятность развития грибковой инфекции. Достаточно эффективные препараты — флуконазол и итраконазол. В некоторых медицинских центрах применяют профилактическую терапию 4-фторхинолонами, действие которых направлено против факультативных анаэробов кишечника (при сохранении анаэробной флоры).
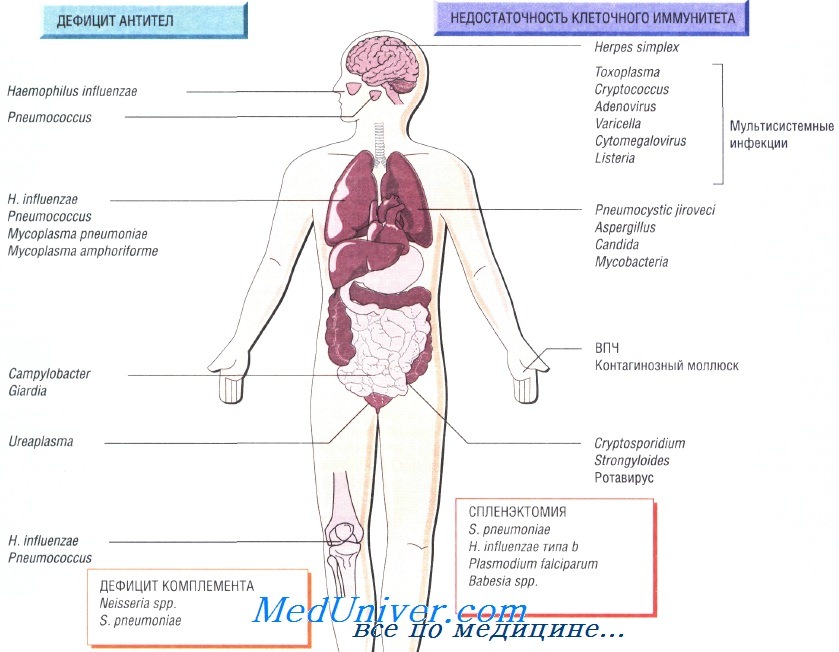
Причины инфекций при иммунодефиците
Недостаточность Т-клеточного иммунитета может быть обусловлена ВИЧ-инфекцией, противоопухолевой химиотерапией, приёмом глюкокортикоидных препаратов или трансплантацией органов. Врождённый дефицит обнаруживают достаточно редко. Он может быть связан только с недостаточностью функции Т-лимфоцитов или сопровождаться гипогаммаглобулинемией.
Возбудители инфекции при недостаточности Т-клеточного иммунитета. Основные возбудители — внутриклеточные патогенные микроорганизмы и паразиты:
• Toxoplasma gondii, Strongyloides stercoralis;
• Mycobacterium tuberculosis, M. avium-intracellulare;
• Listeria monocytogenes, Cryptococcus neoformans, Pneumocystis jiroveci;
• вирусы простого герпеса, цитомегаловирус, вирус опоясывающего герпеса и кори.
При осложнении кори гигантоклеточной пневмонией и энцефалитом у таких больных заболевание может приобрести угрожающий жизни характер.
Диагностика инфекции при недостаточности Т-клеточного иммунитета. Для диагностики инфекционных заболеваний применяют различные методы исследования. Для посева у пациентов отбирают не менее, чем два образца крови, взятых из разных мест.
Пациенты, страдающие сцепленной с Х-хромосомой агамма-глобулинемией, входят в группу повышенного риска заражения различными инфекциями в первые 6 мес своей жизни, в то время как люди с другим иммунодефицитом имеют повышенный риск на протяжении всей жизни. Функциональная гипогаммаглобулинемия возникает у больных с множественной миеломой.
Возбудителями рецидивирующих респираторных заболеваний у таких людей считают Streptococcus pneumoniae, недавно открытую Mycoplasma amphoriforme и не имеющего капсулы Haemophilus influenzae (вызывает бронхоэктазию). Персистирующие инфекции вызывают представители родов Giardia, Cryptosporidium и Campylobacter. Снизить частоту возникновения рецидивирующих инфекций помогает внутривенное введение иммуноглобулина.
Врождённую недостаточность комплемента наблюдают достаточно редко. Недостаточность последних компонентов системы комплемента (С7—С9) вызывает потерю способности лизировать грамотрицательные бактерии, в связи с чем повышается восприимчивость пациента к рецидивирующим инфекциям, вызванным микроорганизмами рода Neisseria. Недостаточность альтернативного пути системы комплемента приводит к развитию тяжёлых стрептококковых инфекций (S. pneumoniae), например менингита.
Приобретённая недостаточность системы комплемента часто возникает при системной красной волчанке.
Маннозасвязывающий лектин путь активации комплемента. Широкий спектр бактерий, грибов, вирусов и простейших прикрепляются к клеткам организма хозяина посредством маннозасвязывающего лектина. Есть данные, что при некоторых видах его недостаточности именно эти микроорганизмы вызывают наиболее частые и тяжёлые заболевания у людей с определёнными генотипами.
Ежегодно после удаления селезёнки в 1% случаев наблюдают развитие тяжёлого сепсиса, при этом чаще всего заболевание возникает у младенцев и детей. Самую высокую смертность отмечают после спленэктомии, выполненной по поводу лимфомы и талассемии. У пациентов с серповидно-клеточной анемией развивается функциональная аспления. Риск развития сепсиса может со временем снизиться, но никогда не исчезнет окончательно.
Наиболее распространённый возбудитель инфекций (две трети всех случаев) — Streptococcus pneumoniae, но Н. influenzae и Е. coli также играют важную роль в этиологии инфекционных заболеваний у таких пациентов. Кроме того, спленэктомия повышает восприимчивость организма к инфекции, вызванной Capnocytophaga canimorsis (особенно после укусов собак). Малярия также может протекать крайне неблагоприятно (фульминантная форма).
Профилактика инфекции после спленэктомии. После удаления селезёнки всем пациентам необходимо провести вакцинацию, направленную против S. pneumoniae, менингококков и Н. influenzae типа В. Более эффективна иммунизация с использованием белковых конъюгированных вакцин. В некоторых случаях для профилактики применяют пенициллин V (в низких дозах).
Пациентов следует предупреждать о том, чтобы они сообщали своему лечащему врачу о любых признаках лихорадки, а также проинструктировать их относительно приёма антибиотиков (во избежание задержки лечения).
[youtube.player]Характеристика антиинфекционного иммунитета. Иммунитет к инфекционным антигенам формируется с помощью тех же механизмов, которые свойственны ответу на неинфекционные антигены. При попадании эффективной дозы вирулентного возбудителя в неиммунный организм развивается инфекционный процесс, характеризующийся цикличностью. Последняя обусловлена особенностями размножения и жизнедеятельности возбудителя, в зараженном организме и иммунологическими сдвигами в нем. Инкубационный период продолжается от проникновения возбудителя в организм до появления первых признаков заболевания. В этот период возбудитель внедряется в- восприимчивые клетки и преодолевает защитные барьеры, затем происходит накопление возбудителя, экзотоксинов (при дифтерии, столбняке, дизентерии Григорьева—Шита), эндотоксинов (при сальмонеллезах, брюшном тифе, дизентерии Флекснера и Зонне). Иммунные реакции в инкубационный период выражены недостаточно, часто они подавлены факторами агрессивности возбудителя и не всегда носят черты строгой специфичности. При инфекциях с коротким инкубационным периодом обнаружить демонстративные иммунологические сдвиги в этот период удается редко (при гриппе, дизентерии, сальмонеллезе), при инфекциях с длительной инкубацией они выявляются е большей частотой (при туберкулезе, вирусном гепатите).
Продромальный период (период предвестников) наблюдается не при всех инфекциях, характеризуется развитием преимущественно общих стереотипных проявлений болезни (лихорадки, недомогания, головной боли, катаральных или диспепсических явлений), краткостью течения (от нескольких часов до 2 - 3 дней), отсутствием выраженных иммунологических сдвигов, которые указывают на формирование специфической невосприимчивости и могут быть использованы как диагностические тесты.
В период разгара заболевания формируется ГЗТ к антигенам возбудителя, происходит активный синтез специфических антител. В начале периода разгара заболевания выявляются антитела, относящиеся к IgM, в последующем они сменяются IgG и IgA. В защите от инфекции играют роль не только циркулирующие в крови, но и секреторные антитела (IgA), продуцируемые слизистыми оболочками дыхательных путей и пищевого канала. Они создают местный иммунитет входных ворот инфекции. При некоторых инфекциях (вирусном гепатите, туберкулезе, бруцеллезе и др.) постинфекционный иммунитет вырабатывается медленно, что обусловливает затяжное (нередко рецидивирующее) течение заболевания. При некоторых инфекциях (трахоме, микозах, сифилисе) могут выявляться иммунные реакции, но не вырабатывается защитный иммунитет. Эти заболевания характеризуются длительным хроническим течением с периодическими обострениями без склонности к самопроизвольному излечению. Диагностические титры антител и другие иммунные сдвиги наиболее часто обнаруживаются с конца 1-й недели периода разгара заболевания. Некоторые аллергические пробы (кожные реакции) могут быть положительными в первые дни заболевания, но их интенсивность нарастает к средине периода разгара инфекции.
Период реконвалесценции характеризуется угасанием клинических признаков заболевания, нормализацией нарушенного гомеостаза, восстановлением угнетенных показателей неспецифической резистентности, постепенным снижением аллергии. У лиц с недостаточностью иммунитета, отягощенным анамнезом, при сопутствующих заболеваниях, а также при массовом инфицировании организма высоковирулентными возбудителями наблюдаются тяжелые формы заболевания с острым или затяжным течением, рецидивами. В этих случаях период реконвалесценции даже остро протекающих инфекций длится несколько недель, а иногда и месяцев.
Иммунитет после перенесенного инфекционного заболевания может быть стерильным (после кори, гриппа, коклюша) и нестерильным (после малярии, туберкулеза). В первом случае иммунные механизмы обеспечивают освобождение организма от возбудителя и препятствуют его развитию в этом организме при реинфекции. Во втором случае состояние специфической невосприимчивости поддерживается присутствием в организме возбудителя, стимулирующего лимфоидную систему биологического хозяина. В последние годы получены данные о возможности длительной персистенции в организме переболевших возбудителей кори, гриппа, брюшного тифа, сальмонеллезов и других инфекций. Высказывается мнение, что длительный, иногда пожизненный, иммунитет при ряде вирусных инфекций определяется не особенностями сто формирования в период заболевания, а постоянной стимуляцией иммунокомпетентных клеток антигенами персистирующих возбудителей.
При инфекциях, вызываемых возбудителями, продуцирующими экзотоксины (столбняке, ботулизме, газовой гангрене, дифтерии), постинфекционный иммунитет определяется в основном выработкой специфических антитоксинов. Однако даже высокие титры этих антител часто не препятствуют вегетации возбудителя в организме реконвалесцеита и здорового носителя (при дифтерии).
Постинфекционный иммунитет может быть кратковременным (при столбняке, гриппе, дизентерии, возвратном тифе, сапе), продолжительным (при сибирской язве, лептоспирозах, риккетсиозах) и даже пожизненным (при кори, полиомиелите, коклюше, паротите). Напряженность и продолжительность иммунитета зависят от характера возбудителя, дозы заразного начала, состояния генотипа, возраста, перенесенных ранее заболеваний, рационального лечения и др.
Особенности иммунитета при бактериальных инфекциях. При попадании в организм возбудителей бактериальной природы первое защитное свойство — действие фагоцитов и неспецифических гуморальных факторов (комплемента, лизоцима, бетализинов, пропердина). Эти факторы, не способные препятствовать вирусной инфекции, определяют резистентность неиммунного организма ко многим патогенным бактериям. Вторая особенность антибактериального иммунитета — более важная роль в нем антител по сравнению с вирусными инфекциями. В процессе заболевания синтезируются антитела, относящиеся к IgM, IgG, IgA, IgE. Антитела могут оказывать прямое бактерицидное действие, нейтрализовать бактериальные токсины, экранировать рецепторы восприимчивых клеток, опсонировать патогенных возбудителей, усиливать фагоцитирование и переваривание их ней-трофильными гранулоцитами и макрофагами. Фагоцитоз, осуществляемый в присутствии антител, является более активным, направленным и завершенным.
При бактериальных инфекциях, особенно с длительным инкубационным периодом и затяжным течением, формируется ГЗТ, обусловленная сенсибилизированными лимфоцитами. Классический пример ее — аллергия при туберкулезе, бруцеллезе и других инфекциях.
В ряде случаев иммунная реакция организма не в состоянии элиминировать возбудителя из организма, что ведет к развитию носительства или хронической формы инфекции. Это явление чаще наблюдается при заражении маловирулентными бактериями, антигенной мимикрии или недостаточности иммунитета у больного.
Особенности иммунитета при вирусных инфекциях. В отличие от бактерий вирусы характеризуются значительно меньшими размерами вириона, неклеточной организацией, наличием в геноме только одного типа нуклеиновой кислоты (РНК или ДНК), неспособностью к репродукции вне клетки хозяина. Многие вирусы имеют белковую оболочку, защищающую их от повреждения во внешней среде и обеспечивающую инфицирование ими комплементарных клеток. Специализация поверхностных структур вируса (рецепторов) увеличивает во много раз его инфекционность (способность адсорбироваться на клетках и проникать в них) и ограничивает экологические связи вируса определенным кругом хозяев и типом ткани. Известную роль в этом играет геном вируса, способный взаимодействовать (интегрировать) с геномами клеток определенного типа.
Первыми барьерами, препятствующими попаданию вируса в восприимчивую клетку и размножению его в клетке, являются факторы неспецифической противовирусной резистентности. Среди них большое значение имеет температура внутренней среды зараженного организма. При многих вирусных инфекциях повышение температуры тела губительно для вирусов, что обусловлено прямой инактивацией вируса, интенсификацией ферментных реакций клеток, синтеза в клетке различных гуморальных субстанций, ингибирующих репродукцию вируса. К факторам неспеци-фической противовирусной защиты относятся также термолабильные ингибиторы, интерферон, клеточные протеазы, кофактор нативной сыворотки и др. Определенную роль в освобождении организма от вирусов играет фагоцитоз (захват, изоляция и переваривание зараженных вирусами клеток) и выделительные акты.
В процессе вирусной инфекции вырабатываются антитела, относящиеся преимущественно к IgM, IgG, IgA. В иммунитете к респираторным и кишечным вирусам большое значение имеет секреторный IgA, препятствующий развитию возбудителя у входных ворот. Однако вирусы, расположенные внутри клеток, не доступны нейтрализующему действию антител. Поэтому при многих вирусных инфекциях основной механизм элиминации инфицирующих агентов — действие цитотоксических Т-лимфоцитов, способных разрушать зараженные клетки-мишени без участия специфических антител и комплемента. Эта способность цитотоксических Т-лимфоцитов основана на механизме двойного распознавания (антигенов вируса и сингенных антигенов HLA клетки-хозяина). Указанный механизм обусловливает защитный эффект и развитие иммунопатологических реакций, свойственных любой вирусной инфекции.
Характерная особенность вирусов — их способность включать в состав наружной оболочки антигенные структуры клетки-хозяина. Эта особенность определяет в последующем характер взаимодействия вируса с новым хозяином.
Многие вирусы не разрушают инфицированные клетки. При этом наблюдается генетическая и биохимическая интеграция вирусных и клеточных компонентов, в результате которой вирус становится не отличимым от клеточных структур хозяина. Эту форму взаимоотношений вируса и хозяина можно отнести к мутуалиетическому симбиозу, полезному обоим симбионтам. Она характеризуется взаимной адаптацией вируса и хозяина друг к другу. В связи с этим вирусные болезни рассматриваются как заболевания адаптации.
Известна группа заболеваний, названных медленными вирусными инфекциями. Их могут вызывать обычные (вирусы кори, бешенства) и необычные, медленные (вирусы куру, Крейтцфельда—Якоба) вирусы. Особенность этих инфекций — длительный инкубационный период, медленное прогрессирующее течение, сопровождающееся поражением центральной нервной системы и ведущее к летальному исходу. Иммунитет (антитела) либо не защищает хозяина (подострый склерозирующий ианэнцефалит), либо совсем не образуется (куру). Природа агентов, вызывающих эти заболевания, и их патогенез окончательно не изучены.
Особенности иммунитета при протозойных инфекциях. Иммунитет при протозойных инфекциях (трипаносомозах, лейшманиезах, малярии и др.) характеризуется стадийной специфичностью. Она заключается в том, что каждая стадия развития паразита в антигенном и иммуногенном отношениях обособлена. Поэтому иммунитет к одной стадии развития паразита в организме хозяина влияет незначительно на другие стадии. Эта особенность является приспособительной реакцией паразита, направленной на сохранение его популяции в условиях развития иммунного ответа хозяина к отдельным стадиям.
Иммунный ответ к протозойным инфекциям отмечается образованием преимущественно антител, относящихся к IgM и IgG. Синтез IgA и IgE не характерен для этих инфекций.
В процессе эволюции простейшие выработали механизмы иммунного уклонения, которые кроме внутриклеточной локализации и стадийного развития паразитов включают генетически Детерминированную изменчивость их поверхностных антигенов в пределах одной стадии развития, наличие антигенов, общих с антигенами хозяина, супрессию паразитом или его антигенами иммунного ответа хозяина. При паразитарных инфекциях на один и тот же антиген или группу близкородственных антигенов паразита образуются два типа антител с диаметрально противоположным действием (паразитоцидные и индуцирующие изменчивость паразита). В результате этого приобретенный иммунитет при протозойных инфекциях часто нестерилен и выступает в роли экологического фактора, регулирующего взаимоотношения паразита и хозяина и поддерживающего длительное их сосуществование.
Особенности иммунитета при микозах. Патогенным грибам свойственно большое разнообразие антигенов, способных изменяться в зависимости от условий их развития, формы и стадии микоза. При поверхностных микозах (стригущем лишае, отрубевидном лишае, трихоспории) иммунный ответ обычно отсутствует. При подкожных (хромомикозе, споротрихозе) и глубоких системных микозах (гистоплазмозе, паракокцидиоидомикозе, бластомикозе и др.) выявляются клеточный и гуморальный типы иммунного ответа.
К грибковым заболеваниям более предрасположены лица с врожденной (синдромы Вискотта—Олдрича, Ди Джорджа, Незелофа) и приобретенной (у больных лимфогранулематозом, лиц с дефицитом питания, получавших иммунодепрессивную терапию и др.) недостаточностью Т-системы иммунитета. При заболевании развивается воспалительный процесс, в механизме которого наиболее важную роль играют нейтрофильные гранулоциты. Воспалительная реакция ограничивает патологический очаг, препятствуя проникновению грибов и их продуктов в ткани. В развившихся очагах наблюдаются хронические воспалительные реакции с участием лимфоцитов, плазмоцитов, макрофагов и меньшего количества нейтрофильных гранулоцитов.
Через 10—14 дней после заражения патогенными грибами у больных развивается ГЗТ, которая может быть обнаружена кожными пробами, реакцией подавления миграции макрофагов, РБТЛ в присутствии грибковых антигенов. Кожные пробы остаются положительными длительное время после выздоровления. Клеточный иммунитет имеет основное значение в невосприимчивости к микозам. При большинстве грибковых инфекций обнаружен синтез антител, относящихся к IgM, IgG, IgA, реже IgE. Однако антитела чаще отражают наличие и активность инфекции, а не протективного иммунитета. Нет также доказательств прямого участия комплемента в освобождении организма от паразитирующих грибов.
В ряде случаев иммунный ответ больного микозом не препятствует, а содействует развитию патологического процесса (избыточная повышенная чувствительность, аутоиммунные поражения). Несовершенство механизмов иммунной защиты обусловливает хроническое, рецидивирующее течение многих микозов без склонности к самопроизвольному излечению.
Методы иммунодиагностики инфекционных заболеваний. Многие инфекционные заболевания в современный период претерпели изменения, заключающиеся в повышении удельного веса легких, стертых, бессимптомных форм (дизентерия, скарлатина, коклюш, дифтерия, холера), увеличении аллергического компонента в патогенезе заболеваний, большей частоте смешанных инфекций. Это затрудняет клиническую диагностику заболеваний и повышает значение специфических лабораторных методов исследования. Различают бактериологические, вирусологические, паразитологические, серологические, аллергические, биохимические методы исследования и др.
Иммунодиагностика инфекционных заболеваний базируется на выявлении антигенов возбудителя или специфических иммунных (аллергических) сдвигов в организме больного человека.
Методы, основанные на обнаружении антигена в сыворотке крови, секретах, выделениях или пораженных тканях, используются для ранней экспрессной диагностики инфекционных заболеваний.
РИФ основана на соединении антигенов бактерий, риккетсий и вирусов со специфическими антителами, меченными флуоресцирующими красителями (например, изотиоцианатом флуоресценна). Преимущества РИФ — простота, высокая чувствительность, возможность исследования в начале заболевания, скорость получения результата. РИФ применяется как метод ранней экспрессной диагностики гриппа и других острых респираторных заболеваний, микоплазменной инфекции, дизентерии, брюшного тифа, сальмонеллезов, бруцеллеза, малярии, чумы, геморрагического нефрозонефрита, туляремии, сифилиса, токсоплазмоза, бешенства.
При некоторых инфекциях (дизентерии Зонне) положительная РИФ является окончательным результатом исследования, но в большинстве случаев этот тест указывает на необходимость применения других, более сложных (бактериологических, вирусологических) методов диагностики.
РНГА используется для раннего обнаружения антигенов в организме больного и объектах внешней среды при дизентерии, брюшном тифе, сальмонеллезах, колиэнтеритах, холере, чуме, сибирской язве, ботулизме.
РГА и РТГА применяются для ранней диагностики вирусных инфекций — гриппа, парагриппа, эпидемического паротита, полиомиелита, аденовирусов, вирусных энцефалитов и других.
РНА используется для обнаружения бактериальных экзотоксинов (клостридий, коринебактерий, стафилококков и др,) и вирусов. Она применяется для диагностики оспы, кори, паротита, краснухи, вирусных энцефалитов, денге, омской геморрагической лихорадки. Недостаток РНА — сложность, позднее получение результатов (от нескольких суток до 2—3 нед).
РП (в жидкой фазе, агаровом геле — простая одномерная диффузия, встречная одномерная и двумерная диффузия, радиальная иммунодиффузия, иммуноэлектрофорез и др.) является чувствительным, высокоспецифичным и относительно простым методом диагностики менингококковой инфекции, трипаносомоза, полиомиелита, сибирской язвы, малярии, вирусного гепатита В (встречный иммуноэлектрофорез). Ее можно также применять для индикации возбудителей брюшного тифа, дизентерии, клостридиозов, бруцеллеза, стрептококкозов и токсинов бактерий столбняка, дифтерии, газовой гангрены (реакции флокуляции).
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
[youtube.player]Читайте также:


