Инфекционное осложнение при эндопротезировании

Увеличение средней продолжительности жизни, несомненно, положительная тенденция настоящего времени, но обратной стороной медали является не всегда высокое качество жизни, особенно в старшем возрасте. Одним из факторов, снижающих это качество, всё чаще становятся заболевания суставов. Боль и ограничение способности к движению при этих заболеваниях со временем значительно осложняют жизнь пациентам. Наиболее эффективным способом лечения в этих случаях считается хирургическое вмешательство. Для лечения пациентов с тяжелыми посттравматическими осложнениями и дегенеративными заболеваниями суставов оптимальным методом считается эндопротезирование. Однако, несмотря на то что после тотального эндопротезирования коленного сустава наблюдается значительное улучшение состояния пациента, существует риск осложнения в виде парапротезной инфекции, при котором увеличиваются сроки и стоимость лечения. Кроме того, инфекционное осложнение может привести к неблагоприятному исходу хирургического лечения. Согласно исследованиям, проведенным в ряде разных центров, после тотального эндопротезирования коленного сустава инфицирование происходило в 0,5-5% случаев 1.
I. Uçkay с соавт. выполнили ретроспективный анализ 6101 случая реэндопротезирования крупных суставов с 1996 по 2008 г. Из них 2099 случаев – после эндопротезирования коленного сустава. Всего было удалено 234 (11,15%) протеза коленного сустава, из них по поводу инфекции удалено 24 (1,14%) протеза. Полученные результаты позволили авторам сделать вывод, что парапротезная инфекция – редкое осложнение [4; 5].
Внедрение эндопротезирования в клиническую практику в России происходило постепенно, и первоначальные результаты не внушали оптимизма. По данным H.Н. Корнилова с соавт., частота инфекционных осложнений в некоторых лечебных учреждениях, где выполнялось лишь несколько эндопротезирований в год, достигала 17% [5; 6].
Волошин В.П. с соавт. проанализировали опыт лечения 66 пациентов с тотальным эндопротезированием крупных суставов. В 87,9% случаев (58 пациентов), в сроки от 1,5 до 3 лет после эндопротезирования, отмечалось развитие гнойной инфекции. Глубокое нагноение отмечено у 6 пациентов (9,1%). В итоге 10 пациентам было выполнено артродезирование коленного сустава аппаратом Илизарова [5; 7].
Т.А. Куляба с соавторами проанализировали результаты лечения 44 пациентов, у которых после первичного и ревизионного эндопротезирования коленного сустава развилось инфекционное воспаление. Происходило это в разные сроки, у 18 пациентов (40,1%) в раннем послеоперационном периоде, а у 26 (59,1%) в отдаленном, но так или иначе, купировать воспаление и сохранить эндопротез удалось только у 10 (22,7%) больных. В подавляющем большинстве случаев потребовалось провести двухэтапное хирургическое лечение, которое позволило купировать гнойный процесс в 89,3% случаев. Артродез был выполнен у 4 (9,1%) больных [5; 8].
Инфицирование может происходить через прямую или гематогенную передачу бактериальной флоры. Некоторыми примерами прямой передачи являются: несоблюдение условий стерильности в операционных, передача от инфицированного пациента, небрежность хирургов и обслуживающего персонала. Гематогенное инфицирование наблюдается после эпизода бактериемии. Например, стрептококковая инфекция может развиться после стоматологического вмешательства, стафилококковая – как следствие кожного инфекционного заболевания, энтерококковая и анаэробные инфекции – в результате желудочно-кишечных инфекционных заболеваний и инфекций мочеполовой системы [9].
Отек, боль и дисфункция коленного сустава возникают после эндопротезирования коленного сустава и усиливаются по мере прогрессирования инфекции. На фоне инфекции происходит перипротезный остеолиз, приводящий к нестабильности эндопротеза. У пациентов, не получающих своевременного лечения, может развиться сепсис и опасный для жизни септический шок [10].
На основе метаанализа, проведенного Cancienne J.M. с соавт., описаны исходы лечения 18 533 пациентов с ранними инфекционными осложнениями (в течение 1 года) после тотального эндопротезирования коленного сустава [11]. Среди них:
- 691 пациент (3,7%) умер в стационаре;
- 574 пациентам (3,1%) потребовалась ампутация конечности;
- 852 пациента (4,5%) перенесли артродез коленного сустава;
- 2683 пациентам (14,5%) проведена вторичная хирургическая обработка, без реимплантации;
- 13743 (74,1%) пациента прошли через двухэтапное реэндопротезирование коленного сустава, из них 11420 пациентам (61,6%) в течение 1 года проведено удаление спейсера и реимплантация, а 2323 пациентам (12,5%) оставлен спейсер.
Nodzo S.R. и соавторы, при проведении двухэтапного реэндопротезирования, разделили пациентов на три группы в зависимости от типа используемого спейсера [12]. В первой группе использовались преформованные артикулирующие спейсеры, во второй – спейсеры из цемента изготавливались интраоперационно. В третьей группе – в качестве спейсера использовали автоклавированный бедренный компонент удаленного эндопротеза. Признаки санации инфекционного процесса отметили в первой группе пациентов в 82,7% случаях, во второй группе – в 88,4%. Наименьшее количество положительных результатов отмечено в третьей группе – 79,4%. Таким образом, использование цементных спейсеров, изготовленных интраоперационно с использованием антибиотика по чувствительности флоры, приносит максимально положительный результат.
Цель исследования: провести анализ частоты, структуры и причин возникновения инфекционных осложнений при тотальном эндопротезировании и реэндопротезировании коленного сустава и определить оптимальную тактику лечения при этих осложнениях.
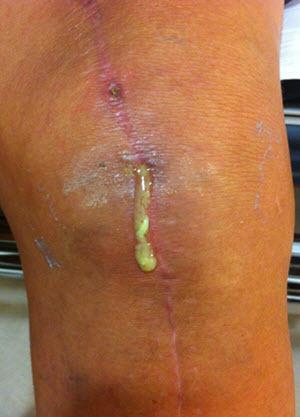
Материал и методы. В Новосибирском НИИТО за период с 2007 по 2016 год было проведено 12 245 операций первичного эндопротезирования коленного сустава. Инфекционные осложнения возникли у 470 (3,84%) человек. При этом эпифасциальная (поверхностная) инфекция была зафиксирована у 252 (2,06%) пациентов. В эту группу включены пациенты с некрозом послеоперационного шва и подкожной клетчатки, лигатурными свищами. В случае распространения процесса в пределах 5-6 см по ходу операционного шва, пациентам проводилась одномоментная санация и ушивание кожного дефекта. В случаях распространения процесса на весь шов, пациентам проводились этапные санационные перевязки до очищения стенок раны с последующим вторичным швом раны. Как результат применения такой методики лечения, у всех пациентов отмечался положительный результат.
Группу пациентов с субфасциальной (глубокой) инфекцией, развившейся в разные сроки, составили 218 пациентов (1,8%), что соответствует мировым тенденциям. По нашим убеждениям, в случае глубокой парапротезной инфекции, на фоне сформированной биопленки, эндопротез сохранять бесполезно, и он подлежит удалению. Однако дальнейшая тактика зависит от патологической флоры и других факторов. После удаления выполняется либо одномоментная имплантация нового эндопротеза, либо проведение этапного лечения с целью санации и последующего реэндопротезирования. В случае невозможности выполнения последующего этапа реэндопротезирования, в рассматриваемых случаях выполнялся артродез коленного сустава.
Бактериальное исследование пациентов с глубокой парапротезной инфекцией дало следующие результаты:
· у 172 (78,9%) пациентов была выделена грамположительная кокковая флора: у 113 пациентов – MSSA, у 33 – MSSE, у 8 пациентов – MRSA, и у 18 пациентов – MRSE;
· грамотрицательные палочки (Klebsiella, Pseudomonas, E.coli) были выделены у 33 пациентов (15,1%);
· грамположительные палочки (Korinebacterium, Propionobacter) – у 2 пациентов (0,9%);
· у 11 пациентов (5,0%) была выявлена смешанная флора.
При выборе тактики хирургического лечения больных с глубокой парапротезной инфекцией анализировались сроки возникновения инфекции, степень стабильности компонентов эндопротеза и степень вирулентности возбудителя. Также немаловажную роль в выборе тактики оперативного лечения играли сопутствующая патология и желания самого пациента.
Одномоментное реэндопротезирование после удаления эндопротеза выполнялось пациентам без выраженной сопутствующей патологии, в раннем послеоперационном периоде (до 6 мес.), при отсутствии признаков нестабильности эндопротеза и в случае чувствительности флоры к возможному проведению антибиотикотерапии. В ходе данного вида оперативного лечения выполняли удаление эндопротеза, патологических грануляций мягких тканей и имплантировали новый эндопротез с добавлением в цемент антибактериальных препаратов, подобранных по чувствительности к флоре. В последующем проводили адресную антибиотикотерапию в течение 6 недель.
Этим способом были пролечены 28 пациентов. В 26 случаях инфекция была купирована. У двух пациентов наблюдался рецидив, потребовавший проведения двухэтапного ревизионного вмешательства. Таким образом, выживаемость имплантата составила 93%.
Клинический пример 1. Больная К., 62 года. Выполнено первичное эндопротезирование КС по поводу левостороннего гонартроза III ст.
Через 3 месяца после проведения оперативного лечения развилось осложнение в виде глубокой парапротезной инфекции. По результатам бактериологического исследования выявлен патогенный микроорганизм – MSSA. Больной выполнено удаление эндопротеза и одномоментное реэндопротезирование коленного сустава.
На контрольных осмотрах через 1 год, 3 и 5 лет признаков рецидива инфекции не было.
В зависимости от степени сохранности связочного аппарата устанавливался артикулирующий либо неартикулирующий спейсер с добавлением антибиотика по чувствительности бактериальной флоры. После первого этапа пациенты получали антибиотикотерапию в течение 6-8 недель. Второй этап лечения – удаление цементного спейсера и реэндопротезирование коленного сустава, проводился по истечении 3-8 месяцев при условии нормализации клинических анализов и отсутствии положительных бактериологических исследований пунктата синовиальной жидкости.
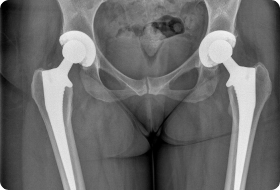
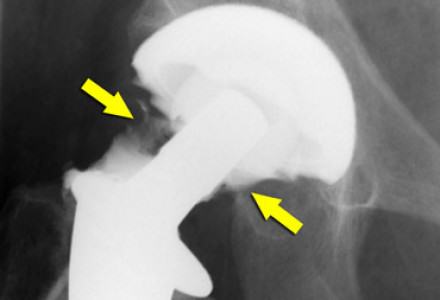
Клинический пример 2. Больная Г., 62 года. Первичное эндопротезирование коленного сустава было проведено по поводу гонартроза III ст. Через 3 года после проведенной операции перенесла рожистое воспаление голени, осложнившееся глубокой парапротезной инфекцией. По результатам бактериологического исследования был выявлен патогенный микроорганизм – MRSA. Больной было выполнено удаление эндопротеза, санация и имплантация цементного артикулирующего спейсера (рис. 1).
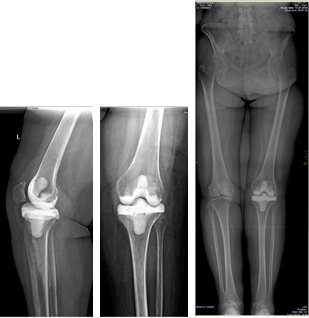
Рис. 1. Клинический пример 2. Рентгенограмма коленного сустава после
имплантации артикулирующего спейсера коленного сустава
Антибиотикотерапия поводилась в течение 6 недель. Через 6 месяцев, когда признаки инфекции были полностью купированы, больной выполнен второй этап оперативного лечения – удаление цементного спейсера и реэндопротезирование коленного сустава (рис. 2). На контрольных осмотрах через 1 и 3 года признаков рецидива инфекции не обнаружено.
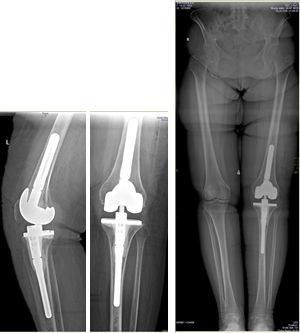
Рис. 2. Клинический пример 2. Рентгенограмма коленного сустава
после удаления спейсера и реэндопротезирования коленного сустава
За период наблюдения двухэтапное оперативное лечение было проведено 146 пациентам. У 124 пациентов признаки инфекции были купированы. Процедив отмечен у 22 пациентов. С целью купирования инфекционного процесса этим больным выполнялся артродез коленного сустава в аппарате внешней фиксации.
Первично артродез коленного сустава выполнялся пациентам с вирулентной флорой, на поддающейся антибиотикотерапии, с выраженной сопутствующей патологией, позволяющей оперировать пациента только по жизненным показаниям, и в случае желания пациента.
Клинический пример 3. Больная Л., 52 года. Первичное эндопротезирование коленного сустава было проведено по поводу вторичного артрозо-артрита коленного сустава III ст. на фоне ревматоидного полиартрита.
Через 6 месяцев после проведенного оперативного вмешательства у больной развилась глубокая парапротезная инфекция. Учитывая высокую активность основного заболевания, пациентка предпочла отказаться от дальнейших оперативных вмешательств, в связи с чем было выполнено удаление и артродез коленного сустава в аппарате внешней фиксации (рис. 3).
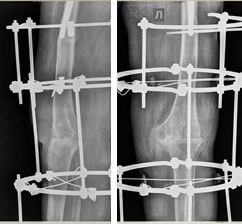
Рис. 3. Рентгенограмма коленного сустава после удаления эндопротеза и артродеза коленного сустава в аппарате внешней фиксации
По различным причинам артродез коленного сустава выполнялся в 66 случаях. В 54 случаях у пациентов сформировался костный анкилоз, и только в 12 случаях отмечалось формирование фиброзного анкилоза или неоартроза. Рецидива инфекции при выполнении артродеза коленного сустава зафиксировано не было.
Результаты. Таким образом, за 10 лет через отделение эндопротезирования коленного сустава Новосибирского НИИТО прошли 470 пациентов с парапротезной инфекцией. Эти пациенты получили следующее лечение:
- 252 (53,6%) пациентам с поверхностной инфекцией проведена вторичная хирургическая обработка, реимплантация эндопротеза не требовалась;
- 26 (5,5%) пациентам проведено одномоментное реэндопротезирование коленного сустава;
- 126 (26,8%) пациентов перенесли двухэтапное оперативное лечение;
- 66 (14,0%) пациентам по различным причинам выполнен артродез коленного сустава.
Ампутаций конечности и летальных исходов, вызванных инфекционным процессом, в отделении не отмечено.
Заключение. Инфекционные осложнения при первичном протезировании коленного сустава, невзирая на улучшение техники хирургического лечения и проводимой профилактики, остаются достаточно частыми и наиболее тяжелыми осложнениями. Как правило, они приводят к повторным оперативным вмешательствам, а зачастую и к инвалидизации пациентов. Обоснованный выбор хирургической тактики позволяет благополучно справиться с инфекционным осложнением и обеспечить пациенту приемлемое качество жизни.
Полная замена суставов от середины 60-х лет прошлого столетия стала самой популярной ортопедической операцией и является одним из самых успешных методов лечения целого ряда заболеваний, используемых ортопедами. Инфицирование тканей в области эндопротеза в связи со своими разрушительными последствиями представляет собой серьезную проблему. Несмотря на всевозможные профилактические меры при увеличении числа имплантаций, увеличивается и число инфекционных осложнений.
В 1969 году сообщалось о 9% появления инфекционных осложнений при заменах тазобедренного сустава. Благодаря современному подходу к операции сегодня частота возникновения глубокой инфекции снизилась до 1-2 % при заменах тазобедренного и коленного суставов.
Тем не менее, в случае ревизионной (повторной) операции ТБС появление воспалительных осложнений увеличивается на 4-11,8 %. Это связано со сложностью и объемом вмешательства, необходимостью использования костных лоскутов, ревизионного имплантата и наличием скрытой инфекции при реимплантации по причине асептической нестабильности.
Пациентам, перенесшим несколько операций по эндопротезированию, может грозить гематогенный перенос инфекции с пораженного протеза на здоровый в случае, если инфекция не будет вылечена как можно быстрее.
Подобная ситуация встречается не так уж и часто, но указывает на то, что инфекции искусственного сустава у пациентов с более, чем одним протезом, должны лечиться быстро и радикально.
Факторы риска
Риск возникновения инфекционных осложнений после операции замены тазобедренного сустава зависит от многих факторов. Влияние оказывают как системные, так и локальные причины. Высокий риск инфекции наблюдается у пациентов, имеющих в анамнезе септический артрит сустава или рожистое воспаление нижней конечности в случае эндопротезирования коленного сустава. Вследствие очень высокого риска гематогенной инфекции хронический остеомиелит является относительным противопоказанием к операции.
К системным факторам относятся прежде всего характер питания, как недоедание, так и избыточный вес, хронические дефекты иммунитета, алкоголизм, состояние после пересадки почек, диабет, повторные инфекции мочеполовой системы, опухоли, лечение иммуносупрессантами и кортикоидами.
На местном уровне большое влияние имеет количество предшествующих операций на данном суставе. Менее важным фактором является способ проведения операции с учетом лишения тканей жизнеспособности, продолжительность операции, использованный тип протеза и качество шва.
Нельзя забывать и о типе операционной, используемой воздухотехнике и соблюдении санитарных правил. В послеоперационном периоде играют роль медленное заживление раны, гематома, дегисценция (расхождение краев раны), поверхностная инфекция раны. В группе риска находятся пациенты с ревматоидным артритом. Механизм, объясняющий повышенную частоту возникновения инфекционных осложнений при хроническом артрите описан неточно. Стандартной частью предоперационной подготовки у больных ревматоидным артритом должна быть отмена метотрексата за несколько недель перед плановой операцией и изменение лекарственной поддержки после консультации с ревматологом.
- Тип I. Ранняя острая инфекция возникает в первом, максимально во втором месяце после операции. Вызывается очень вирулентными штаммами. Состояние острое. Часто возникают системные признаки.
Первым признаком является повышение температуры тела в вечернее время, позже постоянная не очень высокая температура.

Местные признаки — покраснение, отек, припухлость, повышенная температура и выраженная болезненность. Может быть гнойное отделение из раны и/или из полости сустава.
- Тип II. Поздняя скрытая хроническая инфекция возникает вследствие заражения мало вирулентными микроорганизмами в ходе операции. Из-за мало вирулентности симптомы инфекции проявляются постепенно. Обычно спустя 6-12 месяцев обнаруживается ограничение подвижности и болезненность. Местно ничего не обнаруживается, поэтому инфекция часто ошибочно диагностируется и безуспешно лечится как асептическая нестабильность эндопротеза.
- Тип III. Поздний гематогенный эффект вызван инфекцией до того момента здорового протеза сустава. Обычно возникает через 2 года и больше после операции. Возбудитель проникает в здоровый сустав через кровь. В большинстве случаев после повышения температуры тела возникает ограничение функции сустава, боль, локальное покраснение, припухание и местное повышение температуры.
Согласно данной классификации разделяются и профилактические мероприятия. Возникновение острой и скрытой инфекции напрямую зависит от операционного вмешательства. Однако гематогенная инфекция уже никак не связана с операцией, поэтому в профилактике следует придерживаться совершенно других мер.
Профилактика поздних гематогенных инфекций
С течением времени достигается состояние равновесия, пациент сживается с имплантатом, поэтому такое серьезное осложнение, как поздняя гематогенная инфекция является для пациента шоком. Система профилактики подобных осложнений на данный момент не так хорошо проработана, как, например, в кардиологии у пациентов с искусственными клапанами. Профилактический прием антибиотиков сопряжен с большими рисками. Речь не идет только о финансовой стороне вопроса, но, главным образом, о возникновении резистентных штаммов бактерий, аллергических реакций или дополнительных побочных эффектов.
Самой большой проблемой является сложность выявления зависимости между бактериями и глубокой инфекцией аллопластики. В случае инфекции Streptococcus viridans или пептострептококками связь с ротовой полостью была статистически подтверждена. Об инфекциях, вызванных Staphylococcus aureus нельзя однозначно сказать, что они вызваны микрофлорой ротовой полости.
Бактерии возникают не только при рутинных стоматологических процедурах, но и в случае инфекций ротовой полости как таковых, поэтому нельзя пренебрегать гигиеной полости рта.
Антибиотикопрофилактика при стоматологических процедурах обычно не используется у всех пациентов с протезами суставов, но требуется при вмешательствах, где есть риск бактериемий, как например, удаление зубов, хирургические операции десен, хирургическое удаление задержавшихся молочных зубов, установка зубных имплантатов, мероприятия в апикальном пространстве зуба, установка ортодонтических систем, местная интралигаментарная анестезия, чистка зубов и имплантатов с предполагающимся кровотечением.
Гинекологические и акушерские операции относятся к классу операций по степени бактериальной контаминации с риском септическо-воспалительных осложнений 10-40%. Гинекологические процедуры с риском бактериемии — это абдоминальная, вагинальная и лапароскопическая гистерэктомия (удаление матки), онкологические операции, контаминированные вагинальной флорой, операции по реконструкции, операции дефектов тазового дна, связанных с недержанием мочи, использование ксенотрансплантатов. Из акушерских операций в группе риска, прежде всего, кесарево сечение.
В целом, можно сказать, что антибиотикопрофилактика не показана всем урологическим больным с заменой сустава, а только узкой, ясно охарактеризованной группе лиц, и у относительно малого количества процедур и ситуаций, при которых риск гематогенной инфекции значительно повышен.
К урологическим процедурам с риском бактериемии относятся операция простаты (полостная и эндоскопическая), операция опухоли мочевого пузыря (полостная и эндоскопическая), операции мочевых камней (полостные и эндоскопические), экстракорпоральная литотрипсия (дробление камней без разрушения кожи) и биопсия простаты. Бывают и ситуации в урогенитальном тракте, сопряженные с высоким риском бактериальной колонизации. Наиболее часто встречается мочевой катетер или интермиттирующая (периодическая) катетеризация, стент уретры, задержка мочи, инфекция мочевого тракта или воспаление простаты.
В настоящее время общая хирургия имеет широкий спектр значительно отличающихся острых и хронических состояний. Необходимость профилактического приема антибиотиков у пациентов с искусственным клапаном сердца широко известна, однако такие пациенты встречаются нечасто. Напротив, пациенты с заменой сустава, чаще тазобедренного или коленного, попадают в отделения общей хирургии практически ежедневно.
Знания о назначении антибиотикопрофилактики этой группе людей и о возможных рисках поздней гематогенной инфекции иплантата среди хирургов достаточно малы. В отличие от инвазивных стоматологических и урологических операций риск бактериемии при операциях на пищеварительном тракте ниже.
В области общей хирургии профилактическое назначение антибиотиков, помимо ситуаций, где терапия антибиотиками очевидна, показано в случаях развернутой формы острого аппендицита, перипроктального абсцесса, инвазивных эндоскопических операциях на толстом кишечнике, флегмонах и абсцессах мягких тканей и при хирургическом лечении трофических язв нижних конечностей и ампутации конечностей.
В настоящее время уже встречаются пациенты, которые после эндопротезирования решаются на такие инвазивные процедуры, как пирсинг или татуировки, в том числе и в опасной области гениталий. В таких случаях рекомендуется такой же прием, как и в случае профилактики эндокардита или у пациентов с иплантатом сустава в группе риска. Необходимо не только принимать антибиотики перед процедурой, но и тщательно лечить гнойные осложнения.
При выборе необходимо исходить из наличия наиболее частых возбудителей инфекционных осложнений эндопротеза сустава с учетом локализации и нормальной микрофлоры области, которая подвержена риску с точки зрения возможной бактериемии.

Учитывая то, что предпочтительный способ приема per os, препарат должен иметь высокую биодоступность, стабильный уровень в сыворотке крови, дальнейшие фармакокинетические характеристики, важные с точки зрения профилактики инфекции. Препарат для профилактического приема должен быть минимально токсичным.
Рекомендуется принимать перорально амоксициллин 2 г (или цефалексин) за час до операции или клиндамицин 600 мг per os, инравенозно ампициллин 2 г или цефазолин 1 г за полчаса до операции. В случае аллергии на пенициллиновый ряд — клиндамицин 600 мг за полчаса до операции.
Заключение
Необходимо подчеркнуть, что задача врача — не навредить пациенту. Мы должны иметь в виду, что не использование профилактического приема антибиотиков перед рискованной операцией может оказать значительное влияние на дальнейшую жизнь пациента. Лечение гематогенной инфекции подразумевает повторные реоперации, назначение высоких доз антибиотиков и, не в последнюю очередь, долговременную госпитализацию с вероятностью заразиться резистентными, тяжело излечимыми штаммами бактерий, и все это с неоднозначным результатом.
Антибиотикопрофилактика, несомненно, довольно дорога, но инфекционные осложнения эндопротеза являются настолько серьезными, что на этом нельзя экономить. Применение антибиотиков в этом случае, однако, должно имеет рациональный подход, нельзя использовать антибиотики долгое время после операции только для того, чтобы чувствовать себя спокойно. Такой подход, согласно цитируемым статьям, не только не снижает частоту инфекционных осложнений, но и ведет к возникновению и распространению резистентных бактериальных штаммов, а также к давлению со стороны руководства в виде уменьшения финансирования антибиотикопрофилактики и лечения в связи с повышением расходов на антибиотики.
Лечение пациента с помощью эндопротезирования сустава не заканчивается снятием швов. Необходимо относиться ответственно к обеспечению как можно более лучшего и долгого функционирования имплантата. Профилактика инфекционных осложнений, несомненно, рассматривается врачами разных специализаций, конкретный специалист должен всегда ответственно подходить к оценке ситуации пациента. Большую помощь оказывает знающий и коммуникативный пациент. Антибиотикопрофилактика поздней гематогенной инфекции не показана по умолчанию всем пациентам с аллопластикой, а только узкой, определенной группе людей с высоким риском. Тем не менее, у таких пациентов профилактический прием антибиотиков с точки зрения современной медицины необходим.
Похожие темы научных работ по клинической медицине , автор научной работы — И. И. Кузьмин, И. Ф. Ахтямов
Профилактика инфекционных осложнений при эндопротезировании тазобедренного сустава
И.И. Кузьмин, И.Ф. Ахтямов
Prevention of infection complications in the hip endoprosthetics
I.I. Kuzmin, I.F. Akhtiamov
Казанский государственный медицинский университет, Приморская краевая клиническая больница, Владивосток, Россия
Эндопротезирование суставов имеет более чем 50-летнюю мировую историю, но для России данная проблема достаточно нова, и состояние эндо-протезирования можно оценить как этап становления и все более широкого клинического внедрения. Ежегодно в мире выполняется более 500 тысяч операций эндопротезирования суставов, из них около 200 тысяч в США. По данным Н.М. Корнилова (1997), ежегодная потребность в эндопротезировании в России составляет 300 тысяч в год, но делается чуть больше 3 тысяч. Принята Российская программа эндопротезирования, головным институтом назначен Российский НИИТО им. Вредена (С.-Петербург), согласно расчетам которого в России на 10000 населения в эндопротезировании нуждается 30 человек [1].
Широкое внедрение операций эндопротези-рования в практику тормозилось двумя факторами: состоянием качества имплантатов и высоким риском осложнений, палитра которых очень разнообразна [4]. Если первую проблему сейчас можно решить, используя современные импортные эндопротезы с высочайшей степенью гарантии их качества, то второй фактор -риск осложнений - продолжает висеть "домок-ловым мечом" над хирургом. Одной из наиболее значимых групп осложнений являются инфекционные, ввиду своей высокой частоты, непредсказуемости возникновения и течения, тяжести последствий [9]. Высокая вероятность инфицирования обусловлена тем, что эндопротез, как и любой другой абиогенный материал, лишен естественной, иммунной защиты, осуществляемой главным образом системой мононуклеарных фагоцитов (макрофагов), что облегчает микроорганизмам его колонизацию [10].
В последнее время благодаря бурному развитию методов молекулярной биологии и их внедрению в клиническую медицину наметился значительный прогресс в диагностике инфекций, понимания их патогенеза и значения в развитии нестабильности эндопротеза. Применение нового диагностического метода - полимераз-ной цепной реакции показало, что % удаленных
при ревизии эндопротезов являются инфицированными [13, 16, 18, 19, 24], в то время как традиционные методы выявляют менее 10% инфицированных имплантатов [9]. Также было показано, что персистирующие на поверхности им-плантата микроорганизмы в результате контакта с рецепторами макрофагов, окружающих эндо-протез, стимулируют выработку ими провоспа-лительных цитокинов: interleukin 1р (1L-1P), tumor necrosisi factor а (TNF-а), tenascin-C и т.д., которые вызывают индукцию костной резорбции [8, 20]. Таким образом, персистирую-щая инфекция является главной причиной развития нестабильности эндопротеза [24].
Все это имеет особое значение и в связи с тем, что организм человека подвержен риску транзи-торной бактериемии. Транзиторная бактериемия является постоянным фактором жизни организма и постоянно возникает даже в физиологических условиях путем попадания в кровоток микроорганизмов из нестерильных полостей организма, главным образом из желудочно-кишечного тракта, дыхательной и мочеполовой систем. Особенно интенсивной она бывает при проведении в этих областях различных вмешательств: стоматологических, хирургических, урологических, гинекологических, эндоскопических и т.д. [22]. Поэтому можно выделить 2 периода максимума возможных инфекционных осложнений, которые необходимо учитывать: ранний и поздний. Ранний период -микроорганизмы проникают во время операции и колонизируют эндопротез. Поздний - колонизация эндопротеза связана с эпизодами транзитор-ной бактериемии.
Большинство современных классификаций предполагает выделение следующих групп инфекционных осложнений [9, 23, 26]:
1) поверхностные - распространяющиеся не глубже фасции, при этом имплантат не включается в очаг инфекции;
2) глубокие - распространяющиеся глубже фасции, при этом имплантат вовлекается в инфекционный очаг.
По времени возникновения:
1) ранняя послеоперационная инфекция - возникает в течение одного месяца после операции;
2) поздняя хроническая инфекция - возникает позднее одного месяца с момента операции;
3) острая гематогенная инфекция - характеризуется острым началом на фоне хорошо функционирующего имплантата.
Поверхностная инфекция по этиологическим и патогенетическим характеристикам не отличается от поверхностных инфекций в других областях хирургии. Особенностью является высокий риск перехода в глубокую.
Ранняя послеоперационная инфекция является результатом инфицирования послеоперационной гематомы или окружающих эндопротез мягких тканей и не имеет существенных отличий от глубоких инфекций в других областях хирургии.
Специфическими для эндопротезирования являются инфекции, связанные с колонизацией микроорганизмами имплантата, независимо от пути проникновения возбудителя, времени возникновения и выраженности клинических проявлений [10].
Глубокая инфекция, развивающаяся после тотального эндопротезирования тазобедренного сустава, остается самым опасным и трудным для лечения осложнением. Сообщается, что частота глубокой инфекции при эндопротезирова-нии тазобедренного сустава колеблется в пределах 0,2-2,3% [21]. Лечение инфицированных эндопротезов требует многочисленных хирургических процедур, длительной антибиотикоте-рапии и пролонгированной госпитализации [14]. Все это, учитывая сложившиеся новые экономические условия, приводит к увеличению затрат на лечение. Поэтому профилактическим мероприятиям при эндопротезировании должно уделяться первостепенное внимание.
Для адекватного прогноза возникновения инфекционных осложнений необходима оценка факторов риска.
Н.В. Корнилов с соавт. (1997) выделяет следующие факторы риска осложнений: 1) пожилой возраст; 2) избыточный вес; 3) наличие дистантных очагов хронической инфекции; 4) нарушение свертывающей системы крови; 5) почечная недостаточность; 6) белковое истощение; 7) сахарный диабет; 8) гормональная терапия; 9) склонность к аллергическим реакциям; 10) воспалительные заболевания сосудов нижних конечностей; 11) предшествующие операции в этой области; 12) внутрисуставные инъекции; 13) большой предоперационный койко-день; 14) длительность операции свыше 3-х часов; 15) кровопотеря более 1000 мл; 16) дополнительное использование биологических и не-биологичских материалов: 17) малый опыт хирурга; 18) неблагоприятное санитарное состояние лечебного учреждения и операционной.
Мы посчитали необходимым выделить отдельно факторы риска возникновения инфекционных осложнений.
1) снижение иммунологической реактивности:
а) первичные иммунодефициты (генетически детерминированные особенности иммунного ответа, главным образом его фагоцитарного и клеточного компонентов, которые имеют наибольшее значение в местной противоинфекционной защите);
б) вторичные иммунодефициты (пожилой возраст; сахарный диабет; аутоиммунные заболевания, которые часто сопровождаются деструктивными артритами: ревматоидный артрит, серонегативные спондилоартриты, СКВ, псориаз; гормональная и (или) иммуно-депрессивная терапия, тяжелые хронические заболевания [3];
2) повышенный риск транзиторной бактериемии:
а) очаги хронической инфекции;
б) инвазивные манипуляции (стоматологические, эндоскопические, установка ЭКС, катетеризация центральных вен, мочевого пузыря, дренирование раны).
1) состояние регионарного кровообращения (заболевания сосудов нижних конечностей, например: облитерирующий атеросклероз, облитерирующий эндартериит, системные васкулиты и др.);
2) предшествующие операции на тазобедренном суставе.
1) большая длительность предоперационной госпитализации;
2) распространенность госпитальных штаммов;
3) вероятность интраоперационной контаминации.
1) длительность операции;
3) технические трудности;
4) осложнения при проведении анестезиологического пособия;
5) качество гемостаза;
6) адекватность дренирования.
При эндопротезировании имеется ряд специфических особенностей, предрасполагающих к развитию инфекционного процесса: 1) особенности иммунного статуса:
а) индуцированный вторичный иммунодефицит: высокотравматичное продолжительное вмешательство с попаданием в системный кровоток большого количества пептидных фрагментов разрушенных тканей, которые взаимодействуют со специфическими скавенджер рецепторами макрофагов (служащими для удаления этих фрагментов из тканей). Макрофаги акти-
вируются и синтезируют противовоспалительные цитокины (IL-1ß; TNF-a); y-IFN), развивается системный воспалительный синдром, что приводит к состоянию иммунопаралича (Immunjparalysis) - неспособности к адекватным ответным реакциям: активированные макрофаги не способны презентировать антиген (Ag) Т-лимфоцитам.
Дисбаланс регуляторных сингалов: преобладание активационных сигналов (IL-1; y-IFN) над дифференцировочными (IL-2; 11-4), что приводит к снижению (параличу) как клеточного, так и гуморального ответа [25];
б) местный иммунопаралич вызван теми же патогенетическими механизмами, что и общий: связан с местным действием продуктов деструкции тканей;
в) вторичные иммунодефициты. Операция эн-допротезирования обычно производится у больных пожилого возраста, часто имеющих тяжелые сопутствующие заболевания, значительно снижающие возможности местной иммунной системы, такие как сахарный диабет. Многие больные длительно получают иммуносупрессив-ную терапию в связи с системными воспалительными заболеваниями;
2) наличие имплантата, лишенного иммунной защиты;
3) крайне низкое пороговое число микроорганизмов (около 100 на 1 грамм ткани), достаточное для инфицирования имплантата;
4) особенность микрофлоры: в связи с им-муносупрессией, как местной, так и общей, значительно облегчается колонизация имплантата микроорганизами, которой и должна противодействовать иммунная система. Поэтому возможность колонизировать имплантат получают условно патогенная флора и сапрофиты (Staph. epidermidis; E. faecalis; Enterobacter; Citrobacter; Proteus morganii; rettgeri; Providencia; Serratia; Pseudomonas), причем всегда в самых различных сочетаниях. Этиологическая структура инфекционных осложнений, согласно данным Morrey B.E. (1996), представлена на рис. 1 [11]:
I SCN - Staph коагулазонегативные SA - Staphylococcus aureus M - микс-инфекция GNR - Гр(-)палочки CN - Негативные культуры SC - Стрептококки ANA - Анаэробы ENC - энтерококки GPB - Гр(+)бактерии
Рис. 1. Микроорганизмы, выделенные в 781 случае инфекционных осложнений при тотальном эндопротезировании тазобедренного сустава, проанализированных в клинике Mayo с 1969 по 1991.
Эти микроорганизмы характеризуются крайне плохим ростом на типичных питательных средах, высокой распространенностью и часто встречающейся антибиотикорезистентностью (это типичные госпитальные патогены), причем антибиотикорезистентность совершенно непредсказуема - быстро изменяется и распространяется [7].
В связи с вышеизложенным большое значение придается профилактическим мероприятиям, которые по преследуемым целям могут быть классифицированы следующим образом:
1) мероприятия, уменьшающие контаминацию операционной раны:
а) предоперационные - подготовка операционного поля (аппликации антибиотикосодер-жащих мазей, обработка операционного поля непосредственно перед началом операции);
б) интраоперационные - оптимизация режима стерильности;
в) использование закрытых систем дренирования;
г) правильное послеоперационное ведение кожного разреза;
2) эрадикация микроорганизмов, контами-нировавших операционную рану:
а) неадгезированных к биосубстратам:
- интраоперационное промывание раны и послеоперационное дренирование;
- использование антисептиков (лавасепт);
- местное использование нереабсорбирующих-ся антибиотиков: бацитрацин, мупироцин, полимиксин;
б) адгезированных к биосубстратам:
- местное использование биодеградируемых антибиотиковысвобождающих систем;
в) адгезированных к поверхности трансплантата:
- использование антибиотикоимпрегнирован-ных цементов;
3) предотвращение гематогенного инфицирования имплантата:
- проведение антибиотикопрофилактики при инвазивных манипуляциях (стоматологические, эндоскопические и т.д.).
Мы считаем целесообразным проведение следующего комплекса профилактических мероприятий:
I. Предоперационное воздействие на факторы риска:
1) все больные проходят тщательное обследование для выявления факторов риска;
2) выявление и санация всех существующих и вероятных очагов инфекции;
3) для больных сахарным диабетом - достижение устойчивой компенсации гипергликемии, что подтверждается уровнем глико-зированного гемоглобина не более 5% [2];
4) для больных с аутоиммунными заболева-
ниями - коррекция иммуносупрессивной терапии с исключением непрерывного применения глюкокортикостероидов;
5) для больных с сосудистыми заболеваниями нижних конечностей - обеспечение адекватного кровоснабжения зоны операции консервативными или оперативными мероприятиями;
6) для больных с другими хроническими заболеваниями - достижение состояния стабильной компенсации;
7) уменьшение длительности предоперационной госпитализации;
8) раздельная госпитализация с инфицированными больными и больными, получающими любую антибактериальную терапию.
II. Интраоперационные мероприятия:
1) использование наименее травматичного переднего доступа;
2) максимальное сокращение времени операции;
3) щадящее обращение с тканями;
4) тщательный текущий и заключительный гемостаз;
5) аккуратное ушивание тканей с предотвращением образования свободного пространства;
6) дренирование всех возможных мест образования гематомы;
7) использование подкожного шва для предотвращения инфицирования глубоких слоев раны микроорганизмами кожных покровов, распространяющимися вдоль лигатур;
8) использование биодеградируемых монофла-ментных синтетических нитей как менее ре-актогенных, что снижает вероятность инфицирования швов;
9) заполнение кожной раны антибиотикосодер-жащей мазью - 2% мупироцин (бактробан);
10) наложение адгезивной асептической повязки. Ш. Мероприятия, направленные на уменьшение контаминации операционной раны.
Мы считаем достаточным использование общепринятых схем операционной гигиены. Так, применение ламинарного потока воздуха не снизило количество инфекционных осложнений по сравнению с антибиотикопрофилактикой [9].
Любая антибиотикопрофилактика ставит задачу снизить количество микроорганизмов, контамини-рующих операционную рану ниже порога возникновения клинически значимого инфекционного процесса. Поскольку эндопротез является абиогенным материалом, то это критическое количество крайне мало (менее 100 микроорганизмов на 1 грамм ткани). Количество микроорганизмов, попадающих в рану, никакими методами невозможно снизить до уровня, менее указанного. Следовательно, операция эндопротезирования является заведомо инфицированной, что определяет необходимость проведения интенсивной и длительной анти-биотикопрофилактики [6, 7].
Весь возможный спектр возбудителей (т.е.
каждый из возможных возбудителей) должен быть перекрыт двумя антибиотиками. Это предотвращает развитие резистентности, так как ее развитие одновременно к двум антибиотикам менее вероятно [12].
Клиндамицин высокоактивен преимущественно против грамположительных, нетилмицин
- грамотрицательных, цефоперазон действует и на Гр(+) и Гр(-). Все они действуют на наиболее частый возбудитель - стафилоккок. Поэтому даже при развитии резистентности 50% штаммов к каждому антибиотику итоговая чувствительность составит 87,5%, что клинически допустимо.
Клиндамицин: антибиотик группы ликоза-мидов. К нему чувствительны Гр(+) аэробы (Staphylococcus, Streptococcus), анаэробы. Преимущества: 1) нет перекрестной резистентности с ß-лактамами; 2) из всех антибиотиков, действующих на Гр(+) микроорганизмы, является самым активным после гликопептидов; 3) уникальная особенность препарата - способность накапливаться в костной ткани в концентрациях, недостижимых любыми другими антибиотиками; 4) фармакокинетика: выводится печенью
- не требуется коррекции дозы при хронической почечной недостаточности; 5) не кумулирует; 6) совместимость в растворе с аминогликозида-ми и ß-лактамами (но не одновременно!).
Равновесная концентрация в плазме - после 5-го приема per os. Для насыщения костной ткани необходимо принимать не менее 3-х дней.
Цефоперазон - цефалоспорин III поколения (С3):
1) наиболее широкий спектр действия из всех С3 (цефтриаксон не действует на Гр(-), цефтазидим не действует на Гр(+);
2) и отличие от цефалоспоринов II поколения (С2) активен против Гр(-);
3) часто встречающееся утверждение о том, что С3 менее активны в отношении Гр(+), чем С2, клинически неверно: речь идет о мПК (минимальная подавляющая концентрация) - количественной характеристики чувствительности. Действительно, МПК С2 Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Совместим в растворе с клиндамийцином ^ в одной капельнице.
Мы считаем оптимальным внесение по 2 г каждого препарата на 100 г цемента. Доказано, что такие количества антибиотиков не оказывают влияния на механические характеристики цемента.
Использование цемента, содержащего большие количества антибиотиков, обеспечивающее длительное поддержание бактерицидных концентраций антибактериальных препаратов на его поверхности, дает возможность отказаться от применения профилактической антибиотикотерапии
при любых инвазивных манипуляциях.
Считаем, что при таких травматичных операциях, как эндопротезирование крупных суставов, комбинированная направленная антибиоти-копрофилактика оправдана и дает хороший клинический результат. Тем не менее антибио-тикопрофилактика не должна подменять хирургическую технику, асептику и антисептику, тщательную предоперационную подготовку и грамотное послеоперационное ведение раны.
2. Кулешов Е.В., Кулешов С.Е. Сахарный диабет и хирургические заболевания. - М.: Воскресенье, 1996. - 256 с.
3. Пучиньян Д.М., Сисакян М.С. Факторы риска развития послеоперационных осложнений у больных коксартрозом // Травматол. ортопед. России. - 1995. - № 1. - С. 8-11.
4. Bono J.V. et al. Revision total hip arthroplasty / J.V. Bono, J.C. McCarthy, T.S. Thomhill et al. - New York: Springer, 1999.
5. Pharmacokinetics, uses, and limitations of vancomycin-loaded bone cement / М. Chohfi, F. Langlais, J. Fourastier et al. // Int. Orthop. -
1998. -Vol. 22, No. 3. P -171-177.
6. Drangsholt M.T. Current concepts review. Prophylactic use of antibiotics for procedures after total joint replacement // J. Bone Jt. Surg.
- 1998. - Vol. 80-A, No. 9. - P. 1394 -1395.
7. Evolution of bacterial virulence and antibiotic resistance [Multi-author Review] // Cell. Mol. Life Sci. - 1999. - Vol. 56, No. 9-10. - P. 717-787.
8. Adhesion molecules in tissue injury: kinetics of expression and shedding and association with cytokine release in humans / К. Fassbender, S. Kaptur, P. Becker et al. // Clin. Immunol. Immunopathol. - 1998. - Vol. 89, No. 1. - P. 54-60.
Читайте также:


