Инфекционные заболевания современные подходы к диагностике и лечению
Инфекционные заболевания человека представляют собой группу болезней, вызываемых специфическими болезнетворными возбудителями, которые могут передаваться от зараженного человека здоровому. Для каждой инфекции характерен свой возбудитель и определенный путь передачи. Возбудителями инфекций могут быть бактерии, вирусы, риккетсии (микроорганизмы, сочетающие в себе особенности бактерий и вирусов), спирохеты, грибки, протозойные (паразитирующие простейшие, одноклеточные), глисты, которые выводятся из организма больного человека или животного при выдохе, мочеиспускании, дефекации, кашле, рвоте, и когда при определенных условиях этот биологический патологический материал становится источником заражения здорового человека. Известны инфекционные болезни, вызываемые, так называемыми арбовирусами – вирусами, передающимися людям через укусы насекомых: например клещей, комаров, блох и др. Согласно литературным данным в настоящее время известно 1415 возбудителей инфекционных и паразитарных болезней. Наиболее обширную группу составляют болезни, вызываемые бактериями и риккетсиями (538 нозологий). Второе место принадлежит паразитарным болезням - 353 нозологии. Вирусные инфекции составляют 217 нозологий. Постоянно возникают новые или впервые выявленные инфекционные заболевания. Так, начиная, с 1970-х годов ежегодно регистрируется, по крайней мере, одно инфекционное заболевание. За последние годы стали известны более 30 инфекционных заболевании, это и ВИЧ, легионеллез, эпидемический ротавирусный гастроэнтерит и ряд африканских лихорадок (например лихорадка Эбола).
Инфекционные заболевания вызывают у пациента значительные изменения в картине крови. При многих инфекционных болезнях изменяется функция различных внутренних органов – печени, сердца, легких, мозга, почек, кишечника. Практически все инфекционные заболевания протекают с изменениями широкого спектра биохимических параметров, отражающих различные стороны патогенеза. Установлено также, что, к примеру, вирусы краснухи, герпеса, коксаки, полиомиелита, цитомегаловирус и эховирусы (род энтеровирусов) могут вызывать серьезные нарушения в развитии плода и новорожденного.
Диагноз инфекционного заболевания основывается на анамнезе больного, эпидемиологическом анамнезе, включает инструментальные методы обследования и, как правило, диагностика инфекционных заболеваний не обходится без использования комплекса лабораторных методов.
Диагностика инфекционного заболевания начинается с базовых лабораторных методов исследования. Это:
1. клинический анализ крови;
2. общий анализ мочи является лабораторным тестом, который часто используется при исследования инфекционных заболеваний не только почек, но и инфекций другой локализации. Так некоторые инфекционные заболевания сопровождаются протеинурией нефротического типа (количество белка в моче не менее 3г/л). Например хронические инфекционные заболевания могут стать причиной нефротического синдрома. Развитие протеинурии нефротического типа могут вызвать, например, бактериальный эндокардит, туберкулез, сифилис, лепра, гепатит В и С, мононуклеоз, цитомегаловирусная инфекция, ветряная оспа, малярия, токсоплазмоз, шистосомиаз. Появление в моче бактерий и возникновение воспаления указывает на наличие инфекционного заболевания мочеполовой системы.
3. Достаточно эффективным при инфекционных заболеваниях является использование комплекса биохимических тестов, поскольку количественные и качественные изменения биохимических показателей в крови, происходящие во время болезни, отражают происходящие при заболевании биохимические нарушения и позволяют следить за динамикой патологического процесса и адекватностью лечения. К таким эффективным биохимическим параметрам, относится – спектр белков сыворотки крови (белки острой фазы), ферменты и некоторые другие биохимические показатели.
Также, в арсенале специалистов в настоящее время есть новейшие, появившиеся в последние десятилетия и нашедшие широкое применение в практике, разнообразные методы лабораторной диагностики.
Клиническая лабораторная диагностика является наиболее динамично развивающейся отраслью медицины, активно внедряющей и использующей современные научные достижения. Для оценки морфофункционального состояния отдельных органов и систем, диагностики многих болезней используют сотни различных лабораторно-клинических показателей (тестов). Глубина познания физиологических и патологических процессов, диагностическая значимость и надежность исследований зависят от правильности подбора лабораторно-клинических показателей.
В диагностике инфекционных болезней используют многочисленные лабораторно-инструментальные методы, среди которых важнейшее место занимают специфические методы (бактериологический, вирусологический, паразитологический, серологический), имеющие целью установление этиологического (нозологического) диагноза.
Материал для специфических методов исследования в зависимости от характера, формы и периода болезни может быть самым разнообразным: кровь, цереброспинальная жидкость, мокрота, фекалии, моча, дуоденальное содержимое, пунктаты и биоптаты органов, рвотные массы, отделяемое язв, смывы со слизистых оболочек, трупный материал.
Паразитологическое обследование основано на микроскопии толстой капли и мазков крови (при малярии), мазков крови и пунктатов лимфатических узлов (при трипаносомозе, токсоплазмозе), кала (при амебиазе, балантидиазе), испражнений и дуоденального содержимого (при лямблиозе).
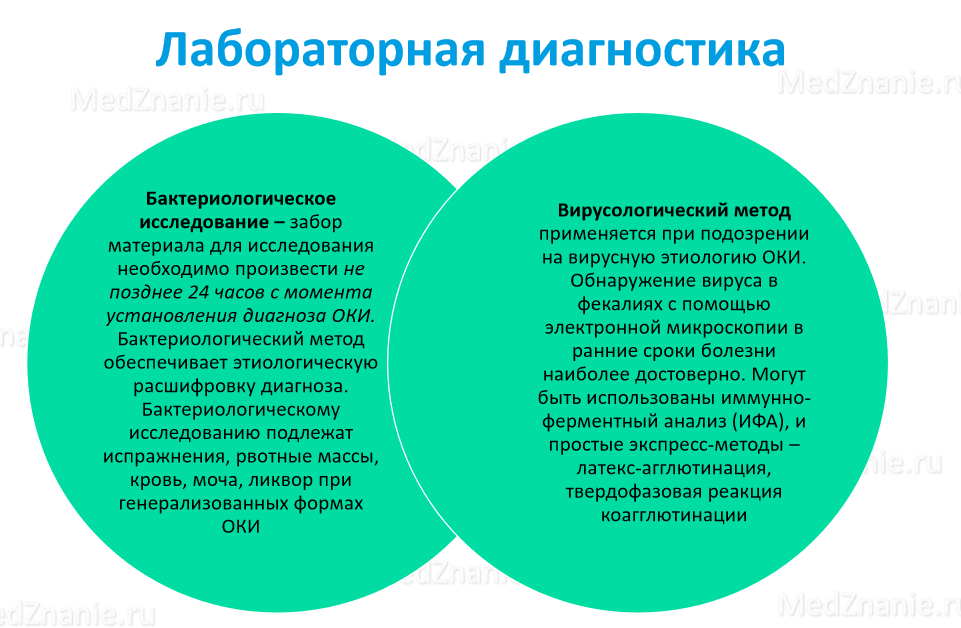
Бактериологическое исследование включает посев материала, взятого у больного на питательные среды, выделение чистой культуры возбудителя и его идентификацию. Определение типовой принадлежности микроба-возбудителя имеет эпидемиологическое значение при выявлении источника инфекции.
Вирусологическая диагностика по сравнению с бактериологической более сложна и трудоемка, что связано с особенностями биологии вирусов. Среди них наиболее важной является облигатный внутриклеточный паразитизм вирусов, что и накладывает отпечаток на методы их выделения с использование тканевых культур или куриных эмбрионов.
Иммунологические методы применяются для определения неизвестных антигенов (АГ) с помощью известных антител (АТ), содержащихся в иммунных диагностических сыворотках, а также для серологической диагностики—определения неизвестных АТ с помощью известного АГ-диагностикума. В настоящее время существует множество методик, в основе которых лежат указанные принципы. К наиболее известным и широко распространенным иммунологическим методам относятся:
- Реакция агглютинации (РА)
- Реакция непрямой (пассивной) агглютинации (РНГА/РИГА)
- Реакция преципитации (РП)
- Реакция иммуноэлектрофореза (РИЭФ)
- Реакция связывания комплемента (РСК)
- Реакция иммунофлюоресценции (РИФ)
- Иммуноферментный анализ (ИФА)
Указанные методы давно применяются для диагностики инфекционных заболеваний и прочно вошли в медицинскую практику. В настоящее время на базе этих, уже ставших классическими, методов разработаны современные методики, такие как латекс-агглютинация, иммунохроматографические тесты, позволяющие быстро получать результаты. Достижением последнего десятилетия стало создание различных приборов, обеспечивающих автоматизацию процессов выполнения и анализа результатов исследований.
- Латекс-агглютинация (РЛА) – агглютинация антителами частиц латекса, на поверхности которых адсорбирован антиген или гаптен. Для постановки РЛА применяют сенсибилизированные частицы полистирольного латекса, которые в присутствии гомологичного реагента склеиваются. Обычно эта реакция проходит очень быстро (3-8 минут), что позволяет применить ее в качестве экспресс-метода для выявления антигенов и антител. Преимущество РЛА в том, что частицы латекса в отличие от эритроцитов не имеют перекрестно реагирующих антигенов, поэтому она специфичнее РНГА.
- Иммунохроматографический анализ (ИХА) – метод определения наличия определенных концентраций вещества в биологических материалах (моча, цельная кровь, сыворотка или плазма крови, слюна, кал и т.д.). Данный вид анализа осуществляется при помощи индикаторных полосок, палочек, панелей или тест-кассет, которые обеспечивают быстроту проведения тестирования. ИХА – сравнительно молодой метод анализа, он часто обозначается в литературе также как метод сухой иммунохимии, стрип-тест, QuikStrip cassette, QuikStrip dipstick, экспресс-тест или экспресс-анализ. Эти названия связаны с быстротой проведения теста.
- Иммунофлюоресцентная диагностика, основанная на специфическом свечении комплекса антиген-антитело, позволяет получить ответ через несколько минут после обработки препарата из первичного материала специфической флюоресцирующей сывороткой.
- Масс-спектрометрия (MALDI-TOF MS) – спектральный метод изучения целых бактериальных клеток и их основных компонентов, основанный на измерении массы молекул или атомов, позволяющий проводить как прямое белковое профилирование для видовой идентификации микроорганизмов, так и обнаружение генетических маркеров лекарственной устойчивости. Преимуществами данного метода является высокая скорость видовой идентификации микроорганизмов (2-5 мин.), возможность автоматизации и роботизации всех стадий исследования, а также высокая специфичность.
Все более востребованными становятся молекулярно-генетические методы, такие как полимеразная цепная реакция (ПЦР) и, на основе него, анализ эволюционно-консервативных генов, фрагментация генома и анализ спектра фрагментов, гибридизация на микрочипах, геномная гибридизация, геномная амплификация и секвенирование/пиросеквенирование.
В основе метода ПЦР лежит комплементарное достраивание ДНК матрицы, осуществляемое in vitro с помощью фрагмента ДНК-полимеразы. Эта реакция носит название репликации ДНК. Преимущества метода ПЦР как метода диагностики инфекционных заболеваний – это прямое определение наличия возбудителей. Многие традиционные методы диагностики, например иммуноферментный анализ, выявляют белки-маркеры, являющиеся продуктами жизнедеятельности инфекционных агентов, что дает лишь опосредованное свидетельство наличия инфекции. Выявление специфического участка ДНК возбудителя методом ПЦР дает прямое указание на присутствие возбудителя инфекции. Применение ПЦР-диагностики также очень эффективно в отношении возбудителей с высокой антигенной изменчивостью и внутриклеточных паразитов. Следует отметить, что методом ПЦР возможно выявление возбудителей не только в клиническом материале, полученном от больного, но и в материале, получаемом из объектов внешней среды (вода, почва и т.д.).
Таким образом, современная лабораторная диагностика инфекционных болезней обладает широким спектром разнообразных методов и способов исследований, сочетание которых позволяет оперативно решать поставленные задачи, доступных для использования в рутинной практике.
Значение диагностики, как процесса распознавания болезней, состоит в том, что ранний, точный, исчерпывающий и максимально конкретный диагноз является основой для проведения рациональной и эффективной терапии, позволяет в большинстве случаев предсказать возможные варианты дальнейшего течения и исходов заболевания, а в инфекционной патологии служит еще и исходным моментом в проведении своевременных и направленных противоэпидемических и профилактических мероприятий.
[youtube.player]Вебинар провела Барамзина С.В. к.м.н., врач-инфекционист первой категории, доцент кафедры инфекционных болезней Кировского ГМУ.
Острые кишечные инфекции (ОКИ) — это большая группа инфекционных заболеваний человека с энтеральным (фекально-оральным) механизмом заражения, вызываемым патогенными и условно-патогенными бактериями, вирусами и простейшими, протекающие с преимущественным поражением желудочно-кишечного тракта в виде острого гастроэнтерита, энтероколита, колита с клиническими эквивалентами в виде болей в животе, рвоты, диареи, в тяжелых случаях — с явлениями токсикоза и эксикоза.
Инфекционная диарея — это диарея, обусловленная инфекционными причинами, часто сопровождающаяся тошнотой, рвотой и/или схваткообразными болями в животе.
Проблема ОКИ очень актуальна. Ежегодно до 30 % населения промышленно развитых стран страдает ОКИ.
Условно-патогенные возбудители кишечных инфекций занимают различное таксономическое положение и способны вызывать патологический процесс при условии сниженной резистентности организма и изменения защитных свойств нормальной микрофлоры кишечника. Они имеют ряд факторов, которые при определенных условиях оказывают патогенное воздействие на организм: эндо- и экзотоксины, гемолизины и др.
3 типа диареи
Диареи делятся на 3 типа:
-
Инвазивный тип диареи
Наличие клинико-эпидемиологических данных, характерных для нозологических форм ОКИ, возбудители которых обладают инвазивностью (сальмонеллез, иерсиниоз, шигеллез). Вовлечение в патологический процесс толстого кишечника (колит, энтероколит, реже энтерит). Гематологические показатели: лейкоцитоз, нейтрофилез, палочкоядерный сдвиг, ускоренная СОЭ. Копрологические изменения: лейкоциты, эритроциты, слизь и другие признаки воспалительного процесса.
Осмотический тип диареи
Наличие клинико-эпидемиологических данных, характерных для ОКИ вирусной этиологии. Вовлечение в патологический процесс только тонкого отдела кишечника (энтерит или гастроэнтерит) с явлениями метеоризма с первых дней болезни. Отсутствие гематологических и копрологических признаков бактериального воспаления.
Секреторный тип диареи
Критерии диагностики диареи
Синдромы при ОКИ
- Синдром общей интоксикации
- Диспепсический синдром
- Болевой синдром
- Эксикоз
- Нейротоксикоз
- Гемодинамические нарушения
- Синдром метаболических нарушений
- Дизентерия
- Сальмонеллёз
- Эшерихиозы
- Холера
Диагностика
Установление диагноза ОКИ проводится в два этапа:
-
I этап — предварительный диагноз устанавливается на основании анамнеза, возрастного фактора, эпидемиологической ситуации в конкретном регионе, клиники с учетом локализации и характера патологического процесса в ЖКТ.
В предварительном диагнозе у взрослых при наличии типичного симптомокомплекса должна быть указана предположительная нозологическая форма, в случае стертого или атипичного течения заболевания – указывается ведущий клинический синдром, тяжесть заболевания.
Ректороманоскопическое исследование (при затяжных и хронических формах сальмонеллеза, дизентерии, кампилобактериоза и т.д.)
Диагностика ОКИ, вызванных условно-патогенными микроорганизмами
- Наличие у больного клинических признаков острого инфекционного заболевания
- Выделение условно-патогенной флоры в первые дни болезни в монокультуре из испражнений, рвотных масс или промывных вод желудка, из остатков пищевого продукта, с которым пациент связывает заболевание
- Массивность выделения условно-патогенной флоры в ранние периоды обследования (106 и более микробных клеток в 1 грамме испражнений)
- Снижение количественного содержания условно-патогенной флоры в динамике заболевания
Общие подходы к лечению диареи

Виды лечения:
1 этап восстанавливающий — 4-6 часов от начала лечения — направлен на ликвидацию водно-солевого дефицита, имеющегося к началу лечения.
- при легкой степени тяжести жидкость (глюкозо-солевые растворы, морс или кипяченая вода) дается из расчета 40-50 мл/кг за 4 часа
- при средней степени тяжести — 80-90 мл/кг за 6 часов
- при тяжелом течении — 80–100 мл/кг за 6 часов
- при легкой степени тяжести жидкость (глюкозо-солевые растворы, морс или кипяченая вода) дается из расчета — 1 литр за 6 часов, 1-3% от массы
- при средней тяжести — 2–3 литра за 4-6 часов или 4-6% от массы тела
- при тяжелом течении — 4–5-7 литров за 2-4 часа 6-9%
Жидкость выпивается дробно, в зависимости от возраста, по 1/2 чайной, 1-2 столовых ложки через каждые 5–10 минут.
Через 4-6 часов повторно оценивается состояние пациента.
Ухудшение в состоянии является показанием для внутривенного капельного введения жидкости.
При стабилизации процесса возможно продолжение 1 этапа оральной регидратации еще в течение 4–6 часов.
Начинается 2 этап (поддерживающая регидратация), направленный на возмещение продолжающейся потери жидкости.
Расчёт 2 этапа: потери + 1/4 или 1/6 или 1/12 от фактической потери (30 мл/кг). 2 этап продолжается в течение 3–5 дней до полной нормализации стула
Показания для парентеральной 3-4 ст. дегидратации. Для парентеральной регидратации - растворы Калия хлорид + Натрия ацетат + Натрия хлорид, Декстроза + Калия хлорид + Кальция хлорид + Магния хлорид + Натрия хлорид + Яблочная кислота
Диетотерапия является постоянным и ведущим компонентом терапии ОКИ на всех этапах болезни. В настоящее время водно-чайные паузы и голодные диеты не рекомендуются, т.к. доказано, что даже при тяжелых формах ОКИ пищеварительная функция кишечника сохраняется, а голодные диеты значительно ослабляют защитные функции организма и замедляют процессы репарации кишечника.
Выбор средств этиотропной терапии осуществляется с учетом предполагаемой этиологии ОКИ (шигеллез, сальмонеллез, ротавирусная инфекция) и типа диареи (инвазивный, секреторный), а также с учетом возрастных ограничений, периода болезни и сопутствующей патологии
К ним относятся широко распространенные препараты, которые при приеме внутрь мало всасываются в кишечнике и оказывают бактериостатическое или бактерицидное действие в просвете кишки, что патогенетически обоснованно в первые часы болезни. Особого внимания заслуживают современные производные нитрофурана.
Антимикробная активность нитрофуранов проявляется в отношении грамположительных и грамотрицательных бактерий, а также некоторых простейших и грибков. В отличие от многих антибиотиков нитрофураны не угнетают иммунитет, а стимулируют его за счет усиления фагоцитарной активности лейкоцитов, повышения адсорбционно-поглотительной способности ретикулоэндотелиальной системы печени и селезенки.
Назначаются обычно в стационаре:
- При неэффективности препаратов I ряда
- При среднетяжелых и тяжелых формах болезни
- При поступлении пациента в поздние сроки, поскольку в эту фазу ― инвазивных ОКИ возбудитель уже проникает за пределы просвета кишки
В качестве альтернативных препаратов рекомендуются амоксициллин/клавулановая кислота, фторхинолоны, аминогликозиды.
Рекомендуется применять только в стационарных условиях:
- При тяжелых и генерализованных формах ОКИ
- При среднетяжелых и тяжелых формах болезни — в случае неэффективности препаратов II ряда
- При сочетании ОКИ с бактериальными осложнениями острого респираторного заболевания
В качестве препаратов — резерва используются обычно антимикробные препараты с высокой биодоступностью, проникающие в ткани, оказывающие бактерицидное действие на внутриклеточно расположенные микроорганизмы
К ним относятся: цефалоспорины III и IV поколения, фторхинолоны, карбапенемы.
Улучшить эффективность антибактериальной терапии среднетяжелых форм ОКИ у пациентов > 1 года можно с помощью специфических бактериофагов, примененных совместно с антибиотиками или химиопрепаратами.
- Как монотерапия при стертых и легких формах ОКИ
- В сочетании с антимикробными препаратами при среднетяжелых формах в острой фазе болезни
- Для проведения 2 курса этиотропной терапии при повторном высеве
- При дисбактериозе кишечника, сопровождающегося ростом кишечной палочки с измененными свойствами, стафилококка
Энтеросорбция. Играет ведущую роль при лечении секреторных диарей.
- Используют сорбенты — кремния диоксид коллоидный, смектит диоктаэдрический, активированный уголь, лигнин гидролизный, повидон — все они представляют собой мельчайшие частицы с очень большой сорбционной поверхностью, способные извлекать, фиксировать на себе и выводить из кишечника вирусы, микробы и их токсины, биологически-активные метаболиты, аллергены
- При приеме адсорбирующих препаратов продолжительность и тяжесть диареи уменьшается
- Смектит диоктаэдрический взаимодействуя с гликопротеинами слизи повышает сопротивляемость барьера слизи — иммуноглобулина А; защищает слизистую кишечника от эрозийного действия желчных кислот, инвазии бактерий в под слизистую кишечника; сорбирует на себе токсины, ротавирусы
Разрешение воспалительного процесса

Ферментотерапия. Выбор ферментного препарата в зависимости от типа диареи:
Противопоказания к назначению ферментотерапии
Выбор ферментного препарата в зависимости от типа диареи:
При решении вопроса необходимости назначения ферментных препаратов при ОКИ следует также учитывать, что пробиотики, используемые в комплексной терапии, обладают ферментативной (главным образом амилолитической) активностью и в этих случаях дополнительного назначения ферментов, как правило, не требуется.
Выписка больных
- Декретированные лица — после клинического выздоровления и отрицательного бактериологического исследования кала
- Недекретированные лица — после клинического выздоровления.
Аннотация научной статьи по клинической медицине, автор научной работы — Кучеренко Марина Анатольевна
В статье представлены данные, касающиеся особенностей послеродовых инфекционных заболеваний в современном акушерстве. Приведены сведения о факторах риска, этиологии заболеваний, особенностей клиники, представлены общие тенденции лечения и профилактики осложнений.
Похожие темы научных работ по клинической медицине , автор научной работы — Кучеренко Марина Анатольевна
и лечению послеродовых инфекционных
НИИ акушерства и гинекологии заболевании
им. Д. О. Отта СЗО РАМН
■ В статье представлены данные, касающиеся особенностей послеродовых инфекционных заболеваний в современном акушерстве. Приведены сведения о факторах риска, этиологии заболеваний, особенностей клиники, представлены общие тенденции лечения и профилактики осложнений.
■ Ключевые слова: послеродовый период; послеродовые инфекционные осложнения; эндометрит.
Долгие годы послеродовые инфекционно-воспалительные заболевания были главной причиной материнской смертности. При существующих методах профилактики и лечения они сравнительно редко приводят к тяжелым осложнениям и смерти. Тем не менее, сепсис вместе с кровотечением и гестозом устойчиво входит в число ведущих причин материнской смертности. Ежегодно в мире от септических акушерских осложнений погибает более 150 000 родильниц [6].
В современных условиях гнойно-воспалительные процессы у родильниц характеризуются рядом особенностей [4, 7, 14]:
1. изменением этиологической структуры заболевания с увеличением значимости условно патогенной микрофлоры и ее ассоциаций;
2. ростом антибиотикорезистентности микроорганизмов;
стертых форм и атипического течения
поздней диагностикой, запоздалым началом лечения и,
следствие, генерализацией инфекционного процесса.
Характерной особенностью послеродовых инфекционных заболеваний в современном акушерстве является их полиэтио-логичность [6, 8]. Большое разнообразие возбудителей, главным образом условно патогенных аэробных и анаэробных бактерий, лишает их нозологической специфичности, что в значительной мере обусловлено бесконтрольным применением антибактериальных препаратов, под действием которых чувствительные виды микроорганизмов уступают место устойчивым. Однако ведущая роль в развитии послеродовых инфекционных осложнений принадлежит более вирулентным микроорганизмам: представителям семейства Enterobacteriaceae (кишечной палочке, клебсиелле) и стафилококкам [4, 11, 12]. Роль анаэробов как копатогенов также является общепризнанной и чаще всего представлена бактероидами, клостридиями, пептострептокок-ками. характерной особенностью воспалительных послеродовых заболеваний является высокая частота микробных ассоциаций, при которых наблюдаются наиболее тяжелые формы заболеваний. Возбудителями послеродовых заболеваний могут быть также стрептококки группы А и В, а также хламидии. Как правило, C. trachomatis вызывает поздние формы послеродового эндометрита, развивающиеся через 2-3-недели после родов. Объектом интенсивных дискуссий является этиологическая роль генитальных микоплазм, которые присутствуют во влагалищной микрофлоре практически всех женщин, однако подавляющее большинство видов микоплазм являются сапрофита-ми. Только некоторые из этих условно патогенных микоплазм (M. hominis, M. genitalium , U. urealiticum, U. parvum) рассматриваются как возможные возбудители послеродового эндометрита, однако даже для них этиологическая роль признается при исключении всех других причин воспаления.
Возбудителями большинства инфекций в акушерстве является эндогенная микрофлора кожи пациентки, слизистых обо-
лочек или полых органов, представленная различными сочетаниями условно патогенных аэробных и анаэробных микроорганизмов. Доказана возможность проникновения кишечной палочки сквозь плодные оболочки, которые образуют слабый барьер для восходящей инфекции и не ингибируют бактериальный рост [14]. Экзогенные возбудители инфекции заносятся в половой тракт извне медицинским персоналом при различных манипуляциях и вмешательствах и состоят преимущественно из грамположительных кокков (стафилококки, стрептококки), ферментирующих (Escherichia coli, Klebsiella pnevmoniae) и неферментирующих (P. aeruginosa) грамотрицательных палочек. Они, как правило, относятся к нозокомиальным возбудителям и обладают более высоким уровнем пато-генности, резистентности к антибиотикам и тяжестью клинического течения заболевания.
В настоящее время накоплен обширный материал о факторах, предрасполагающих к развитию инфекционного процесса [8, 14, 13], которые условно можно разделить на 2 группы. Первая группа факторов связана с состоянием организма женщины до и во время беременности, и к ним относится иммуносупрессия, обусловленная беременностью, хронические соматические заболевания, ожирение, анемия. Ряд авторов [14, 13] дополнительно считают необходимым учитывать низкий социальный статус женщины, прием кортикостероидов и антибактериальных препаратов при беременности, генитальные инфекции и особенно наличие бактериального вагиноза. Но основное значение в развитии гнойно-септических осложнений в послеродовом периоде имеют факторы риска, связанные с родоразрешением [8]. Затяжные роды, длительный безводный промежуток, амнионит, многочисленные влагалищные исследования, ин-вазивный фетальный мониторинг, абдоминальное родоразрешение оцениваются в качестве наиболее важных предрасполагающих факторов развития инфекционных заболеваний у родильниц, как при самопроизвольных родах, так и в случае кесарева сечения. Родовая деятельность и разрыв плодного пузыря являются наиболее важными причинами, ведущими к повышению опасности инфекции в родах, причем, чем больше продолжительность каждого из них во времени, тем больше опасность инфицирования. Однако, R. Natale и соавторы указывают на то, что выжидательная тактика в течение 48 часов после преждевременного разрыва плодных оболочек не влияет на частоту кесарева сечения и послеродового эндометрита, хотя хорио-амнионит при выжидательной тактике развивается достоверно чаще. У 20 % родильниц, перенесших хориоамнионит в родах, развиваются послеродовый эндометрит и другие пуэрперальные заболева-
ния. В клинической практике отмечается большое число случаев преждевременных родов, асфиксии новорожденных, рождения детей с низкой массой тела, у матерей которых впоследствии послеродовый период осложнился эндометритом, при этом из амниотической жидкости выделялись E. coli и стрептококки группы В [4, 10].
В структуре послеродовых инфекционно-воспалительных осложнений преобладают эндометрит и раневая инфекция, которые рассматриваются как начальные проявления воспалительного процесса, причем подавляющее большинство заболеваний приходится на родильниц после абдоминального родоразрешения [9].
В последние годы все чаще клиническая картина эндометрита не отражает тяжести состояния родильницы [1, 4, 9]. Такие классические симптомы пуэрперального эндометрита, как нарушение общего самочувствия, боли внизу живота, лихорадка, изменения в периферической крови, пастозность и болезненность матки при ее пальпации встречаются менее чем у половины родильниц. Наиболее частыми клиническими проявлениями являются: субинволюция матки и патологический характер лохий. При таком варианте течения заболевания, при запоздалой диагностике и неадекватном лечении, довольно быстро наступает генерализация процесса.
Не существует единой точки зрения о механизме развития послеродового эндометрита. В послеродовом периоде внутренняя поверхность матки представляет собой раневую поверхность, а содержимое полости матки является благоприятной средой для развития инфекции. Чаще всего бактерии проникают в полость матки восходящим путем во время родов или в послеродовом периоде. Однако даже при выявлении бактерий в полости матки не всегда развивается эндометрит. Тяжесть и длительность заболевания во многом определяется распространенностью процесса, характером поражения и видом выделенного возбудителя. Одной из основных причин возникновения эндометрита является инфицирование полости матки при наличии в ней сгустков крови, внеплацентарных оболочек и остатков плацентарной ткани. Назначаемая в такой ситуации антибактериальная терапия недостаточно эффективна и рассчитана в основном на предупреждение распространения инфекции за пределы матки. Прекращению инфекционного процесса способствует освобождение матки от инфицированных и некротических тканей.
Существенную помощь в диагностике послеродовых инфекционных заболеваний оказывает ультразвуковое исследование (УЗИ), которое позволяет оценить размеры и состояние полости матки, динамику ее инволюции и состояние послеоперационного шва. Значение УЗИ для диагностики по-
слеродовой инфекции подчеркивает большинство авторов [3, 15], рекомендуя его в качестве скрининга у родильниц. При отсутствии убедительной ультразвуковой картины внутриматочной патологии применяют гистероскопию, в сложных случаях возможно проведение компьютерной и магнитно-резонансной томографии, позволяющих выявить патологические процессы вне матки (абсцесс, гематому, свищи, кишечную непроходимость, септический тазовый тромбофлебит и др.).
Бактериологическая диагностика послеродового эндометрита затруднена, что обусловлено полимикробным характером заболевания. Для определения возбудителя воспаления проводится бактериологическое исследование материала полученного из полости матки. О наличии инфекционного процесса в полости матки свидетельствует количество выделенных микроорганизмов 104-105 КОЕ/мл и выше. Ряд исследователей считают рутинные микробиологические исследования отделяемого генитального тракта у женщин с послеродовой инфекцией клинически мало информативным [8]. Микроорганизмы, выделенные из лохий, могут не совпадать с той микрофлорой, которая находится в полости матки. Частота обнаружения микоплазм и хламидий в качестве возбудителя послеродового эндометрита составляет не более 10 %, причем хламидии чаще выделяются при позднем развитии заболевания.
В основе лечения послеродового эндометрита лежит хирургическая санация полости матки и рациональная антибактериальная терапия [4, 6]. Ряд авторов считают аспирацию содержимого матки у таких родильниц обязательной, способствующей диагностике и эффективному лечению эндометрита. Антибактериальная терапия носит, как правило, эмпирический характер, поэтому антибактериальные препараты должны оказывать действие на весь спектр возможных аэробных и анаэробных микроорганизмов, находящихся в полости матки [2, 5].
клинических формах послеродовых заболеваний используют фторхинолоны в сочетании с метрони-дазолом или линкосамидами, и карбапенемы. При поздних эндометритах необходимо обязательное включение макролидов в схему лечения.
Терапия считается эффективной в случае купирования симптомов заболевания, и при нормализации температуры тела лечение антибиотиками целесообразно прекращать через 24-48 часов.
Профилактика инфекционных послеродовых заболеваний должна начинаться во время беременности и включать лечение гинекологических и экстрагенитальных инфекций. Большое значение имеет рациональное ведение родов и послеродового периода. Первым шагом к уменьшению инфекционной заболеваемости у родильниц после абдоминального родоразре-шения является снижение до минимума числа необоснованных кесаревых сечений. Кроме того, необходимо повышенное внимание ко многим факторам, уменьшающим опасность инфицирования беременной, а именно, минимальное по времени пребывание пациентки в стационаре до операции, обработка операционного поля и рук хирургов, внимание к хирургической технике и объему кровопотери. Ранее, с целью уменьшения инфекционной заболеваемости у женщин высокого риска проводилось экстраперитонеальное кесарево сечение, но в современном акушерстве этот подход представляет лишь исторический интерес. В настоящее время целесообразность антибиотикопрофи-лактики при хирургических вмешательствах не вызывает сомнения [2, 9]. Доказано, что применение антибиотиков с целью профилактики послеродовых осложнений при операции кесарева сечения приводит к существенному, клинически важному и статистически значимому снижению частоты послеродового эндометрита и раневой инфекции. По рекомендациям ACOG (1998), ан-тибиотикопрофилактика рекомендована только при выполнении экстренных операций кесарева сечения. Рутинная профилактика во время операции, выполняемой в плановом порядке, а также у беременных с низким риском развития инфекционных послеродовых осложнений не показана, т. к. существует высокая опасность побочных аллергических и токсических реакций, развития резистентности микроорганизмов к антибактериальным препаратам. Что касается выбора антибактериального препарата, то пенициллины широкого спектра являются такими же эффективными, как цефалоспорины. Строгих доказательств в пользу использования цефалоспоринов второго или третьего поколения не существует.
Таким образом, проблема послеродовых инфекционных заболеваний далека от своего решения и оценка факторов риска их развития, своевременная диагностика, рациональная профилактика и лечение способствуют уменьшению количества тяжелых, генерализованных форм заболеваний и тем самым приводят к снижению материнской смертности.
1. Акушерство: учебник для медицинских вузов / Айлама-зян Э. К. [и др.]. — 7-е изд. — СПб.: СпецЛит, 2010. — 543 с.
2. Гуртовой Б. Л., Кулаков В. И., Воропаева С. Применение антибиотиков в акушерстве и гинекологии. — М.: Триада-Х, 2004. — 175 с.
3. Коробков Н. А. Диагностика морфо-функционального состояния матки при послеродовой субинволюции: авто-реф. дис. . канд. мед. наук. — СПб., 2006. — 24 с.
4. Кулинич С. И., Турусов Ю. В., Сухинина Е. В. Современные особенности послеродового эндометрита // Российский вестник акушера-гинеколога. — 1999. — № 1. — С. 47-51.
5. Страчунский Л. С., Козлов С. Н. Современная антимикробная химиотерапия: руководство для врачей. — М., 2002. — 431 с.
7. Чернуха Е. А. Нормальный и патологический послеродовый период. — М., 2006. — 272 с.
8. A clinical and microbiologic analysis of risk factors for puerperal endometritis / Newton E. R. [et al.] // J. Obstret. Gynecol. — 1990. — Vol. 75, N 3. — P. 402-406.
9. Endometritis after cesarean: The effect of age / Magee K. P. [et al.] // Am J. Perinotal. — 1999. — Vol. 11. — P. 24.
10. Grop B streptococcal disease in the era of intrapartum antibiotic prophilaxis / Schrag S [et al.] // N. Engl. J. Med. — 2000. — Vol.342. — P. 15.
11. Monif G. R. G., Barcer D. A. Infectious diseases in obstetrics and gynecology. — 1-st edn. — N.Y.: The Parthenon Publishing Group, 2005. — 1434 p.
12. OLeary J. Brest abscess // Infectious diseases in obstetrics and gynecology. — N.Y.: The Parthenon Publishing Group, 2005. — P. 497-503.
13. Risk factors for postcesarean surgical infection / Tran T. S. [et al.] // J. Obstret. Gynecol. — 2000. — Vol. 95. — P. 367.
14. Risk factors in puerperal endometritis-myometritis / Libom-bo A. [et al.] // Gynecol. Obstet. Invest. — 2004. — Vol. 38. — P. 198-204.
15. Ultrasound assessment of the effect of parity on postpartum uterine involution / Olayemi O. [et al.] // J. Obstret. Gynecol. — 2002. — Vol. 22, N4. — P. 381-384.
16. Willams Obstetrics / eds. Cunningham F. G. [et al.]. — 22-st edn. — N.Y.: McGraw-Hill, 2005. — 1667 p.
CURRENT APPROACHES TO DIAGNOSIS AND TREATMENT OF POSTPARTUM INFECTIOUS DISEASES
■ Summary: Current approaches to diagnosis and treatment of postpartum infectious diseases. The article presents data concerning the characteristics of postpartum infectious diseases in modern obstetrics. Provides information about risk factors, etiology of disease, especially hospitals, are the general trends of treatment and prevention of complications.
■ Key words: postpartum; postpartum infectious complications; endometritis.
■ Адреса авторов для переписки-
Кучеренко Марина Анатольевна — к. м. н., заведующая I акушерским физиологическим отделением.
НИИ акушерства и гинекологии им. Д. О. Отта СЗО РАМН. 199034, Санкт-Петербург, Менделеевская л., д. 3. E-mail: Kucherenko.ma@mail.ru.
Kucherenko Marina Anatolievna — PhD, Head of 1-st obstetric physiological department.
[youtube.player]Читайте также:


