Ингибитор фно альфа при псориатическом артрите
За последние десятилетия в ревматологии произошли существенные изменения, которые связанны с активным внедрением в клиническую практику генно–инженерных биологических препаратов (ГИБП). Их действие направлено на специфические компоненты механизма развития ревматических заболеваний. Ревматологи Юсуповской больницы применяют ГИБП препараты, зарегистрированные в РФ.
Лечение назначают после комплексного обследования пациентов с помощью новейшей аппаратуры ведущих мировых производителей и точных методов лабораторной диагностики. Тяжёлые случаи заболеваний обсуждают на заседании Экспертного Совета. Доктора и кандидаты медицинских наук, врачи высшей категории коллегиально вырабатывают тактику ведения каждого пациента.
Для лечения аутоиммунных заболеваний, особенно ревматоидного артрита ревматологи применяют генно-инженерные биологические препараты (ГИБП). Они представляют собой моноклональные антитела и рекомбинантные белковые молекулы, которые подавляют активность важнейших факторов, которые принимают участие в развитии аутоиммунного воспалительного процесса. В настоящее время список ГИБП пополнил новый точечный ингибитор киназы (ингибитор JAK-киназы). Врачи Юсуповской больницы применяют генно-инженерные биологические препараты в ревматологии. Цена препаратов высокая, но они обладают высокой эффективностью.

Классификация
Генно-инженерные биологические препараты представлены следующими лекарственными средствами:
- Ингибиторами фактора некроза опухоли-альфа (ФНО-альфа);
- Моноклональные антитела к рецепторам интерлейкин;
- Анти В-клеточные моноклональные антитела;
- Блокатор КО-стимуляции Т-лимфоцитов;
- Ингибитор протеинкиназы.
К ингибиторам ФНО-альфа относится инфликсимаб (ремикейд). Препарат оказывает селективное иммуномодулирующее действие. Лекарственное средство применяют при следующих ревматических заболеваниях:
- Ревматоидном артрите;
- Анкилозирующем спондилоартрите;
- Ювенильном ревматоидном артрите.
- Псориатическом артрите.
Адалимумаб (хумира) – селективный иммунодепрессант, рекомбинантное человеческое моноклональное антитело. По пептидной последовательности идентичен иммуноглобулинам Ig. Лекарственное средство применяют при среднетяжёлом и тяжёлом ревматоидном артрите в виде монотерапии или в сочетании с метотрексатом, ГИБП. Хумира применяется для лечения псориатического артрита, активного анкилозирующего спондилита.
Этанерцепт (Энбрел) тормозит биологические эффекты ФНО-α. Препарат представляет собой гибридную молекулу, которая состоит из ФНО-рецептора, соединённую с Fс-фрагментом IgG человека. Состоит из 934 аминокислот. Димерная структура ФНОР в молекуле этанерцепта обеспечивает более высокое взаимодействие препарата к ФНО-α, чем с мономерный рФНОР.
Препарат эффективен в лечении ревматоидного артрита, хорошо переносится пациентами даже при длительном применении. Комбинированная терапия этанерцептом и метотрексатом значительно превосходит монотерапию энбрелом у пациентов как с ранним, так и развёрнутым ревматоидным артритом. Потенциальными преимуществами этанерцепта перед другими ингибиторами ФНО-α является сохранение эффекта терапии в процессе длительного лечения и меньший риск активации туберкулёза.
Цертолизумаб пэгол – моноклональное антитело, ингибитор ФНО-α. Препарат нейтрализует мембранные и растворимые рецепторы фактора некроза опухоли альфа. Ревматологи назначают цертолизумаб пациентам, страдающим ревматоидным артритом средней и высокой активности у взрослых. Препарат применяют для монотерапии или в комбинации с другими базисными средствами.
Препарат назначают для лечения ревматоидного артрита в комбинации с метотрексатом при неэффективности других базисных средств, а также для терапии пациентов с тяжёлым прогрессирующим течением ревматоидного артрита, которые ранее не получали метотрексат. Показанием к применению препарата является псориатический артрит, тяжелый, прогрессирующий анкилозирующий спондилит без ответа на стандартную терапию.
Моноклональное антитело к рецепторам интерлейкин – устекинумаб (стелара). Это человеческие моноклональные антитела (класса Ig-G/к). Применяется для лечения псориаза, псориатического артрита. Ревматологи назначают устекинумаб в виде монотерапии и в сочетании с метотрексатом.
Анакинра (Кинерет) – рекомбинантный антагонист рецептора ИЛ-1, медиатора воспаления, который присутствует в синовиальной жидкости и плазме пациентов, страдающих ревматоидным артритом. Применяют для терапии пациентов, страдающих среднетяжелыми и тяжёлыми формами ревматоидного артрита, резистентных к метотрексату и действию других базисных средств. Препарат эффективен при острой и подострой формах подагры. Значительно облегчает боль, особенно у тех пациентов, кто не переносит стандартные противовоспалительные средства.
Тоцилизумаб – рекомбинантное гуманизированное моноклональное антитело к человеческому рецептору интерлейкина-6 из подкласса иммуноглобулина Ig-G. Избирательно связывается и подавляет растворимые и мембранные рецепторы интерлейкина 6. Применяется для лечения ревматоидного артрита со средней или высокой степенью активности в виде монотерапии и в комбинации с другими базисными средствами. Особенно эффективно тормозит рентгенологически доказанную деструкцию суставов. Препарат используют в терапии активного полиартикулярного ювенильного идиопатического артрита и активного системного ювенильного идиопатического артрита.
Анти В-клеточные моноклональные антитела представлены препаратом ритуксимаб-РТМ (мабтера). Это синтетическое (генно-инженерное) химерное моноклональное антитело мыши или человека. Оно по структуре относится к иммуноглобулинам класса G1 (IgG1 каппа).
Ритуксимаб обладает высокой эффективностью при лечении пациентов, страдающих системной красной волчанкой с активными внепочечными проявлениями (серозитом, полиартритом, поражением кожи, стоматитом, лихорадкой, анемией), прогрессирующим волчаночным нефритом. Он является быть препаратом выбора для терапии системной красной волчанки, протекающей критически.
Ритуксимаб ревматологи применяют при мультиорганном тромбозе, связанном с катастрофическим антифосфолипидным синдромом. Препарат успешно применяют для лечения следующих заболеваний:
- Синдрома Шегрена;
- Полимиозита;
- Дерматомиозита;
- Гранулематоза Вегенера.
Ритуксимаб успешно применяют при пузырчатке – потенциально смертельном аутоиммунном заболевании, в основе которого лежит выработка аутоантител, реагирующих с десмоглеином 1 и 3 и молекулами адгезии эпидермиса. Ритуксимаб является родоначальником нового направления в лечении аутоиммунных заболеваний человека. Он модулирует В-клеточное звено иммунитета.
Блокатор КО-стимуляции Т-лимфоцитов абатацепт (оренсия) продуцируется путём технологии рекомбинантной ДНК на клетках яичников китайского хомячка. Препарат назначают пациентам с ревматоидным артритом при непереносимости и неэффективности других средств базисной терапии совместно с метотрексатом. Не сочетают с другими базисными препаратами, в том числе ингибиторами ФНО-α, анакинрой, ритуксимабом.
Тофацитиниб (Яквинус) – мощный избирательный ингибитор янус-киназы. Обладает высокой избирательностью в отношении янус-киназы 1, 2, 3. Препарат применяют при умеренном или тяжёлом активном ревматоидном артрите у взрослых с неадекватным ответом на один или несколько базисных средств.
Осложнения
Невзирая на высокую эффективность, ГИБП оказывают побочные действия. Тяжёлым осложнением терапии генно-инженерными биологическими препаратами ревматологи считают инфекции, ассоциированные с ГИБП. Ситуация осложняется тем, что лечение ревматических заболеваний требует применения иных антиревматических препаратов, которые обладают иммуносупрессивным действием.
При лечении ГИБП могут развиться следующие инфекционные осложнения:
- Септический артрит;
- Остеомиелит;
- Инфекции;
- Кожи и мягких тканей;
- Пневмония.
Основными прогностическими критериями развития инфекций при ревматических заболеваниях являются лейкопения, хронические заболевания лёгких, внесуставные проявления болезни, увеличение СОЭ, наличие ревматоидного фактора, лечение глюкокортикоидами. Применение метотрексата у больных ревматоидным артритом приводит к достоверному повышению общего числа вторичных инфекций.
Чтобы свести к минимуму риск развития инфекционных осложнений, связанных с терапией генно-инженерными биологическими препаратами, ревматологи Юсуповской больницы проводят тщательный отбор больных в строгом соответствии с показаниями, не назначают ГИБП пациентам, страдающим клинически значимой инфекцией в активной форме. Врачи проводят тщательное обследование пациентов с целью выявления латентной инфекции, соответствующее лечение в случае её обнаружения, откладывают начало терапии ГИБП. Крайнюю осторожность проявляют при решении вопроса о лечении ГИБП у пациентов с повышенной восприимчивостью к инфекциям, с наличием в анамнезе рецидивирующих инфекций или страдающим хроническим инфекционным заболеванием.
Во время и после лечения информируют пациентов о том, что ГИБП могут повышать способность к развитию инфекций. Ревматологи проводят инструктаж больных о необходимости немедленного обращения к врачу при появлении во время или после лечения ГИБП симптомов инфекции (повышения tº тела, общей слабости, кашля или гриппоподобных симптомов) или признаков, которые позволяют заподозрить туберкулёз (субфебрилитета, длительно сохраняющегося кашля, снижения массы тела).
Врачи Юсуповской больницы проводят тщательное наблюдение как минимум в течение шести месяцев после окончания лечения ГИБП. При развитии тяжёлой инфекции терапию генно-инженерными биологическими препаратами прекращают, проводят в связи с этим соответствующее обследование и лечение

Терапия остеопороза при ревматоидном артрите
Ревматоидный артрит является центральной проблемой современной ревматологии. Это хроническое прогрессирующее заболевание с постепенно нарастающей деструкцией мягких тканей, хряща и костей. Наиболее часто встречающееся и тяжелое проявление ревматоидного артрита – остеопороз. Он может быть обусловлен активностью самого заболевания и побочным действием проводимой терапии.
Деструкцию костной ткани вызывают медиаторы воспалительного и иммунного процессов — провоспалительные цитокины, которые вырабатываются субпопуляцией Т-лимфоцитов. К ним относят:
- Фактор некроза опухоли а (ФНО-а);
- Интерлейкины 1, 2, 12, 17;
- Интерферон;
- Простагландины;
- Протеолитические ферменты.
Генно-инженерные биологические препараты (ГИБП), которые применяют для лечения ревматоидного артрита, уменьшают воспалительные изменения суставов, сдерживают развитие деструкции и развитие остеопороза. При применении ГИБП наблюдается стабилизация или повышение минеральной плоскости кости. У пациентов повышается образование костной ткани и снижается рассасывание кости. Препараты способствуют замедлению деструкции суставов при ревматоидном артрите. Для того чтобы пройти комбинированную терапию ревматических заболеваний, в том числе генно-инженерными биологическими препаратами, по доступной цене, звоните в контакт центр Юсуповской больницы.
В.В.Бадокин, Ю.Л.Корсакова
Российская медицинская академия последипломного образования, Москва
Псориатический артрит (ПА) является одним из основных воспалительных заболеваний суставов и позвоночника. Как известно, ПА относится к серонегативным спондилоартритам (спондилоартропатиям, спондилитам). В эту группу, помимо ПА, входит анкилозирующий спондилоартрит (болезнь Бехтерева), реактивные артриты, воспалительные заболевания кишечника и недифференцированный спондилит. Для всех этих нозологических форм характерна заинтересованность в патологическом процессе не только синовиальной оболочки, сколько энтезов и кости, что имеет прямое отношение к симптоматике этих заболеваний. При серонегативных спондилоартритах наблюдается большое количество общих клинических стигматов, а также однотипность ответа на фармакологические препараты, что проявляется, например, низкой эффективностью системных глюкокортикостероидов, положительным действием сульфасалазина на периферический артрит, но не спондилит, ярком "драматическом" влиянием ингибиторов фактора некроза опухоли-альфа (ФНО-а) на основные проявления этих заболеваний, включая артрит, сакроилиит и спондилит, энтезит, острый передний увеит. В настоящее время тяжелое течение анкилозирующего спондилоартрита, болезни Крона и ПА является прямым показанием для назначения ингибиторов ФНО-а, при этом их лечебный эффект существенно выше, чем при ревматоидном артрите [1, 2].
Распространенность артрита у больных псориазом, по данным разных авторов, колеблется от 13,5 до 47,0% (в среднем 36%), а распространенность ПА в популяции составляет 0,06-1,4% [3]. Наиболее часто заболевание начинается в возрасте от 20 до 50 лет. Мужчины и женщины заболевают одинаково часто. По своему течению ПА имеет в целом ту же степень тяжести, что и ревматоидный артрит. При этом заболевании наблюдается неуклонно прогрессирующее течение, нередко рефрактерность к проводимой терапии, быстрое развитие функциональной недостаточности опорнодвигательного аппарата, ранняя инвалидизация. У преобладающего большинства больных развивается деструктивный (эрозивный) артрит и формирование анкилозов. Факторами риска тяжелого течения ПА являются мужской пол, развитие заболевания до 30 лет, экссудативный, эритродермический и пустулезный псориаз, дебют заболевания с поражения периферических суставов и позвоночника. При ПА наблюдается увеличение смертности по сравнению с популяционной (у мужчин на 59% и женщин на 65%) [4]. Основными причинами летальных исходов являются метаболические нарушения и вызванные ими обструктивные заболевания сосудов сердца и мозга, хроническая почечная недостаточность как следствие амилоидой нефропатии, болезни системы дыхания, злокачественные опухоли, а также осложнения проводимой терапии (гемоцитопении, печеночная недостаточность).
Особенности ПА в каждом конкретном случае характеризуют два его основных синдрома - кожный, представленный различными клиническими вариантами псориаза, и суставной. Суставной синдром включает широкий диапазон своих проявлений и занимает ведущее место в клинической картине. Он имеет не только общие черты, присущие основным воспалительным ревматическим заболеваниям, но и свои отличительные признаки, совокупность которых лежит в основе клинико-анатомических вариантов суставного синдрома. Выделяют следующие основные варианты суставного синдрома: дистальный, олигоартрический, полиартритический, остеолитический и спондило-артритический [5]. Именно эти варианты и определяют, главным образом, клиническое лицо ПА у отдельных больных. Кроме того, некоторые авторы в рамках ПА выделяют особые варианты, такие как синдром передней грудной клетки, изолированный дактилит, пахидермо-периостит, синдром SAPHO [6]. Детальная оценка отдельных стигматов суставного синдрома оказывает решающее значение не только для правильной и своевременной диагностики, но и для выбора адекватной терапии.
Объем терапевтических мероприятий при ПА определяется, прежде всего, выраженностью и степенью тяжести суставного и кожного синдромов. Точками приложения медикаментозной терапии при этом заболевании являются не только хронический синовит пролиферативного типа, сакроилиит и анкилозирующий спондилоартрит, но и распространенная энтезопатия, остит, дерматит, висцериты (аортит, кардит, гепатопатия, диффузный гломерулонефрит, амилоидная дистрофия внутренних органов). Чрезвычайно важно применение таких препаратов, которые активно воздействовали бы на эти основные проявления болезни. Близость клинических проявлений ПА к ревматоидному артриту и серонегативным спондилоартритам позволяет использовать при осложненном псориазе базисные противовоспалительные (иммуноактивные) препараты, которые с успехом применяются при других основных воспалительных заболеваниях суставов и позвоночника, хотя терапия осложненного псориаза имеет и свои отличительные особенности. Среди базисных противовоспалительных препаратов фигурируют не только метотрексат, циклоспорин, соли золота и сульфасалазин, но и колхицин, ароматические ретиноиды, соматостатин, фумаровая кислота и, конечно, препараты биологического действия.
Теоретическим обоснованием применения при ПА базисных противовоспалительных препаратов (БПВП) явились результаты многочисленных исследований, убедительно показавших, что патогенетической его основой является активация клеточного иммунитета у лиц с врожденной предрасположенностью и иммунное воспаление лежит в основе тканевых изменений при этом заболевании [7, 8]. Участие иммунных нарушений в патогенезе псориаза и ПА базируется на ведущем значении CD8+T-лимфоцитов, стимуляции пролиферации кератиноцитов Т-клетками эпидермиса и синовиальной оболочки, обнаружением фиксированных на клетках покровного и подпокровного слоев синовиальной оболочки иммуноглобулинов и комплемента, а также ее инфильтрация макрофагами, Т-лимфоцитами и плазмоцитами. Большой удельный вес иммунных нарушений в патогенезе ПА подчеркивает эффективность селективных иммуносупрессоров (циклоспорин А, такролимус) и биологических агентов.
Как известно, в развитии псориаза и ПА существенное место принадлежит дисбалансу про- и противовоспалительных цитокинов 9. При этих заболеваниях наблюдается преобладание провоспалительных цитокинов, прежде всего ФНО-a, в биологических средах и тканях организма, в частности в очагах псориаза, синовиальной оболочке, энтезах, синовиальной жидкости и крови, причем выявлена прямая коррелятивная зависимость активности воспалительного процесса с содержанием этого цитокина. При кожном псориазе ФНО-а также имеет большое значение, способствуя активации Т-лимфоцитов, воспалительной инфильтрации и пролиферации кератиноцитов. Показано, что экспрессия провоспалительных цитокинов в синовиальной оболочке, включая ФНО-а, интерлейкин (ИЛ)-2, интерферон у и, особенно, ИЛ-10 при ПА выше, чем при ревматоидном артрите, т.е. том заболевании, при котором дисбаланс цитокинов рассматривается в качестве ведущего патогенетического механизма. В этом же плане определенное значение имеет выявление TNFabc1d3, который не встречается у здоровых лиц и выявляется у больных псориазом и ПА.
Любой воспалительный процесс в организме характеризуется сложностью и многоступенчатостью своего развития, что и определяет появление большого числа лекарственных средств с разнообразным механизмом действия. Одним из медиаторов широкого спектра действия, участвующим в функциональной активности клеток иммунной системы и поливалентной регуляции иммунного воспаления, а также в реализации воспалительных процессов в организме, является ФНО-а, а введение ингибиторов этого цитокина в клиническую практику является одним из самых крупных достижений современной медицинской науки и практики.
Еще в 1996 г. было установлено, что неконтролируемая гиперпродукция ФНО-а лежит в основе хронизации иммунопатологического процесса и костной деструкции [11]. Он синтезируется моноцитами, макрофагами, дендритными клетками дермы, кератиноцитами, клетками Лангерганса, тучными клетками и активированными Т-лимфоцитами и обладает широким спектром биологических эффектов. Этот цитокин повышает экспрессию клеточных и сосудистых молекул адгезии (ICAM и Е-селектин), участвующих в миграции лимфоцитов в зону воспаления, активирует лимфоциты и пролиферацию фибробластов, стимулирует синтез простагландинов, лейкотриенов, оксида азота, а также матриксных металлопротеиназ, в частности коллагеназы, стромелизина и желатиназы, которые способствуют костно-хрящевой деструкции. Этот цитокин путем активации факторов транскрипции (прежде всего, ядерного фактора кВ) регулирует активность нескольких генов, кодирующих синтез провоспалительных цитокинов, таких как ИЛ-1, ИЛ-6, гранулоцитарно-макрофагальный колониестимулирующий фактор, интерферон g и провоспалительных хемокинов (ИЛ-8 или RANTES), а также других медиаторов воспаления. Кроме того, ФНО-а повышает содержание С-реактивного и других острофазовых белков, индуцирует синтез свободных кислородных радикалов и тормозит апоптоз воспалительных клеток, а также принимает активное участие в костном ремодулировании, усиливая RANKL-зависимый остеокластогенез [2, 12].
Антитела в сверхмалых дозах (СМД) обладают рядом уникальных свойств. Введение в организм СМД антител к эндогенным регуляторам физиологических функций (гормоны, цитокины, мембранные белки и др.) не блокируют функциональную активность молекул, к которым они выработаны, а модифицируют их эффекты [13, 14]. Следует отметить, что антитела к эндогенным регуляторам физиологических функций в малых (эквивалентная концентрация 10-6 массовых долей) и сверх-малых ( *p
Выраженность утренней скованности и ее продолжительность претерпели существенные изменения только к концу 6-го месяца лечения (уменьшились в 1,6 и 1,3 раза соответственно по сравнению с исходными значениями). Эти данные указывают на целесообразность проведения длительной терапии препаратом "Артрофоон", который по своим фармакологическим свойствам является медленнодействующим. Положительной динамике подверглись и другие показатели воспалительного процесса, в частности число болезненных и воспаленных суставов (см. рис. 1). Не было выявлено влияния артрофоона на кожный синдром: индекс распространенности и тяжести псориаза не претерпел существенных изменений. Отмечена тенденция к снижению СОЭ и улучшению функции пораженных суставов по показателю HAQ. Глобальная оценка состояния здоровья, по мнению пациентов, претерпела достоверные и позитивные изменения уже к 3-му месяцу терапии, и такая тенденция продолжала нарастать (табл. 3, рис. 3, 4). Терапия артрофооном позволила достигнуть значительного улучшения и улучшения к 3-му месяцу у 68% больных и к 12 - у 72%, в то время как ухудшение наблюдали только у 3 больных.
Артрофоон характеризуется высокой безопасностью. Нежелательные явления были зарегистрированы лишь у 4 из 25 больных, из них у 2 наблюдали усиление болей в суставах в первые 10 дней лечения. Эти явления держались в течение 1-2 нед и полностью проходили без коррекции программы лечения. Еще у 2 больных наблюдали диспепсические явления, что могло быть также связано с приемом НПВП.
Таким образом, артрофоон при ПА обладает антивоспалительной и аналгезирующей активностью, а также способствует нормализации функционального состояния суставов и позвоночника. Он обладает хорошей переносимостью и безопасен при длительном лечении. Позитивной стороной этого препарата является его небольшая стоимость. Его целесообразно применять при минимальной и умеренной активности воспалительного процесса в качестве составной части комплексной антивоспалительной терапии осложненного псориаза, при этом он позволяет снижать суточную потребность в НПВП вплоть до полного отказа от них. Необходимы дальнейшие исследования по оптимизации терапии сверхмалыми дозами антител к ФНО-а, проведение длительных (на протяжении 12 мес и более) многоцентровых хорошо контролированных исследований, что позволит наиболее полно определить место и значение артрофоона в комплексной терапии ПА, конкретные показания к его назначению, выбор оптимальной суточной и курсовой дозы.
Фактор некроза опухоли является белком, с которым связывают многие воспалительные состояния, включая артрит. У здорового человека фактор некроза опухоли (ФНО) помогает организму бороться с инфекциями. Однако у людей с аутоиммунными заболеваниями отмечается повышение уровня ФНО в крови, что может вызвать нежелательные воспаление. Фактор некроза опухоли связан с воспалительными состояниями, такими как псориатический артрит, ревматоидный артрит, язвенный колит и болезнь Крона. ФНО может убивать определенные опухолевые клетки. Ученые изучают способы использования ФНО для лечения определенных видов рака.
Фактор некроза опухоли и воспаление
ФНО является белком, который играет роль в естественном процессе заживления. Когда человек получает травму или поражен бактериальной или вирусной инфекцией, его организм запускает механизм воспаления, чтобы защитить область и восстановить. Чтобы запустить воспаление, белки ФНО начинают циркулировать в крови и поступают в область, где необходимо вызвать процесс воспаления. У здоровых людей организм деактивирует избыток ФНО в крови, поэтому он не вызывает воспаление. Когда этот процесс работает плохо, у человека может развиться аутоиммунное состояние.
Типы ФНО
Существует семейство белков ФНО, и каждый тип играет различную роль в организме. Результаты исследования, проведенные в конце 1980-х и начале 1990-х годов, показали, что чрезмерная продукция определенного типа ФНО, называемого ФНО-альфа, приводит к разрушительному воспалению, наблюдаемому при ревматоидном артрите. ФНО-альфа запускает продукцию нескольких молекул иммунной системы, включая интерлейкин-1 и интерлейкин-6. Обе молекулы участвуют в процессе, который разрушает хрящ и кость, вызывая еще большее воспаление.
Симптомы высокого ФНО
У здоровых людей повышенный уровень ФНО не должен вызывать беспокойство. Организм способен регулировать свои иммунные реакции, чтобы избежать неадекватного воспаления. Однако у людей с аутоиммунным заболеванием высокий уровень ФНО приводит к обострению их состояния.
Исследователи связывают многие аутоиммунные заболевания с высоким уровнем ФНО-альфа в крови. При таких заболеваниях белок приводит к избыточному воспалению, что, в свою очередь, проявляется такими симптомами, как боль. Все эти состояния являются хроническими и не поддаются лечению.
Воспалительные состояния, которые врачи связывают с ФНО
Женщины в три раза чаще страдают этим заболеванием, чем мужчины. Состояние чаще всего поражает суставы рук, ног, запястий, локтей, коленей и стопы, которые характеризуются ригидностью и отеком. У женщин ревматоидный артрит обычно проявляется в возрасте от 30 до 60 лет, в то время как у мужчин он чаще встречается в более позднем возрасте.
Приблизительно у 30% людей с псориазом кожи также проявляется псориатический артрит. Симптомы включают боль в суставах и скованность. Состояние может вызвать слабость, проблемы с глазами, отеки и слабость в пальцах и стоп.
Ювенильный артрит является общим термином, который включает:
- ювенильный идиопатический артрит;
- ювенильный дерматомиозит;
- ювенильную волчанку;
- ювенильную склеродермию;
- Болезнь Кавасаки.
Перечисленные заболевания имеют много общих симптомов, таких как боль, отек суставов, покраснение кожи. Состояния могут поражать глаза, кожу, мышцы и желудочно-кишечный тракт.
Воспалительные заболевания кишечника относится к группе гастроэнтерологических состояний. К ним относятся болезнь Крона и язвенный колит, симптомами которых являются воспаление в кишечнике. Это приводит к таким симптомам, как боль, слабость, ректальное кровотечение и диарея.
Анкилозирующий спондилит является одним из видов артрита, который в основном поражает позвоночник и приводит к сильной боли. Наряду со своим воздействием на позвоночник, анкилозирующий спондилит может также поражать другие области тела, вызывая боль и скованность. Но чаще всего влияет на:
- плечевой сустав;
- тазобедренный сустав;
- мелкие суставы рук;
- мелкие суставы ног.
Симптомы анкилозирующего спондилита имеют тенденцию развиваться от 17 до 45 лет.
Как снизить уровень ФНО?
Люди с воспалительными состояниями здоровья могут снизить уровень ФНО с помощью ряда манипуляций.
Врачи зачастую назначают людям с аутоиммунными заболеваниями препараты, которые называются ингибиторами ФНО. Ингибиторы ФНО включают в себя:
- инфликсимаб;
- этанерцепт;
- адалимумабом;
- цертолизумаб.
Ингибиторы ФНО обычно вводятся под кожу в бедро или живот или в виде инфузии непосредственно в вену. Назначают эти препараты в течение длительного времени, обычно требуется около 3 месяцев, чтобы заметить улучшение. Как и все лекарственные средства, они могут вызывать побочные эффекты. К ним относятся боль или отек в месте инъекции и повышенный риск инфекций, включая туберкулез и грибковую инфекцию.
Некоторые исследователи считают, что куркумин (соединение в куркуме) может снизить уровень ФНО в крови. Ученые пришли к выводу, что куркумин, по-видимому, способен подавлять пути, которые ведут к воспалению. Однако большинство исследований проводились в лаборатории, а не на людях. Необходимо провести больше исследований, прежде чем подтвердить эффективность куркумина в качестве блокатора ФНО у людей.
Ряд авторов считают, что экстракты плодов граната могут помочь снизить уровень ФНО у людей, живущих с воспалительными заболеваниями.

Приглашаем подписаться на наш канал в Яндекс Дзен
- 4963
- 4,1
- 0
- 5
Моноклональные антитела — новая надежда в лечении ревматических заболеваний.
![]()
Анна Огородник
![]()
Антон Чугунов![]()
Андрей Панов




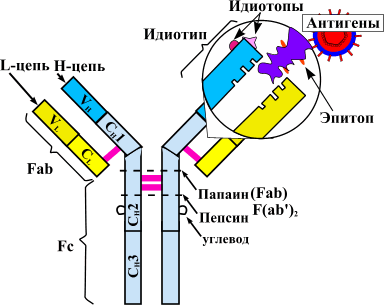
Теорию аутоиммунитета сформулировал еще столетие назад немецкий исследователь Пауль Эрлих. За последующие годы описано множество аутоиммунных заболеваний. К ним относятся ревматоидный артрит, системная красная волчанка (СКВ), системная склеродермия, миопатии, васкулиты и прочие патологии .
Болезни, ассоциированные с аутоиммунным компонентом, — серьезная проблема современного общества . Их распространенность в мировой популяции составляет примерно 5%. Заболевания быстро переходят в хроническую форму, из-за чего снижается качество жизни пациентов. Аутоиммунные патологии часто приводят к инвалидизации больных [1], [4].
Несмотря на многолетний поиск новых путей фармакотерапии, современная медицина не может предложить способов лечения, непосредственно влияющих на причину возникновения аутоиммунитета. Врачи способны лишь замедлить прогрессирование патологии и снизить выраженность клиники — провести патогенетическое и симптоматическое лечение. Для этого разработана базисная терапия, которая применяется уже многие годы. Однако не всегда проверенные препараты работают так, как надо.
Почему необходимо искать новые способы лечения?
Для лечения аутоиммунных заболеваний используют широкий арсенал противоревматических лекарств. Классическая терапия включает нестероидные противовоспалительные средства, глюкокортикоиды, цитостатики. В зависимости от особенностей развития заболевания подбирают препараты из той или иной группы [4].
- Большие иммунодепрессанты:
- глюкокортикоиды (преднизолон, дексаметазон);
- антибиотики (циклоспорин, такролимус);
- антиметаболиты (метотрексат, азатиоприн, меркаптопурин);
- цитостатики (циклофосфан).
- Малые иммунодепрессанты:
- плаквенил, хингамин;
- купренил;
- препараты золота (ауронофин);
- гепарин;
- нестероидные противовоспалительные средства.
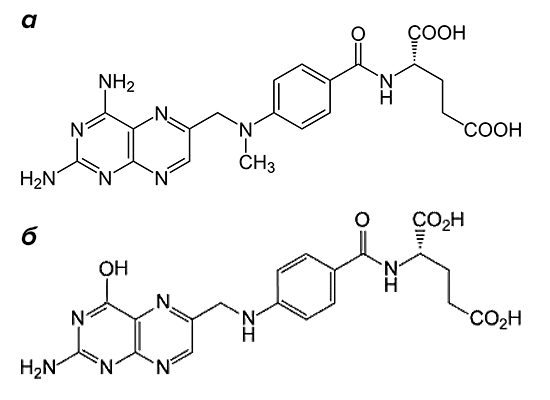
Рисунок 2. Структурные формулы метотрексата и фолиевой кислоты. Препарат (а) по строению похож на фолиевую кислоту (б). Он состоит из птеридиновых групп и парааминобензойной кислоты. Действующий компонент метотрексата отличается от структуры фолата отсутствием гидроксильной группы (–OH) и наличием дополнительного метильного радикала (–CH3).
По механизму действия метотрексат относится к антиметаболитам. Препараты этой группы тормозят физиологические реакции в организме, связываясь с ферментами и выключая их активность. Вещество, которое в норме участвует в реакции, уже не может попасть в биохимический круговорот из-за повышенной конкуренции с компонентами лекарства. Основной мишенью для действия метотрексата является фермент, расщепляющий фолиевую кислоту, — дигидрофолатредуктаза (ДГФ). Этот белок воздействует на поступающий в организм фолат, переводя его в активную форму. При этом образуется тетрагидрофолиевая кислота. Она участвуют в синтезе строительного материала для ДНК — пуриновых оснований и тимидилата.
Метотрексат вклинивается в цепочку реакций благодаря структурному сходству с молекулой фолиевой кислоты (рис. 2). Конкуренция за фермент приводит к тому, что содержание активного фолата в ткани значительно снижается. Нет строительного материала — нет и новых молекул ДНК, без которых клетки не могут размножаться. Повышенной чувствительностью к воздействию лекарства обладают те ткани, структурные элементы которых постоянно делятся. К ним относятся и компоненты костного мозга, из которых формируются будущие иммунные клетки.
Еще один важный момент в работе метотрексата связан с активностью его полиглутамированных метаболитов. Эти молекулы формируются после активации препарата непосредственно в клетках человеческого организма. Они ингибируют другие ферменты, которые взаимодействуют с фолиевой кислотой. В эту группу входят тимидилсинтетаза и АИКАР-трансамилаза. Активность производных метотрексата запускает процесс выработки аденозина. Он оказывает мощное противовоспалительное действие, благодаря чему снижается выраженность симптомов ревматоидного артрита [7].
Метотрексат удобно использовать — он легко дозируется и может назначаться длительными курсами. Кроме того, важное преимущество этого препарата — низкая цена, в сравнении с современными лекарствами импортных фармкомпаний [8]. Несмотря на все достоинства, лечение метотрексатом не всегда приводит к снижению активности заболевания. У многих пациентов использование препарата неэффективно даже в комбинации с другими классическими средствами [5]. Это подтверждается при анализе статистики. Исследования показали, что при проведении лечения метотрексатом и комбинациями базисных препаратов только половина пациентов достигла ремиссии [9], [10].
Несостоятельность классической терапии заставляет ученых искать новые способы лечения ревматоидного артрита. Стоит отметить, что, несмотря на новые разработки, борьбу с заболеванием все же начинают с назначения метотрексата и его аналогов. Дополнительные препараты используют только при высокой активности аутоиммунного процесса. У таких пациентов применение одного лекарства часто бывает неэффективно [7]. В зависимости от особенностей течения патологии подбирают подходящую схему терапии (рис. 3).
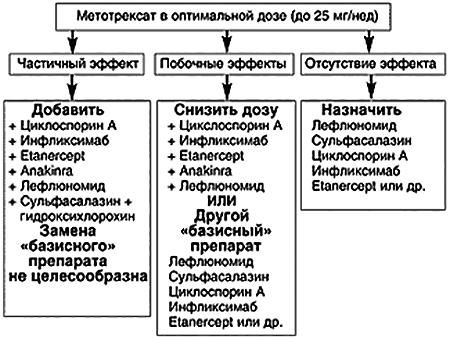
Рисунок 3. Тактика ведения пациента с ревматоидным артритом при неэффективности использования метотрексата.
Неэффективность препаратов базисной терапии встречается не только при ревматоидном артрите, но и при других заболеваниях аутоиммунного происхождения (системной красной волчанке, склеродермии, болезни Бехтерева). Это мотивирует специалистов-ревматологов разрабатывать другие лекарства и подбирать новые схемы терапии.
Генно-инженерные препараты: дополнение к базисной терапии
По-новому взглянуть на лечение аутоиммунных заболеваний позволила разработка терапевтических моноклональных антител [11]. Принципиально новый класс препаратов получен благодаря достижениям генной инженерии. Для понимания механизма действия этих лекарств стоит вспомнить о том, как работают иммунные клетки в норме и при патологии [1], [12].
При аутоиммунных заболеваниях можно подавлять сразу весь сложный механизм иммунитета, что и делают препараты классической терапии. Но это оставляет человека без защиты от вражеских агентов — бактериальных инфекций, вирусов и прочих патогенов. Поэтому предпочтительнее сохранить активность иммунной системы в целом, избавив человека от аутоагрессии определенных ее компонентов. Именно так работают новые препараты — моноклональные антитела.
- Ингибиторы ФНО (фактора некроза опухолей) — инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
- Блокаторы интерлейкиновых рецепторов — тоцилизумаб (ИЛ-6R), канакинумаб (ИЛ-1R), секукинумаб (ИЛ-17R).
- Анти-В-клеточные антитела (антитела к мембранным молекулам CD20) — ритуксимаб, белимумаб [17].
- Анти-Т-клеточные антитела (антитела к молекулам CD80 и CD86) — абатацепт [18].
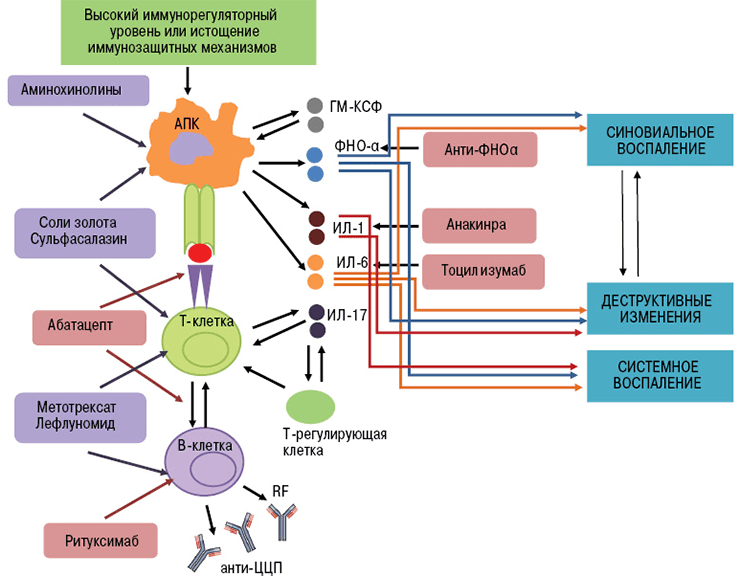
Ингибиторы фактора некроза опухолей — это первые моноклональные антитела, внедренные в ревматологическую практику. В эту группу входят инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
Фактор некроза опухолей (ФНО) — это провоспалительный цитокин (вещество, которое стимулирует развитие воспалительной реакции). В норме при его выделении происходит пролиферация клеток сосудов, активация макрофагов, лизис опухолевых агентов. Эти эффекты играют важную роль в защите организма от патогенов. Воспаление можно считать ответной реакцией на воздействие повреждающих факторов.
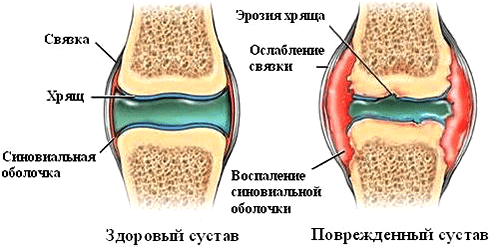
Рисунок 5. Патологические изменения в суставе при ревматоидном артрите. Аутоиммунный процесс вызывает появление эрозий, синовит (воспаление синовиальной оболочки), разрушение суставного хряща.
Такое строение связано с механизмом получения препарата. Первоначально синтезируют антитело к фактору некроза опухолей в организме мыши. Полученный иммуноглобулин специфичен к ФНО и уже может его обезвреживать, но полностью чужеродные белки вводить в организм пациентов, конечно, нельзя. Это вызовет активную иммунную реакцию — выработку антител уже против терапевтических агентов. Поэтому домены мышиного иммуноглобулина заменяют сходными участками человеческих белков. Антитела, имеющие фрагменты разного происхождения, называются химерными. Фактически, они берут лучшие качества своих предшественников. Мышиная часть обеспечивает высокую чувствительность к ФНО, а человеческие фрагменты снижают иммуногенность — вероятность развития иммунного ответа.
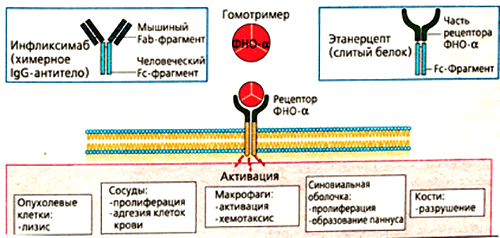
Рисунок 6. Основные эффекты ФНО и блокирующие его моноклональные антитела (инфликсимаб и этанерцепт). Мишенями для моноклональных антител являются свободная и мембраноассоциированная формы фактора некроза опухолей. Лекарства препятствуют связыванию цитокина с рецептором, благодаря чему снижается активность ревматоидного артрита.
В развитии аутоиммунного воспаления важную роль играют интерлейкины, которые, как и ФНО, относятся к провоспалительным цитокинам (рис. 7). Основными представителями этой группы являются ИЛ-6, ИЛ-1, ИЛ-17. Функция интерлейкинов — это контроль процессов дифференцировки, пролиферации и гибели (апоптоза) иммунных клеток, который осуществляется через соответствующие гены-мишени [20].
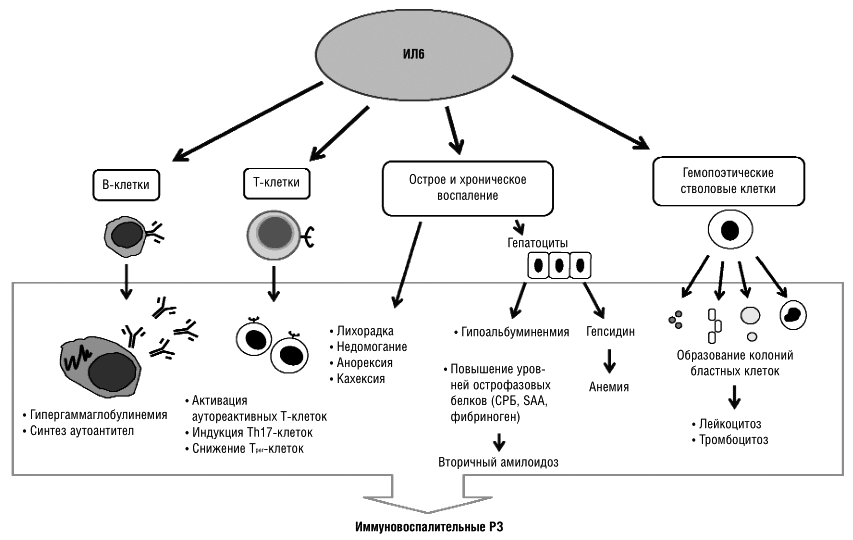
Рисунок 7. Механизм действия интерлейкинов при аутоиммунном воспалении (на примере ИЛ-6). Цитокин влияет на T- и B-лимфоциты, гемопоэтические клетки, гепатоциты. Он стимулирует выработку аутоантител В-клетками, а также формирование аутореактивных Т-клонов, которые непосредственно участвуют в аутоиммунном процессе. Влияние на костный мозг заключается в стимуляции выработки новых клеток крови — повышается число лейкоцитов и тромбоцитов. Воспаление сопровождается ответной реакцией клеток печени, появлением характерных симптомов аутоиммунного заболевания.
Тоцилизумаб — это препарат, который блокирует работу ИЛ-6. Рецептор этого вещества состоит из двух компонентов — мембранного ИЛ-6R (α-цепь) и гликопротеина g130 (β-цепь). Мембранная часть рецептора связывается с ИЛ-6, образуя устойчивый комплекс. Вместе они активируют компонент g130, вызывая изменение его структуры (гомодимеризацию). Образуется рецепторный комплекс из двух молекул g130, который в свою очередь активирует JAK1-киназу. Этот фермент запускает каскад реакций в клетке, который приводит к появлению биологического эффекта цитокина — развитию воспаления. В некоторых случаях ИЛ-6 связывает не мембранная, а растворимая форма α-цепи (рис. 8). Механизм действия рецептора при этом не меняется [21].
В основе работы тоцилизумаба лежит конкуретное ингибирование. Сигнальные молекулы активно связываются с моноклональным антителом. Вакантное место занято — интерлейкин не может образовать комплекс с рецептором, а значит, он не способен активировать процесс воспаления.
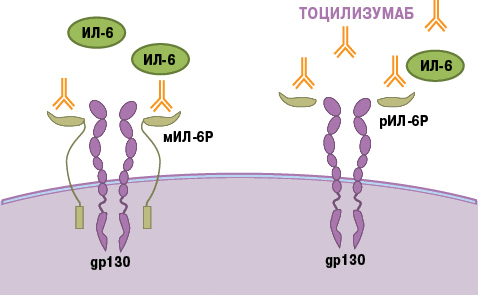
Рисунок 8. Механизм действия тоцилизумаба. Препарат связывает растворимые и мембранные рецепторы ИЛ-6, блокируя передачу сигналов.
Тоцилизумаб считается одним из самых безопасных препаратов, входящих в группу моноклональных антител. Это позволяет применять его при ювенильном идиопатическом артрите, который возникает в возрасте до 16 лет. Дети особенно остро реагируют на токсические воздействия, поэтому препараты, которые используют при их лечении, должны иметь минимальное число побочных реакций. Применение тоцилизумаба позволяет достигнуть необходимого эффекта лечения, не вызвав тяжелых осложнений.
Препараты из группы анти-B-клеточной терапии (ритуксимаб и белимумаб) блокируют активность В-лимфоцитов путем связывания их мембранных молекул CD20. Эти вещества есть только у определенных категорий В-клеток. Они специфичны для пре-В-лимфоцитов и зрелых В-лимфоцитов. CD20 нет у стволовых элементов и про-В-клеток, из которых будут образовываться новые лимфоцитарные элементы. Мембранные молекулы данного типа не содержатся и у плазматических клеток, которые вырабатывают иммуноглобулины [22].
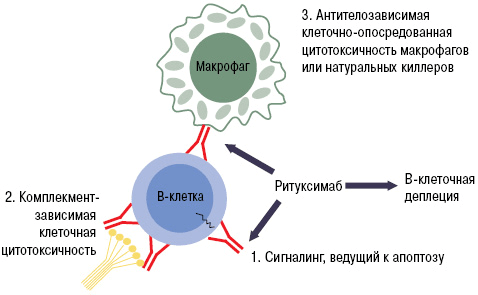
Рисунок 9. Механизм работы ритуксимаба. Fab-фрагмент моноклонального антитела связывается с CD20 на поверхности B-лимфоцита. Это запускает лизис клетки, который может осуществляться несколькими путями: через систему комплемента, программу апоптоза или агрессию натуральных киллеров и макрофагов.
Блокировка действия Т-лимфоцитов возможна благодаря особенностям их активации. Чтобы Т-лимфоцит вступил в аутоиммунный процесс и связался с антигеном, он должен получить два сигнала от антигенпрезентирующих клеток (АПК). Первый сигнал обеспечивает распознавание специфического аутоантигена Т-клеточными рецепторами. Второй сигнал — это неспецифический процесс связывания мембранных молекул CD80 и CD86 на поверхности АПК с рецептором CD28 лимфоцита. Сочетание этих взаимодействий вызывает активацию Т-клеток, которые в свою очередь стимулируют выработку провоспалительных цитокинов. Это и есть основной вклад Т-лимфоцитов в аутоиммунный процесс.
Знания о механизме активации Т-клеток использовали при разработке моноклональных антител. Основной представитель анти-Т-клеточных агентов — это абатацепт. Препарат представляет собой белок, состоящий из двух частей. Специфическая часть образована молекулой CTLA-4 (антиген 4 цитотоксических лимфоцитов). Неспецифическая область — это Fc-фрагмент человеческого иммуноглобулина G1 [23].
Воздействие абатацепта направлено как раз на неспецифический (костимулирующий) сигнал. Компонент CTLA-4 связывает белки CD80 и CD86 на поверхности антигенпрезентирующих клеток. Рецептор лимфоцита CD28 уже не может взаимодействовать с ними, из-за чего активация Т-клетки не завершается (рис. 10).
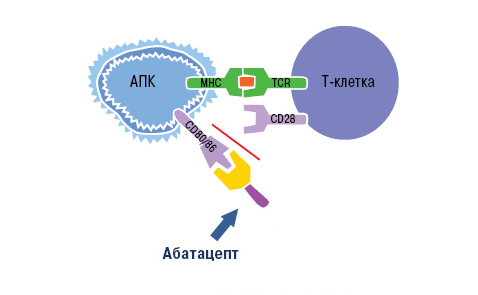
Рисунок 10. Механизм действия абатацепта. Абатацепт модулирует иммунный ответ через связывание с CD80/CD86 на антигенпрезентирующих клетках. Это препятствует связыванию CD80/CD86 с CD28 T-клеток, то есть активация Т-клеток отменяется через блокировку костимуляции.
Не всё так просто: возможные проблемы при использовании моноклональных антител
Например, одна пачка метотрексата стоит примерно 200 рублей. Цена упаковки инфликсимаба — около 43 тыс. рублей. Разница очевидна. За год лечения метотрексатом даже в максимальной дозировке пациент потратит на лекарство 1–2 тыс. рублей (в зависимости от фирмы-производителя, схемы лечения и стоимости препарата в местных аптеках). Цена годовой терапии инфликсимабом составляет примерно 700 тыс. рублей. Понятно, что самостоятельно обеспечить себя этим лекарством сможет только очень ограниченная группа пациентов.
Использование биологических препаратов допустимо в тех случаях, когда к базисным средствам у пациента развивается непереносимость. Больные испытывают тяжелое побочное воздействие лекарства, которое еще сильнее ухудшает их состояние. Применение препаратов с другим механизмом действия, в том числе и моноклональных антител, позволяет минимизировать побочные эффекты [18].
Другая сложность, с которой можно столкнуться при использовании биологических препаратов, — это побочные реакции. Параллельно с накоплением данных об эффективности использования лекарств выявляют все новые нежелательные эффекты от их применения. Большая часть таких реакций связана с процессом иммуносупрессии. Подавляя активность иммунных клеток, моноклональные антитела снижают защитную функцию организма. В первую очередь страдают противоинфекционный и противоопухолевый иммунитеты [18], [24].
Парадоксально, но применение новых лекарств против аутоиммунитета может вызвать острые аутоиммунные реакции. Все биологические препараты представляют собой белковые молекулы, которые в той или иной степени чужеродны для организма. Поэтому при проникновении терапевтических агентов в тело больного иммунитет может распознать их как антигены. Появляется активный иммунный ответ — вырабатываются антитела уже против компонентов препарата.
Несмотря на все возможные сложности, моноклональные антитела прочно вошли в регистр лекарств, применяющихся в ревматологии. Перспектива использования биологических препаратов и их место в ревматологии будет зависеть от результатов многолетних исследований, которые еще предстоит провести. Но даже сейчас можно сказать, что разработка терапевтических моноклональных антител является важным шагом на пути к победе над аутоиммунным воспалением.
Читайте также:





