Как лечить инфекцию после глубокой стимуляции мозга
Глубокая стимуляция мозга (DBS) является хирургическим лечением, при котором устройство под названием нейростимулятор обеспечивает крошечные электрические сигналы в участки мозга, которые контролируют движения. Система DBS состоит из трех частей:
- Тонкий, изолированный провод – электрод, который помещается в мозг
- Нейростимулятор, похожий на кардиостимулятор, который обычно помещается под кожу около ключицы, но может быть размещен в других частях тела
- Другой тонкий изолированный провод называемый расширением, который подходит к нейростимулятору

DBS требует хирургического вмешательства, чтобы правильно разместить каждую часть нейростимуляторной системы. DBS у взрослых обычно состоит из двух отдельных операций. 1 этап, как правило, проводится под местной анестезией, то есть вы не спите, но вы не ощущаете боль. (Если процедура проводится у детей, общий наркоз дается).
- Ваша голова помещается в специальную рамку и крепится с помощью винтов, чтобы держать её во время процедуры. Анестетик вкалывается где будут прижиматься винты к голове.
- Лекарство, вызывающее онемение распространяется также на волосистую часть головы на место, где хирург просверлит небольшое отверстие в черепе и поместит электрод в определенную область мозга.
- Если обе стороны мозга лечатся, хирург сделает открытие с обеих сторон черепа, и два провода будут вставлены.
- Будут проводиться различные неврологические тесты, чтобы убедиться, что электроды вставлены правильно.
2 этап проводится под общей анестезией. Сроки этого этапа операции зависят от того, где в мозгу будет размещен стимулятор.
- Хирург делает небольшое отверстие, как правило, чуть ниже ключицы и внедряет нейростимулятор.(Иногда он помещается под кожу, в нижней части грудной клетки или живота).
- Хирург делает еще одно небольшое отверстие за ухом и помещает расширительный провод.
- Расширительный провод соединяется к нейростимулятору.
Эти крошечные импульсы мешают и блокируют электрические сигналы, которые вызывают тремор и симптомы, двигательных расстройств, таких, как те, которые происходят с болезнью Паркинсона, эссенциальный тремор, или обсессивно-компульсивное расстройство. Эта операция может стать альтернативой для пациентов с очень тяжелыми симптомами болезни Паркинсона, которая не может управляться лекарствами. Операция не излечивает болезнь Паркинсона, но может помочь уменьшить тяжесть симптомов, такие как:
Глубокая стимуляция мозга может также использоваться для лечения следующих условий:
- Тремор
- Дистония
- Толчки рук, связанные с рассеянным склерозом
- Синдром Туретта (в редких случаях)
- Обсессивно-компульсивное расстройство
Риски
DBS считается безопасным и эффективным, когда выполняется у правильно подобранных пациентов. Риски, связанные с глубокой стимуляцией мозга могут включать в себя:
- Аллергическая реакция на DBS части
- Трудности с концентрацией
- Головокружение
- Инфекция
- Утечка цереброспинальной жидкости, что может привести к головной боли или менингиту
- Потеря равновесия
- Снижение координации
- Незначительные потери движения
- Проблемы со зрением
- Временная боль или припухлость в месте, где устройство было имплантировано
- Временные покалывания в области лица, рук или ног
Проблемы могут также возникнуть, если компоненты системы DBS ломаются или перемещаются. Например, это могут быть:
- Разлом устройства, который может привести к другой операции, чтобы заменить сломанные детали
- Выход из строя батареи, которая обеспечивает работу должным образом (батарей обычно хватает от 3 до 5 лет)
- Провод, который соединяет стимулятор пробивает кожу (обычно это происходит только у людей с очень тонкой кожей)
Возможные риски любой операции на головном мозге:
- Сгусток крови или кровотечение в головном мозге
- Отек головного мозга
- Кома
- Путаница, как правило, длится только в течение нескольких дней или недель, не более
- Инфекция в мозге, в ране или в черепе
- Проблемы с речью, памятью, проблемы равновесия, зрения, координации, а также другие функции, которые могут быть краткосрочными или постоянными
- Приступы
DBS, как правило, хорошо переносится и не повреждает нервные клетки, как и другие хирургические методы лечения болезни Паркинсона. Многие пациенты отмечают значительное улучшение симптомов после того, как проходят это лечение. Тем не менее, большинству из них по-прежнему необходимо принимать лекарства, хотя и в меньших дозах, которые улучшают качество их жизни. Эта операция, является рискованной для людей старше 70 лет и для тех у кого хронические заболевания. Вы и Ваш врач должны тщательно взвесить все преимущества этой операции против потенциальных рисков. Процедура DBS может быть отменена, если это необходимо. Большинство людей, которые прошли DBS находятся в больнице в течение 3 дней. Врач может прописать антибиотики для предотвращения возможного заражения. Позвоните своему врачу, если у Вас возникли любые из следующих проблем:
- Лихорадка
- Головная боль
- Зуд и сыпь
- Мышечная слабость
- Тошнота и рвота
- Онемение или покалывание на одной стороне тела
- Боль
- Покраснение, отек, раздражение
- Проблемы с речью
- Проблемы со зрением
Электрическая стимуляция зон, участвующих в управлении движением – успешный метод терапии болезни Паркинсона. Но этот подход требовал имплантации в мозг пациента электродов – сложной процедуры с определенными рисками (мы подробно писали об этом методе в цикле материалов, посвящённых болезни Паркинсона).


Электроды для лечения болезни Паркинсона, как правило, размещаются в субталамическом ядре – структуре, расположенной под таламусом глубоко внутри мозга. Электростимуляция этой области может улучшить состояние многих пациентов, но и операция по имплантации электродов несет в себе риски, в том числе — кровоизлияние в мозг и инфекции.
Команда из Массачусетского технологического института в сотрудничестве с исследователями медицинского центра Диакониссы Бет Израель (Beth Israel Deaconess Medical Center, BIDMC) и фонда IT’IS разработала способ неинвазивной электрической стимуляции областей глубоко внутри мозга через электроды, помещаемые на кожу головы, благодаря очень красивой физике процесса. В методе электроды, расположенные за пределами мозга, генерируют два высокочастотных электрических поля, частоты которых различаются лишь на очень небольшую величину (в эксперименте на мышах авторы применяли поля с частотой колебаний 2,01 КГц и 2 КГц ровно). Суть в том, что столь высокочастотные поля не оказывают никакого стимулирующего эффекта на нейроны, которым для стимуляции нужны частоты на два порядка меньше.
И здесь на помощь приходит явление интерференции. Два этих близких по частоте поля перекрываются глубоко в мозге, их частоты со сдвигом накладываются друг на друга и взаимно вычитаются. Так в этой области возникает низкочастотное поле, стимулирующее только нейроны в области перекрытия. Согласитесь, некое подобие (по принципу получения рабочей зоны перекрытием нескольких лучей или полей, не влияющих на мозг) гамма-ножа. Получившееся поле стимулирует активность нейронов, в то время как ток высокой частоты проходит через окружающие ткани при отсутствии эффекта.
Меняя частоту тока, количество и расположение электродов, ученые могут контролировать размер и расположение области головного мозга, которая получит низкочастотную стимуляцию. Они могут настраиваться на места в глубине мозга, не затрагивая окружающие структуры. А также регулировать расположение без перемещения электродов, просто изменяя частоту тока. Таким образом можно стимулировать участки мозга как в терапии, так и для научных исследований.

Исследователи протестировали этот метод на мышах и обнаружили, что могут стимулировать небольшие области в глубине мозга, включая гиппокамп. Они также были в состоянии переместить место стимуляции, что позволяет им активировать разные участки моторной коры и побудить мышь переместить свои конечности, уши или усы.
«Я предполагаю, что эта технология может стать портативной для неинвазивной глубокой стимуляции мозга в качестве терапии. Если работа может быть осуществлена на более крупных животных, чем мыши, я буду еще более оптимистичен”, — заявил Типу Азиз (Tipu Aziz), профессор нейрохирургии в Оксфордском университете, который не был вовлечен в исследование.
Примечательно, что в экспериментах на гиппокампе мыши метод вообще не затронул нейроны в коре головного мозга — области, лежащей между электродами на черепе и цели глубоко внутри мозга. Исследователи также не обнаружили никаких вредных воздействий ни в одной части головного мозга.
Врачи также предполагают использовать свой метод для лечения некоторых пациентов с обсессивно-компульсивным расстройством, эпилепсией и депрессией, и изучают возможность ее использования для лечения других заболеваний – например, аутизма. Благодаря новому неинвазивному подходу, возможно, будет легче адаптировать глубокую стимуляцию мозга для лечения многих неврологических заболеваний.
Текст: Любовь Пушкарская
Noninvasive Deep Brain Stimulation via Temporally Interfering Electric Fields. Nir Grossman et al, Cell, June 1, 2017
Глубокая стимуляция мозга — это метод лечения, при котором осуществляется раздражение слабыми токами определенных участков головного мозга. Методика схожа с искусственным водителем ритма сердца, она признана и применяется с большим успехом в лечении двигательных расстройств при таких заболеваниях, как болезнь Паркинсона. Процедура также используется для лечения эпилепсии, хронической боли, и обсессивно-компульсивного расстройства.
Что такое глубокая стимуляция мозга?
Сама система состоит из нейростимулятора, электродов, программного устройства и пульта управления. Электроды водятся непосредственно в ту область, которая отвечает за патологический процесс. Каждый электрод имеет четыре контактных пункта из платины, это делает возможным стимуляцию на разной глубине. Посредством электрического кабеля электроды соединены с нейростимулятором (водителем ритма), который имплантируется под кожу в области груди. Пульсогенератор программируется с помощью компьютера (программного устройства) по беспроводному соединению. То есть стимуляция может быть настроена в соответствии с клинической картиной пациента.
Является ли данное лечение болезненным или опасным?
Глубокая стимуляция мозга является инвазивным хирургическим вмешательством, по сути, с помощью дрели происходит вторжение в череп, затем электроды вставляются глубоко в мозг, поэтому вся операция проходит под местной анестезией. Во время операции производится нейрофизиологическое обследование и контроль электрических импульсов, которые вызываются определенным ареалом мозга, что дает возможность гарантировать правильное и оптимальное положение электродов в участке головного мозга.
Риски могут быть разделены на три группы: связанные с самим хирургическим вмешательством; побочные эффекты операции; побочные эффекты глубокой мозговой стимуляции. Риски операции индивидуальны в каждом конкретном случае. В любом случае, врачи контролируют процесс операции таким образом, чтобы минимизировать возможные побочные эффекты.
Данный метод был использован для лечения болезни Паркинсона в течение 20 лет. В среднем при двигательных расстройствах после глубокой стимуляции мозга улучшение наблюдается у подавляющего большинства пациентов. Исследования показывают, что при применении глубокой стимуляции мозга у двух из трех пациентов с тяжелой формой депрессии наблюдаются значительные улучшения в состоянии.
Какие пациенты могут пройти глубокую стимуляцию мозга?
Глубокая стимуляция мозга является признанной методикой лечения пациентов с медикаментозными, экстрапирамидальными нарушениями движений. ГСМ также применяется и у пациентов с тяжелым депрессивным синдромом. На сегодняшний день глубокая стимуляция мозга дала успехи при лечение таких заболеваний, как болезнь Паркинсона, эссенциальный тремор, дистония, эпилепсия, депрессивные состояния.
Глубокая стимуляция мозга не проводится у пациентов с повышенным анестезиологическим риском, а также у пациентов с дополнительными сопутствующими психическими или неврологическими заболеваниями.
Рекомендации
До и после имплантации электродов выполняется магнитно-резонансная томография (МРТ) непосредственно в операционном зале. Через 2-3 недели после операции, когда клиническая картина достаточно стабильна и сделана первоначальная корректировка стимулятора, пациент может быть выписан. В последующие месяцы необходимо посещать врача с контрольными визитами, чтобы отрегулировать какие-либо изменения параметров стимуляции и назначить лекарственную терапию.
Улучшение симптомов болезни Паркинсона проявляется в течение первых нескольких дней после начала стимуляции. Это позволяет уменьшить дозы дофаминергических препаратов на 50 — 80%, при этом 15 – 20% пациентов, которым совсем не нужно принимать терапию.
Подготовка пациента
Перед началом операции пациент проходит тщательное клиническое обследование с использованием шкалы оценки болезни Паркинсона, в соответствии с состоянием ума, повседневной деятельности, двигательных функций, осложнений терапии, прогрессирования заболевания и стадии болезни. Перед процедурой врач проводит беседу с пациентом, в ходе которой уточняется состояние пациента, симптомы заболевания, препараты и другие лечебные мероприятия, которые использовались для лечения в прошлом. Также проводятся дополнительные тесты, а именно: анализы крови, рентген грудной клетки, ЭКГ, рентген черепа, КТ или МРТ головного мозга — цель которых – удостовериться, что проведение глубокой мозговой стимуляции не только возможно, но и безвредно и не приведет к ухудшению состояния.
Многие знают о том, что одним из способов лечения болезни Паркинсона является нейрохирургическая операция. Небольшая часть читателей хорошо понимает, о чем идет речь, и уже серьезно задумывается об операции для себя или своих близких. Но большинство все же слабо представляет себе, что это такое, кому показаны и противопоказаны операции и как врачи научились проникать в мозг без нарушения других функций тела.
До 1980-х единственным хирургическим способом облегчить симптомы болезни Паркинсона была общемировая практика деструкций – разрушение нервных клеток в тех частях мозга, которые отвечают за движение. Деструктивные операции (таламотомия, паллидотомия) до сих пор практикуются, но их основной минус – это необратимость разрушений, т.е. погибшие клетки не восстанавливаются.
Альтернативой деструкциям при болезни Паркинсона стала операция по глубокой стимуляции мозга, или DBS – Deep Brain Stimulation.

Пионерами в этой области выступили французы – нейрохирург Алим Бенабид (Alim Benabid) и невролог Пьер Поллак (Pierre Pollak), которые в 1980-е в Гренобле впервые провели операцию по имплантированию электродов в раздел мозга под названием гипоталамическое ядро. Впоследствии глубокая стимуляция мозга стала золотым стандартом хирургического лечения болезни Паркинсона.
На данный момент операция по глубокой стимуляции мозга показана пациентам на более продвинутой стадии заболевания, когда симптомы болезни сложно контролировать медикаментозно без серьезных побочных эффектов.
Я делюсь подробным и понятным описанием операции, которое я нашла на одном русскоязычном сайте.
Система для DBS состоит из трех компонентов:
• Электрод, представляющий собой тонкий изолированный провод с открытым концом, внедряемый в мозг посредством небольшого отверстия на черепе.
• Подкожная система проводов, которая позволяет поместить генератор сигналов на расстоянии от головного мозга. Провода размещаются под кожей и проходят через голову, шею и плечи.
• Нейростимулятор – устройство, генерирующее импульсы. Размещается также подкожно, обычно в области ключицы.

Компоненты устройств для пациента
Процедуру проводят квалифицированные нейрохирурги. Установка компонентов системы проходит в два этапа. На первом этапе под местной анестезией проделывается небольшое отверстие в черепе. Процедура проводится без общей анестезии для того, чтобы во время установки общаться с пациентом и уточнять его ощущения.
Введение электрода проходит без болей, поскольку мозг человека обладает уникальной особенностью – он не может передавать болевые сигналы, потому что не имеет болевых рецепторов. Для точного введения электродов используется система трехмерной компьютерной навигации, что позволяет точно определить зону головного мозга, ответственную за тремор.
После установки электродов в течение нескольких недель устройство настраивается посредством регулировки специальных магнитов. Настройка может проходить в течение нескольких недель.
Когда эффективность достигнута, осуществляется второй этап процедуры – размещение нейростимулятора, которое может проводиться либо под общей, либо под местной анестезией.
После завершения этапов процедуры пациенту выдается специальное устройство магнитного действия, с помощью которого он может управлять прибором (включать или выключать). Батареи в нейростимуляторе хватает на 3-5 лет, самые современные устройства имеют более долгий срок службы – до 10 лет.
На видео вы можете увидеть пациента с болезнью Паркинсона 1) до операции; 2) сразу после операции без включения электродов; 3) электроды подключены.
Важно знать!
! Глубокая стимуляция мозга подходит НЕ всем людям с болезнью Паркинсона.
Большое число людей с болезнью Паркинсона, которые задумываются об операции, не являются подходящими для нее кандидатами. В то же время часть пациентов, которым эта операция принесет серьезное облегчение, совершенно не знают о ней.
! Глубокая стимуляция уменьшает проявления болезни Паркинсона, но не дает полного излечения и не влияет на прогресс заболевания.
! Операция DBS влияет на тремор, скованность и замедленность движений.
! После глубокой стимуляции мозга пациенты продолжают принимать антипаркинсонические лекарства, но уже в меньшей дозировке.
Кто является идеальным кандидатом на глубокую стимуляцию мозга и как врачи делают отбор?
1. Идиопатическая форма болезни Паркинсона (болезнь возникла сама по себе без связи с генетическими нарушениями или другими заболеваниями, такими как инсульт)
4. Исчерпан весь ресурс медикаментозного лечения
5. Отсутствие деменций и когнитивных нарушений
6. Реалистичные ожидания от операции
Кому НЕ подходит глубокая стимуляция мозга?
Здесь есть несколько важных показателей:
1. Минимальный или отсутствующий эффект от принятия леводопосодержащих лекарств
2. Серьезные когнитивные нарушения
3. Депрессии или другие психические расстройства
4. Неконтролируемая гипертензия или повышенная склонность организма к кровотечениям и кровоизлияниям
Наиболее подходящее время для операции со времени постановки диагноза показано на рисунке.

Лучшее время для глубокой стимуляции мозга
Возможные осложнения после операции:
- Увеличение веса (у 95% пациентов)
- Нарушение речи
- Гиперкинезы
Обратите внимание, как ученые в США и других странах работают над улучшением операции по глубокой стимуляции мозга. Возможно, и в наших странах скоро появится что-то подобное.
Традиционно, два наиболее распространенных места стимуляции – это области субталамического ядра и бледного шара. Но другие зоны также обладают потенциалом.
• Внедрение электродов в проводящие пути, соединяющие различные области мозга
• Стимуляция с обратной связью (“closed-loop” stimulation)
Предполагается, что встроенное в мозг устройство будет записывать волны, излучаемые мозгом. На основе этих сигналов можно будет определять дисфункциональные периоды работы мозга (например, когда ухудшаются симптомы болезни в течение дня) и включать электроды именно в период ухудшений (сейчас стимуляторы работают без остановки).
Такая ограниченная стимуляция позволит сохранить продолжительность жизни батареи и потенциально удлинить время действия терапевтического эффекта от операции.
• Высокоинтенсивный сфокусированный ультразвук (пока на стадии клинических испытаний)
Эта методика – альтернатива деструкциям и подойдет пациентам, которым в силу медицинских показателей не подходит глубокая стимуляция мозга. Процедура является неинвазивной (не нарушается целостность тканей) и направлена на разрушение клеток, выполняющих моторную функцию.
Давайте подведем небольшой итог.
Если вы или ваши близкие принимаете препараты леводопы и относительно хорошо себя чувствуете, то имейте операцию в виду как альтернативу на будущее. Пока не исчерпаны медикаментозные возможности, операция может подождать.
Хроническая глубокая стимуляция мозга (ХГСМ) стала методом выбора в хирургии двигательных расстройств, заняв место таких процедур, как таламотомия и паллидотомия, которые широко используются для лечения пациентов с болезнью Паркинсона (БП), тремором или дистонией. По сравнению с абляционной хирургией, ХГСМ предлагает неповреждающую модуляцию базальных ганглиев; ее последствия являются принципиально обратимыми кроме того, ее можно адаптировать в зависимости от течения заболевания и индивидуальных потребностей пациента.
Основное преимущество, однако, в том, что двусторонняя операция может быть выполнена в один оперативный прием без повышенного риска побочных эффектов. Возрождается интерес к хирургическому лечению БП, а также интерес к функциональной стереотаксической хирургии для других двигательных расстройств, таких как дистония. В крупных рандомизированных исследованиях ХГСМ было показано, что она обеспечивает существенную выгоду при БП и треморе, а также при дистонии.
Механизмы хронической глубокой стимуляции мозга (ХГСМ) являются предметом интенсивных исследований, и они все еще полностью не изучены. Судя по данным анализа записей микроэлектродов и локальных потенциалов от базальных ганглиев. Хроническая глубокая стимуляция мозга (ХГСМ), вероятно, инактивирует патологические импульсы от базальных ганглиев.
В будущем хроническая глубокая стимуляция мозга (ХГСМ) может быть использована в сочетании с другими новыми методами лечения, технологиями, и перспективными направлениями, такими как вирусные векторы, генная терапия, терапия стволовыми клетками и введение нейротрофических факторов.
В настоящее время хроническая глубокая стимуляция мозга (ХГСМ) утвердилась в качестве мощной нейрохирургической процедуры для лечения различных двигательных расстройств. Помимо основных показаний для ХГСМ, улучшение было также доказано для таких редких заболеваний как гемихорея/гемибаллизм, синдрома Мейгса и нейродегенерации, связанной с пантотенаткиназой (PKAN). Этот раздел дает краткий обзор принципов хирургии ХГСМ и основных показаний и клинических результатов ХГСМ для двигательных расстройств.
а) Принципы хирургии хронической глубокой стимуляции мозга (ХГСМ) двигательных расстройств:
1. Анатомия и цели. Общие цели при БП, треморе и дистонии показаны на рисунке и таблице ниже.
Другие цели — педункулопонтинные ядра и интраламинарные ядра таламуса. Самой выгодной мишенью для лечения тремора является вентроинтермедиальное ядро таламуса или задние вентролатеральные ядра. Дорсолатеральная часть субталамического ядра и заднебоковые сегменты бледного шара являются общими анатомическими целями ХГСМ при лечении болезни Паркинсона (БП). Заднебоковые сегменты бледного шара были установлены также в качестве целевого выбора при тяжелой дистонии. Для лечения вторичной дистонии при ХГСМ было предложено воздействие на таламус.

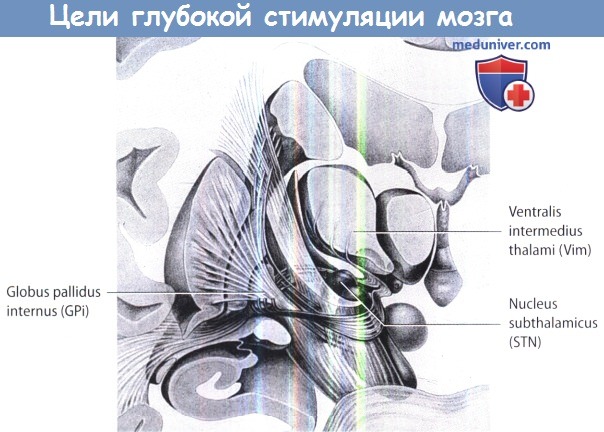
Общие анатомические цели для глубокой стимуляции мозга. 
Анатомические цели для глубокой стимуляции мозга при лечении двигательных расстройств.
2. Оборудование. Система ХГСМ состоит из трех основных компонентов:
1. Имплантируемый генератор импульсов (ИГИ).
2. Удлинительный кабель подключения электродов и ХГСМ ИГИ.
3. Четырехполюсные (четыре контакта) ХГСМ-электроды (две модели с различными зазорами между контактами: 3387, 1,5-мм интервалы и 3389 0,5-мм интревалы; Medtronic)
На протяжении многих лет два разных ИГИ были доступны для ХГСМ: одноканальные системы (например, Soletra, Medtronic) или двухканальные системы (например, Kinetra, Medtronic,).
С 2009 г. в комплект входят также перезаряжаемые аккумуляторные батареи ИГИ. Два электрода могут быть подключены к двухканальному ИГИ. Устройство для внешнего программирования используется для изменения регулируемых переменных, в том числе выбора стимулирующих контактов, длительности импульса, амплитуды и частоты. ИГИ можно выключить или изменить его параметры в заданных пределах с помощью ручного программатора.
3. Оперативная техника. Стереотаксическая хирургия позволяет достичь определенной целевой области в любой точке мозга с трехмерной точностью наведения системы координат. Стереотаксическая система состоит из прямоугольной или круглой рамы, которая крепится к голове пациента с помощью штифтов под местной анестезией. Каждое место в мозге может быть определено в прямоугольной системе координат (X/Y/Z) или в полярной системе координат относительно рамки. Для расчета целевых координат, выполняют стереотаксическое КТ и/или стереотаксическое МРТ сканирование.
Как правило, операция проводится под местной анестезией, чтобы пользоваться контактом с пациентом, в частности, для тестирования порогов эффективности подавления симптомов и побочных эффектов от макростимуляции. При тяжелой дистонии или у детей оперируют под общим наркозом. Для дальнейшего уточнения цели используются несколько нейрофизиологических методов. Самым простым является запись с микроэлектрода. После имплантации электродов ХГСМ макростимуляция осуществляется через различные контакты.
Для тестирования клинической эффективности или для записи местных потенциалов электрод может располагаться снаружи. При второй процедуре он подключается через удлинитель к ИГИ, размещаемому подкожно в подключичной области под общей анестезией. Риск операции сравнительно невелик. В недавнем исследовании (n=319) зафиксированы серьезные осложнения, включая судороги у четырех пациентов (1,2%), внутримозговые кровоизлияния у двух пациентов (0,6%), внутрижелудочковое кровоизлияние у двух пациентов (0,6%) и субдуральную гематому у одного пациента (0,3%).
4. Неполадки оборудования. Технические проблемы, связанные с оборудованием, могут включать дислокацию электродов из-за недостаточной фиксации на фрезевом отверстии, кабельные разъединения (кабель-удлинитель) и инфекции системы (кабеля или ИГИ). Общий уровень инфекции описывается в диапазоне от 2 до 10%. В серии из 119 пациентов в 15% случаев было 23 аппаратных осложнения, которые включали восемь поломок электродов, четыре миграции электрода, две миграции стимулятора, три эрозии, две эрозии и инфекции, два случая инфекции и два случая неисправности ИГИ. Большинство из этих осложнений произошло в первые четыре года после операции. В случае инфекции в первую очередь следует назначать антибиотики; если это не удается, всю систему иногда приходится удалять.
Полный разряд батареи в ИГИ требует дополнительной операции. Время до разряда батареи отличается в зависимости от выбранных параметров стимуляции (амплитуды, длительности импульса и выбора контактов). Необходимость смены ИГИ батареи чаще у пациентов с дистонией (1-3 года) в связи с более высокой энергией стимуляции, чем при болезни Паркинсона (БП) или у пациентов с тремором (3-6 лет).
в) Отбор пациентов для глубокой стимуляции мозга. Для рассмотрения возможности ХГСМ необходимо соответствующее диагностическое исследование и медикаментозное лечение. Заметьте, что ХГСМ является комплесным подходом, включающим междисциплинарный отбор и наблюдение за пациентами. Противопоказаниями являются слабоумие, психопатологические изменения и тяжелая депрессия. Кроме того, ограничивающим фактором может быть преклонный возраст.
1. Хроническая глубокая стимуляция мозга при треморе. Тремор определяется как непроизвольные ритмические колебания одной или нескольких частей тела. Типы тремора классифицируются по режиму активации (отдых, действия или кинестезии), частоте, наследственности и сопутствующей симптоматике, которая может прояснить этиологию тремора (симптомы других нарушений движения, полинейропатии и др.). Распространенность тремора составляет до 400/100000 в нормальной популяции и до 4,8% у пациентов старше 65 лет.
Тремор может быть не просто помехой, но привести к инвалидности и к серьезным социальным осложнениям. Консервативное лечение тремора включает в себя применение пропранолола, примидона или топирамата. Медикаментозная терапия первой линии для лечения тремора при болезни Паркинсона во многих случаях не дает существенного улучшения. Фармакологическая терапия, с другой стороны, часто неэффективна при треморе. Это должно быть учтено, однако атаксия, сопровождающаяся тремором, плохо контролируется ГСМ. Было отмечено, что у пациентов с БП дополнительные симптомы, такие как постуральная нестабильность, акинезия или ригидность, которые могут возникнуть при развитии болезни, не зависят от ГСМ таламуса.
Таким образом, вряд ли таламус является целью при ХГСМ у молодого пациента с тремором. ГСМ субталамического ядра подавляет тремор в одинаковой степени при БП. ГСМ таламуса можно использовать, но вероятно, только у пожилых пациентов с БП, страдающих моносимптомным тремором в течение многих лет.
2. Хроническая глубокая стимуляция мозга при болезни Паркинсона (БП). БП—результат дегенерации нескольких конкретных областей, и, в частности, дисфункции нигростриарных путей в связи с потерей дофаминергических нейронов в черной субстанции. Основные двигательные симптомы — акинезия, ригидность, тремор и постуральная неустойчивость — сопровождаются сенсорным, вегетативным, психологическим и когнитивным дефицитом. Распространенность среди населения в возрасте старше 55 лет была оценена как 1,5-2,0%. ХГСМ—вариант лечения для пациентов с болезнью Паркинсона.
Лучший кандидат для хирургического лечения — пациент, хорошо реагирующий на дофаминергическую терапию, но имеющий двигательные осложнения, которые развиваются через 5-7 лет дофаминергической терапии. Снижается выраженность тяжелых флюктуаций и дискинезии, также улучшаются основные двигательные симптомы БП (тремор, ригидность, акинезия, и постуральная неустойчивость).
После стимуляции доза дофаминергических препаратов может быть уменьшена. Депрессия или тревожность могут также зависеть от ХГСМ. Должны быть учтены возраст пациента и стадия заболевания. В целом возраст не должен превышать 70 лет, а стадия заболевания не должна быть терминальной. Степень послеоперационного улучшения может быть предсказана предоперационным ответом на прием леводопы, что имеет первостепенное значение для выявления пациентов с другими паркинсонизмами, такими как множественная системная атрофия, прогрессивный супрануклеарный паралич и кортикобазальноядерная дегенерация.
В этих случаях результаты от ХГСМ обычно отсутствуют. У пациентов с моносимптомным тремором при БП ХГСМ таламуса может быть альтернативой в пожилом возрасте, так как в меньшей степени вызывает психосоциальные или когнитивные проблемы.
3. Хроническая глубокая стимуляция мозга при дистонии. Дистония характеризуется устойчивым сокращением мышц, часто вызывая скручивание и повторяющиеся движения или ненормальные позы. Дистонию можно классифицировать по трем различным направлениям: возраст начала заболевания, анатомическое распределение (очаговая, сегментарная, общая, гемидистония) и этиологии (первичная или вторичная). Спастическая кривошея или цервикальная дистония (ЦД) является наиболее распространенной формой координационной дистонии. ЦД встречается у 0,39% жителей США.
Фокусная дистония может успешно лечиться инъекциями ботулинического токсина. При гемидистонии, сегментарной или общей дистонии, часто необходим хирургический подход в связи с распространенным вовлечением нескольких групп мышц. В то же время пациенты с первичной (генетической или спорадической) генерализованной и сегментарной дистонией и пациенты со сложными ЦД считаются лучшими кандидатами для паллидумальной ХГСМ. В целом, пациенты с первичными дистониями, по всей видимости, хорошо реагируют на лечение, а пациенты с вторичными дистониями отвечают на лечение хуже.
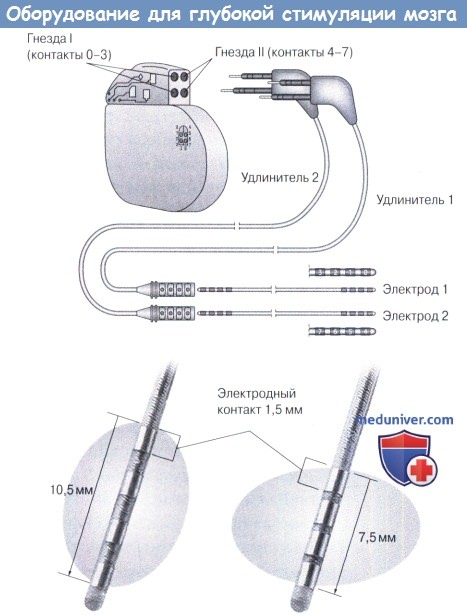
Оборудование для глубокой стимуляции мозга. Четырехполюсные электроды и имплантированный генератор импульсов (ИГИ) соединены кабелями. 
А-Г. Стереотаксические рамки. CRW рамка (А), рама Leksell (Б), рама Riechert-Mundiger (В), рама Riechert-Mundiger с аркой Zamorano-Dujovny (Г). 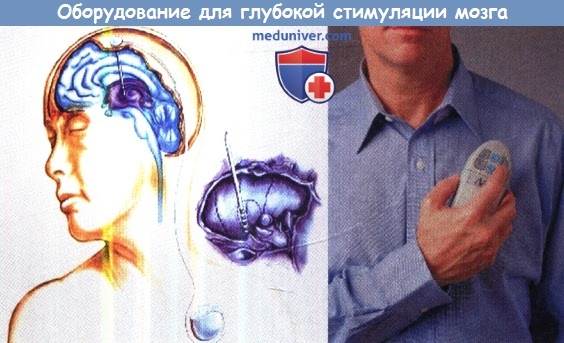
Программер для включения, выключения либо смены частоты ИГИ. 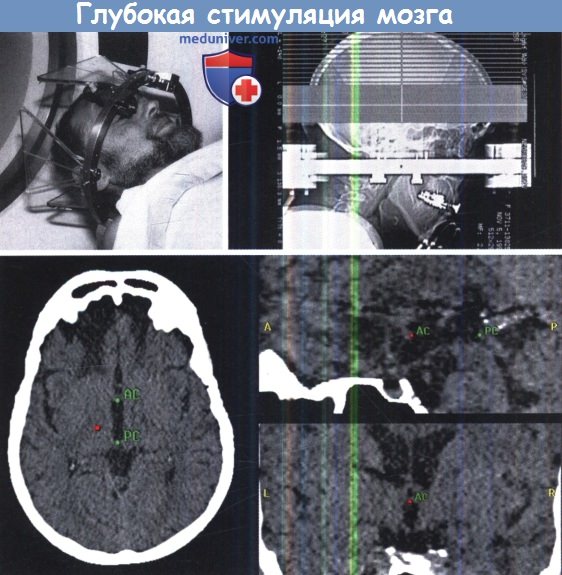
Стереотаксическая рамка (рама Riechert-Mundiger), установленная на голове пациента и полученные стереотаксические изображения (верхний ряд).
Идентификация передней и задней комиссур на КТ с одновременным улучшением визуализации в аксиальной, сагиттальной и коронарной проекциях (нижний ряд). 
Возможен наклон линии АС-3С относительно стереотаксической рамки во всех трех плоскостях.
Эти отклонения должны быть скорректированы с использованием специальных измерительных алгоритмов.
Читайте также:


