Кардиоваскулярная патология при ревматоидном артрите
При обнаружении у больного РА митрального стеноза всегда необходимо исключать его ревматическую этиологию, так как сочетание РА с предшествующим ревматическим пороком признается многими авторами. Патогмоничным признаком ревматоидного артрита являются рев
Ревматоидный артрит (РА) — хроническое системное воспалительное заболевание соединительной ткани с прогрессирующим поражением преимущественно периферических (синовиальных) суставов по типу симметричного эрозивно-деструктивного полиартрита с частыми внесуставными проявлениями, среди которых поражение сердца, по данным вскрытия, отмечается в 50-60% случаев [1, 4, 7]. Изменения в сердце при РА в недавнем прошлом выделяли в суставно-сердечную форму заболевания. При поражении суставов, когда заметно снижается физическая активность, сердечная патология часто маскируется, что требует от врача более внимательного и тщательного обследования больного. При этом клинические изменения со стороны сердца, как правило, минимальные и редко выходят на первый план в общей картине основной болезни. Системные проявления РА, в том числе и поражение сердца, определяют прогноз в целом, поэтому важно их раннее распознавание и целенаправленное лечение.
 |
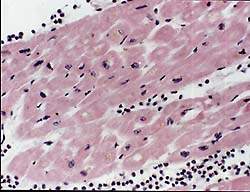
| Рисунок 1. Интерстициальный миокардит, умеренный васкулит. Окр. гематоксилином и эозином. Х 150 |
Частота поражения миокарда при РА в форме миокардита не выяснена. Это обусловлено, с одной стороны, трудностью диагностики миокардита у лиц с ограниченной двигательной активностью, с другой — отставанием клинических проявлений от морфологических изменений сердца [6, 7]. Патология миокарда носит полиморфный характер в связи с наличием различной давности сосудистых поражений [7]. В одних сосудах имеется васкулит, в других — гиалиноз, в третьих — склероз. Характер васкулита может быть пролиферативным и редко пролиферативно-деструктивным. В воспалительном инфильтрате преобладают лимфогистиоцитарные элементы как в периваскулярном пространстве (рис. 1), так и в стенке сосудов. Следует отметить, что при активации основного процесса наблюдается сочетание старых и свежих сосудистых изменений. Наряду с этим встречается очаговый, или диффузный, интерстициальный миокардит, заканчивающийся развитием мелкоочагового кардиосклероза. У больных ревматоидным артритом нередко развивается бурая атрофия миокарда с накоплением липофусцина в кардиомиоцитах (рис. 2). Эти изменения могут являться причиной стенокардии. Патогмоничным признаком ревматоидного артрита являются ревматоидные узелки в миокарде, перикарде и эндокарде в основании митрального и аортального клапанов, в области фиброзного кольца. В исходе узелка развивается склероз, вызывающий формирование недостаточности клапанов. Миокардит проявляется и диагностируется, как правило, на высоте активности основного ревматоидного процесса, то есть при очередном выраженном обострении суставного синдрома.
 |
| Рисунок 2. Интерстициальный миокардит. Отложения липофусцина в перинуклеарных пространствах. Окр. гематоксилином и эозином. Х 400 |
Ведущей жалобой при миокардите в дебюте поражения сердца являются неприятные ощущения в области сердца (кардиалгии), невыраженные, длительные, разлитые и без четкой локализации, как правило, без иррадиации и не купирующиеся нитратами. К основным жалобам относятся сердцебиение, перебои и реже одышка при физической нагрузке. Быструю утомляемость, повышенную потливость и субфебрилитет врачи обычно связывают с очередным обострением РА, а не с кардиальной патологией [3].
При аускультации физикальные данные выявляют тахикардию и ослабление I тона с систолическим шумом, нередко удается выслушать III тон. Как правило, миокардит при РА не склонен к прогрессированию, признаки сердечной недостаточности отсутствуют [4].
При обычном ЭКГ-исследовании могут отмечаться снижение зубцов Т, опущение интервалов ST, небольшие нарушения внутрижелудочковой проводимости. Эти изменения неспецифичны и могут сопровождать различные заболевания. Более характерное для миокардитов замедление атриовентрикулярной проводимости бывает редко.
В литературе описано значительное число наблюдений, когда нарушение ритма сердца служит единственным патологическим симптомом поражения коронарных артерий. Нарушение ритма и проводимости при активном РА существенно чаще определяется при суточном мониторировании ЭКГ и чреспищеводном электрофизиологическом исследовании, чем при обычной ЭКГ. Так,
И. Б. Виноградова [2] при исследовании больных РА с использованием вышеуказанной методики выявила нарушение ритма и проводимости у 60% больных, в том числе предсердную (18%) и желудочковую (10%) экстрасистолию, пароксизмальную тахикардию (4%), мерцательную аритмию (6%), проходящую блокаду правой ножки пучка Гиса (20%) и атриовентрикулярную блокаду II степени (2%). Также было высказано предположение, что депрессия ST, выявляемая при чреспищеводном электрофизиологическом исследовании, является косвенным признаком изменения коронарной микроциркуляции вследствие ревматоидного васкулита. Поэтому у данных больных отмечены высокие уровни циркулирующих иммунных комплексов, ревматоидного фактора, антител к кардиолипину Ig M. Важно отметить, что в этой же группе больных имелись другие признаки васкулита: дигитальный артериит, сетчатое ливедо, синдром Рейно и ревматоидные узелки. Следовательно, если рутинные клинические методы исследования не выявляют достаточно убедительных признаков ревматоидного миокардита, то современные электрофизиологические исследования обнаруживают факты нарушений функции сердца, что указывает на связь этих изменений с активностью ревматоидного процесса. Подтверждением этому может служить положительная динамика изменений под влиянием адекватного лечения основного заболевания, обычно отмечаемая при регрессе суставного синдрома.
Дифференциальная диагностика миокардита и миокардиодистрофии, нередко проводящаяся у больных РА, длительно получающих массивную лекарственную терапию, затруднена, т. к. клинические проявления в том и другом случае близки [5, 6]. Наличие миокардита подтвердит положительная динамика его проявлений под влиянием правильно подобранного и назначаемого в адекватных дозах противоревматического лечения.
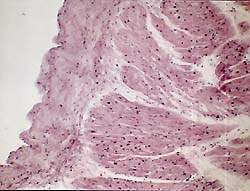 |
| Рисунок 3. Утолщение перикарда. Склероз. Окр. гематоксилином и эозином. Х 150 |
Перикардит является наиболее характерным поражением сердца при РА [1]. Патологоанатомически он выявляется в подавляющем большинстве случаев в виде фиброзного, реже геморрагического перикардита; нередко обнаружение характерных ревматических гранулем. Отличительной особенностью перикардита при ревматоидном артрите является участие в воспалении крупных базофильных гистиоцитов под зоной фибринозных наложений. Глубже формируется грануляционная ткань, содержащая лимфоциты и плазматические клетки, с утолщением перикарда и формированием грубого склероза (рис. 3).
Больной может предъявлять жалобы на боли в области сердца разной интенсивности и длительности. Частота клинической диагностики перикардита различна (20-40%) и зависит в основном от тщательности клинического изучения больного и уровня компетентности клинициста. В большинстве случаев анатомически определяются спайки в полости перикарда и утолщение последнего за счет склеротического процессса, нередко рецидивирующего. Выпот обычно небольшой, без признаков тампонады. Подтверждается, как правило, данными рентгенологического исследования, указывающими на нечеткость и неровность контуров сердца. Шумы трения перикарда непостоянны, выслушиваются далеко не у всех больных, хотя в некоторых случаях остаются длительно в виде перикардиальных щелчков в различные фазы сердечного цикла, что фиксируется качественным ФКГ-исследованием. ЭКГ-изменения у большинства больных неспецифичны для перикардита. Но в случае появления даже умеренного экссудата можно наблюдать снижение вольтажа QRS с положительной динамикой при уменьшении выпота. Перикардиты при РА склонны к рецидивированию. В части случаев перикардиты сопровождаются появлением конкордантных отрицательных зубцов Т на многих ЭКГ-отведениях, что может приводить к постановке ошибочного диагноза инфаркта миокарда. Большое значение в обнаружении РА-перикардитов имеет эхокардиография, позволяющая выявлять изменения перикарда (его уплотнение, утолщение, наличие жидкости) и динамику этих изменений при повторных исследованиях. Во многих случаях ЭХО-изменения перикардита являются неожиданной находкой как для больного, так и для лечащего врача [8].
Эндокардит при РА отмечается значительно реже, чем перикардит. Патологоанатомические данные свидетельствуют о нередком вовлечении в процесс эндокарда, в том числе клапанного, в виде неспецифических воспалительных изменений в створках и клапанном кольце, а также специфических гранулем. У большинства больных вальвулит протекает благоприятно, не приводит к значительной деформации створок и не имеет ярких клинических проявлений. Однако у некоторых больных течение вальвулита может осложняться деформацией створок и сопровождаться выраженной недостаточностью пораженного клапана, чаще митрального, что диктует необходимость хирургической коррекции порока. Обычно эндокардит сочетается с миокардитом и перикардитом. В литературе обсуждается возможность образования стенозов митрального и аортального клапанов, но единого мнения по этому вопросу нет [6]. При обнаружении у больного РА митрального стеноза всегда необходимо исключать ревматическую этиологию его, т. к. сочетание РА с предшествующим ревматическим пороком признается многими авторами [4].
С целью изучения характера клапанной патологии сердца при РА проанализированы результаты лечения 297 больных с достоверным РА по критериям АРА. Анализ показал, что чаще всего — в 61,6% случаев — имеет место митральная регургитация. При этом у 17,2% больных она была умеренной или выраженной. У 152 (51,2%) больных полипроекционное ЭХО-КГ-исследование структурных изменений створок клапанов не выявило. Более детальный анализ позволил выделить в отдельную группу 14 больных, которые имели в анамнезе ревматизм и ревматический порок сердца. РА эти больные заболели за 1–24 года до исследования (в среднем через 8,9 года). 7 человек из них имели характерные признаки ревматического митрального стеноза (у 3 — выраженного) в сочетании с митральной регургитацией разной выраженности и признаки аортального порока, который у 1 больной был диагностирован как сочетанный. У 2 больных митральный порок был в виде умеренной митральной недостаточности и комбинировался с недостаточностью аортального клапана. У 3 больных выявлены признаки ревматической недостаточности митрального клапана. У 2 больных отмечался выраженный сочетанный аортальный порок в комбинации с относительной недостаточностью митрального клапана.
Таким образом, наши данные подтверждают возможность заболевания РА лиц, ранее болевших ревматизмом и имеющих ревматические пороки сердца.
В отдельную группу были выделены 38 больных (средний возраст 58,7 года, давность РА 12,8 года) с наличием структурных изменений клапанного аппарата сердца в виде тотального краевого утолщения створок или отдельных очагов утолщения, нередко достигающих больших величин (13х6 мм), признаков кальциноза и ограничения подвижности створок. Створки митрального кольца оказались измененными у 19, аортального — у 33, трикуспидального — у 1 больной, причем у 16 пациентов были сочетанные изменения митрального и аортального клапанов, у 1 — митрального и трикуспидального. У 17 из 19 больных структурные изменения митральных створок сопровождались митральной регургитацией.
У 17 из 33 больных с изменениями аортальных створок диагностировалась аортальная регургитация, при этом у 12 она была умеренной или выраженной. У 16 больных, в том числе у 2 с признаками кальциноза, имел место склероз аортальных створок без нарушения функции клапана, что нашло свое подтверждение и неизмененным трансаортальным кровотоком. У 1 больной со значительным утолщением створок и умеренной аортальной регургитацией имелось ограничение открытия их (1-2 см) и повышение трансаортального градиента давления, т. е. признаки аортального стеноза. И еще у 1 больной 33-летнего возраста был диагностирован врожденный двухстворчатый аортальный клапан с признаками умеренной аортальной регургитации. Выраженная трикуспидальная регургитация была диагностирована у 3 больных с очаговым утолщением трикуспидальных створок, причем у 1 из них было диагностировано легочное сердце как осложнение ревматоидного поражения легких.
Возникает вопрос: все ли обнаруженные изменения у этой группы, состоящей из 33 больных, являются следствием РА? Анализ наших данных показал, что большинство больных этой группы были в возрасте 51–74 лет. У 19 из них диагностировалась артериальная гипертензия, имелись признаки ишемической болезни сердца, 4 больных перенесли инфаркт миокарда, 1 — острое нарушение мозгового кровообращения. Результаты исследования показали, что у лиц с высокими цифрами артериального давления изменения клапанного аппарата были более выраженными, и только у них диагностировался кальциноз митрального клапана и/или аортального клапана, признаки аортальной регургитации, гипертрофия стенки левого желудочка и межжелудочковой перегородки, а также утолщение стенок аорты с признаками дилятации и диастолическая дисфункция левого желудочка. Выявленные ЭХО-КГ-изменения в этой группе больных не отличаются от таковых при атеросклеротическом кардиосклерозе, атеросклерозе аорты и являются классическими. Поэтому в этой группе больных не представляется возможным исключить атеросклеротический генез пороков сердца. Вместе с тем вполне вероятно, что собственно ревматоидное поражение клапанов может служить тем благоприятным фоном, на котором в дальнейшем развиваются выраженные структурные изменения створок, патология которых доминирует как в клинической, так и в ЭХО-КГ-картине атеросклеротического поражения клапанов сердца. В каждом случае вопрос о генезе порока при РА требует учета всех имеющихся клинических данных.
1. Балабанова Р. М. Ревматоидный артрит. В кн.: Ревматические болезни (руководство по внутренним болезням)/ Под ред. В. А. Насоновой и Н. В. Бунчука. — М.: Медицина, 1997. С. 257-295.
2. Виноградова И. Б. Нарушение сердечного ритма и проводимости у больных ревматоидным артритом// Автореф. дис. . канд. мед. наук. М., 1998. С. 21.
3. Елисеев О. М. Амилоидоз сердца// Тер. арх. 1980. № 12. С. 116-121.
4. Котельникова Г. П. Поражение сердца при ревматоидном артрите// В сб.: Ревматоидный артрит. — М.: Медицина, 1983. С. 89-90.
5. Котельникова Г. П., Лукина Г. В., Муравьев Ю. В. Кардиальная патология при вторичном амилоидозе у больных ревматическими заболеваниями// Клин. ревматол. 1993. № 2. С. 5-8.
6. Немчинов Е. Н., Каневская М. З., Чичасова Н. В. и др. Пороки сердца у больных ревматоидным артритом (результаты многолетнего проспективного клинико-эхокардиографического исследования)// Тер. арх. 1994. № 5. С. 33-37.
7. Раденска-Лоповок С. Г. Морфологические методы исследования и диагностики в ревматологии В кн.: Ревматические болезни (руководство по внутренним болезням) под ред. В. А. Насоновой и Н. В. Бунчука. М.: Медицина, 1997. С. 80-94.
8. Цурко В.В. Асептический некроз головок бедренных костей при ревматоидном артрите и системной красной волчанке. Клинико-инструментальная диагностика и исходы: Автореф. дис. . д-ра мед. наук. М., 1997. С. 50
С позиции государственной статистики ревматические заболевания (РЗ) не относятся к категории жизнеугрожающих, однако в клинической практике системные заболевания соединительной ткани нередко являются причиной смерти больных молодого и среднего возраста. Ревматоидный артрит (РА), системная склеродермия (ССД), системная красная волчанка (СКВ), антифосфолипидный синдром (АФС), анкилозирующий спондилит (АС) и многие другие приводят к сокращению продолжительности жизни больных, а 5-летняя выживаемость больных с тяжелыми формами системных болезней соединительной ткани не превышает 50%, что сопоставимо с исходами при лимфогранулематозе и распространенных поражениях коронарных артерий [8, 9, 14, 23].
Исследования последних лет показали, что ведущей причиной снижения продолжительности жизни при РЗ являются кардиоваскулярные осложнения, связанные с атеросклеротическим поражением сосудов и тромбозами [1-4,8, 10,13,16]. Доклинические формы атеросклероза (эндотелиальная дисфункция, утолщение комплекса интим-медиа, повышение резистентности артериальной стенки, увеличение уровня коронарного кальция) у больных РЗ выявляются значительно чаще, чем в общей популяции [1-6, 10-16]. Установлено, что риск преждевременного развития и прогрессирования атеросклероза при РЗ выше, чем в популяции и ассоциируется не только с традиционными факторами риска, но и с активностью воспалительного процесса, а также проводимой лекарственной терапией [5,14].
Каждый третий больной РА [7] и 30% больных СКВ [6] имеют признаки доклинического атеросклероза. Показано, что у больных РА риск сердечно-сосудистые заболевания (ССЗ) в 2-5 раз выше, чем в общей популяции. Это уменьшает продолжительность жизни данной категории пациентов на 5-10 лет. У больных РА в 2 раза чаще, чем у больных без РА, развивается инфаркт миокарда и внезапная коронарная смерть. За 2 года до установления диагноза РА эти лица в 3 раза чаще госпитализируются по поводу острого коронарного синдрома, чем наблюдаемые в выборке из общей популяции [5,15]. При проведении коронароангиографии у больных РА с большей частотой, чем в контрольной группе, выявляется многососудистое атеросклеротическое поражение коронарных артерий [6]. Доказано, что риск ишемической болезни сердца (ИБС) у больных СКВ в 5-6 раз выше, чем в общей популяции, а у молодых женщин с СКВ в возрасте 35-44 года – в 50 раз [5-8, 13,16]. По данным проспективных исследований, примерно у 10% пациентов с СКВ наблюдаются клинические проявления атеросклероза (стенокардия, инфаркт миокарда, поражение мозговых и периферических артерий), а при аутопсии атеросклероз выявляют более чем у половины пациентов [18].
Известны некоторые особенности кардиоваскулярной патологии при РЗ. Так ревматоидный коронариит в большинстве случаев протекает бессимптомно и описан у больных ревматоидным артритом с генерализованным васкулитом. При СКВ у молодых пациенток развивается ишемия или инфаркт на фоне коронариита или раннего развития атеросклероза коронарных артерий [1-5,11, 21, 23-26]. В клинике больных АС частым проявлением является стенокардия. Особое место в структуре кардиоваскулярных нарушений при СКВ занимают тромбозы и тромбоэмболии, ассоциированные с вторичным АФС. Кардиальные проявления АФС включают развитие венозных, артериальных и внутрисердечных тромбозов с формированием венозной и артериальной гипертензии, ИМ, хронической ишемической дисфункции желудочков, клапанной патологии [8,9].
При системных васкулитах, в отличие от других РЗ, поражение сосудов — кардинальный и патогномоничный признак болезни [9]. В основе кардиоваскулярных проявлений системных васкулитов лежит иммунное воспаление структур сердца и сосудов, развитие системного некротизирующего васкулита, в том числе гранулёматозного, гигантоклеточного с образованием аневризматических выпячиваний (узелковый полиартереит, гранулёматоз Вегенера, бо-лезнь Хортона), либо деструктивных изменений в системе дуги аорты и её ветвей с их стенозированием и ишемией органов (болезнь Такаясу), либо с формированием гранулём и эозинофильных инфильтратов преимущественно в стенках легочных сосудов (синдром Чарджа- Стросс).
Обсуждается несколько возможных причин и их взаимосвязей, приводящих к увеличению риска кардиоваскулярных катастроф на фоне ускоренного атеросклеротического поражения сосудов при РЗ [2,4,10,11]:
1) накопление классических кардиоваскулярных факторов риска;
3) побочные эффекты лекарственной терапии (нестероидные противовоспалительные препараты (НПВП), глюкокортикостероиды, базисные противовоспалительные препараты);
4) недостаточное внимание к необходимости профилактики кардиоваскулярных осложнений при этих заболеваниях;
5) факторы, связанные с прогрессированием самих РЗ.
В многочисленных исследованиях [4,7,19, 27-33] подчёркивается важная роль классических факторов риска в развитии атеросклероза у пациентов с РЗ. Доказано, что детерминантами атеросклеротической бляшки и утолщения комплекса интима-медиа по данным ультразвукового исследования сонных артерий больных РА, СКВ и ССД являются возраст, пол, курение, дислипидемия, артериальная гипертензия, инсулинорезистентность, избыточный вес, малоподвижный образ жизни, отягощенная наследственность по сердечно-сосудистым заболеваниям [11, 12]. Показано, что РА и СКВ ассоциируются с инсулинорезистентностью и накоплением висцеральной жировой ткани. Оба состояния являются компонентами метаболического синдрома, который рассматривается в настоящее время как следствие субклинического иммунного воспаления и является фактором риска атеросклероза у больных РЗ.
Среди традиционных кардиоваскулярных ФР особое значение имеет курение, предрасполагающее к развитию не только ССЗ, но и серопозитивного РА, выявляемого у пациентов до клинической манифестации артрита, и ассоциирующееся с более тяжелым течением РА. При РА курение коррелирует с развитием атеросклеротического поражения сонных артерий и тяжестью кальцификации коронарных артерий. При исследовании влияния курения на уровни провоспалительных цитокинов показано, что у курящих мужчин концентрация ИЛ 6 выше, чем у некурящих (9,6±7,6 пг/мл против 6,2±6,6 пг/мл; р=0,013) [11,12]. Можно предположить, что курение реализует атерогенные эффекты посредством влияния на сосудистую стенку путем провоспалительных сигналов, ассоциированных с гиперпродукцией ИЛ 6. Системное воспаление играет важную роль в развитии нарушений, связанных с системой транспорта холестерина крови. Следует отметить, что у пациентов с РА за несколько лет до клинической манифестации заболевания наблюдается повышение уровня холестерина (ХС), триглицеридов (ТГ) и снижение концентрации ХС липопротеидов высокой плотности (ХСЛПВП). При активном РА нарушения липидного спектра крови проявляются в снижении концентрации атерогенных липидов (ХС, ТГ) и антиатерогенных липопротеидов (ХСЛПВП) и ассоциируются с повышением маркеров воспаления, прежде всего СРБ и ИЛ 6 [10,14, 28, 32].
У больных РА, ССД и СКВ установлена гипергомоцистеинемия - потенциально модифицируемый фактор риска атеросклероза. Гипергомоцистеинемия ассоциируется с утолщением комплекса интима-медиа и повышенным уровнем коронарного кальция, причем у пациентов со стабильной и нестабильной бляшками концентрация гомоцистеина достоверно отличается [1, 7, 13, 14]. Отмечена связь между гипергомоцистеинемией и приёмом БПВП с антифолатной активностью (метотрексат, сульфасалазин). На фоне приёма фолиевой кислоты наблюдают нормализацию уровня гомоцистеина при РА.
По сравнению со здоровыми лицами у больных РА и СКВ наблюдается увеличение концентрации маркеров гиперкоагуляции (фибриногена, тканевого активатора плазминогена, ингибитора тканевого активатора плазминогена типа 1, Д – димера и фактора фон Виллебранда), которые по данным эпидемиологических исследований ассоциируются с повышенным риском кардиоваскулярных осложнений [10, 12, 28-35].
Опубликованы данные о самостоятельном патогенетическом значении СРБ в процессах атерогенеза и атеротромбоза, увеличении риска сердечно-сосудистых катастроф у здоровых людей и больных ИБС [3]. Небольшое увеличение концентрации СРБ отражает субклиническое воспаление в сосудистой стенке, связанное с атеросклеротическим процессом [4]. В серии работ прослежена связь между атеросклеротическим поражением сосудов (утолщение комплекса интима-медия, наличие атеросклеротических бляшек по данным ультразвукового исследования сосудов) и концентрацией СРБ при СКВ и РА [2,8,16,19,22]. Имеются данные, что у мужчин с недифференцированным артритом увеличение концентрации СРБ до 5-15 мг/л связано с увеличением сердечно со-судистой смертности в 3,7 раза (в течение 10 лет), при концентрации СРБ > 16 мг/л в 4 раза.
Было идентифицировано несколько атеросклероз-ассоциированных аутоантигенов, включая оксигенированные липопротеиды низкой плотности (ЛПНП), белки теплового шока, кардиолипин, бета2- гликопротеин-1. Наиболее выраженными атерогенными свойствами обладают оксигенированные ЛПНП, белки теплового шока 60/65, индуцирующие сильный локальный иммунный ответ в бляшке. Кроме того, оксигенированные ЛПНП могут стимулировать апоптоз, участвующий в процессах дестабилизации бляшки [1,2,6, 13, 18]. Проведены исследования по изучению уровней аутоантител (к оксигенированным ЛПНП, белкам теплового шока, кардиолипину, бета2-гликопроте-ину-1, кардиолипину) как факторов прогрессии атеросклероза при РА, СКВ и ССД. Доказано увеличение уровней аутоантител и иммунных комплексов у данной категории больных по сравнению со здоровыми пациентами, что ассоциировалось с доклиническими проявлениями атеросклероза по данным ультразвукового исследования толщины комплекса интима-медиа у этих больных [7,8,14, 26].
Не вызывает сомнения роль дисфункции эндотелия в патогенезе атеросклероза [1,8,14]. Проявления дисфункции эндотелия связывают с недостатком продукции или биодоступности оксида азота в стенке артерий, обеспечивающего вазодилатацию, торможение экспрессии молекул адгезии, агрегации тромбоцитов, антипролиферативное, антиапоптотическое и антитромботическое действие. При атеросклерозе нарушается баланс между гуморальными факторами, оказывающими потенциальное защитное действие (оксид азота, эндотелиальный фактор гиперполяризации, простациклин), и факторами, повреждающими стенку сосуда (эндотелин-1, тромбоксан А2, супероксид-анион). Критериями дисфункции эндотелия могут служить некоторые гуморальные факторы, связанные с деятельностью клеток эндотелия, такие как эндотелин-1, фактор Виллебранда, E-селектин, молекулы межклеточной адгезии, молекулы адгезии сосудистых клеток и другие [11]. Дисфункция эндотелия выявляется при РА и СКВ как на ранней, так и на поздней стадиях заболевания, независимо от активности болезни и наличия кардиоваскулярных факторов риска. У больных РА и СКВ отмечались повышение уровней молекул межклеточной адгезии, молекул адгезии сосудистых клеток, E-селектина, фактора Виллебранда по сравнению со здоровыми пациентами, которое было достоверно связано с наличием атеросклеротических бляшек в сосудах либо признаками доклинического атеросклероза [2,6,8,10,13,15]. У пациентов с РА наблюдают достоверное снижение эластичности мелких и крупных сосудов, увеличение системной сосудистой резистентности по сравнению с контролем.
Баланс между провоспалительными и противовоспалительными цитокинами и другими молекулярными факторами воспаления может быть решающим для прогрессирования атеросклероза. Провоспалительными и, следовательно, проатерогенными считаются: СРБ, E-селектин, эндотоксин, фактор некроза опухоли (ФНО), интерлейкины (ИЛ-1b, ИЛ-6, ИЛ-8, ИЛ-12, ИЛ-18), макрофагальный хемоаттрактантный протеин, лейкотриен P4, продукты деградации липоксигеназы. Противовоспалительными, или атеропротекторными, являются ИЛ-4 и ИЛ-10. Из медиаторов межлейкоцитарного взаимодействия наибольшее значение при атеросклерозе придается ИЛ-1, ИЛ-6 и ФНО. ИЛ-1, ИЛ-6 и ФНО увеличивают адгезивность клеток крови к эндотелию сосудов и их прокоагулянтную активность, повышают подвижность нейтрофилов, для ряда клеток являются хемоаттрактантом, способствуют активации клеток в очаге воспаления, усиливают продукцию ими других цитокинов, а также простагландинов, синтез коллагена и фибронектина, стимулируют фагоцитоз, генерацию супероксид- радикалов, вызывают дегрануляцию тучных клеток, обусловливают синтез белков острой фазы воспаления. Все это способствует развитию экссудативной и пролиферативной составляющих воспалительной реакции. ФНО обладает способностью индуцировать в клетках апоптоз, а также стимулировать синтез металлопротеиназ и протеолитических ферментов (три-птазы и химазы) [7,12]. Многими исследователями доказано увеличение уровней ИЛ-1, ИЛ-6 и ФНО у больных РА и СКВ по сравнению с контрольной группой, причем их повышение ассоциировалось с начальными признаками развития атеросклеротического поражения сосудов у данной категории больных [3,8,13,16]. Ключевая роль в развитии аутоиммунного воспаления и сердечно-сосудистых катастроф принадлежит ИЛ 6.
Воспалительные клетки, инфильтрирующие бляшку, участвуют в процессах деградации экстрацеллюлярного матрикса путем фагоцитоза и секреции протеолитических ферментов (активаторы плазминогена, матричные металлопротеиназы), что может вызвать истончение фиброзного покрытия и явиться причиной разрыва атеросклеротической бляшки [6]. Установлено увеличение уровней матричных металлопротеиназ у больных РА по сравнению со здоровыми пациентами, что указывает на повышение риска нестабильности атеросклеротических бляшек у этих больных [10, 15, 26, 29, 33].
Таким образом, данный анализ позволяет сделать следующие выводы:
1. РЗ – заболевания с доказано высоким кардиоваскулярным риском;
2. Сочетание факторов (традиционных и обусловленных болезнью) у больных РЗ повышает риск сердечно-сосудистых осложнений;
3. Системное воспаление – основной фактор риска развития сердечно-сосудистых осложнений при РЗ;
1. Ильина А.Е., Варфоламеева Е.И., Волков А.В. и др. Соотношение толщины комплекса интима – медиа, факторов риска сердечно-сосудистых заболеваний и уровня СРБ у пациентов с подагрой. Тер. арх 2009;10:46-8.
2. Кардиология: Национальное руководство / Под ред. Ю.Н. Беленкова, Р.Г. Оганова. – М.: ЭОТАР – Медиа, 2007. – 1232 с.
3. Насонов Е.Л. Проблема атеротромбоза в ревматологии // Вестник РАМН. – 2007. – №5. – С. 6 – 10.
4. Насонов Е.Л. Иммунологические маркеры атеросклероза // Тер. Архив. – 2008. - №5. – 80 – 85.
5. Насонов Е.Л., Попкова Т.В. Кардиоваскулярные проблемы ревматологии. Науч.- практич. ревматол. 2004; 4: 4–9.
6. Попкова Т.В. Атеросклеротическое поражение сосудов при системной красной волчанке и ревматоидном
артрите. Автореф. дис. … д-ра мед. наук. М., 2006.
7. Попкова Т.В., Новикова Д.С., Писарев В.В. и др. Факторы риска кардиоваскулярных заболеваний при ревматоидном артрите. Науч.-практич. Рев-матол. 2009; 3: 4–11.
8. Ревматология: национальное руководство. Под ред. Е.Л.Насонова, В.А. Насоновой. М.: ГЭОТАР-Медиа, 2008.
9. Ревматология: Клинические рекомендации. Под ред. акад. РАМН Е.Л. Насонова. М.: ГЭОТАР-Медиа, 2010.
10. Avalos I, Rho YH, Chung CP et al. Atherosclerosis in rheumatoid arthritis and systemic lupus erythematosus. Clin Exp Rheumatol 2008; 26 (Suppl. 51): 5–13.
11. Abou-Raya, A, Abou-Raya, S. Inflammation: a pivotal link between autoimmune diseases and atherosclerosis //Autoimmun Rev. 2006. Vol. 5. № 5. P. 331 – 337.
12. Ahmad, Y, Shelmerdine, J, Bodill, H e.a. Subclinical atherosclerosis in systemic lupus erythematosus (SLE): the relative contribution of classic risk factors and the lupus phenotype // Rheumatology (Oxford). 2007. Vol. 46. № 6. P. 983 – 988.
13. Bassi, N, Ghirardello, A, Iaccarino, L e.a. OxLDL/beta(2)GPI-anti-oxLDL/beta(2)GPI complex and atherosclerosis in SLE patients // Autoimmun Rev. 2007. Vol. 7. № 1. P. 52 – 58.
14. Blann, A.D., Lip, G.Y.H. The endothelium in atherothrombotic disease assessment of function, mechanisms and clinical implications // Blood Coagul. Fibrinolysis. 1998. № 9. P. 297 – 306.
15. Carotti, M, Salaffi, F, Mangiacotti, M e.a. Atherosclerosis in rheumatoid arthritis: the role of high-resolution B
mode ultrasound in the measurement of the arterial intima-media thickness // Reumatismo. 2007. Vol. 59. № 1. P. 38 – 49.
16. Chung, CP, Avalos, I, Raggi, P, Stein, CM. Atherosclerosis and inflammation: insights from rheumatoid arthritis // Clin Rheumatol. 2007. Vol. 26. № 8. P. 1228 – 1233.
17. Colombo, BM, Murdaca, G, Caiti, M e.a. Intima-media thickness: a marker of accelerated atherosclerosis in women with systemic lupus erythematosus // Ann N Y Acad Sci. 2007. № 1108. P. 121 – 126.
18. Chung C.P., Oeser A., Solus J.F. et al. Inflammation-associated insulin resistance: differential effects in rheumatoid arthritis and systemic lupus erythematosis define potential mechanisms. Arthr Rheum 2008; 58(7):2105-12.
19. Dessein PH, Joffe BI, Veller MG et al. Traditional and nontraditional cardiovascular risk factors are associated with atherosclerosis in rheumatoid arthritis. J Rheumatol 2005; 32: 435–42.
20. Dessein PH, Tobias M, Veller MG. Metabolic syndrome and subclinical atherosclerosis in rheumatoid arthritis. J Rheumatol 2006; 33: 2425–32.
21. Dessein, PH, Norton, GR, Woodiwiss, AJ e.a. Influence of nonclassical сardiovascular risk factors on the accuracy of predicting subclinical atherosclerosis in rheumatoid arthritis // Rheumatol. 2007. Vol. 34. № 5. P. 943 – 591.
22. Edwards N.L. The role of hyperuricemia and gout in kidney and cardiovascular disease. Cleve Clin J Med 2008;75(Suppl. 5):S13–S16.
23. Frostegard, J. SLE, atherosclerosis and cardiovascular disease // J Intern Med. 2005. Vol. 257. № 6. P. 485 – 495.
24. Grover, S, Sinha, RP, Singh, U e.a. Subclinical atherosclerosis in rheumatoid arthritis in India // J Rheumatol. 2006. Vol. 33. № 2. P. 201 – 203.
25. Han C., Robinson D.W., Hackett M.V. et al. Cardiovascular disease and risk factors in patients with rheumatoid arthritis, psoriatic arthritis and ankylosing spondilitis // J. Rheumatol. – 2006. – N 33. – P. 2167 – 2172.
26. Hurlimann, D, Enseleit, F, Ruschitzka, F. Rheumatoid arthritis, inflammation, and atherosclerosis // Rheumatol.2004. Vol. 29. № 8. P. 760 – 768.
27. Hoshi T., Kitagawa K., Yamagami H. et al. Relation between interleukin-6 level and subclinical intracranial large- artery atherosclerosis. Atherosclerosis 2008; 197(l): 326-32.
28. Kerekes, G. Effects of rituximab treatment on endothelial dysfunction, carotid atherosclerosis, and lipid profile in rheumatoid arthritis / G. Kerekes, P. Soltesz, H. Der // Clin Rheumatol, 2009.– 28.– P. 705–10.
29. La Montagna, G, Cacciapuoti, F, Buono, R e.a. Insulin resistance is an independent risk factor for atherosclerosis in rheumatoid arthritis // Diab Vasc Dis Res. 2007. Vol. 4. № 2. P. 130 – 135.
30. McMahon, M, Hahn, BH. Atherosclerosis and systemic lupus erythematosus-mechanistic basis of the association
// Curr Opin Immunol. 2007. Vol. 19. № 6. P. 633 – 639.
32. Peterson MJ, Symmons PM, McCarey D et al. EULAR evidence-based recommendations for cardiovascular risk management in patients with rheumatoid arthritis and other forms of inflammatory arthritis. Ann Rheum Dis 2009; doi: 10.1136/ard.2009.113696.
33. Ross R. Atherosclerosis – an inflammatory disease // N. Engl. J. Med. – 2005. – N 340. – P. 115 – 126.
Читайте также:


