Лабораторная диагностика раневых инфекций
Все УПМ могут вести к развитию раневой инфекции, особенно на фоне иммунокомп-ромиссного организма. В настоящее время ведущая роль в этиологии раневой инфекции принадлежит стафилококкам, энтеробактери-ям и неферментирующим грамотрицательным палочкам (псевдомонады и др.), увеличивается значение неспорообразующих анаэробных бактерий, грибов.
Раневое отделяемое берут стерильными ватными тампонами из глубины раны до обработки ее антисептическими растворами. Тампоны срочно направляют в бактериологическую лабораторию. При наличии в ране дренажа отделяемое берут стерильным шприцем, из которого оно переносится с соблюдением правил асептики в стерильную пробирку или анаэробный транспортный флакон. Удаляемые при обработке раны кусочки тканей отправляют в лабораторию в стерильных чашках Петри.
Посев раневого отделяемого с тампона производят на питательные среды в следующем порядке: кровяной агар; сахарный бульон; среда для анаэробов.
Жидкие пробы засевают на плотную среду петлей. Предпочтительнее производить посев по 0,1 мл разведенной до 10"' и неразведенной пробы, растирая материал по поверхности питательной среды шпателем. В жидкие питательные среды посев производят пастеровской пипеткой. При посеве на анаэробы пипетку с исследуемым материалом опускают на дно пробирки, не допуская попадания пузырьков воздуха в среду.
Кусочки тканей режут стерильными ножницами, взвешивают в стерильной чашке Петри и измельчают в стерильной ступке с бульоном из расчета 1 мл бульона на 1 г ткани. Затем готовят десятикратные разведения взвеси до 10 3 . По 0,1 мл каждого разведения засевают на кровяной агар.
Подсчет КОЕ/г ткани производят с учетом числа выросших колоний и сделанных разведений.
Посевы инкубируют аэробно и анаэробно при температуре 37 "С и ежедневно просматривают. При появлении роста на плотной среде изучают культуральные свойства. Делается количественная оценка роста. В случае выявления колоний различного вида подсчитывают число колоний каждого вида. При этом выявляют ведущий вид в ассоциации. По 2—3 колонии каждого типа отсевают на соответствующие питательные среды для дальнейшей идентификации.
При проявлении роста в жидких питательных средах готовят мазки для окраски по Граму; с сахарного бульона производят высев на кровяной агар, среду Эндо, молочно-со-левой агар. Отрицательный результат исследования выдают через 7 суток при отсутствии роста на всех питательных средах.
Для приготовления мазков отделяемого ран используют тампоны, которыми забирают и переносят материал на стекло. Мазки окрашивают по Граму. При микроскопии мазков отмечают морфологию и количество микробов. Выделяемые при это особенности могут внести коррекцию в ход исследования — использование дополнительных питательных сред.
Экссудат берут, соблюдая правила асептики, пункцией полостей и отсасывают содержимое с помощью шприца. Из шприца материал переносят у пламени газовой горелки в стерильный анаэробный транспортный флакон и отправляют в лабораторию.
В лаборатории прозрачную жидкость центрифугируют 15—20 мин при 3000 об/мин и осадок используют для посева и приготовления мазков. При гнойном характере экссудата готовят тонкие мазки для микроскопии без предварительного центрифугирования. Посев проб производят на кровяной агар, сахарный бульон, среду для анаэробов. Кроме того, используют специальные питательные среды в зависимости от особенностей источника выпота. Плевральный выпот чаще всего наблюдается у больных с туберкулезом легких, поэтому после центрифугирования
осадок дополнительно засевают на среды для культивирования туберкулезной палочки или заражают патологическим материалом морскую свинку. При эмпиемах частым возбудителем может быть пневмококк, стрептококк группы А, стафилококк, анаэробы, а следовательно, необходимо сделать посев на соответствующие элективные питательные среды. При исследовании синовиальной жидкости следует использовать питательные среды для выделения гонококков.
Интерпретация полученных данных обычно не представляет трудности, так как при условии соблюдения правил асептики во время взятия материала из закрытых полостей и из глубины гнойных ран выделенные микробы являются возбудителями данного гнойно-воспалительного процесса.
При выделении ассоциаций микробов из раневого отделяемого ведущее значение в течении раневого процесса следует отдавать видам, количественно преобладающим в данном микробиоценозе. Уровень обсеменен-ности тканей в ране, равный 10 5 КОЕ/г, является критическим. Превышение этого уровня указывает на большую вероятность развития гнойной инфекции и возможность генерализации процесса. При обсмененности менее 10 5 КОЕ/г ткани раны заживают без явлений нагноения.
Дата добавления: 2016-02-04 ; просмотров: 961 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
| Материал | Метод исследования | Результат |
| – кусочки пораженной ткани – содержимое раны – кровь | 1. Микроскопический метод 2. Бактериологический метод Посев исследуемого материала на тиогликолевую среду, молоко, среду Вильсона-Блера, кровяной агар. Изучить биохимические свойства (ферментация глюкозы, лактозы, сахарозы, ферментация молока, расщепление желатина). Идентификация токсина с помощью реакции нейтрализации с помощью специфических антитоксических сывороток. |
Вопросы для обсуждения
1. Этиология раневой инфекции.
2. Биология возбудителя.
3. Патогенез газовой гангрены.
4. Лабораторная диагностика газовой гангрены.
5. Профилактика и лечение раневой газовой гангрены.
Самостоятельная работа
1. Бактериологическое исследование отделяемого раны.
2. Из отделяемого раны приготовить мазок, окрасив по методу Грама, микроскопировать, наметить ход исследования.
3. Провести посев отделяемого раны на среду Вильсона-Блера, молоко и тиогликолевую среду.
4. Оценить результаты посевов на тиогликолевую и Вильсона-Блера средах, а также молоко.
ПЕРЕЧЕНЬ ЭКЗАМЕНАЦИОННЫХ ВОПРОСОВ
ОБЩАЯ ЧАСТЬ
1. Место микробиологии и иммунологии в современной медицине. Роль микробиологии и иммунологии в подготовке врачей- клиницистов и врачей профилактической службы.
2. Основные этапы развития микробиологии и иммунологии. Работы Л. Пастера, Р. Коха и их значение для развития микробиологии и иммунологии.
3. Роль И .И. М ечникова в формировании учения об иммунитете. Значение открытия Д.И. Ивановского, роль отечественных ученых(Н.Ф. Гамалея, П.Ф. Здродовский, А.А. Смородинцев, М.П. Чумаков, З.В. Ермольева, В.М. Жданов и др.) в развитии микробиологии и иммунологии.
4. Основные принципы классификации микробов.
I. Морфология микробов
1. Морфологические и тинкториальные свойства бактерий. Методы окраски.
2. Структура и химический состав бактериальной клетки. Особенности строения грамположительных и грамотрицательных бактерий.
3. Морфология грибов.
4. Морфология простейших.
5. Особенности биологии вирусов.
6. Структура и химический состав бактериофагов.
7. Методы микроскопии (люминесцентная,темнопольная, фазовоконтрастная, электронная).
II. Физиология микробов
1. Рост и размножение бактерий. Фазы размножения.
2. Способы получения энергии бактериями (дыхание, брожение). Методы
3. Типы и механизмы питания бактерий.
4. Основные принципы культивирования бактерий.
5. Искусственные питательные среды, их классификация. Требования, предъявляемые к питательным средам.
6. Принципы и методы выделения чистых культур бактерий.
7. Ферменты бактерий. Идентификация бактерий по ферментативной активности.
8. Внутривидовая вдентифижация бактерий (эпидемическое маркирование).
9. Особенности физиологии грибов.
10. Особенности физиологии простейших.
11. Типы взаимодействия вируса с клеткой. Стадии репродукции вирусов.
12. Бактериофаги. Взаимодействие фага с бактериальной клеткой. Умеренные и вирулентные бактериофаги. Лизогения.
13. Применение фагов в биотехнологии, микробиологии и медицине.
14. Методы культивирования вирусов.
III. Экология микробов.
Влияния на микробы факторов окружающей среды
1. Нормальная микрофлора организма человека и ее функции.
2. Дисбиозы. Дисбактериозы. Препараты для восстановления нормальной микрофлоры: пробиотики, эубиотики.
3. Действие физических и химических факторов на микроорганизмы. Понятие о стерилизации, дезинфекции, асептике и антисептике.
4. Методы стерилизации, аппаратура.
5. Методы санитарно-микробиологического исследования воды.
6. Микрофлора воздуха и методы ее исследования.
IV. Генетика бактерий. Основы биотехнологии
1. Строение генома бактерий. Понятие о генотипе и фенотипе. Виды изменчивости. Подвижные генетические элементы, их роль в эволюции бактерий.
2. Механизмы передачи генетического материала у бактерий.
3. Плазмиды бактерий, их функции и свойства. Использование плазмид в генной инженерии.
4. Медицинская биотехнология, ее задачи достижения.
5. Молекулярно-биологические методы, используемые в диагностике инфекционных болезней (ПЦР, рестрикционный анализ и др.).
V. Микробиологические основы химиотерапии
1. Понятие о химиотерапии. История открытия химиопрепаратов.
2. Антибиотики. Природные и синтетические. История открытия природных антибиотиков. Классификация антибиотиков по химической структуре, механизму, спектру и типу действия. Способы получения.
3. Осложнения антибиотикотерапии, их предупреждение.
4. Механизмы лекарственной устойчивости возбудителей инфекционкых болезней. Пути ее преодоления.
5. Методы определения чувствительности бактерий к антибиотикам.
6. Принципы рациональной антибиотикотерапии.
VI. Инфекция и иммунитет
1. Понятие об инфекции. Условия возникновения инфекционного процесса.
2. Формы инфекции.
3. Стадии развития и характерные признаки инфекционной болезни.
4. Патогенность и вирулентность. Факторы патогенности.
5. Токсины бактерий, их природа, свойства, получение.
6. Иммунитет. Виды и формы иммунитета.
7. Роль И.И. Мечникова в формировании учения об иммунитете. Неспецифические факторы защиты организма.
8. Комплемент, его структура, функции, пути активации, роль в иммунитете.
9. Интерфероны, природа. Способы получения и применения.
10. Видовой (наследственный) иммунитет.
11. Структура и функции иммунной системы. Кооперация иммунокомпетентных клеток.
12. Иммунокомпетентные клетки. Т-и В- лимфоциты, макрофаги, их кооперация.
13. Иммуноглобулины, структура и функции.
14. Классы иммуноглобулинов, их характеристика.
15. Антигены: определение, основные свойства. Антигены бактериальной клетки.
16. Классификация антигенов.
17. Иммунный ответ: гуморальный, клеточный.
18. Антителообразование: первичный и вторичный ответ.
19. Иммунологическая память. Иммунологическая толерантность.
20. Классификация гиперчувствительности по Джейлу иКумбсу.
21. Механизмы гиперчувствительности замедленного типа. Клинико-диагностическое значение.
22. Аллергические пробы, их сущности, применение.
23. Гиперчувствительность немедленного типа. Механизмы возникновения, клиническая значимость.
24. 0собенности противовирусного, противогрибкового, противоопухолевого, трансплантационного иммунитета.
25. Понятие о клинической иммунологии. Иммунный статус человека и факторы, влияющие на него.
26. Оценка иммунного статуса: основные показатели и методы их определения. Тесты 1-го, 2-го уровней.
27. Расстройства иммунной системы: первичные и вторичные иммунодефициты.
28. Иммунологические методы исследования: общие закономерности, основные группы.
VII. Реакции иммунитета
1. Реакция агглютинации. Компоненты, механизм, способы постановки. Применение.
2. Реакция Кумбса. Механизм. Компоненты. Применение.
3. Реакция пассивной гемагглютинации. Компоненты. Применение.
4. Реакция коагглютинации. Механизм. Компоненты. Применение.
5. Реакция торможения гемагглютинации. Механизм. Компоненты. Применение.
6. Реакция преципитации. Механизм. Компоненты. Применение. Способы постановки.
7. Реакция связывания комплемента. Механизм. Компоненты. Применение.
8. Реакция нейтрализации токсина антитоксином. Механизм. Способы постановки. Применение.
9. Реакция иммунофлюоресценции. Механизм. Компоненты. Применение.
10. Иммуноферментный анализ, иммуноблоттинг. Механизм. Компоненты.
11. Серологические реакции, используемые для диагностики вирусных инфекций.
12. Диагностикумы. Получение. Применение.
13. Моноклональные антитела. Получение. Применение.
14. Методы приготовления и применения агглютинирующих, адсорбированных сывороток.
Раневую анаэробную инфекцию у человека вызывают как спорообразующие анаэробные бактерии (Clostridium perfringens, Clostridium novy, Clostridium oedematiens, Clostridium septicum, Clostridium sordelli, Clostridium histolyticum), так и неспорообразующие анаэробные микроорганизмы родов Bacteroides, Peptococcus, Peptostreptococcus, Veilonella и др.
Методы микробиологических исследований при анаэробной инфекции представлены в схеме 3.
Бактериоскопический метод. Проводится микроскопия окрашенных по Граму, Цилю-Нильсену и Гинсу-Бурри мазков, приготовленных из раневого отделяемого, отечной жидкости, некротизированной ткани. Обнаружение в препаратах крупных прямых грамположительных палочек, образующих капсулы и центрально или субтерминально расположенные споры (рис. 3), дает основание поставить предварительный диагноз газовой гангрены. Для экспресс-диагностики применяют прямой метод иммунофлюоресценции.
Бактериологический метод.Производят посев исследуемого материалана среды Цейсслера (анаэробный кровяной МПА), Китт-Тароцци, железо-сульфитный агар (ЖСА) и молоко. В молоке через 3-4 часа образуется губкообразный сгусток, погруженный в прозрачную жидкость. На среде Китт-Тароцци через сутки регистрируется помутнение и образование газа, на ЖCA - черные колонии в глубине агарового столбика, на среде Цейсслера – шероховатые (реже – гладкие), крупные, плоские сероватые колонии с зоной гемолиза. В глубине плотных питательных сред образуются колонии в виде чечевичек, дисков, комочков ваты и т.д. В мазках из колоний обнаруживают крупные грамположительные палочки (рис. 5). Для выделения чистой культуры возбудителей газовой гангрены типичные колонии пересевают на среду Китт-Тароцци и идентифицируют до вида в соответствии с таблицами 4 и 5.
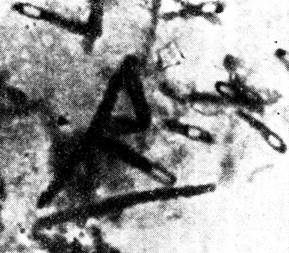 | 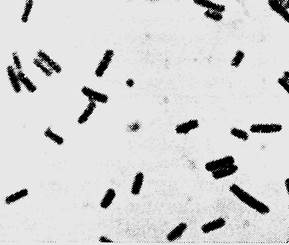 |
| Рис. 4. Возбудитель газовой гангрены (Clostridium perfringens) в материале от больного. Окраскапо Граму. х 900 | Рис. 5. Возбудитель газовой гангрены. Чистая суточная культура Clostridium perfringens. Окраскапо Граму. х 900 |
Таблица 4. Биологические свойства неспорообразующих и спорообразующих анаэробов
| Свойства | Бактерии | ||||||||
| Peptococcus | Peptostreptococcus | Veilonella | Bacteroides | C.perfringens | C.novy | C.septicum | C.sordelli | C.histolyticum | |
| Морфология | кокки | кокки | кокки | палочки | палочки | палочки | палочки | палочки | палочки |
| Подвижность | - | - | - | ± | - | + | + | + | + |
| Споры | - | - | - | - | + | + | + | + | + |
| Окраска по Граму | + | + | - | - | + | + | + | + | + |
| Ферментация углеводов | + | + | - | + | + | + | + | + | - |
| Свертывание молока | - | - | + | + | + | v | - | + | + |
| Продукция H2S | + | - | + | ± | - | - | - | v | v |
| Продукция индола | - | - | - | ± | - | - | - | - | - |
| Разжижение желатины | - | - | - | ± | + | + | + | + | + |
| Редукция нитратов | ± | - | + | ± | ± | ± | ± | - | - |
| Гемолиз эритроцитов | - | - | ± | + | + | + | + | + | |
| Образование токсина | - | - | - | - | + | + | + | + | + |
Обозначения:(+) - постоянный признак, (±) - непостоянный признак, (-) – отсутствие признака, V- вариабельный признак
Таблица 5.Биологические свойства основных возбудителей газовой гангрены и столбняка
| Виды клостридий | Капсула | Подвижность | Лецитиназа | Индол | Ферментация | ||
| лактозы | сахарозы | маннита | |||||
| Clostridium perfringens | + | - | + | - | + | + | + |
| Clostridium Novy | - | + | + | - | - | - | - |
| Clostridium septicum | - | + | _ | - | + | - | - |
| Clostridium Tetani | - | + | _ | + | - | - | - |
Обозначения:(+) - постоянный признак, (-) – отсутствие признака,
Определение лецитиназной активности. Положительная реакция на лецитиназу проявляется в виде помутнения взвеси лецитина. При отрицательной реакции, которая наблюдается при нейтрализации фермента соответствующей антисывороткой, жидкость остается прозрачной.
Окончательную идентификацию выделенных клостридий газовой гангрены проводят с помощью биопробы (см. ниже) путем постановки реакции нейтрализации с поливалентными и моновалентными сыворотками для выявления и типирования экзотоксинов клостридий.
Биопроба. Смесь исследуемого материала с моновалентными антитоксическими сыворотками против различных видов клостридий вводят подкожно морским свинкам. Контролем служит морская свинка, которой вводят исследуемый материал без сывороток. При наличии токсина контрольная морская свинка погибает через 30 минут – 4 часа после инъекции материала. В опытах нейтрализации токсина антитоксическими сыворотками выживает одна морская свинка, при этом вид сыворотки соответствует виду токсина.
Не нашли то, что искали? Воспользуйтесь поиском:
Инфекционные болезни — это заболевания, вызванные проникновением в организм бактерий, грибков или вирусов. Самая важная часть диагностики инфекций — это определение возбудителя и его концентрации. Для этих целей используются разнообразные лабораторные методы, которые позволяют выяснить, чем именно и как давно атакован организм, а в некоторых случаях — спрогнозировать эффективность лечения тем или иным препаратом.
Особенности диагностики инфекционных заболеваний
В клинической практике данный тип заболеваний встречается очень часто. Именно они, по данным Всемирной организации здравоохранения, становятся причиной 26% всех смертей. В список самых распространенных инфекционных заболеваний входят инфекционная пневмония и другие воспалительные заболевания дыхательных путей, гепатит, ВИЧ, туберкулез, малярия, воспаления органов половой системы и мочевыводящих путей, гистоплазмоз, ротавирусные инфекционные заболевания, ветряная оспа, герпес, вирус папилломы человека и еще несколько десятков болезней. Хотя бы раз в жизни каждый из нас сталкивается с инфекционными заболеваниями и необходимостью быстрой постановки диагноза.
Все инфекционные болезни делятся на пять типов — прионные, вирусные, бактериальные, протозойные и грибковые поражения. Далее будут рассмотрены последние четыре типа как наиболее распространенные. Разные возбудители иногда могут вызывать одно и то же заболевание. В частности, пневмония может быть результатом как вирусной, так и бактериальной инфекции. Лечение зависит не от проявлений, а от возбудителя болезни. Противовирусные препараты бесполезны в борьбе с бактериями и грибками, антибиотики не действуют на вирусы. Поэтому основная задача лабораторной диагностики инфекционных заболеваний — выявление типа возбудителя.
Способы лабораторной диагностики инфекционных болезней можно разделить на два типа: неспецифические и специфические методы.
К неспецифическим относятся общий анализ крови и исследование соотношения ее белковых фракций, печеночные пробы, общий анализ мочи и кала. Эти методы не дают информации о виде возбудителя, но позволяют узнать, в какой мере болезнь затронула органы и системы организма, что именно в их работе нарушено и насколько далеко зашел процесс.
Специфические — вирусологический и бактериологический методы, микроскопическое исследование возбудителей, анализы на антигены и антитела — направлены непосредственно на обнаружение возбудителя.
Современная медицина располагает множеством методов выделения возбудителей бактериальной инфекции:
Бактериоскопический . Исследуется окрашенный специальным образом мазок.
Бактериологический . Биоматериал высеивается в питательную среду, и через некоторое время специалист исследует колонию бактерий, выросшую в ней.
Биологический . Направлен на определение патогенности микроорганизмов.
Серологический . Выявляет антитела и антигены в сыворотке крови — особые вещества, которые вырабатываются организмом при контакте с возбудителем определенной болезни.
Чаще всего для исследований используют кровь или сыворотку крови, реже — слюну, мочу, кал, клетки эпителия (мазок и соскоб) и другой биоматериал.
В лабораторной диагностике вирусных заболеваний используются:
Вирусологическое исследование . Световая и электронная микроскопия дает возможность выявить наличие вирусных включений и сами вирусы и идентифицировать их.
Серологическое исследование для обнаружения антител и антигенов. Этот метод дает возможность быстро выявить агрессора, как и в случае с бактериальными инфекциями. Для диагностики используются разнообразные способы исследования материала — реакции гемадсорбции, гемагглютинации или метод непрямой иммунофлюоресценции. Имунноблоттинг, в частности, позволяет выявлять антитела сразу к нескольким инфекциям и считается современным и точным диагностическим методом.
Молекулярно-генетические методы . Последнее слово в лабораторной диагностике. Позволяют обнаружить вирус даже тогда, когда его концентрация ничтожно мала — то есть на самых ранних стадиях. Самым известным из этих методов является ПЦР, при которой фрагмент вируса многократно копируется до тех пор, пока специалист не получит достаточно материала для определения типа вируса и его изначальной концентрации.
Для выявления вирусов обычно требуется сделать анализ крови.
Так называют инфекции, вызванные простейшими паразитами, например, амебами. Малярия, амёбиаз, токсоплазмоз, лямблиоз, трихомониаз, сонная болезнь — вот неполный список самых распространенных протозойных инфекций. Лабораторная диагностика таких заболеваний включает в себя следующие методы:
Микроскопический . Простейшие паразиты выявляются путем исследования под микроскопом окрашенных образцов биоматериала. Самый простой и надежный метод для многих возбудителей.
Культуральный . Посев биоматериала в питательную следу для дальнейшего исследования размножившихся простейших. У этого метода есть существенный недостаток: результатов нужно ждать долго, сам процесс может занять не менее 5-6-ти дней.
Серологический . Используют редко ввиду малой информативности.
Аллергический . Также не является распространенным. Кожные аллергопробы делают для того, чтобы подтвердить лейшманиоз и токсоплазмоз. Это вспомогательный диагностический метод.
В качестве биоматериала для исследований в основном используется кровь, иногда — – кал или моча.
Микроскопическое исследование . Препарат окрашивается и рассматривается под мощным микроскопом. Посредством иммунофлюоресцентной микроскопии исследуется проба, помеченная флюоресцеинами — специальным красителем. Наиболее быстрый способ выявления грибка по сравнению с другими методами.
Культуральный . Происходит посев пробы на питательную среду и дальнейшее исследование полученной в результате колонии грибков.
Серологический . Используется для выявления грибковых поражений, однако для микозов он считается не особенно точным.
Гибридизация нуклеиновых кислот . Самый современный способ выявления грибковых инфекций, его применяют для идентификации основных возбудителей системных микозов. Из культуры извлекается РНК и вносится особым способом помеченная молекула ДНК. Если в пробе наличествует один из основных патогенных грибков, ДНК объединится с его РНК, создав легко различимую структуру. Несомненным преимуществом метода является возможность определить инфекцию на самых ранних стадиях.
Биоматериалом для исследований являются клетки кожи, волос и ногтей, клетки слизистых оболочек (мазок или соскоб), мокрота, моча, секрет простаты, сперма, грудное молоко.
Современные методики диагностики инфекций позволяет выявить их на начальном этапе, Чем раньше болезнь будет обнаружена, тем проще ее вылечить. Поэтому сдавать анализы на инфекции желательно регулярно, даже если вы ни на что не жалуетесь и не замечаете никаких перемен в самочувствии.

Перед сдачей биоматериала для исследований иногда требуется определенная подготовка. Так, кровь обычно сдают с утра, натощак, а перед забором мазка не рекомендуется принимать душ. Эти требования очень важны: они обеспечивают точность результата, поэтому узнайте у врача заранее о подготовительных мерах и точно следуйте всем его рекомендациям.
Диагностика инфекционных заболеваний является одной из самых сложных проблем в клинической медицине. Лабораторные методы исследования при ряде нозологических форм играют ведущую, а в целом ряде клинических ситуаций решающую роль не только в диагностике, но и в определении конечного исхода заболевания.
Диагностика инфекционных заболеваний почти всегда предусматривает использование комплекса лабораторных методов.

- бактериологические;
- серологические;
- метод полимеразной цепной реакции (ПЦР) для обнаружения ДНК или РНК возбудителя инфекционного заболевания в исследуемом материале.
У одних пациентов для диагностики этиологии инфекционно-воспалительного процесса достаточно провести бактериологическое исследование, в других клинических ситуациях решающее значение имеют данные серологических исследований, в третьих, предоставить полезную информацию может только метод ПЦР. Однако наиболее часто в клинической практике врачу-клиницисту необходимо использовать данные различных методов лабораторных исследований.
Бактериологические методы исследования
Бактериологические исследования наиболее часто проводят при подозрении на гнойно-воспалительные заболевания (составляют 40-60% в структуре хирургических заболеваний) с целью их диагностики, изучения этиологической структуры, определения чувствительности возбудителей к антибактериальным препаратам. Результаты бактериологических анализов способствуют выбору наиболее эффективного препарата для антибактериальной терапии, своевременному проведению мероприятий для профилактики внутрибольничных инфекций.
Возбудителями гнойно-воспалительных заболеваний являются истинно-патогенные бактерии, но наиболее часто условно-патогенные микроорганизмы, входящие в состав естественной микрофлоры человека или попадающие в организм извне. Истинно-патогенные бактерии в большинстве случаев способствуют развитию инфекционного заболевания у любого здорового человека. Условно-патогенные микроорганизмы вызывают заболевания преимущественно у людей с нарушенным иммунитетом.
Бактериологические исследования при заболеваниях, вызываемых условно-патогенными микроорганизмами, направлены на выделение всех микроорганизмов, находящихся в патологическом материале, что существенно отличает их от аналогичных исследований при заболеваниях, вызванных истинно патогенными микроорганизмами, когда проводится поиск определенного возбудителя.
Для получения адекватных результатов бактериологического исследования при гнойно-воспалительных заболеваниях особенно важно соблюдать ряд требований при взятии биоматериала для анализа, его транспортировки в лабораторию, проведения исследования и оценки его результатов.
Для идентификации вида возбудителя гнойно-воспалительных заболеваний и определения чувствительности к антибактериальным препаратам бактериологические лаборатории используют комплекс методов. Они включают:
- микроскопическое исследование мазка (бактериоскопия) из доставленного биоматериала;
- выращивание культуры микроорганизмов (культивирование);
- идентификацию бактерий;
- определение чувствительности к антимикробным препаратам и оценку результатов исследования.
Доставленный в бактериологическую лабораторию биоматериал первоначально подвергается микроскопическому исследованию.
Микроскопическое исследование мазка (бактериоскопия), окрашенного по Граму или другими красителями, проводят при исследовании мокроты, гноя, отделяемого из ран, слизистых оболочек (мазок из цервикального канала, зева, носа, глаза и т.д.). Результаты микроскопии позволяют ориентировочно судить о характере микрофлоры, ее количественном содержании и соотношении различных видом микроорганизмов в биологическом материале, а также дает предварительную информации об обнаружении этиологически значимого инфекционного агента в данном биоматериале, что позволяет врачу сразу начать лечение (эмпирическое). Иногда микроскопия позволяет выявить микроорганизмы, плохо растущие на питательных средах. На основании данных микроскопии проводят выбор питательных сред для выращивания микробов, обнаруженных в мазке.
Культивирование микроорганизмов. Посев исследуемого биоматериала на питательные среды производят с целью выделения чистых культур микроорганизмов, установления их вида и определения чувствительности к антибактериальным препаратам. Для этих целей используют различные питательные среды, позволяющие выделить наибольшее количество видов микроорганизмов. Оптимальными являются питательные среды, содержащие кровь животного или человека, а также сахарный бульон, среды для анаэробов. Одновременно производят посев на дифференциально-диагностические и селективные (предназначенные для определенного вида микроорганизмов) среды. Посев осуществляют на стерильные чашки Петри, в которые предварительно заливают питательную среду для роста микроорганизмов.

Микроскопия мазков, окрашенных по Граму
1 - стрептококки; 2 - стафилококки; 3 - диплобактерии Фридленда; 4 - пневмококки
Чашки Петри с посевами инкубируют в термостате при определенных температурных, а для ряда микроорганизмов газовых (например, для выращивания анаэробов создают условия с низким содержанием кислорода) режимах в течение 18-24 ч. Затем чашки Петри просматривают. Количественную обсемененность доставленного биоматериала микрофлорой определяют по числу колониеобразующих единиц (КОЕ) в 1 мл или 1 мг исследуемого образца. При просмотре чашек Петри выявляют некоторые особенности изменения цвета среды, ее просветления в процессе роста культуры. Многие группы бактерий образуют характерные формы колоний, выделяют пигменты, которые окрашивают колонии или среду вокруг них. Из каждой колонии делают мазки, окрашивают по Граму и микроскопируют. Оценивают однородность бактерий, форму и размер, наличие спор или других включений, капсулы, расположение бактерий, отношение к окраске по Граму. Вся эта информация служит важнейшей составляющей для выбора сред и получения в дальнейшем чистой культуры каждого микроорганизма.
Колонии отсевают на плотные, жидкие, полужидкие питательные среды, оптимальные для культивирования определенного вида бактерий.
Выделенные чистые культуры микроорганизмов подвергают дальнейшему изучению в диагностических тестах, основанных на морфологических, ферментативных, биологических свойствах и антигенных особенностях, характеризующих бактерий соответствующего вида или варианта.
Определение чувствительности к антибактериальным препаратам. Чувствительность к антимикробным препаратам изучают у выделенных чистых культур микроорганизмов имеющих этиологическое значение для данного заболевания. Поэтому в направлении на бактериологические анализы требуется указать диагноз заболевания у больного. Определение чувствительности бактерий к спектру антибиотиков помогает лечащему врачу правильно выбрать препарат для лечения больного.
Оценка результатов исследования. Принадлежность условно-патогенных микроорганизмов к естественной микрофлоре организма человека создает ряд трудностей при оценке их этиологической роли в развитии гнойно-воспалительных заболеваний. Условно-патогенные микроорганизмы могут представлять нормальную микрофлору исследуемых жидкостей и тканей или контаминировать их из окружающей среды. Поэтому для правильной оценки результатов бактериологических исследований необходимо знать состав естественной микрофлоры изучаемого образца. В тех случаях, когда исследуемый биоматериал в норме стерилен, как, например, спинномозговая жидкость, экссудаты, все выделенные из него микроорганизмы могут считаться возбудителями заболевания. В тех случаях, когда исследуемый материал имеет собственную микрофлору, как, например, отделяемое влагалища, кал, мокрота, нужно учитывать изменения ее качественного и количественного состава, появление несвойственных ему видов бактерий, количественную обсемененность биоматериала. Так, например, при бактериологическом исследовании мочи степень бактериурии (число бактерий в 1 мл мочи), равная и выше 10 5 , свидетельствует об инфекции мочевых путей. Более низкая степень бактериурии встречается у здоровых людей и является следствием загрязнения мочи естественной микрофлорой мочевых путей.
Установить этиологическую роль условно-патогенной микрофлоры помогают также нарастание количества и повторность выделения бактерий одного вида от больного в процессе заболевания.
Врач-клиницист должен знать, что положительный результат бактериологического исследования в отношении биологического материала, полученного из в норме стерильного очага (кровь, плевральная жидкость, спинномозговая жидкость, пунктат органа или ткани), всегда тревожный результат, требующий немедленных действий по оказанию медицинской помощи.
Серологические методы исследования
В основе всех серологических реакций лежит взаимодействие антигена и антитела. Серологические реакции используются в двух направлениях.
С внедрением в практику лабораторий метода иммуноферментного анализа (ИФА) стало возможным определять в крови больных антитела, относящиеся к различным классам иммуноглобулинов (IgM и IgG), что существенным образом повысило информативность серологических методов диагностики. При первичном иммунном ответе, когда иммунная система человека взаимодействует с инфекционным агентов в первый раз, синтезируются преимущественно антитела, относящиеся к иммуноглобулинам класса М. Лишь позднее, на 8-12 день после попадания антигена в организм, в крови начинают накапливаться антитела иммуноглобулинов класса G. При иммунном ответе на инфекционные агенты вырабатываются также и антитела класса А (IgA), которые играют важную роль в защите от инфекционных агентов кожи и слизистых оболочек.
2. Установление родовой и видовой принадлежности микроба или вируса. В этом случае неизвестным компонентом реакции является антиген. Такое исследование требует постановки реакции с заведомо известными иммунными сыворотками.
Серологические исследования не обладают 100 % чувствительностью и специфич-ностью в отношении диагностики инфекционных заболеваний, могут давать перекрестные реакции с антителами, направленными к антигенам других возбудителей. В связи с этим оценивать результаты серологических исследований необходимо с большой осторожностью и учетом клинической картины заболевания. Именно этим обусловлено использование для диагностики одной инфекции множества тестов, а также применение метода Western-blot для подтверждения результатов скрининговых методов.
В последние годы прогресс в области серологических исследований связан с разработкой тест-систем для определения авидности специфических антител к возбудителям различных инфекционных заболеваний.
Авидность - характеристика прочности связи специфических антител с соответствующими антигенами. В ходе иммунного ответа организма на проникновение инфекционного агента стимулированный клон лимфоцитов начинает вырабатывать сначала специфические IgM-антитела, а несколько позже и специфические IgG-антитела. IgG-антитела обладают поначалу низкой авидностью, то есть достаточно слабо связывают антиген. Затем развитие иммунного процесса постепенно (это могут быть недели или месяцы) идет в сторону синтеза лимфоцитами высокоспецифичных (высокоавидных) IgG-антител, более прочно связывающихся с соответствующими антигенами. На основании этих закономерностей иммунного ответа организма в настоящее время разработаны тест-системы для определения авидности специфических IgG-антител при различных инфекционных заболеваниях. Высокая авидность специфических IgG-антител позволяет исключить недавнее первичное инфицирование и тем самым с помощью серологических методов установить период инфицирования пациента. В клинической практике наиболее широкое распространение нашло определение авидности антител класса IgG при токсоплазмозе и цитомегаловирусной инфекции, что дает дополнительную информацию, полезную в диагностическом и прогностическом плане при подозрении на эти инфекции, в особенности при беременности или планировании беременности.
Метод полимеразной цепной реакции
Полимеразная цепная реакция (ПЦР) являющаяся одним из методов ДНК-диагностики, позволяет увеличить число копий детектируемого участка генома (ДНК) бактерий или вирусов в миллионы раз с использованием фермента ДНК-полимеразы. Тестируемый специфический для данного генома отрезок нуклеиновой кислоты многократно умножается (амплифицируется), что позволяет его идентифицировать. Сначала молекула ДНК бактерий или вирусов нагреванием разделяется на 2 цепи, затем в присутствии синтезированных ДНК-праймеров (последовательность нуклеотидов специфична для определяемого генома) происходит связывание их с комплементарными участками ДНК, синтезируется вторая цепь нуклеиновой кислоты вслед за каждым праймером в присутствии термостабильной ДНК-полимеразы. Получается две молекулы ДНК. Процесс многократно повторяется. Для диагностики достаточно одной молекулы ДНК, то есть одной бактерии или вирусной частицы. Введение в реакцию дополнительного этапа - синтеза ДНК на молекуле РНК при помощи фермента обратной транскриптазы - позволило тестировать РНК-вирусы, например, вирус гепатита С. ПЦР - это трехступенчатый процесс, повторяющийся циклично: денатурация, отжиг праймеров, синтез ДНК (полимеризация). Синтезированное количество ДНК идентифицируют методом иммуноферментного анализа или электрофореза.
В ПЦР может быть использован различный биологический материал - сыворотка или плазма крови, соскоб из уретры, биоптат, плевральная или спинномозговая жидкость и т.д. В первую очередь ЦПР применяют для диагностики инфекционных болезней, таких как вирусные гепатиты В, С, D, цитомегаловирусная инфекция, инфекционные заболевания, передающиеся половым путем (гонорея, хламидийная, микоплазменная, уреаплазменная инфекции), туберкулез, ВИЧ-инфекция и т.д.
Преимущество ПЦР в диагностике инфекционных заболеваний перед другими методами исследований заключается в следующем:
- возбудитель инфекции может быть обнаружен в любой биологической среде организма, в т.ч. и материале, получаемом при биопсии;
- возможна диагностика инфекционных болезней на самых ранних стадиях заболевания;
- возможность количественной оценки результатов исследований (сколько вирусов или бактерий содержится в исследуемом материале);
- высокая чувствительность метода; например чувствительность ПЦР для выявления ДНК вируса гепатита В в крови составляет 0,001 пг/мл (приблизительно 4,0 . 10 2 копий/мл), в то время как метода гибридизации ДНК с использованием разветвленных зондов - 2,1 пг/мл (приблизительно 7,0 . 10 5 копий/мл).
Читайте также:


