Лабораторная диагностика риккетсиозов ку лихорадки
Лабораторная диагностика сыпного тифа и других риккетсиозов включает выделение возбудителя, определение его антигенов и ДНК, выявление антител к риккетсиям соответствующих видов. Чаще осуществляется серологическими (РСК, РНГА, РНИФ, ИФА) и молекулярно-генетическими (ПЦР, определение нуклеотидных последовательностей фрагментов генов) методами.
Выделение возбудителей риккетсиозов от больных наиболее эффективно в острый лихорадочный период, до начала антибиотикотерапии. Основные риккетсиоло-гические методы включают заражение, чаще интраперитонеальное, чувствительных животных (морские свинки, хомячки, хлопковые и белые крысы, белые мыши), развивающихся куриных эмбрионов (в желточный мешок по Коксу), перевиваемых культур клеток (Vero, HeLa, Hep-2, L929), клеток членистоногих.
Животным и в куриные эмбрионы вводят дефибринированную кровь или суспензию растертых в физиологическом растворе сгустков крови, биопсийного материала кожи, а также других тканей больного в зависимости от формы поражений.
При заражении клеточных культур используют плазму, гепаринизированную (или обработанную ЭДТА) кровь, биопсийный материал. Целесообразно выделение возбудителя не только от больного, но и из переносчиков (клещей, блох, вшей).
Эффективно риккетсиологическое обследование снятых с человека переносчиков классическими (выделение возбудителя) и экспресс-методами (метод флюоресцирующих антител, ИФА, РИГА с иммуноглобулиновыми диагностикумами для выявления антигенов риккетсий групп СТ и КПЛ).
Для биопробы используют молодых, весом 300-350 г, морских свинок-самцов. Заражение проводят путем внутрибрюшинного введения 3-5 мл крови или 10%-ных суспензий материалов, содержащих риккетсии (сгустки крови и органы человека и животных, членистоногие). Животным ежедневно измеряют температуру ректально. После инкубационного периода (от нескольких дней до нескольких недель) у морских свинок развиваются различные формы риккетсиозов (лихорадочные, лихорадочно-скротальные, бессимптомные). При заражении R. rickettsii, реже О. tsutsugamushi и С. burnetii у морских свинок может возникать летальная инфекция.
Наиболее характерным проявлением экспериментальных риккетсиозов у морских свинок-самцов при внутрибрюшинном заражении является скротальный феномен — периорхит с накоплением риккетсий во влагалищных оболочках яичка. В ряде случаев может возникать специфический перитонит; риккетсии накапливаются в эндотелиальных клетках кровеносных сосудов различных органов и тканей (тести-кулы, мозг, селезенка, надпочечники). При всех формах инфекционного процесса у биопробных животных выявляют антитела к антигенам риккетсий в различных серологических реакциях (РСК, РНИФ, ИФА) через 2-3 нед. после заражения.
При пассажах штаммов риккетсий на морских свинках наиболее часто используют 10%-ные суспензии мозга и яичек, в ряде случаев также селезенок, надпочечников, реже — печени и почек (Ку-лихорадка, крысиный сыпной тиф). При лихорадке цуцугамуши, крысином и осповидном риккетсиозах, коксиеллезе для изоляции возбудителя можно применять белых мышей. Их заражают внутрибрюшинно 10%-ными суспезиями риккетсиальных материалов в объеме 0,5 мл. Летальность у мышей чаще наблюдается при заражении О. tsutsugamushi, R. akari, реже — R. typhi.
При подкожном заражении морских свинок и белых мышей С. burnetii характерно образование подкожного инфильтрата на месте введения, где накапливаются коксиеллы.
В ряде случаев при экспериментальных риккетсиозах воспроизводят тестикулярные, легочные, перитонеальные и глазные формы инфекционного процесса.
Культивирование в желточных мешках развивающихся куриных эмбрионов более эффективно в отношении накопления риккетсий. Первичное выделение штаммов риккетсий на этой модели проводят редко в связи с высокой вероятностью контаминации посторонней микрофлорой, преимущественно при получений гемокультур.
По результатам овоскопии для заражения отбирают нормально развившиеся куриные эмбрионы с характерным сосудистым рисунком. Заражение проводят со строгим соблюдением правил асептики в специальном стерильном боксе. После дезинфекции спиртом, затем йодной настойкой с последующей обработкой смоченной спиртом поверхности куриного яйца пламенем через пробуравленное в скорлупе отверстие над вершиной воздушной камеры проводят заражение риккетсиальной суспензией в объеме до 0,5 мл проколом в полость желточного мешка. Отверстие в скорлупе заливают расплавленным стерильным парафином. Для контроля на стерильность суспензии для заражения параллельно ее высевают на специальные среды (сахарный бульон, тиогликолевую среду, среды для микоплазмы.
Для культивирования риккетсий группы КПД используют 4-5-суточные эмбрионы, для риккетсий группы сыпного тифа и ориенций — 6-7-суточные, для коксиелл Бернета — 7-8-суточные. Зараженные яйца помещают в термостат при влажности 45-60% и инкубируют при оптимальной для каждой группы риккетсий температуре до массовой гибели эмбрионов. Оптимальной температурой для накопления риккетсий группы сыпного тифа, ориенций и R. akari является 35°С, риккетсий группы клещевых пятнистых лихорадок — 33°С.
При культивировании учитывают сроки гибели зараженных эмбрионов, видимые изменения (геморрагические поражения), интенсивность накопления риккетсий. Погибшие в течение 3 сут. после заражения эмбрионы отбраковывают (неспецифические проявления, чаще — гибель, связанная с травматизацией). При дальнейшей ежедневной овоскопии отбирают для вскрытия погибшие эмбрионы (отсутствие подвижности, утрата сосудистого узора).
Гибель эмбрионов при культивировании риккетсий группы сыпного тифа наступает в более поздние сроки (6-10-е сутки после заражения, иногда и позже), чем риккетсий группы КПД (4-6-е сутки), сопровождается более интенсивным накоплением риккетсий при менее выраженных изменениях геморрагического характера. Заражение куриных эмбрионов коксиеллами Бернета вызывает относительно позднюю гибель эмбрионов (6-8-е сутки) при интенсивном размножении возбудителя без выраженных изменений самого эмбриона.
Для культивирования риккетсий могут быть использованы как первично трипсинизированные, так и перевиваемые культуры клеток. Большинство видов риккетсий размножаются в культурах клеток почечного эпителия, мезотелия, перевиваемых линиях клеток Vero, HeLa, Hep-2, L929. Коксиеллы Бернета хорошо размножаются также в культурах фибробластов куриного эмбриона и морских свинок, макрофагов и ретикулярных клеток костного мозга и селезенки. Получены данные о возможности культивирования на культурах клеток Vero и Нер-2 риккетсий, не культивируемых на традиционных моделях — морских свинках и куриных эмбрионах (R. tarasevichiae, риккетсии подгруппы R. massiliae).
Для пассирования культуры клеток подвергают версенизации по стандартной методике. Культуры клеток Vero и Нер-2 выращивают в стеклянных флаконах, засев проводят в концентрации 150 тыс. клеток на 1мл. В качестве питательной среды используют среду Игла М ЕМ с двойным набором аминокислот, к общему объему добавляют до 10% эмбриональной сыворотки. Подготовленные флаконы заражают 10%-ной риккетсиальной суспензией в объеме 0,5 мл на флакон. Флаконы с зараженным содержимым центрифугируют при 800 об/мин при температуре 22°С в течение 30 мин. После центрифугирования во все флаконы добавляют среду поддержки (Игла МЕМ с добавлением эмбриональной сыворотки до 1%) в объеме 1,5 мл на флакон. Флаконы с зараженными клетками культивируют в углекислотном термостате при температуре 35,6°С в течение 8 сут.
После завершения инкубации все флаконы подвергают замораживанию в низкотемпературном холодильнике на -20°С, а потом оттаиванию для разрушения клеток и максимального выхода из них микроорганизмов. После оттаивания материал центрифугируют 10 мин при 3000 об/мин, супернатант в объеме 0,5 мл берут на следующий пассаж, а из 0,2 мл делают мазки. Остатки супернатанта хранят в криопробирках в низкотемпературном холодильнике. Инфицированность и стерильность культуры клеток определяют в мазках, окрашивая их по Романовскому-Гимзе и методом флюоресцирующих антител. Отсутствие посторонней микрофлоры в пассажах контролируют также посевом на питательные среды (сахарный бульон, тиогликолевая среда, среда Сабуро, среды на микоплазмы).
Развитие инфекции в клеточных культурах у различных видов родов Rickettsia и Orientia отличается. Для риккетсий Провачека и ориенций цуцугамуши характерно накопление микроорганизмов в больших количествах в отдельных клетках. Дегенеративные изменения клеток вследствие перепроизводства возбудителя сопровождаются их разрывом и освобождением микроорганизмов с распространением инфекции на соседние клетки.
У риккетсий группы КПЛ накопление возбудителя в отдельных клетках не сопровождается их переполнением, риккетсии еще на ранней стадии выходят из клеток без существенных их повреждений с быстрым распространением инфекции клеточной культуры. Дегенеративные изменения клеток обусловлены преимущественно токсическим действием риккетсий.
Методы выделения и последующей идентификации риккетсий требуют специальной подготовки, соблюдения режимных требований (возбудители 2-3-й группы патогенности). К возбудителям 2-й группы патогенности относят R. prowazekii, Coxiella burnetii, R. rickettsii. Их культивирование можно осуществлять в специализированных риккетсиологических лабораториях или лабораториях особо опасных инфекций, что ограничивает возможности использования методов выделения риккетсий в диагностических целях.
При изучении штаммов риккетсий придерживаются общей схемы дифференциации, предложенной П.Ф. Здродовским и Е.М. Голиневич (1972), которая включает:
а) изучение морфологии;
б) характеристику размножения при культивировании в желточных мешках куриных эмбрионов;
в) воспроизведение экспериментальной инфекции на лабораторных животных;
г) иммунологическую характеристику в опытах перекрестного иммунитета;
д) серологический анализ антигенной структуры.
Дальнейшая идентификация проводится в перекрестной РСК с сыворотками мышей СВА и набором антигенов риккетсий, в реакции непрямой иммунофлюоресценции (РНИФ) — с моноклональными антителами к риккетсиям, а также при помощи генетических методов (рестрикционный анализ ДНК, ДНК-зондирование, ПЦР с использованием праймеров области гена цитратсинтазы и белкового антигена 190 кД и др.).
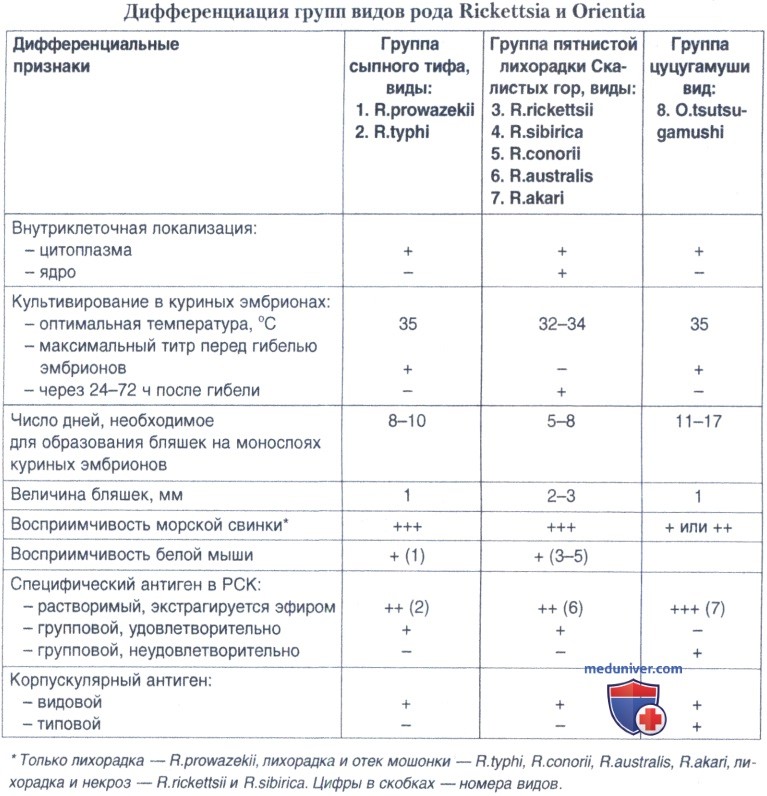
а) Серологическая диагностика. У риккетсий и ориенций выявлено наличие перекрестно реагирующих эпитопов с протеями. Реакция агглютинации Вейля-Феликса с протеями была первым тестом, использованным для серодиагностики риккетсиозов. Антигены из клеточных стенок Proteus vulgaris ОХ-2 реагируют в реакции агглютинации с сыворотками больных риккетсиозами группы КПЛ, за исключением пятнистой лихорадки Скалистых гор, Proteus vulgaris OX-19 - с сыворотками крови больных риккетсиозами группы СТ и пятнистой лихорадки Скалистых гор. Сыворотки больных болезнью Брилля-Цинссера и осповидного (вызываемого R. akari) риккетсиоза обычно не вступали в реакцию агглютинации Вейля-Феликса. Ориенции не имеют антигенных связей с риккетсиями групп СТ и КПЛ, однако имеют общие антигенные детерминанты с Proteus mirabilis ОХК, выявляемые в реакции Вейля-Феликса.
В течение многих десятилетий реакция связывания комплемента (РСК) являлась базовым методом серологической диагностики риккетсиозов. Метод обладает высокой групповой специфичностью даже при низких (1:10 — 1:20) разведениях сывороток, однако недостаточно чувствителен в ранней фазе заболевания. Комплементсвязываюшие антитела при большинстве риккетсиозов групп СТ и КИЛ выявляют в конце первой — начале второй недели инфекции, в некоторых случаях — в более поздние сроки. Наличие группоспецифического полисахаридного комплекса в составе препарата растворимого антигена для РСК приводит к отсутствию четкой видовой дифференциации внутри групп СТ и КПЛ, хотя титры антител обычно бывают выше к гомологичному антигену.
Иммуноферментный анализ (ИФА) применяют для серодиагностики риккетсиозов групп СТ и КПЛ, лихорадки цуцугамуши. Используют различные варианты ИФА с ренографин-очищенными антигенами для сенсибилизации планшет. По чувствительности и специфичности ИФА сопоставима с РНИФ, однако имеет некоторые преимущества при выявлении низких титров антител (у вакцинированных, в период поздней реконвалесценции), что можно использовать при ретроспективном эпидемиологическом анализе. В России выпускают тест-системы ИФА для выявления антигенов коксиелл Бернета и антител к ним (Санкт-Петербургский НИИЭМ им.Пастера).
Реакция непрямой иммунофлюоресценции (РНИФ) считается золотым стандартом серологической диагностики риккетсиозов, используемым в большинстве лабораторий. Метод обладает высокой специфичностью и чувствительностью, воспроизводимостью, позволяет выявлять IgM- и IgG-антитела как вместе, так и раздельно в зависимости от применяемых конъюгатов. При риккетсиозах группы КПЛ и лихорадке цуцугамуши диагностически значимые титры IgM-антител выявляют в конце первой недели, IgG-антител — в конце второй недели заболевания. В России корпускулярных антигенов для РНИФ не выпускают, экспериментальные серии производят НИИЭМ им.Гамалеи РАМН, Омский НИИ природноочаговых инфекций, Санкт-Петербургский НИИЭМ им.Пастера.
Методом подтверждения стандартных серологических методов диагностики является иммуноблоттинг. Показано, что перекрестно реагирующие антитела направлены против ЛПС и относятся к IgM-антителам, IgG-антитела образуются как к ЛПС, так и к белковым антигенам риккетсий. Коммерческие наборы для им-муноблоттинга находятся в стадии разработки.
Диагноз коксиеллеза вследствие полиморфизма клинического течения невозможен без лабораторного подтверждения. Основной метод — РСК. Наряду с ним используют более чувствительные методы — РНИФ и ИФА. У больных преобладают антитела к антигену С. burnetii фазы 2; антитела к антигену фазы 1 преобладают при формировании хронического течения.
б) Генетические методы. Генетические методы находят все более широкое применение для изучения и идентификации риккетсий. Среди них используют анализ полиморфизма длин рестрикционных фрагментов ДНК (ПДРФ), метод геномной дактилоскопии (ДНК-зонды), анализ полиморфизма длин рестрикционных фрагментов амплифицированной в полимеразной цепной реакции ДНК (ПДРФ аДНК ПЦР), пульсовый гелевый электрофорез, метод сравнения нуклеотидных последовательностей.
Рестрикционный анализ требует для своего осуществления большого количества ДНК, что на первых этапах генетического изучения риккетсий требовало накопления биомасс риккетсий на чувствительных моделях (желточные мешки куриных эмбрионов, культуры клеток). Использование методов, основанных на полимеразной ценной реакции, является более рациональным. При этом не только не требуется длительное культивирование микроорганизмов, но часто эти варианты генетического анализа оказываются более чувствительными и специфичными.
Несмотря на высокую перспективность, особенно для диагностики новых риккетсиозов и анаплазмозов, эти методы не нашли широкого применения в практике ввиду сложности и трудоемкости, а также в связи с методическими проблемами взятия и исследования клинического материала от больных. Тем не менее при помощи методов генодиагностики в последние годы доказана этиологическая значимость возбудителей ряда новых риккетсиозов — вызываемого R. slovaca синдрома TIBOLA (англ. — tick borne lymphoadenopathy — лимфоаденопатия после присасывания клеща), вызываемого R. heilongjiangii клещевого риккетсиоза и др.
в) Определение чувствительности к антибактериальным препаратам. С учетом внутриклеточного цикла жизни риккетсий определение их антибиотикочувствительности классическими микробиологическими методами невозможно. Для этих целей используют лабораторных животных, развивающиеся куриные эмбрионы и различные модели клеточных культур.
Редактор: Искандер Милевски. Дата публикации: 17.2.2020
Возбудитель - Coxiella burnetii.
Ку-лихорадка (от анг. guery - неясный, неопределённый, сомнительный) - природно-очаговая зооантропонозная болезнь домашних, промысловых и диких млекопитающих и птиц, чаще протекающая бессимптомно, характеризуется развитием ринита, бронхита, пневмонии, конъюнктивита, плеврита, мастита (у самцов орхита), а также абортами.
Как отдельные заболевание впервые Ку-лихорадка была выявлена в 1935 году Дёрриком в Южном Куинсленде (Австралия), возбудитель был идентифицирован в 1937 году и по предложению Дёррика назван Coxiella burnetii. Независимо от австралийских исследоварелей в США Кокс выделил фильтрующийся агент клещей переносчиков, доказав его риккетсиозную природу (1938).
Краткие эпизоотологические данные
Ку-риккетсиоз имеет повсеместное распространение, но чаще встречается в Австралии.
Экономический ущерб, причиняемый Ку-риккетсиозом значительный. Он складывается: из недополучения приплода животных (аборты, рождение нежизнеспособного молодняка, бесплодие); снижением удоя у коров и яйценоскости у домашних птиц и истощения.
К риккетсиям Бернета наиболее восприимчивы крупный и мелкий рогатый скот, свиньи, лошади, верблюды, буйволы, собаки, куры, гуси и голуби. C. burnetii способны спонтанно инфицировать 70 видов млекопитающих, 50 видов птиц и более 50 видов различных клещей из родов Dermacentor, Ambliomma, Yxodes, Rhipiceрhalus, Hyalomma, Haemaphisalis, а также десяти видов вшей и блох.
Источником возбудителя инфекции могут служить восприимчивые животные, а также в природных очагах клещи и грызуны, которые являются резервуаром возбудителя.
В естественных условиях животные и человек заражаются трансмиссивно через укусы клешей, аэрогенно, алиментарно с кормом и водой, через загрязненные экскретами больных животных корма, животное сырье (кожа, шерсть, мясо, молоко и др.).
Инфицированные животные выделяют возбудителя с кровью, слюной, мочой, калом и молоком. Особенно инфицированы плодные оболочки и воды, поэтому человек чаще заражается при родовспоможении.
При совместном содержании больных и здоровых животных возбудитель может передаваться и прямым путем. Особую опасность представляют в стадах животных инфицированные сторожевые собаки, выделяющие возбудителя с мочой и калом. Они чаще заражаются при поедании плацент, через укусы клещей.
Эпидемические вспышки Ку-лихорадки в сельских местностях чаще совпадают с сезонами отела и окота.
В местности с теплым климатом Ку-риккетсиоз встречается чаще и протекает тяжелее.
В.Я. Никитин и Л.Д. Тимченко (1994), проводя исследования в трех хозяйствах. Ставропольского края и Белгородской области установили диагноз на Ку-лихорадку, которая проявлялась кератоконъюнктивитом. У 36 % коров с поражением глаз регистрировали задержание последа, некротические изменения в околоплодных оболочках и эндометриты (98-100 %).
У больных животных в маточных выделениях были обнаружены в 78 % случаев риккетсии Бернета.
Благодаря бессимптомному хроническому течению летальность при Ку-риккетсиозе минимальна.
При Ку-лихорадке патогенез наиболее полно изучен на экспериментальных животных. Установлено, что возбудитель, попав в организм хозяина аэрогенным, алиментарным, контактным или трансмиссивным путем, вызывает состояние риккетсиемии и затем размножается в тканях и клетках СМФ - гистиоцитах и макрофагах, после разрушения которых отмечается генерализация процесса и токсинемия. После стадии генерализации, вследствие выраженной избирательной способности возбудителя к тканям, процесс локализуется и C. burnetii начинают обильно размножаться в легких, лимфоузлах, вымени, семенниках и особенно часто в беременной матке. В результате образуются микронекротические фокусы, заменяющие в последующем соединительной тканью. Из локальных фокусов возбудитель вновь может проникать в кровяное русло.
Такая органотропность приводит к абортам, конъюнктивитам, бронхопневмониям, маститам и выделению риккетсий с околоплодной жидкостью, плацентой, истечениями из глаз, носа и молоком.
В процессе инфекции развивается реакция гиперчувствительности замедленного типа и обнаруживаются комплементсвязывающие антитела.
Основные симптомы и патологоанатомические изменения
Инкубационный период при Ку-лихорадке продолжается от 3 до 30 дней. Болезнь развивается медленно, часто латентно с накоплением специфических антител в сыворотке крови.
На третий день инкубационного периода (после экспериментального заражения) у крупного рогатого скота повышается температура тела до 41-41,8 0С и удерживается 3-5 дней. Отмечают угнетение, отказ от корма, серозный ринит и конъюнктивит, значительное и длительное (до нескольких месяцев) снижение удоя молока, у стельных коров аборты, плацентиты. В течение 3-8 месяцев регистрируют повторные нерегулярные подъемы температуры тела.
В естественных условиях заражения болезнь у коров протекает чаще бессимптомно и выявляют ее лишь серологическими исследованиями и заражением лабораторных животных. Однако иногда отмечают приступы острого лихорадочного состояния, аборты во втором периоде стельности, длительное выделение риккетсий с молоком, мочой, испражнениями. Кроме того, отмечают бронхопневмонию, поражение половых органов, маститы (у быков орхиты), конъюнктивиты.
Тяжело протекает у животных экспериментальная инфекция: с поражением селезенки и других внутренних органов, абортами.
Патологоанатомические изменения не специфичны, у стельных коров поражаются легкие, плодные оболочки и матка, наблюдают очаги фибринозного мастита, увеличение и гиперемию надвымянных лимфоузлов, увеличение селезенки с полосчатыми и точечными кровоизлияниями, отек междольчатой соединительной ткани легких и дистрофические изменения в печени и почках.
Морфологические и тинкториальные свойства.
Риккетсии Бернета (Coxiella burnetii) - плеоморфные микроорганизмы, преобладают кокковидные и палочковидные формы шириной 0,2-0,4 мкм и длиной 0,4-1 мкм, реже нитевидной формы до 10-12 мкм, располагаются одиночно, попарно, иногда короткими цепочками. Образуют фильтрующиеся формы, способны к фазовой изменчивости. Встречаются в природе в I фазе, а после длительных пассажей превращаются во II фазу. Риккетсии II фазы склонны к спонтанной агглютинации и агглютинации в нормальной сыворотке крови, фагоцитируются при отсутствии антител (см. п. 2.4.3.). Иногда образуют спорообразные формы, обеспечивающие устойчивость к высоким температурам и высушиванию.
C. burnetii - аэробы, культивируюся при 37 0С будучи облигатными внутриклеточными паразитами коксиеллы не растут на обычных питательных средах.
В условиях лаборатории коксиелл культивируют в РКЭ, организме лабораторных животных (белые мыши, морские свинки, хомячки, кролики), реже - в иксодовых клещей, а также в культурах клеток (фибробласты, клетки L и другие).
Антигенная структура риккетсий Бернета отличается от микроорганизмов семейства Rickettsiaceae, серологических перекрестов с другими риккетсиями не установлено. Они имеют два антигена: поверхностный (растворимый) полисахаридный, присутствует у риккетсий фазы 1 и соматический (корпускулярный) - у фазы 2. Оба антигена иммунологически активны и вызывают образование антител у экспериментально и естественно зараженных животных. Диагностический титр антител к антигенам фазы 1 появляется на 40-60 день, а к антигенам из фазы 2 на 7-10 день.
У людей антигены второй фазы используют для иммунизации и в качестве аллергена для постановки внутрикожных проб.
Риккетсии Бернета более устойчивы к факторам внешней среды по сравнения с другими риккетсиями, как во влажном так и сухом материале. В высохшей моче инфицированных животных коксиеллы выживают в течении нескольких недель, в сухих фекалиях до двух лет, в высохшей крови, взятой от больных животных, сохраняются 180 дней, в фекалиях иксодовых клещей и мертвых клещах многие месяцы. В стерильной водопроводной воде - до 160 дней. В стерильном молоке коксиеллы сохраняют жизнеспособность до 257 дней.
В свежем мясе при хранении в леднике коксиеллы выживают не менее 30 дней, в засоленном - до 80 дней и более, в масле и сыре при 4 градусах остаются жизнеспособными более года.
На шерсти коксиеллы выживают в зависимости от температуры хранения - от 4 до 16 месяцев. Возбудитель весьма устойчив к ультрафиолетовому облучению (до 5 часов) и повышенной температуре (часовое нагревание до 80-90 градусов не обеспечивает его гибели). Кипячение убивает коксиелл в течение одной минуты.
Обезвреживание коксиелл требует применения более высоких концентраций химических веществ и большей их экспозиции, чем для других риккетсий. Применяя 3-5 % раствор фенола, 3 % раствор хлорамина, 2 % раствор хлорной извести, последний вызывает гибель коксиелл в течение 2-5 минут. В ветеринарной практике для дезинфекции помещений и предметов ухода за скотом применяют 2 %-ные растворы NaOH и формальдегида, 3 % раствор креолина, раствор хлорной извести с 2 %-ым содержанием активного хлора.
Устойчивость коксиелл Бернета к воздействию факторов внешней среды обуславливает сохраняемость их при транспортировке с загрязненным сырьем животного и растительного происхождения на любые расстояния, и создает предпосылки возникновения заболеваний лихорадкой Ку - в местностях, весьма отдаленных от энзоотических районов.
Лабораторная диагностика Ку-риккетсиоза.
При подозрении на наличие лихорадки-Ку у сельскохозяйственных животных, а также при появлении в хозяйстве заболевания неизвестной этиологии, с признаками, напоминающими лихорадку-Ку, поводят лабораторную диагностику путем исследования клещей и грызунов.
Материал для исследования.
Объектами лабораторного исследования могут быть: при жизни животного - кровь, взятая из яремной вены (2-1,5 мл), клещи, собранные с животных, на пастбище, мелкие зверьки, грызуны (полевки, крысы), или их свежие трупы, экссудат из матки и влагалища, плацента абортировавшего животного, от погибших или убитых с диагностической целью сельскохозяйственных животных, части пораженного легкого, головного мозга, селезенки, регионарных лимфоузлов, паренхимы вымени, кровь.
Материал отправляют в специализированную лабораторию в герметизированных контейнерах, поддерживая температуру в контейнерах +4 0С.
Лабораторная диагностика лихорадки-Ку заключается в:
выявлении специфических антител в сыворотке крови сельскохозяйственных животных и грызунов в реакции длительного связывания комплемента (РДСК) с использованием антигена из возбудителя фазы 1 лихорадки-Ку (ретроспективная диагностика);
обнаружении и идентификации возбудителя этой болезни в патологическом материале грызунов и сельскохозяйственных животных, а также от клещей, собранных в природном очаге и от животных, путем постановки биологической пробы и микроскопии мазков.
Серологическая диагностика лихорадки-Ку
Серодиагностика основана на проведении РДСК, а также разработаны РСК, РП, РА, РИФ (непрямой метод).
Биопробу проводят или на морских свинках с живой массой 300-400 г или белых мышах с живой массой 8-10 г или 6-7-дневных куриных эмбрионах (КЭ).
Заражение морских свинок
Заражение белых мышей
Для каждой исследуемой пробы материала берут не менее 4-х белых мышей. Исследуемый материал вводят внутрибрюшинно по 0,5-1,0 мл. Наблюдение ведут в течение 12 дней. Мыши, павшие в течение 3 дней после введения материала, утилизируются. Мышей, павших через 4 и более дней и оставшихся в живых, по истечении 12 дней убивают под эфирным наркозом и вскрывают с соблюдением асептики. Для микроскопии готовят мазки-отпечатки из селезенок. При патологоанатомическом исследовании обнаруживаются признаки пневмонии, увеличение селезенки и печени.
В качестве лабораторных животных можно использовать белых крыс, хомячков, сусликов и кроликов.
Если заражать лабораторных животных внутривенно или в переднюю камеру глаза (после предварительно анестезии) Ку-риккетсиоз протекает бессимптомно. После убоя животных риккетсий обнаруживают в почках, селезенке (Т.С. Костенко, 1989 г.).
Заражение развивающихся куриных эмбрионов
При использовании КЭ исследуемый материал вводят в желточный мешок не менее 4 эмбрионов 6-7 дневного, по 0,3-0,5 мл и наблюдают в течение 12 дней. Гибель эмбрионов на 1-3 сутки после введения материала считается неспецифической и они утилизируются. Погибших эмбрионов через 4 и более дней, оставшихся в живых через 12 дней вскрывают в асептических условиях, извлекают желточные мешки и из них готовят мазки-отпечатки для микроскопии.
Микроскопическое исследование мазков на наличие возбудителя Ку - лихорадки
Проводят с использованием окраски мазков по методу Здродовского. Высушенные на воздухе мазки фиксируют обычным способом на пламени и окрашивают основным фуксином Циля, разведенным бидистиллированной водой из расчета 15-18 капель фуксина на 10 мл воды. Мазки окрашивают в течение 5 минут, затем фуксин смывают водой, препарат погружают на 2-3 секунды в 0,5 % раствор лимонной кислоты и промывают водой. Затем в течение 15-30 секунд окрашивают 0,5 % водным раствором метиленовой сини и снова промывают водой, мазок высушивают фильтрованной бумагой и микроскопируют в иммерсионной системе при увеличении 7 90. При этом риккетсии имеют вид палочек или кокков красного цвета на синем фоне.
При отсутствии возбудителя в мазках в первом пассаже проводят 3 последовательных пассажа.
Дифференциация возбудителя Ку-лихорадки
При дифференциации исключают хламидиоз, бруцеллез, пастереллез и листериоз, которые могут протекать самостоятельно и в виде смешанных инфекций.
Диагноз на Ку-лихорадку считают установленным при получении одного из следующих результатов:
- выявлении специфических антител в сыворотке крови сельскохозяйственных животных и грызунов в реакции длительного связывания комплемента с использованием антигена из возбудителя фазы I лихорадки Ку (ретроспективная диагностика);
обнаружении и идентификации возбудителя этой болезни в патологоанатомическом материале грызунов и сельскохозяйственных животных, а также от клещей, собранных в природном очаге и от животных, путем постановки биологической пробы и микроскопии мазков.
Окончательный диагноз на лихорадку Ку устанавливается на основании эпизоотологических, клинических и патологоанатомических данных с учетом лабораторных исследований.
Диагностическая оценка результатов исследований
В случае выделения возбудителя от клещей и грызунов или обнаружении специфических антител в сыворотке крови морской свинки при постановке биопробы местность (регион) считают природным очагом Ку-лихорадки, а при выделении возбудителя из организма сельскохозяйственных животных (ферму) считать неблагополучной по этой болезни.
Сроки исследований: биопробы на морских свинках - до 30 дней, на белых мышах и куриных эмбрионах - до 13 дней.
Читайте также:


