Лабораторные животные в диагностике инфекций в ветеринарии

На сегодняшний день методы лабораторной диагностики в ветеринарии довольно многочисленны, и продолжают расширяться. Применяют их главным образом для подтверждения диагноза или его уточнения, установления причины болезни, для характеристики формы, тяжести течения и определения прогноза болезни, для выбора этиологической и патогенетической терапии, для оценки и контроля результатов лечения, а также для обнаружения патологии при скрининговых исследованиях.
Благодаря новейшему высокотехнологичному оборудованию и реактивам, лабораторная диагностика способна обеспечить выполнение как распространенных, так и самых редких анализов, и получить качественные и максимально информативные данные о процессах, происходящих в организме в самые короткие сроки.
Лабораторные анализы выполняются практически у всех больных животных и значительно чаще, чем другие дополнительные методы обследования.
Наиболее распространенной услугой лабораторной диагностики в ветеринарии является анализ крови, который помогает определить изменения в общем состоянии животного и функциональные характеристики большинства органов и систем.
Общий клинический анализ крови позволяет диагностировать большинство заболеваний крови (анемии, лейкозы и др.), а также оценить динамику воспалительного процесса, эффективность проводимого лечения, вовремя обнаружить развивающиеся побочные эффекты от применяемых препаратов.
Клинический анализ крови проводят на гематологических анализаторах (автоматические счетчики, основанные на кондуктометрическом методе) или ручным способом (камера Горяева) с целью подсчета клеток крови (лейкоциты, эритроциты, тромбоциты), а также оценки их размеров, структуры и цитохимических характеристик клеток, концентрации гемоглобина. Помимо количественных характеристик, общий анализ крови дает оценку и качественному составу клеток при помощи исследования мазка периферической крови при тысячекратном увеличении под микроскопом. Основная задача микроскопии мазка крови – это подсчет лейкоцитарной формулы, т.е. разделение лейкоцитов на популяции (нейтрофилы, эозинофилы, базофилы, моноциты, лимфоциты), оценка их степени зрелости и состояния клеток. Помимо лейкоцитарной формулы, оценивается и состояние эритроцитов (размеры, форма, наличие ядерных форм, насыщенность гемоглобином, наличие различных включений, в т.ч. паразитарного происхождения и пр.), а также качество тромбоцитов.
Для оценки регенераторной способности костного мозга при анемии проводят анализ на ретикулоциты. Процент ретикулоцитов оценивается при помощи микроскопии мазка, окрашенного специальным красителем.
Коагулометрия при помощи клоттинговых тестов (определение времени образования сгустка) позволяет оценить состояние свертывающей системы крови. На специальном автоматическом коагулометре измеряют протромбиновое время (ПВ), тромбиновое время (ТВ), активированное частичное тромбопластиновое время (АЧТВ), концентрацию фибриногена.
Биохимический анализ крови отражает функциональное состояние различных органов и систем организма животного. При биохимическом анализе крови исследуются ферменты (АСТ, АЛТ, щелочная фосфатаза, липаза, амилаза и др.), белки, небелковые азотистые компоненты (мочевина, креатинин), пигменты (билирубин), показатели углеводного (глюкоза, фруктозамин), липидного (триглицериды, холестерин) и водно-солевого обменов (натрий, калий, хлор, кальций, магний, фосфор и др.).
Для выполнения биохимического анализа используются специальные автоматические биохимические анализаторы, принцип работы которых основан на различных методах исследования, главным образом оптических (спектрофотомерия, флюорометрия и др.) Также широко применяют электрофорез (для определения белков), различные виды хроматографии, ионо-специфическую потенциометрию (для исследования уровня электролитов), иммуноферментный анализ и др.
Определение концентрации гормонов в крови является важнейшим способом оценки состояния эндокринных функций организма. С помощью иммуноферментного анализа (ИФА) в сыворотке крови определяется уровень гормонов щитовидной железы (тироксин, трийодтиронин), половых гормонов (тестостерон, прогестерон, эстрадиол, ЛГ, ФСГ), кортикостероидных гормонов (кортизол) и др.
В ряде случаев определение гормонов проводят в условиях специфических нагрузок на организм животного, что позволяет оценить резервные возможности той или иной железы внутренней секреции или сохранность механизмов обратной связи. Например, для оценки функции коры надпочечников используют тест на стимуляцию АКТГ (адренокортикотропным гормоном), применимый для диагностики недостаточности коры надпочечников (гипоадренокортицизма) и гиперадренокортицизма, основанный на измерении концентрации кортизола в сыворотке крови до и после введения синтетического аналога АКТГ (синактена), стимулирующего надпочечники.
В других случаях концентрацию определяемого гормона, сопоставляют с содержанием его физиологического регулятора (например, тироксина (Т4) и тиреотропного гормона (ТТГ)), что способствует дифференциальной диагностике близких патологических состояний (например, первичного и вторичного гипотиреоза).
Помимо исследований крови, среди лабораторных методов в ветеринарии часто выполняется анализ мочи. Общий клинический анализ мочи позволяет оценить функцию почек и других внутренних органов, а также выявить воспалительный процесс в мочевых путях.
Исследование мочи состоит из физико-химического анализа, с помощью которого определяют цвет, прозрачность, относительную плотность, белок, глюкозу и кетоновые тела, и микроскопического исследования, позволяющего обнаружить эритроциты и лейкоциты, эпителиальные клетки, цилиндры, слизь, кристаллы и некоторые патологические микроорганизмы. Определение концентрации мочи (удельный вес, или относительная плотность мочи) проводится рефрактометрическим методом на специальном приборе.
Общий клинический анализ кала, или копрограмма позволяет оценить работу желудочно-кишечного тракта, выявить наличие воспалительных процессов, яиц гельминтов или простейших.
При помощи физико-химических методов определяют цвет, форму, запах, консистенцию, кислотность кала, наличие примесей (слизь, шерсть, членики гельминтов и пр.), а также наличие крови, билирубина, стеркобилина, крахмала, нейтрального жира и др. При микроскопическом исследовании определяют переваримость корма, наличие клеточных элементов (лейкоциты, эритроциты, эпителиальные клетки) и паразитов (яйца и личинки гельминтов, различные формы простейших).
Помимо копрограммы, яйца гельминтов и простейших в кале можно обнаружить при помощи такого метода, как овогельминтоскопия, в основе которого лежит принцип флотации и микроскопия.
Для обнаружения эктопаразитов (саркоптоз, нотоэдроз, хейлетиеллез, демодекоз, отодектоз и др.) и дерматофитов проводится исследование соскобов с кожи при помощи световой микроскопии. Этот метод достаточно информативен и выполнятся очень быстро.
Для видового определения дерматофитов (микроспория, трихофития) и выявления животных-носителей (без клинического проявления заболевания) необходимо сделать посев на специальные среды.
Для диагностики инфекционных заболеваний часто используют иммунологические методы исследования, основанные на образовании специфических иммунных комплексов из антигенов и антител. Используя специфические реакции, часто определяют наличие и титры антител к лептоспирозу (РМА), вирусному гепатиту (РДП), возбудителю токсоплазмоза и другим инфекциям, позволяя оценить устойчивость организма к различным инфекционным заболеваниям и прогнозировать развитие этих заболеваний, а также оценить эффективность вакцинации.
В настоящее время широкое применение в ветеринарии получили такие иммунологические методы как, иммуноферментный анализ (ELISA) и иммунохроматография (ИХ), позволяющие обнаружить антитела к определенным вирусам (например, к вирусу иммунодефицита кошек) в сыворотке крови, или антигены (такие как, парвовирус, вирус чумы плотоядных, вирус лейкемии кошек) в исследуемом образце.
Несмотря на многообразие методов лабораторной диагностики инфекционных заболеваний, самым современным и точным является полимеразная цепная реакция (ПЦР) в реальном времени. ПЦР очень чувствительна в определении возбудителей таких инфекций, как хламидиоз, микоплазмоз, калицивироз, инфекционный ринотрахеит, аденовироз, короновирусный энтерит, инфекционный перитонит кошек, вирусная лейкемия кошек, вирусный иммунодефицит кошек, парвовирусный энтерит, панлейкопения, чума плотоядных и др.
Метод ПЦР в реальном времени (PCR- real time) основан на принципе естественной репликации нуклеиновых кислот, который позволяет добиться значительного увеличения малых концентраций определённых фрагментов ДНК в биологической пробе. Процесс ПЦР состоит из серии циклически повторяющихся реакций: денатурации ДНК, отжига зондов и синтеза ДНК (элонгации). Отсутствие стадии электрофореза позволяет минимизировать риск контаминации продуктами ПЦР и, таким образом, резко уменьшить число ложноположительных результатов, т.к. регистрация результатов проводится непосредственно в процессе полимеразной цепной реакции.
Бактериоскопические методы лабораторной диагностики проводят с целью исследования мазков-отпечатков с кожи, содержимого наружного слухового прохода, пустул и прочих образцов на наличие бактерий, грибов, паразитов и клеточного состава при помощи микроскопии. Это достаточно простой и быстрый способ лабораторной диагностики дерматологических заболеваний, но более точным методом остается бактериологический посев.
Бактериологический посев - это лабораторное исследование, направленное на выявление и идентификацию микроорганизмов, вызывающих заболевание, с определением их чувствительности к антибиотикам, для назначения правильного лечения или определения эффективности проведенного лечения.
Бактериологический посев чаще всего проводят при подозрении на инфекционно-воспалительные процессы в тканях и органах, которые в норме не содержат бактерий, поэтому важным условием для исследования является правильный забор исследуемого биологического материала, исключающий контаминацию образца.
Лабораторная диагностика в ветеринарии обладает широким спектром востребованных методов, обеспечивающих получение важной дополнительной информации, которая позволяет врачу точно поставить диагноз и назначить лечение.
Меркитанова М.А.
Ветеринарный врач-лаборант
лаборатории BIOVETLAB

Биохимический анализ крови — это лабораторный метод исследования, использующийся в ветеринарии, который отражает функциональное состояние органов и систем организма животного.

Существует разделение животных по признаку ритма полового цикла на моно- и полициклических. Первая группа включает в себя животных имеющих 1 половой цикл в году. У полициклических животных происходит несколько циклов, которые в течение сезона или всего года повторяются с определенной частотой в зависимости от вида животного. Отнести собак к какой-либо определенной из этих групп сложно, поскольку на протяжении года у них могут быть 1-2 и даже 3 половых цикла. Поэтому некоторые авторы относят собак к моноциклическим, а другие считают их дициклическими животными.
Радюк Екатерина Васильевна – врач-лаборант ИВЦ МВА
Инфекционные заболевания весьма часто встречаются в ветеринарной практике. Для владельца животного важно вовремя обратить внимание на симптомы недомогания питомца. Для большинства инфекционных заболеваний эти симптомы неспецифичны: угнетение, отказ от корма, повышенная температура тела, рвота, понос; при некоторых заболеваниях встречается хромота и опухание суставов; возможно изменение цвета мочи.
Для ветеринарного врача, к которому приводят заболевшее животное, важно составить список дифференциальных диагнозов и исключить (или подтвердить) их специальными методами диагностики. Однако стоит помнить, что выбор диагностического метода будет зависеть от вида возбудителя, его локализации и стадии заболевания. Методика, применимая для диагностики одной инфекции, совершенно неприемлема для диагностики другой.
В данной статье представлен обзор основных методов диагностики инфекционных заболеваний, которыми располагает современная ветеринарная медицина.
Возбудители многих заболеваний, как правило, достаточно требовательны к питательным средам и достаточно сложны для культивирования invitro. Не для всех возбудителей определены условия культивирования. В некоторых случаях используют синтетические или полусинтетические среды – однако при этом рост возбудителей очень медленный (до нескольких месяцев) и всегда присутствует значительный риск грибковой или бактериальной контаминации, несмотря строгое соблюдение асептики. Кроме того, проведение работ по культивированию возможно только в специализированных микробиологических лабораториях. Поэтому в ветеринарии данный метод не нашел широкого применения при диагностике инфекционных заболеваний; работы, связанные с культивированием возбудителей, проводятся, как правило, только в специальных исследовательских институтах с целью их более детального изучения и разработки диагностических тест-систем.
2. Световая микроскопия
1) Микроскопия фиксированных окрашенных препаратов
Является наиболее доступным и потому распространенным методом диагностики инфекционных (особенно трансмиссивных) заболеваний в ветеринарной медицине. Основан на выявлении возбудителя в клиническом материале по характерной морфологии. Однако, несмотря на свою простоту и доступность, у этого метода есть свои недостатки.
Во-первых, у метода световой микроскопии достаточно ограниченная чувствительность. При незначительном количестве возбудителей в материале результат микроскопии может быть отрицательным.
Во-вторых, необходимо тщательное приготовление и окраска мазков для минимизации возможных артефактов.
В-третьих, лаборанту или врачу, интерпретирующему мазок, требуется достаточный опыт и хорошее знание морфологии как клеток тканей, так и возбудителей и умение отличать последних от возможных рефракционных артефактов или преципитатов красителя. И, в-четвертых, точное определение вида возбудителя при использовании только световой микроскопии возможно далеко не всегда. Поэтому световую микроскопию стараются дополнять другими методами диагностики, основанными на обнаружении специфических антител либо генетического материала возбудителя.
2)Темнопольная микроскопия
Вид оптической микроскопии, в которой контраст изображения увеличивают за счет регистрации только света, рассеянного изучаемым образцом. Как правило, используется для обнаружения спирохет - боррелий и лептоспир. Из-за необходимости наличия специального оборудования в рутинной ветеринарной практике применяется редко. Кроме того, с помощью темнопольной микроскопии невозможно определить видовую принадлежность возбудителя и его патогенность.
3. Полимеразная цепная реакция (ПЦР)
Полимеразная цепная реакция (ПЦР) – это метод ферментативного получения ампликонов (большого количества копий) исследуемых фрагментов ДНК путем повторных циклов репликации и денатурации (разделения цепи ДНК на отдельные нити); при этом происходит копирование только исследуемого участка ДНК (при условии его присутствия в данном образце), поскольку только этот участок соответствует заданным условиям.
Метод ПЦР идеально подходит для обнаружения микроорганизмов, трудно визуализирующихся, медленно растущих или сложных в культивировании. ПЦР является наиболее предпочтительным методом для диагностики заболевания в острый период. Основным лимитирующим фактором при использовании ПЦР является содержание в исследуемой пробе достаточного количества материала (нуклеиновой кислоты возбудителя). Для многих возбудителей известно, что их количество в крови меняется с течением времени; таким образом, в какой-то момент времени ПЦР может показать ложноотрицательный результат у инфицированного пациента. Таким образом, для врача крайне важно знать тропность возбудителя к тканям организма и отправлять на исследование тот материал, в котором вероятность обнаружения возбудителя наиболее высока (например, мочу – при диагностике лептоспироза, плаценту или пунктат семенников при подозрении на бруцеллез, синовиальную жидкость - при исследовании на боррелиоз).
4. Серологические методы диагностики
Данные методы основаны на выявлении у животных специфических антител. Заражение инфекционным агентом, если оно происходит впервые, в течение недели вызывает у животного умеренный рост иммуноглобулинов класса М (IgM) и постепенное увеличение иммуноглобулинов класса G (IgG), которое достигает пика через 14 дней. Определение уровня антител у животных с остро начинающимся заболеванием (таким как бабезиоз) дает мало полезной диагностической информации. Для диагностики хронических заболеваний (например, моноцитарного эрлихиоза) измерение уровня антител будет более полезным.
Продукция антител у каждого животного может сильно варьироваться; этот процесс зависит от возраста, иммунного статуса и генетической принадлежности. Лучший способ оценки степени сероконверсии заключается в исследовании парных сывороток, взятых с интервалом в 2-3 недели. Растущий титр антител указывают на недавнюю и, следовательно, клинически значимую инфекцию, особенно если это подтверждается соответствующими клиническими признаками. Альтернативным методом определения недавней инфекции является измерение уровня IgM, однако в ветеринарной практике данный метод практически не используется.
1) Твердофазный иммуноферментный анализ (ИФА, ELISA)
Принцип метода заключается в том, один их специфических реагентов (антиген) иммобилизуют на твердой фазе. Затем последовательно добавляют другие специфические реагенты, проводя после инкубации каждого из них промывку с целью удаления несвязавшихся компонентов. Один из специфических реагентов, так называемый конъюгат, содержит ферментную метку. Для визуализации результата в конце реакции добавляют хромогеновый субстрат. Через определенный промежуток времени реакцию останавливают и проводят считывание на спектрофотометре.
Для определения титра антител в сыворотке готовят несколько последовательных разведений; титр антител определяется как обратный последнему видимому разведению (к примеру, если последнее разведение было 1:2000, то титр антител составит 2000). Метод твердофазного ИФА является наиболее предпочтительным для определения наличия антител к возбудителям, антигены которых легкодоступны (т.е. это либо легко культивируемые микроорганизмы, либо те, для которых получены рекомбинантные антигены). Кроме того, он может использоваться и для выявления антигенов возбудителя – например при диагностике инвазии Dirofilariaimmitisили вируса лейкемии кошек.
Для использования полноценного твердофазного иммуноферментного анализа необходимо наличие специального лабораторного оборудования. Однако существует экспресс-модификация ИФА (SNAP, IDEXX Laboratories), где антиген/антитела иммобилизированы не на плашке, а на мембранном фильтре. Эти тесты широко используются в клиниках для диагностики трансмиссивных заболеваний (лейшманиоза, дирофиляриоза, анаплазмоза, эрлихиоза и боррелиоза). Однако они не дают возможность зафиксировать рост или снижение титра антител, а также определить их принадлежность к M или G классу.
2) Метод флюоресцирующих антител (МФА, IFA)
В случае, когда культивирование микроорганизма сопряжено с техническими сложностями либо небезопасно, применяют метод иммунофлюоресценции. При этом может быть обнаружен как сам организм в зараженных клетках и тканях пациента (прямой МФА) либо наличие в сыворотке специфичных антител (непрямой МФА). В непрямом МФА зараженные клетки (как правило, культурального происхождения) зафиксированы на предметных стеклах либо планшетках. Сама процедура исследования схожа с таковой в ИФА. Однако в конъюгате вместо фермента здесь используется специальный краситель, дающий при определенной длине волны флюоресцентное свечение, которое можно видеть в специальный микроскоп. Количество антител также определяется по последнему разведению, давшему положительный результат.
Прямой МФА считается менее чувствительным; используется в тех случаях, когда число зараженных клеток невелико (например, для выявления в мазках крови морул Anaplasmaphagocytophilum).
3) Иммуноблот (вестерн-блот)
Таким образом, в статье были рассмотрены основные методы, применяемые сегодня для диагностики инфекционных заболеваний животных. Особое внимание хотелось бы уделить тому, что не существует какого-либо универсального метода для диагностики того или иного заболевания. Поэтому от врача при постановке диагноза требуется комплексный подход; необходимо учитывать анамнез, длительность заболевания, клинические признаки и данные общих лабораторных исследований.
Кроме того, необходимо умение правильно интерпретировать результаты – ведь даже обнаружение антител (особенно класса G) к тому или иному возбудителю не говорит о том, что именно этот этиологический агент является причиной нынешнего состояния животного. Только грамотное применение и интерпретация специальных методов исследования (не только при диагностике трансмиссивных заболеваний) в сочетании с клинической картиной дает возможность правильно поставить диагноз и назначить адекватное лечение.
[youtube.player]



Здоровье питомцев зависит от многих факторов, среди которых:
• условия кормления и содержания;
При появлении первых признаков недомогания следует незамедлительно обратиться за квалифицированной ветеринарной помощью. После проведенного клинического осмотра, вероятнее всего, врачу понадобится дополнительная информация о состоянии внутренних органов и систем организма пациента, в связи с чем, будут проведены необходимые анализы.
Причины недомоганий кошек и собак различны. Наиболее распространенными обращениями являются случаи с расстройством пищеварения, чаще из-за неправильного кормления питомцев. Для оценки работы пищеварительной системы и принятия решения о дальнейших действиях, врачу потребуются данные лабораторных результатов анализов крови и кала, а также ультразвуковое исследование (УЗИ) брюшной полости.
Второе место по распространенности занимают инфекционные заболевания. Например, для диагностики парвовирусного энтерита у собак (СPV –CanineParvovirus) врач назначит анализ кала или ректального мазка на наличие возбудителя заболевания. Для дифференциальной диагностики, врачу понадобятся анализы на коронавирусный энтерит (CCoV – CanineCoronavirus) и чуму плотоядных (CDV–CanineDistempervirus). Помимо этого, клинический и биохимический анализы крови для оценки степени обезвоживания организма и функционального состояния работы внутренних органов. У кошек при подозрении на инфекцию верхних дыхательных путей, необходимо взять анализ на инфекционный ринотрахеит (FHV – FelineHerpesvirus) и калицивироз (FCaV – FelineCalicivirus).
Важно знать, что некоторые инфекционные заболевания опасны и для человека (токсоплазмоз, лептоспироз, дерматофитии), поэтому ряд исследований, направленных на выявление этих возбудителей, поможет снизить риск заражения зооантропонозами и оказать своевременную помощь питомцу.
Хронические заболевания кошек и собак занимают третье место по распространенности. Так, для оценки состояния мочевыделительной системы при хронической почечной недостаточности необходимо контролировать такие показатели в крови, как креатинин, мочевина, уровень электролитов, а также получить данные анализа мочи (удельный, вес, белок, микроскопия осадка).
При диспансеризации питомцев, проводимой один раз в год, анализы (общий клинический анализ крови, биохимический анализ крови, анализы кала и мочи) необходимы для получения информации об общем состоянии животного, осуществления мониторинга и, при необходимости, назначения и корректировки лечения.
В случае подтверждения или опровержения поставленного животному предварительного диагноза, проводят бактериологические, микологические, гистологические, цитологические и вирусологические исследования, а также исследования гормонального фона и микроскопические исследования соскобов с кожи.
Спектр анализов, проводимых для кошек и собак, достаточно велик, и он постоянно расширяется в связи с разработкой новых методик диагностики заболеваний. Только компетентный и опытный ветеринарный врач способен назначить необходимый в той или иной ситуации анализ и сделать верное заключение. При этом важно понимать, что качественную ветеринарную помощь можно получить лишь тогда, когда проведено не только клиническое обследование домашнего животного (осмотр), но и взяты анализы и проведены дополнительные исследования по диагностике заболевания. Ведь своевременное обращение за квалифицированной ветеринарной помощью поможет сохранить здоровье питомца на более продолжительное время.
[youtube.player]Микроскопия (световая, люминесцентная)
Микроскопия (люминесцентная, световая, электронная)
Выделение вируса биопроба
Гематологический
Примечание. Для каждой болезни существует перечень показателей, по которым диагноз считают установленным.
Благодаря правильному и своевременному диагнозу удается обеспечить эффективность оздоровительных мероприятий, т. е. быстро купировать возникший эпизоотический очаг и предупредить дальнейшее распространение болезни.
Эпизоотологический метод. Представляет собой систему изучения проявлений эпизоотического процесса. Для характеристики последнего необходимо собрать точную информацию о восприимчивых видах, источнике и резервуаре возбудителя болезни, механизме его передачи, воротах инфекции, интенсивности проявления эпизоотического процесса, сезонности, предрасполагающих факторах, заболеваемости, смертности, летальности. Кроме того, особое внимание обращают на факторы, определяющие пути дальнейшего распространения заболевания — выполнение противоэпизоотических мероприятий и условия внешней среды.
Чтобы охарактеризовать эпизоотическое состояние хозяйства, сопоставляют и оценивают обобщенные эпизоотологические показатели, получаемые путем статистической обработки данных первичного учета заболеваний и профилактических мероприятий.
Клинический метод. При клиническом исследовании животных, подозреваемых в заболевании инфекционной болезнью, необходимо всегда строго соблюдать правила работы, предусмотренные соответствующей инструкцией.
Клиническое исследование рекомендуют начинать с измерения температуры тела животного. Далее осматривают животное в нефиксированном состоянии: обращают внимание на положение тела реакцию на различные раздражители, прием корма и воды, характер фекалий, особенности дефекации и мочеиспускания. Затем приступают к исследованию отдельных систем и органов по схеме, общепринятой в клинической диагностике болезней.
Клинические признаки инфекционной болезни зависят от многих факторов: вида и локализации возбудителя, течения, формы проявления и стадии болезни, резистентности организма и других причин. Во всех случаях клинические признаки одной и той же инфекционной болезни у животных даже одного вида сильно варьируют.
Патоморфологический метод. Включает в себя патологоанатомический и гистологический методы исследований. Патологоанатомический метод считают важным, но не всегда окончательным методом диагностики. Например, если при вскрытии трупа животного (птицы) отмечают характерные изменения — туберкулы, то сразу же диагностируют туберкулез, при обнаружении в селезенке свиньи краевых геморрагических инфарктов — чуму, кровоизлияний на границе мышечного и железистого желудка у кур — болезнь Ньюкасла и т. д.
Порядок патологоанатомического исследования: оценивают состояние трупа, кожи и слизистых оболочек, затем исследуют лимфатическую систему, серозные покровы, мышцы и суставы, органы дыхания, сердце и кровеносные сосуды, печень, селезенку, почки, глотку, пищевод, желудок, тонкий кишечник, толстый кишечник, мочевой пузырь, органы воспроизводства, головной и спинной мозг.
Однако во многих случаях наряду с патологоанатомическим применяют и метод лабораторных исследований (гистологических, бактериологических и др.). С помощью гистологического метода устанавливают точный диагноз при таких болезнях, как - бешенство (тельца Бабеша—Негри), ринопневмония (внутриядерные включения типа Коудри), оспа (тельца-включения).
Бактериологический метод. Это ценный метод диагностики инфекционных болезней. Для бактериологического исследования от больных или павших животных необходимо правильно взять патологический материал и грамотно оформить сопроводительный документ. Поступивший биоматериал обрабатывают в зависимости от предполагаемой болезни, делают мазки-отпечатки, красят их соответствующими методами, выделяют чистую культуру посевом на питательные (элективные) среды, заражают чувствительных лабораторных животных биоматериалом или выделенной чистой культурой (табл.1).
1. Бактериологический метод диагностики некоторых инфекционных болезней
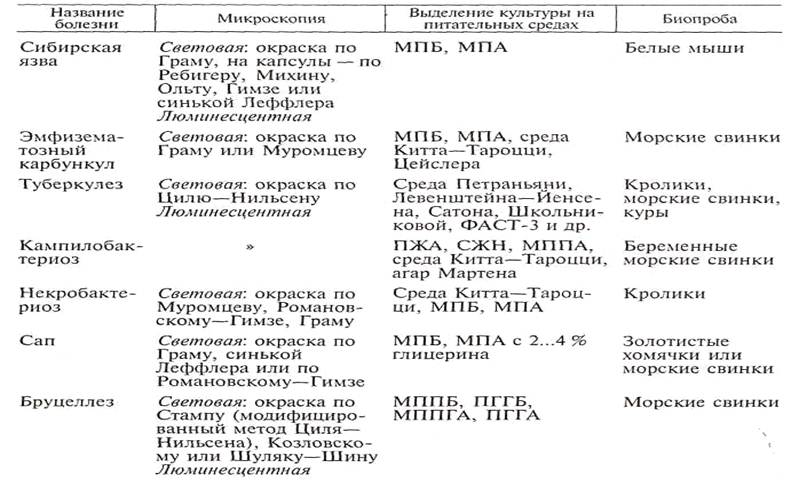
На основании обнаружения патогенных микроорганизмов в поступившем материале устанавливают этиологический диагноз.
Вирусологический метод. Для вирусологического исследования в лабораторию направляют патологический материал от больных животных, взятый в период проявления у них клинических признаков (температурная реакция, угнетение, воспалительные процессы в верхних дыхательных путях, сопровождающиеся серозными или слизистыми истечениями из носовой полости, диарея, образование везикул, афт, иногда аборты), или вынужденно убитых (павших) животных, взятый не позднее чем через 2 ч после их гибели. Вирусологический метод диагностики включает в себя: обнаружение возбудителя в патологическом материале различными методами (электронная, люминесцентная или световая микроскопия, заражение культуры клеток, лабораторных животных и т. д.), выделение и идентификацию вируса в различных серологических реакциях, биопробу.
Гематологический метод. В лабораторию для гематологического исследования отправляют кровь, которую берут с соблюдением правил асептики из яремной вены в пробирки с антикоагулянтом— 10 %-м раствором трилона Б, гепарина, цитрата натрия из расчета 0,02 мл раствора на 1 мл крови.
Гематологический метод используют как вспомогательный, а при некоторых инфекционных болезнях (лейкоз крупного рогатого скота, инфекционная анемия лошадей) — в качестве основного метода диагностики. При лейкозе крупного рогатого скота диагноз основан на обнаружении в периферической крови повышения содержания лейкоцитов основного лимфоидного ряда в 1-10-3 мл крови, а при инфекционной анемии лошадей — на основании снижения содержания эритроцитов в 1 • 103 мл крови, гемоглобина и замедленной скорости оседания эритроцитов (СОЭ).
Иммунологический метод. Включает в себя серологическую диагностику — в лаборатории исследуют сыворотки крови для обнаружения антител и аллергическую пробу, с помощью которой в хозяйствах выявляют животных, больных туберкулезом, паратуберкулезом, бруцеллезом, сапом, реже — сибирской язвой, листериозом, туляремией.
[youtube.player]Читайте также:


