Лечение иммуноглобулином ревматоидного артрита
Ревматоидный артрит – тяжелое, с трудом поддающееся лечению заболевание. Причины развития его установлены не полностью, тем не менее, при проведении правильно назначенного комплексного лечения качество жизни пациента может быть вполне удовлетворительным. Но это при условии неукоснительного выполнения больным всех рекомендаций лечащего врача.
Что такое ревматоидный артрит
Ревматоидный артрит (РА) – хроническое системное прогрессирующее заболевание, проявляющееся в виде воспаления в основном мелких суставов. Связано оно не с инфекцией, а с поломкой иммунной системы. Поражается соединительная ткань, поэтому данное заболевание называется системным. Патологический процесс часто распространяется и внутренние органы (сердце, сосуды, почки) – это внесуставные проявления болезни.
Всего в мире ревматоидным артритом болеет около 1% населения. Заболеть можно в любом возрасте, но чаще это случается в 35 – 55 лет у женщин и немного позже (в 40 – 60 лет) у мужчин. Ревматоидный артрит у женщины диагностируют в три раза чаще, чем мужчины.
Причины
Точные причины начала данного заболевания не установлены. Но известны основные причинные факторы:
- Наследственная предрасположенность – встречаются случаи семейных заболеваний.
- Влияние внутренних (эндогенных) факторов – у большинства больных женщин и мужчин отмечается низкий уровень мужских половых гормонов; научно подтверждено, что после использования оральных контрацептивов (ОК) риск развития болезни снижается.
- Влияние факторов внешней среды (экзогенных). Возбудители инфекции запускают аутоиммунную реакцию – аллергию на собственные ткани организма. Это связано с тем, что некоторые инфекционные возбудители имеют в составе своих клеток белки, схожие с белками тканей человека. При попадании этих возбудителей в организм иммунная система вырабатывает антитела (IgG), которые по неизвестной науке причине становятся антигенами (чужеродными для организма веществами). На них вырабатываются новые антитела IgM, IgA, IgG (ревматоидные факторы), уничтожающие их. Нарастание количества антител сопровождается усилением воспаления. Некоторые возбудители выделяют вещества, способствующие разрастанию суставной синовиальной оболочки и ферменты, повреждающие ткани.
В результате целого комплекса причин клетки синовиальной оболочки начинают выделять воспалительные цитокины – белковые молекулы, инициирующие и поддерживающие воспаление. Развивается длительно протекающий воспалительный процесс, происходит разрушение хрящевой и костной суставной ткани, деформация конечности. Хрящевая ткань заменяется соединительной, появляются костные разрастания, нарушается функция сустава. Очень часто причиной развивающегося аутоиммунного поражения суставов является герпетическая инфекция – вирусы простого герпеса 1, 2 типа, цитомегаловирус, вирус Эпштейна – Барр (вызывает мононуклеоз) и другие возбудители, например, микоплазмы.
Предрасполагающие (запускающие, триггерные) факторы:
- травмы, заболевания суставов;
- переохлаждения, постоянное пребывание в сыром помещении или в сыром климате;
- нервные перенапряжения, стрессы;
- имеет значение наличие хронических очагов инфекции – тонзиллиты, кариозные зубы, любые инфекционно-воспалительные процессы;
- прием некоторых лекарств с мутагенными свойствами.
Симптомы
Заболевание протекает волнообразно, в виде периодов обострений (рецидивов) и ремиссий.
Начало в большинстве случаев подострое и имеет связь с перенесенной инфекцией, переохлаждением, травмой или нервным перенапряжением, беременностью, родами.
Одновременно появляются незначительно выраженные боли в пораженных суставах, сначала преходящие, а затем постоянные. Еще один из первых симптомов, на который стоит обратить внимание, - легкая припухлость в суставной области. Она может проходить в течение дня, но затем становится постоянной.
В большинстве случаев при ревматоидном артрите поражается сначала небольшое количество суставов стоп и кистей. На ранней стадии могут также поражаться коленные суставы. Поражения симметричны. При подостром течении первые признаки нарушений появляются через несколько недель, при медленном, хроническом – через несколько месяцев.
Острое начало, высокая активность патологического процесса и системные проявления характерны для ювенильного ревматоидного артрита у детей и подростков. Он может начинаться с высокой температуры, изначального поражения сразу нескольких суставов и признаков поражения внутренних органов.
Ревматоидный артрит сопровождается признаками общей интоксикации. Это слабость, недомогание, небольшое повышение температуры тела, головные боли. Нарушается аппетит, больной теряет массу тела.
Суставной синдром. Поражаются сначала мелкие суставы кисти (число их увеличивается), а затем и крупные суставы (плечевые, коленные). Они опухают, становятся очень болезненными, постепенно теряют свою функцию, обездвиживаются. Длительное обездвиживание приводит к выраженной атрофии (уменьшению в объеме) мышц. Ревматоидный артрит характеризуется также тем, что поражения разных суставов могут быть неодинаковыми: в одних могут преобладать признаки воспаления (отек), в других – пролиферации (разрастания соединительной ткани с деформацией и нарушением функции).
Появляются подкожные ревматоидные узелки – небольшие, умеренно плотные, безболезненные образования, располагающиеся на поверхности тела, чаще всего на коже локтей.
Поражается периферическая нервная система. Из-за поражения нервов больные ощущают онемение, жжение, зябкость в конечностях.
При ревматоидном васкулите происходит поражение различных мелких и частично средних кровеносных сосудов. Часто это проявляется в виде точечных очагов некроза в области ногтей или безболезненных язв в области голени. Иногда васкулит может проявляться в виде микроинфарктов.
При частых обострениях и прогрессировании ревматоидного артрита происходит поражение внутренних органов - сердца (эндокардит), почек (нефрит), легких (узелковое поражение легочной ткани) и т.д.
К врачу следует обращаться при появлении следующих симптомов:
- Болей в суставах, легкой скованности движений по утрам, если:
- кто-то из близких родственников болеет ревматоидным артритом;
- вы недавно перенесли какое-то инфекционно-воспалительное заболевание (ОРВИ, ангину), затяжной стресс или просто переохладились;
- вы проживаете в холодной сырой местности.
- Небольшого повышения температуры, недомогания, снижения аппетита, потери массы тела, сопровождающихся легкой утренней скованностью движений.
Локализации процесса
При ревматоидном артрите вначале обычно поражаются мелкие суставы кистей, пальцев рук и стоп. Внешний вид верхних х конечностей:
Хруст в суставах - когда стоит беспокоиться
Внутрисуставные инъекции гиалуроновой кислоты
Внешний вид нижних конечностей:
- пальцы стоп приобретают молоточковидную форму;
- подвывихи мелких суставов приводят к развитию плоскостопия;
- для ревматоидной стопы характерно также вальгусное (кнаружи) отклонение стопы, связанное с поражением голеностопа;
- при поражении коленных суставов появляется сгибательная контрактура (неподвижность).
Тазобедренные суставы поражаются редко.
Стадии ревматоидного артрита
Ревматоидный артрит протекает в три стадии:
- Начальная, воспаления– поражение синовиальных сумок сопровождается болями, отеком околосуставных тканей.
- Прогрессирующая, пролиферации – быстрое деление клеток синовиальной оболочки, приводящее к ее уплотнению.
- Завершающая, деформации – при длительном течении воспаленные клетки начинают выделять фермент, разрушающий хрящевую и костную ткань, что приводит к изменению суставной формы и тяжелому нарушению их функции.
По длительности течения выделяют следующие стадии ревматоидного артрита:
- очень ранняя – до полугода;
- ранняя – от полугода до года;
- развернутая – до 2-х лет;
- поздняя – после 2-х лет.
- Околосуставной остеопороз – разрежение, истончение костной ткани;
- Сужение суставной щели и единичные эрозии на хрящевой суставной поверхности;
- Множественные глубокие эрозии суставных хрящей и костей;
- Присоединяется анкилоз - неподвижность сустава из-за сращения суставных поверхностей.
Стадии ревматоидного артрита
Существует несколько типов классификаций ревматоидного артрита по разным критериям.
По клинико-анатомическим признакам выделяют следующие формы ревматоидного артрита:
- суставная форма;
- суставно-висцеральная (системная) – поражаются не только суставы, но и внутренние органы;
- ювенильная форма – развивается у детей до 16 лет, характеризуется острым началом, лихорадкой и выраженными внесуставными проявлениями.
- медленнопрогрессирующий РА – самая частая форма, может продолжаться годами;
- быстропрогрессирующий РА – характеризуется злокачественным течением;
- без признаков прогрессирования – встречается редко.
По иммунологическим признакам:
- Наличие или отсутствие содержания в крови ревматоидного фактора (РФ) – антител к собственному иммуноглобулину G:
- серопозитивные – РФ обнаружен;
- серонегативные – РФ не обнаружен.
- Наличие или отсутствие в крови антител к циклическому цитрулинсодержащему пептиду – анти-ЦЦП или АЦЦП (цитрулин – продукт обмена, в норме полностью выводящийся из организма; при РА выделяются ферменты, встраивающие цитрулин в белки и превращающие его в чужеродный белок – антиген; на этот антиген иммунная система вырабатывает антитела):
- серопозитивные – АЦЦП обнаружен;
- серонегативные – АЦЦП не обнаружен.
Выделяют следующие критерии сохранности функций опорно-двигательного аппарата:
- Выполнение движений в полном объеме.
- Снижение двигательной активности. Появляются трудности, не позволяющие выполнять движения в полном объеме, особенно в профессиональной сфере.
- Нарушение подвижности, возможно только самообслуживание.
- Невозможны любые виды двигательной активности, в том числе самообслуживание.
Что будет, если не лечить
Если ревматоидный артрит не начать лечить своевременно, в дальнейшем он начнет быстро прогрессировать, что увеличивает риск развития возможных осложнений:
- деформации и утрата суставных функций, приводящие к инвалидности;
- изменению нервно-мышечной системы с нейропатиями и уменьшением объема мышц;
- поражению сердечно-сосудистой системы в виде васкулитов, эндокардитов, микроинфарктов;
- нарушениям со стороны почек с постепенным формированием хронической почечной недостаточности;
- поражениям органов зрения, в том числе язвенного характера;
- поражению плевры и легких - развитию плеврита и интерстициальной пневмонии;
- развитию анемии и системных тромбозов мелких кровеносных сосудов.
Диагностика
Диагноз ревматоидного артрита подтверждается данными дополнительного обследования. Диагностика ревматоидного артрита включает:
- Лабораторные исследования:
- общий анализ крови – выявляет воспалительный процесс (ускоряется СОЭ, изменяется число лейкоцитов);
- биохимия – позволяет уточнить причины воспаления и нарушения обменных процессов;
- иммунологические исследования – наличие или отсутствие специфических антител.
- Инструментальные исследования:
- рентгендиагностика – выявляет патологию суставов;
- компьютерная и магнитно-резонансная томография (КТ, МРТ) – позволяют провести оценку ранних суставных изменений;
- УЗИ – выявляет увеличение объема суставной жидкости и наличие участков некроза.
Как лечат ревматоидный артрит
Лечение ревматоидного артрита начинается с устранения воспаления и боли. Затем присоединяется комплексное лечение:
- диета;
- медикаментозная терапия (базисное лечение);
- средства народной медицины;
- физиотерапевтические процедуры;
- лечебная гимнастика и массаж;
- новые методики;
- хирургические методы лечения.
Питание при ревматоидном артрите должно быть регулярным и полноценным. В суточном рационе должны присутствовать продукты, богатые кальцием (творог, сыр, кефир), овощи, фрукты, овощные супы, нежирное мясо и рыба.
Из рациона должны быть исключены: концентрированные бульоны, овощи, богатые эфирными маслами (свежий лук, чеснок, редис), жирные, копченые, консервированные продукты, сладости, сдоба, сладкие газированные напитки. Должен быть полностью исключен прием алкоголя.
Это индивидуально подобранная терапия, включающая в себя применение нестероидных противовоспалительных препаратов (НПВП), глюкокортикоидных средств (ГКС), базисных препаратов и биологических агентов.
Чтобы облегчить состояние больного, лечение начинают с назначения НПВП. Современные лекарственные препараты этого ряда (нимесулид, целекоксиб, мелоксикам) снимают воспаление и боль в суставах, не вызывая выраженных побочных явлений, характерных для ранних НПВП (диклофенака и др.).
Если воспаление и боль носят выраженный характер и НПВП не помогают, назначают глюкокортикоидные гормоны (ГКС - преднизалон, дексаметазон, триамсинолон). Они быстро снимают отек, боль, устраняют повышенное содержание синовиальной жидкости, но имеют много побочных эффектов, поэтому их стараются назначать короткими курсами. Препараты этой группы назначают также для того, чтобы подавить разрастание синовиальной оболочки сустава. Иногда ГКС вводят в суставную полость. При сильных болях и воспалении ГКС назначают в виде пульс-терапии: внутривенно большими дозами на протяжении не более трех дней.
При тяжелом течении ревматоидного артрита назначают плазмаферез – очищение крови от антител. С этой же целью назначают сорбенты, например, Энтеросгель, очищающий организм от токсинов.
Препараты базисной терапии подавляют аутоиммунный воспалительный процесс и пролиферацию (размножение) клеток соединительной ткани, оказывающих разрушающее действие на суставы. Базисные средства действуют медленно, поэтому их назначают длительными курсами и подбирают индивидуально. Эффективные, проверенные временем базисные препараты метотрексат, сульфасалазин и лефлуномид (Арава). Последний препарат относится к новому поколению и имеет меньше побочных эффектов.
В последнее время для лечения ревматоидного артрита стали применять биологические агенты – антитела, цитокины и другие активные вещества, играющие значительную роль в иммунных реакциях. Одним из таких препаратов является ритуксимаб (Мабтера, Реддитукс). Активным действующим веществом препарата являются антитела мыши и человека, которые подавляют иммунные реакции. Назначение этого препарата позволяет реже назначать курсы комплексной медикаментозной терапии.
Народные средства при ревматоидном артрите применяют в основном наружно. Вот некоторые из них:
- кору вяза высушить, растереть в порошок, развести водой, разложить на салфетке над пораженной поверхностью в виде компресса на всю ночь; хорошо лечатся воспаление и боль;
- спиртовые растирания с экстрактами растений (корня лопуха, хмеля, цветков одуванчика, чабреца); в стеклянную банку помещают измельченные растения, заливают водкой, настаивают в темном месте 10 дней и используют как растирание.
Физиотерапевтические процедуры помогают быстрее избавить больного от воспаления и боли. С этой целью назначают:
- электрофорез с диклофенаком;
- фонофорез с дексаметазоном;
- аппликации с димексидом.
Хондропротекторы что это как выбрать, насколько они эффективны
Иммуноглобулин для в/в введения
Препарат нормального поливалентного IgG. Стандартный ВВИГ содержит 96% IgG, нестандартный — IgG, IgM, IgA.
• При полиартикулярном варианте ВВИГ вводят в дозе 1,5-2,0 г/кг на введение 2 раза в месяц в течение 2 мес, далее ежемесячно в течение последующих 6 мес. Однако эффект быстро теряется после отмены препарата.
• При системных вариантах ЮРА ВВИГ вводят в дозе 0,7-1 г/кг на курс: эффективен в отношении системных проявлений, вероятно, снижает риск развития интеркуррентных инфекций, но не влияет на течение артрита.
• ВВИГ противопоказан при селективном дефиците IgA.
Инфликсимаб
Инфликсимаб — моноклональные AT к ФНО-а (см. Ревматоидный артрит). Изучается возможность применения инфликсимаба при тяжёлых, резистентных к классическим БПВП формах ЮРА. В настоящее время препарат не зарегистрирован к применению у детей. У детей старше 16 лет в клинических испытаниях показана высокая эффективность препарата. Инфликсимаб в ряде случаев оказывает быстрый выраженный противовоспалительный эффект уже после первого введения.
Тактика назначения: 0, 2-, 6-я неделя и далее каждые 8 нед. Дозировка — 3— 20 мг/кг на введение. Начинать целесообразно с дозы 3 мг/кг. В случае недостаточной эффективности продолжают вводить препарат по указанной схеме, но повышают дозировку; либо уменьшают интервал между введениями до 4-5 нед и при необходимости увеличивают дозу.
Лечение инфликсимабом сочетают с приёмом метотрексата в дозе 7,5— 10 мг/м2 в неделю.
Перед началом лечения необходимо провести туберкулиновую пробу. В случае положительной или сомнительной туберкулиновой пробы лечение инфликсимабом проводить не следует.
Комбинированная иммуносупрессивная терапия
Цель комбинированной терапии — преодоление резистентности к предшествующей монотерапии БПВП.
• Метотрексат 7,5-10 мг/м2/нед и циклоспорин 4,4-4,5 мг/кг/сут. Комбинированная терапия метотрексатом и циклоспорином существенно снижает скорость прогрессирования деструкции в суставах по сравнению с монотерапией указанными препаратами (данные у взрослых).
Показания:
♦ сохранение высокой активности воспалительного процесса у больных системным ЮРА, получающих только метотрексат или циклоспорин;
♦ развитие коксита с асептическим некрозом костей, образующих тазобедренный сустав, или без него у больных, получающих метотрексат;
♦ развитие увеита у больных с олиго- и полиартикулярным ЮРА, получающих метотрексат;
♦ сохранение высоких лабораторных показателей активности заболевания у больных системным ЮРА при хорошем клиническом эффекте лечения циклоспорином.
• Циклоспорин 4,4—4,5 мг/кг/сут и сульфасалазин 30-40 мг/кг/сут.
Показания:
♦ развитие увеита у больных с олиго-или полиартикулярным вариантом ЮРА, получающих сульфасалазин;
♦ развитие коксита у больных с олигоартритом с поздним началом, получающих сульфасалазин.
• Метотрексат 7,5-10 мг/м2/нед и сульфасалазин 30-40 мг/кг/сут.
Показания:
♦ персистирующая активность воспалительного процесса у больных с полиартикулярными вариантами ЮРА, получающих метотрексат;
♦ прогрессирование поражения суставов у больных с олигоартритом с поздним началом, получающих сульфасалазин.
• Метотрексат 7,5—10 мг/м2/нед и гидроксихлорохин 5—7 мг/кг/сут.
Показания:
♦ сохраняющаяся активность воспалительного процесса у больных с оли-го- и полиартритом без поражения глаз, получающих метотрексат.
Лечение отдельных форм ЮРА описано в клинических рекомендациях по диагностике и лечению ювенильного ревматоидного артрита Союза педиатров России.
Дальнейшее ведение больного
В дальнейшем детям с системными вариантами ЮРА госпитализация целесообразна не менее 3 раз в год для проведения полного обследования и при необходимости коррекции терапии. Обязательна госпитализация в случае обострения системных проявлений. Детей с олиго- и полиартикулярным ЮРА госпитализируют в плановом порядке 1 —2 раза в год, а также при обострении заболевания, которое не удаётся купировать в амбулаторных условиях.
• Консультацию районного ревматолога необходимо осуществлять 1 раз в месяц для оценки клинических проявлений и переносимости терапии.
• При лечении БПВП 1 раз в 2 недели проводят клинический (содержание эритроцитов, гемоглобина, тромбоцитов, лейкоцитов, лейкоцитарная формула, СОЭ) и биохимический (общий белок, белковые фракции, концентрация мочевины, креатинина, билирубина, калия, натрия, ионизированного кальция, трансаминаз, щелочной фосфатазы) анализы крови.
При снижении содержания лейкоцитов, эритроцитов, тромбоцитов ниже нижней границы нормы и повышении концентрации мочевины, креатинина, трансаминаз, билирубина выше верхней границы нормы иммунодепрессанты отменяют на 5—7 дней; после контрольного анализа крови при нормализации показателей приём препарата возобновляют.
• ЭКГ проводят 1 раз в 3—6 месяцев.
• УЗИ органов брюшной полости, сердца, почек, рентгенографию органов грудной клетки, поражённых суставов — по показаниям.
• ФЭГДС с биопсией слизистой оболочки желудка с последующим тестированием на Н. pylori и морфологическим исследованием - 1 раз в 6 месяцев у больных, получающих лечение НПВП и ГК.
• Консультация окулиста и осмотр с помощью щелевой лампы проводят всем больным с поражением суставов 1 раз в 3 месяца.
Во время посещения школы запрещают занятия физкультурой в общей группе. Необходимы занятия ЛФК. Противопоказаны профилактические прививки, введение гамма-глобулинов, которые могут вызвать тяжёлые обострения заболевания на сроках от 2 недель до 2 месяцев. Детям, получающим комбинированную терапию БПВП, реакцию Манту и рентгенографию органов грудной клетки целесообразно выполнять каждые 6 месяцев.
Прогноз
При системных вариантах ЮРА прогноз неоднозначный. У 40—50% детей прогноз благоприятный: может наступить ремиссия продолжительностью от нескольких месяцев до нескольких лет, однако обострение заболевания может развиться спустя годы после стойкой ремиссии. У 1/3 больных отмечают непрерывно рецидивирующее течение заболевания.
Наиболее неблагоприятен прогноз у детей с упорной лихорадкой, тромбоцитозом, получающих длительную ГК-терапию. У 50% развивается тяжёлый деструктивный артрит. У 20% во взрослом возрасте развивается амилоидоз, у 65% — тяжёлая функциональная недостаточность. Неблагоприятный прогноз у всех детей с ранним дебютом полиартикулярного серонегативного ЮРА. У подростков с серопозитивным полиартритом высок риск развития тяжёлого деструктивного артрита, инвалидизации по состоянию опорно-двигательного аппарата.
У 40% больных с олигоартритом с ранним началом формируется деструктивный симметричный полиартрит. У больных с поздним началом возможна транс-формация заболевания в анкилозирующий спондилит. У 15% больных с увеитом возможно развитие слепоты. Смертность при ЮРА невысока. Большинство летальных исходов связано с развитием амилоидоза или инфекционными осложнениями, развивающимися у больных с системными формами ЮРА в результате длительной терапии ГК.
- 4963
- 4,1
- 0
- 5
Моноклональные антитела — новая надежда в лечении ревматических заболеваний.
![]()
Анна Огородник
![]()
Антон Чугунов![]()
Андрей Панов




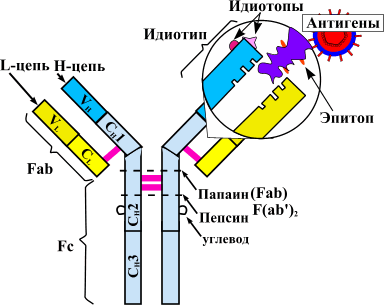
Теорию аутоиммунитета сформулировал еще столетие назад немецкий исследователь Пауль Эрлих. За последующие годы описано множество аутоиммунных заболеваний. К ним относятся ревматоидный артрит, системная красная волчанка (СКВ), системная склеродермия, миопатии, васкулиты и прочие патологии .
Болезни, ассоциированные с аутоиммунным компонентом, — серьезная проблема современного общества . Их распространенность в мировой популяции составляет примерно 5%. Заболевания быстро переходят в хроническую форму, из-за чего снижается качество жизни пациентов. Аутоиммунные патологии часто приводят к инвалидизации больных [1], [4].
Несмотря на многолетний поиск новых путей фармакотерапии, современная медицина не может предложить способов лечения, непосредственно влияющих на причину возникновения аутоиммунитета. Врачи способны лишь замедлить прогрессирование патологии и снизить выраженность клиники — провести патогенетическое и симптоматическое лечение. Для этого разработана базисная терапия, которая применяется уже многие годы. Однако не всегда проверенные препараты работают так, как надо.
Почему необходимо искать новые способы лечения?
Для лечения аутоиммунных заболеваний используют широкий арсенал противоревматических лекарств. Классическая терапия включает нестероидные противовоспалительные средства, глюкокортикоиды, цитостатики. В зависимости от особенностей развития заболевания подбирают препараты из той или иной группы [4].
- Большие иммунодепрессанты:
- глюкокортикоиды (преднизолон, дексаметазон);
- антибиотики (циклоспорин, такролимус);
- антиметаболиты (метотрексат, азатиоприн, меркаптопурин);
- цитостатики (циклофосфан).
- Малые иммунодепрессанты:
- плаквенил, хингамин;
- купренил;
- препараты золота (ауронофин);
- гепарин;
- нестероидные противовоспалительные средства.
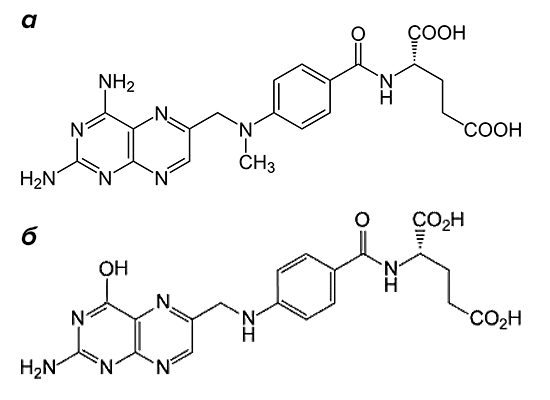
Рисунок 2. Структурные формулы метотрексата и фолиевой кислоты. Препарат (а) по строению похож на фолиевую кислоту (б). Он состоит из птеридиновых групп и парааминобензойной кислоты. Действующий компонент метотрексата отличается от структуры фолата отсутствием гидроксильной группы (–OH) и наличием дополнительного метильного радикала (–CH3).
По механизму действия метотрексат относится к антиметаболитам. Препараты этой группы тормозят физиологические реакции в организме, связываясь с ферментами и выключая их активность. Вещество, которое в норме участвует в реакции, уже не может попасть в биохимический круговорот из-за повышенной конкуренции с компонентами лекарства. Основной мишенью для действия метотрексата является фермент, расщепляющий фолиевую кислоту, — дигидрофолатредуктаза (ДГФ). Этот белок воздействует на поступающий в организм фолат, переводя его в активную форму. При этом образуется тетрагидрофолиевая кислота. Она участвуют в синтезе строительного материала для ДНК — пуриновых оснований и тимидилата.
Метотрексат вклинивается в цепочку реакций благодаря структурному сходству с молекулой фолиевой кислоты (рис. 2). Конкуренция за фермент приводит к тому, что содержание активного фолата в ткани значительно снижается. Нет строительного материала — нет и новых молекул ДНК, без которых клетки не могут размножаться. Повышенной чувствительностью к воздействию лекарства обладают те ткани, структурные элементы которых постоянно делятся. К ним относятся и компоненты костного мозга, из которых формируются будущие иммунные клетки.
Еще один важный момент в работе метотрексата связан с активностью его полиглутамированных метаболитов. Эти молекулы формируются после активации препарата непосредственно в клетках человеческого организма. Они ингибируют другие ферменты, которые взаимодействуют с фолиевой кислотой. В эту группу входят тимидилсинтетаза и АИКАР-трансамилаза. Активность производных метотрексата запускает процесс выработки аденозина. Он оказывает мощное противовоспалительное действие, благодаря чему снижается выраженность симптомов ревматоидного артрита [7].
Метотрексат удобно использовать — он легко дозируется и может назначаться длительными курсами. Кроме того, важное преимущество этого препарата — низкая цена, в сравнении с современными лекарствами импортных фармкомпаний [8]. Несмотря на все достоинства, лечение метотрексатом не всегда приводит к снижению активности заболевания. У многих пациентов использование препарата неэффективно даже в комбинации с другими классическими средствами [5]. Это подтверждается при анализе статистики. Исследования показали, что при проведении лечения метотрексатом и комбинациями базисных препаратов только половина пациентов достигла ремиссии [9], [10].
Несостоятельность классической терапии заставляет ученых искать новые способы лечения ревматоидного артрита. Стоит отметить, что, несмотря на новые разработки, борьбу с заболеванием все же начинают с назначения метотрексата и его аналогов. Дополнительные препараты используют только при высокой активности аутоиммунного процесса. У таких пациентов применение одного лекарства часто бывает неэффективно [7]. В зависимости от особенностей течения патологии подбирают подходящую схему терапии (рис. 3).
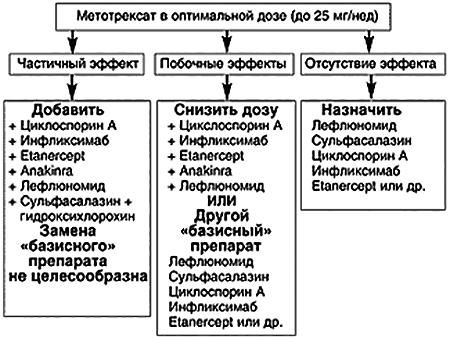
Рисунок 3. Тактика ведения пациента с ревматоидным артритом при неэффективности использования метотрексата.
Неэффективность препаратов базисной терапии встречается не только при ревматоидном артрите, но и при других заболеваниях аутоиммунного происхождения (системной красной волчанке, склеродермии, болезни Бехтерева). Это мотивирует специалистов-ревматологов разрабатывать другие лекарства и подбирать новые схемы терапии.
Генно-инженерные препараты: дополнение к базисной терапии
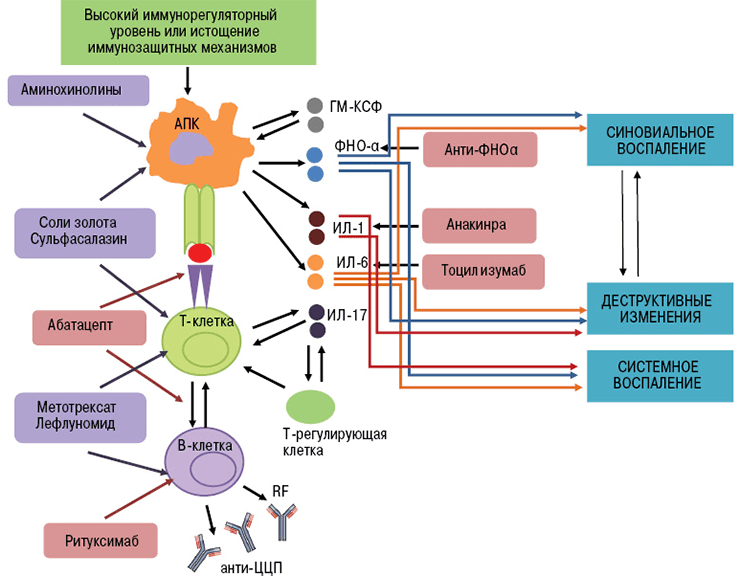
По-новому взглянуть на лечение аутоиммунных заболеваний позволила разработка терапевтических моноклональных антител [11]. Принципиально новый класс препаратов получен благодаря достижениям генной инженерии. Для понимания механизма действия этих лекарств стоит вспомнить о том, как работают иммунные клетки в норме и при патологии [1], [12].
При аутоиммунных заболеваниях можно подавлять сразу весь сложный механизм иммунитета, что и делают препараты классической терапии. Но это оставляет человека без защиты от вражеских агентов — бактериальных инфекций, вирусов и прочих патогенов. Поэтому предпочтительнее сохранить активность иммунной системы в целом, избавив человека от аутоагрессии определенных ее компонентов. Именно так работают новые препараты — моноклональные антитела.
- Ингибиторы ФНО (фактора некроза опухолей) — инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
- Блокаторы интерлейкиновых рецепторов — тоцилизумаб (ИЛ-6R), канакинумаб (ИЛ-1R), секукинумаб (ИЛ-17R).
- Анти-В-клеточные антитела (антитела к мембранным молекулам CD20) — ритуксимаб, белимумаб [17].
- Анти-Т-клеточные антитела (антитела к молекулам CD80 и CD86) — абатацепт [18].
Ингибиторы фактора некроза опухолей — это первые моноклональные антитела, внедренные в ревматологическую практику. В эту группу входят инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
Фактор некроза опухолей (ФНО) — это провоспалительный цитокин (вещество, которое стимулирует развитие воспалительной реакции). В норме при его выделении происходит пролиферация клеток сосудов, активация макрофагов, лизис опухолевых агентов. Эти эффекты играют важную роль в защите организма от патогенов. Воспаление можно считать ответной реакцией на воздействие повреждающих факторов.
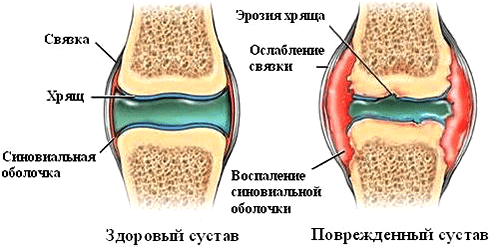
Рисунок 5. Патологические изменения в суставе при ревматоидном артрите. Аутоиммунный процесс вызывает появление эрозий, синовит (воспаление синовиальной оболочки), разрушение суставного хряща.
Такое строение связано с механизмом получения препарата. Первоначально синтезируют антитело к фактору некроза опухолей в организме мыши. Полученный иммуноглобулин специфичен к ФНО и уже может его обезвреживать, но полностью чужеродные белки вводить в организм пациентов, конечно, нельзя. Это вызовет активную иммунную реакцию — выработку антител уже против терапевтических агентов. Поэтому домены мышиного иммуноглобулина заменяют сходными участками человеческих белков. Антитела, имеющие фрагменты разного происхождения, называются химерными. Фактически, они берут лучшие качества своих предшественников. Мышиная часть обеспечивает высокую чувствительность к ФНО, а человеческие фрагменты снижают иммуногенность — вероятность развития иммунного ответа.
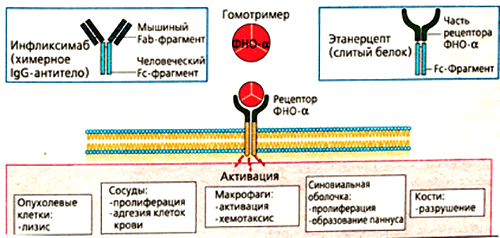
Рисунок 6. Основные эффекты ФНО и блокирующие его моноклональные антитела (инфликсимаб и этанерцепт). Мишенями для моноклональных антител являются свободная и мембраноассоциированная формы фактора некроза опухолей. Лекарства препятствуют связыванию цитокина с рецептором, благодаря чему снижается активность ревматоидного артрита.
В развитии аутоиммунного воспаления важную роль играют интерлейкины, которые, как и ФНО, относятся к провоспалительным цитокинам (рис. 7). Основными представителями этой группы являются ИЛ-6, ИЛ-1, ИЛ-17. Функция интерлейкинов — это контроль процессов дифференцировки, пролиферации и гибели (апоптоза) иммунных клеток, который осуществляется через соответствующие гены-мишени [20].
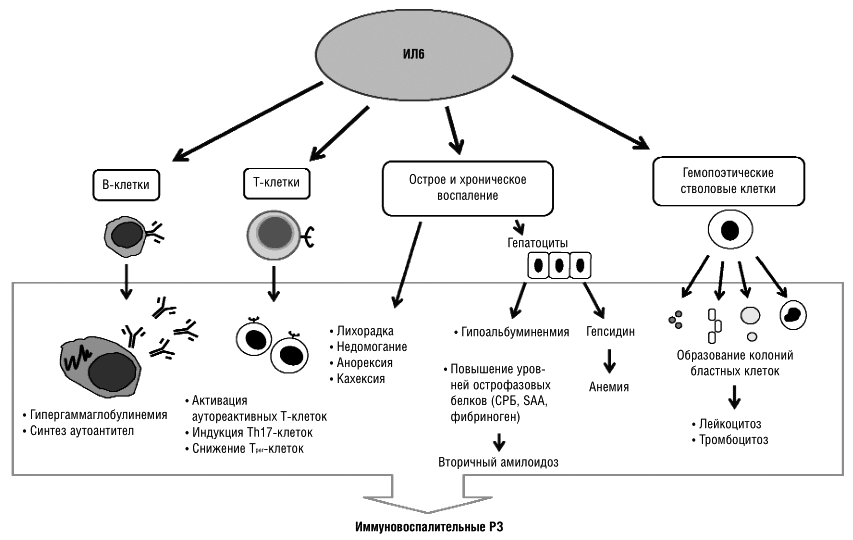
Рисунок 7. Механизм действия интерлейкинов при аутоиммунном воспалении (на примере ИЛ-6). Цитокин влияет на T- и B-лимфоциты, гемопоэтические клетки, гепатоциты. Он стимулирует выработку аутоантител В-клетками, а также формирование аутореактивных Т-клонов, которые непосредственно участвуют в аутоиммунном процессе. Влияние на костный мозг заключается в стимуляции выработки новых клеток крови — повышается число лейкоцитов и тромбоцитов. Воспаление сопровождается ответной реакцией клеток печени, появлением характерных симптомов аутоиммунного заболевания.
Тоцилизумаб — это препарат, который блокирует работу ИЛ-6. Рецептор этого вещества состоит из двух компонентов — мембранного ИЛ-6R (α-цепь) и гликопротеина g130 (β-цепь). Мембранная часть рецептора связывается с ИЛ-6, образуя устойчивый комплекс. Вместе они активируют компонент g130, вызывая изменение его структуры (гомодимеризацию). Образуется рецепторный комплекс из двух молекул g130, который в свою очередь активирует JAK1-киназу. Этот фермент запускает каскад реакций в клетке, который приводит к появлению биологического эффекта цитокина — развитию воспаления. В некоторых случаях ИЛ-6 связывает не мембранная, а растворимая форма α-цепи (рис. 8). Механизм действия рецептора при этом не меняется [21].
В основе работы тоцилизумаба лежит конкуретное ингибирование. Сигнальные молекулы активно связываются с моноклональным антителом. Вакантное место занято — интерлейкин не может образовать комплекс с рецептором, а значит, он не способен активировать процесс воспаления.
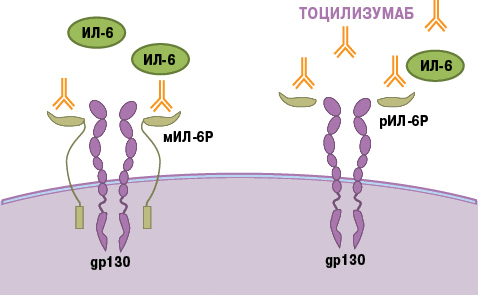
Рисунок 8. Механизм действия тоцилизумаба. Препарат связывает растворимые и мембранные рецепторы ИЛ-6, блокируя передачу сигналов.
Тоцилизумаб считается одним из самых безопасных препаратов, входящих в группу моноклональных антител. Это позволяет применять его при ювенильном идиопатическом артрите, который возникает в возрасте до 16 лет. Дети особенно остро реагируют на токсические воздействия, поэтому препараты, которые используют при их лечении, должны иметь минимальное число побочных реакций. Применение тоцилизумаба позволяет достигнуть необходимого эффекта лечения, не вызвав тяжелых осложнений.
Препараты из группы анти-B-клеточной терапии (ритуксимаб и белимумаб) блокируют активность В-лимфоцитов путем связывания их мембранных молекул CD20. Эти вещества есть только у определенных категорий В-клеток. Они специфичны для пре-В-лимфоцитов и зрелых В-лимфоцитов. CD20 нет у стволовых элементов и про-В-клеток, из которых будут образовываться новые лимфоцитарные элементы. Мембранные молекулы данного типа не содержатся и у плазматических клеток, которые вырабатывают иммуноглобулины [22].
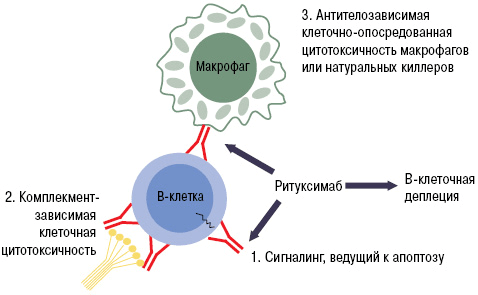
Рисунок 9. Механизм работы ритуксимаба. Fab-фрагмент моноклонального антитела связывается с CD20 на поверхности B-лимфоцита. Это запускает лизис клетки, который может осуществляться несколькими путями: через систему комплемента, программу апоптоза или агрессию натуральных киллеров и макрофагов.
Блокировка действия Т-лимфоцитов возможна благодаря особенностям их активации. Чтобы Т-лимфоцит вступил в аутоиммунный процесс и связался с антигеном, он должен получить два сигнала от антигенпрезентирующих клеток (АПК). Первый сигнал обеспечивает распознавание специфического аутоантигена Т-клеточными рецепторами. Второй сигнал — это неспецифический процесс связывания мембранных молекул CD80 и CD86 на поверхности АПК с рецептором CD28 лимфоцита. Сочетание этих взаимодействий вызывает активацию Т-клеток, которые в свою очередь стимулируют выработку провоспалительных цитокинов. Это и есть основной вклад Т-лимфоцитов в аутоиммунный процесс.
Знания о механизме активации Т-клеток использовали при разработке моноклональных антител. Основной представитель анти-Т-клеточных агентов — это абатацепт. Препарат представляет собой белок, состоящий из двух частей. Специфическая часть образована молекулой CTLA-4 (антиген 4 цитотоксических лимфоцитов). Неспецифическая область — это Fc-фрагмент человеческого иммуноглобулина G1 [23].
Воздействие абатацепта направлено как раз на неспецифический (костимулирующий) сигнал. Компонент CTLA-4 связывает белки CD80 и CD86 на поверхности антигенпрезентирующих клеток. Рецептор лимфоцита CD28 уже не может взаимодействовать с ними, из-за чего активация Т-клетки не завершается (рис. 10).
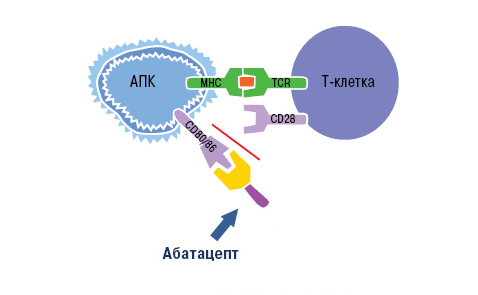
Рисунок 10. Механизм действия абатацепта. Абатацепт модулирует иммунный ответ через связывание с CD80/CD86 на антигенпрезентирующих клетках. Это препятствует связыванию CD80/CD86 с CD28 T-клеток, то есть активация Т-клеток отменяется через блокировку костимуляции.
Не всё так просто: возможные проблемы при использовании моноклональных антител
Например, одна пачка метотрексата стоит примерно 200 рублей. Цена упаковки инфликсимаба — около 43 тыс. рублей. Разница очевидна. За год лечения метотрексатом даже в максимальной дозировке пациент потратит на лекарство 1–2 тыс. рублей (в зависимости от фирмы-производителя, схемы лечения и стоимости препарата в местных аптеках). Цена годовой терапии инфликсимабом составляет примерно 700 тыс. рублей. Понятно, что самостоятельно обеспечить себя этим лекарством сможет только очень ограниченная группа пациентов.
Использование биологических препаратов допустимо в тех случаях, когда к базисным средствам у пациента развивается непереносимость. Больные испытывают тяжелое побочное воздействие лекарства, которое еще сильнее ухудшает их состояние. Применение препаратов с другим механизмом действия, в том числе и моноклональных антител, позволяет минимизировать побочные эффекты [18].
Другая сложность, с которой можно столкнуться при использовании биологических препаратов, — это побочные реакции. Параллельно с накоплением данных об эффективности использования лекарств выявляют все новые нежелательные эффекты от их применения. Большая часть таких реакций связана с процессом иммуносупрессии. Подавляя активность иммунных клеток, моноклональные антитела снижают защитную функцию организма. В первую очередь страдают противоинфекционный и противоопухолевый иммунитеты [18], [24].
Парадоксально, но применение новых лекарств против аутоиммунитета может вызвать острые аутоиммунные реакции. Все биологические препараты представляют собой белковые молекулы, которые в той или иной степени чужеродны для организма. Поэтому при проникновении терапевтических агентов в тело больного иммунитет может распознать их как антигены. Появляется активный иммунный ответ — вырабатываются антитела уже против компонентов препарата.
Несмотря на все возможные сложности, моноклональные антитела прочно вошли в регистр лекарств, применяющихся в ревматологии. Перспектива использования биологических препаратов и их место в ревматологии будет зависеть от результатов многолетних исследований, которые еще предстоит провести. Но даже сейчас можно сказать, что разработка терапевтических моноклональных антител является важным шагом на пути к победе над аутоиммунным воспалением.
Читайте также:





