Методики по созданию инфекционных фонов
Виды фонов. Инфекционный фон подразумевает наличие инфекции, способной вызвать заражение растений, и условий, обеспечивающих успех развития болезни или вредителя.
В соответствии с особенностями организации можно выделить несколько разновидностей фонов:
- инфекционный (естественный и искусственный);
Провокационным фоном называют прием, при котором создают условия для оптимального развития патогенов, но пропагулы дополнительно не вносят на участок. Для создания провокационного фона испытуемый материал может быть размещен на участках с оптимальным микроклиматом для проявления болезни. Например, для испытания зерновых на устойчивость к снежной плесени полезно размещать питомники в низинах, где скапливается снег и весной затягивается таяние.
Кроме того, провокационный фон может быть создан с помощью агротехнических приемов, способствующих проникновению патогенов, а также развитию заболеваний и размножению вредителей. Например, внесение азотных удобрений в повышенных дозах приводит к увеличению поражения всеми видами ржавчины, мучнистой росой, корневой гнилью.
Однако чаще для более надежного поражения растений специально размножают или дополнительно вносят пропагулы, то есть создают инфекционный фон. Инфекционные фоны подразделяются на естественные и искусственные.
Естественный инфекционный фонможет быть создан при бессменном возделывании культуры на одном участке.
Такой фон, как правило, создают для почвенных патогенов: возбудителей увядания, корневых гнилей и др.
Искусственные фоны предполагают специальное размножение микроорганизмов или накопление вредителей в лабораторных условиях и последующее заражение (заселение) растений.
Фон для оценки устойчивости растений к вредителям называют инвазионным.
Инфекционные фоны могут быть созданы для оценки на устойчивость к одному вредному виду (простые фоны) или к несколькими видам (комбинированные фоны).
Конкретные методы создания фонов зависят от биологии патогенов и вредителей. Их можно разделить на несколько общих приемов: инфицирование почвы, инокуляцию органов растений и использование переносчиков (для вирусных заболеваний).
Инфицирование почвы. Этот прием используют для почвенных микроорганизмов, вредителей, нематод и растений-паразитов. Инфекцию вносят с пораженными растительными остатками или в виде специально размноженных культур. Так создают фон для оценки льна и люпина на устойчивость к фузариозному увяданию, злаков — к корневым гнилям и снежной плесени, подсолнечника — к заразихе, капусты — к киле.
Инокуляция органов растений. Иногда при создании инфекционных фонов для некоторых болезней не вносят инфекцию в почву, а инфицируют семена. Так, для заражения пшеницы твердой головней споры вносят в каждый пакет при подготовке семян к посеву. После обработки семена подсушивают и используют для посева.
Инокуляцию поверхности растений осуществляют для создания инфекционного фона ко всем видам ржавчины, септориозу, мучнистой росе. Заражение цветков применяют прежде всего для возбудителей пыльной головни злаков. Для этого используют сухие хламидо-споры или суспензии спор. В первом случае инокулюм наносят на предварительно подготовленный колос с подрезанными колосками с помощью кисточки, натиранием головневым колосом или стряхиванием спор. Суспензию спор вводят в колоски с помощью пипетки или медицинского шприца (шприц-метод). В некоторых случаях инокулюм вводят непосредственно в ткань или полость органа.
Использование переносчиков. Для многих вирусов свойственно распространение в природе с помощью векторов (тлей, клещей, почвенных грибов). Для оценки устойчивости к вирусным заболеваниям на участке создают условия для привлечения и размножения переносчиков. Например, для создания цепи переноса вирусов злаки размещают после злаков, в севообороты вводят культуры, привлекающие векторных переносчиков.
Для инфицирования подобными вирусами проводят специальное размножение и заражение переносчиков (цикадок, тлей).
При создании любых инфекционных фонов (включая инвазионные) способ и время заражения должны быть максимально приближены к биологическим особенностям микроорганизмов и вредителей.
Для объективной оценки количество пораженных (поврежденных) растений или органов должно быть достаточно большим.
Методы создания инфекционных фонов многообразны. В зависимости от особенностей патогена заражают почву, поверхность того или иного органа растения, вводят инфекцию в орган (не в ткани), инокулюм в ткани, используют для заражения насекомых, клещей и других переносчиков инфекции. Здесь описаны только некоторые приемы.
Если споры намечено использовать в течение ближайшего месяца, то их можно хранить в чашках Петри или в открытых бюксах в эксикаторе над раствором серной кислоты, создающем влажность 30 %, при температуре 10—12 °С. Для длительного хранения споры помещают на сутки в эксикатор над прокаленным гипсом. Медицинский гипс смачивают водой, месят из него тесто, делают лепешку и после затвердения раскалывают ее щипцами. Куски прокаливают па железном противне в течение 6—8 ч при 180 °С. Высушенные споры помещают в пробирку, изображенную на рисунке 19 (5 г спор на пробирку). К воронке пробирки, горлышко которой нужно предварительно заткнуть комочком ваты, приставляют толстый резиновый шланг от работающего на отсос насоса Комовского, а тонкое горлышко пробирки нагревают на газовой горелке и запаивают. Таким образом, споры оказываются в вакууме. В холодильнике при температуре плюс 5 °С они могут храниться неограниченно долго.
На участке инфекционного фона перед посевом яровой пшеницы вносят 100 кг азота на 1 га. Для внесения под озимую пшеницу эту норму делят поровну: половину применяют перед посевом, а половину — при весенней подкормке. Участок обсевают восприимчивым сортом. При испытании яровой пшеницы можно посеять озимый сорт, который обеспечит раннее накопление инфекции. Заражение ведут в начале колошения. На 5 г спор берут 0,8 л талька или муки, тщательно перемешивают, засыпают в мешочек из двойного слоя марли и встряхивают над делянками. Указанное количество спор вносят на 0,12 га посева. Заражение ведут в вечерние часы (с 17 ч).

Рисунок 18 - Циклон для сбора спор, внизу – пробирка для хранения спор
Если погода сухая, то перед заражением проводят полив дождеванием. Если площадь инфекционного фона невелика, то можно опрыснуть посевы водой из ранцевого опрыскивателя. Заражают посевы спустя 0,5 ч после полива. Если есть возможность, делянки после заражения укрывают пленкой, натягивая ее на металлический каркас. В этом случае создается парниковый эффект, и, кроме того, споры не могут быть смыты дождем. В противном случае дождь, прошедший в течение суток после заражения, смоет споры, и заражение придется повторять.
Заражение пшеницы и ячменя мучнистой росой
В тех местностях, где мучнистая роса наносит существенный вред посевам, обычно нет необходимости в специальном заражении этой болезнью: она проявляется ежегодно в достаточно сильной степени. Однако бывают годы, когда необходимо создавать инфекционный фон этой болезни. Обильное азотное удобрение и обсев восприимчивым сортом, как и при заражении ржавчиной, создают провокационный фон. Выращивают в теплице восприимчивый сорт (здесь инокулюм присутствует всегда). Инфекцию вносят, срезая с растений пораженные листья, встряхивая их над посевами и разбрасывая по полю.
Заражение пшеницы и ячменя твердой головней
Материал для заражения готовят, измельчая колосья, пораженные твердой головней, в ступке непосредственно перец, заражением. До этого колосья хранят в лаборатории в бумажных пакетах. На 100 семян требуется 0,05—0,2 г (до 0,5 г при сильных инфекционных нагрузках) спор.
При массовом заражении нагрузку точно не дозируют. Берут кончиком ножа столько спор, сколько примерно необходимо для заражения, и высыпают их в пакет с семенами. Все образцы должны содержать стандартное число семян (в Краснодарском НИИ сельского хозяйства — 200 семян озимой пшеницы). Пакет закрывают и хорошо встряхивают его содержимое, чтобы споры перемешались с семенами. Так же ведут заражение ржи стеблевой головней.
У ячменя, как у пленчатой культуры, более эффективного заражения можно добиться, используя водную суспензию спор: 2 г спор на 1 л воды (способ Тапке). Семена выдерживают в суспензии 15 мин, а затем помещают в матерчатый мешочек. Мешочек кладут в деревянный ящик с плотно прилегающей крышкой и отверстиями на дне для стока избытка суспензии. Ящик укрывают мокрой мешковиной. Семена оставляют в нем на сутки при температуре 18— 20 °С. Затем их высушивают в тени до состояния сыпучести и высевают. Ранний посев сглубокой заделкой способствует заражению. Для заражения озимой пшеницы, напротив, необходим поздний посев, когда температура воздуха понизится примерно до 10 °С.
Заражение пшеницы и ячменя пыльной головней. Самым простым способом является посев сильно восприимчивого сорта на участке заражения. Через две полосы, засеянные изучаемыми образцами, размещают полосу восприимчивого сорта. Можно также развешивать пораженные колосья на участке заражения, помещая их на полметра выше колосьев испытываемых образцов.
Лучшие результаты дают способы, облегчающие проникновение спор внутрь цветка. Однако в этом случае нет возможности выявить такие формы устойчивости, как устойчивость, связанная с закрытым цветением, морфологией цветка. В Краснодарском НИИСХ для заражения пшеницы используют водную суспензию спор. Ее готовят, опуская в полулитровую банку с водой 45 зараженных колосьев смывая с них споры. На делянке каждого образца у 5 колосьев подрезают наполовину цветковые чешуи. Окунают кисточку или зубную щетку в суспензию и проводят ею по колосу сверху вниз с одной и другой стороны. После созревания срезают эти колосья, а также 5 контрольных, обмолачивают те и другие раздельно и семена используют для посева и сравнения.
Сильный инфекционный фон можно создать, внося споры головни кисточкой в каждый цветок. В этом случае в колосе предварительно удаляют нижние и верхние колоски, а также третьи цветки и цветки более высокого порядка, как при гибридизации. Способ довольно трудоемок и применяется только в том случае, когда хотят выявить абсолютно устойчивые (иммунные) формы. Мур предложил использовать для заражения вакуум-метод. В нашей стране онприменяется в модификации В. И. Кривченко.
Прибор, предложенный В. И. Кривченко, состоит из камеры, в которой происходит заражение, насоса, сосуда для суспензии спор и соединительных шлангов (рис. 19). Камера представляет собой стеклянный цилиндр, открытый снизу и заканчивающийся наверху двумя патрубками. Один служит для присоединения резинового шланга от насоса, работающего на отсос, другой для сообщения с атмосферой. Нижнее отверстие цилиндра закрывается резиновой пробкой с ограничителем. В средней части пробки вклеен слой пористой резины. Вдоль этого слоя пробка разрезана, но не до конца, так чтобы ее половинки могли расходиться как створки двери. В пробке имеется сквозное отверстие, в которое вставляется трубка. На выступающий наружу конец трубки надевают резиновый шланг, другой конец которого опускают в резервуар с суспензией. В разрез вставляют соломины 5—10 колосьев, смыкают половинки пробки и помещают колосья в камеру для заражения, затыкая пробкой ее нижнее отверстие. У колосьев ячменя срезают ости, а у пшеницы подрезают, кроме того, цветковые чешуи на 1 /3. Пальцем перекрывают отверстие, соединяющее камеру с атмосферой, и, откачивая воздух из нее насосом, добиваются, чтобы колосья целиком погрузились в суспензию. В этот момент пальцами сжимают шланг, по которому суспензия подается в цилиндр, и продолжают откачивать воздух в течение 5—10 с. Над поверхностью суспензии появляется туман — следствие быстрого испарения, что свидетельствует о достаточной степени разрежения. Открывают отверстие, соединяющее камеру с атмосферой, и дают суспензии стечь обратно в сосуд. Суспензию готовят непосредственно перед заражением, беря 0,4—0,5 г спор на 1 л воды. Указанное количество высыпают в 200—300 см 3 воды, энергично встряхивают и доливают воду до л.
Можно также вводить суспензию в каждый цветок с помощью медицинского шприца.

Рисунок 19 - Прибор В.И. Кривченко для заражения пыльной головней; справа – разрезная пробка прибора
Оценки устойчивости к вредителям
Селекция на устойчивость к некоторым вредителям (гессенской мухе, пилильщикам, подсолнечниковой моли и т. д.) ведется довольно успешно. В связи с этим оценкам на устойчивость к вредителям придается большое значение. Как и при оценках на поражение болезнями, наиболее полная характеристика дается образцам в конкурсном сортоиспытании. При этом используется методика государственного сортоиспытания.
Оценивают распространенность повреждений, если растения погибают или не дают продукции (например, при повреждении хлебными пилильщиками), и степень повреждения, если оно охватывает часть растения (например, повреждение пьявицей). В первом случае определяют процент поврежденных растений, во втором — процент поврежденной площади органа (например, листовых пластинок). Кроме того, практикуют учет заселенности вредителем (число особей, яйцекладок и т. д. на растение, единицу площади). Повреждение может оцениваться в баллах. При грубых оценках используют трехбалльную шкалу: повреждение слабое, среднее, сильное. Может быть использована международная система.
В конкурсном сортоиспытании оценку проводят в двух несмежных повторениях, но если повреждения распространены неравномерно, то оценивают делянки во всех повторениях. Учет ведут путем осмотра делянок или путем осмотра некоторой части растений (выборки) или даже отбора проб с последующим анализом. Общий принцип выборки заключается в том, что ее берут 5 местах по диагонали делянки. В каждом месте осматривают площадку 50x50 см (первый способ) или 10 растений в ряду подряд (второй способ).
Если вредитель повреждает посев пятнами (например, пьявица), то определяют процент площади, занятой этими пятнами, и средний процент повреждений в самих пятнах. Общую оценку дают в виде дроби: первый показатель в знаменателе, второй — в числителе. При глазомерной оценке процента распространения или повреждения (без подсчета) ее ведут с точностью до 10 %.
Учет повреждения злаков гессенской, шведской и яровой мухами, стеблевой блохой
Все эти вредители относятся к скрытостебельным. Личинки гессенской мухи находятся глубоко за влагалищем листа. Они молочно-белые с зеленым пятном в середине. Верхний лист отстает в росте, остальные листья имеют более темную окраску, они более широкие, чем у неповрежденных растений. Личинки шведской и яровой мух и стеблевой блохи вгрызаются в стебель. Верхний лист засыхает. Личинки яровой мухи окукливаются в почве, поэтому ложнококоны ее в растениях не встречаются. Личинка шведской мухи желто-белая, задний конец ее имеет два широко расставленных отростка. Личинка яровой мухи крупнее, и отростков на заднем конце у нее нет, он тупой мелкобугорчатый. Личинка стеблевой блохи имеет хорошо развитую голову и три пары ног.
Учет проводят по выборке, взятой вторым способом. Растения отбирают в пробу и анализируют. Те побеги, у которых при внешнем осмотре обнаруживаются признаки повреждения, исследуют более подробно. Отгибают влагалища листьев, чтобы установить, находятся ли там личинки или ложнококоны гессенской мухи. Препаровальной иглой вскрывают стебель сверху до узла кущения, чтобы обнаружить личинки и ложнококоны других вредителей и установить их видовую принадлежность. Рассчитывают процент поврежденных растений и процент поврежденных стеблей по каждому виду вредителя отдельно.
У озимых культур первый учет проводят осенью перед окончанием вегетации, второй — во время весеннего кущения до начала выхода в трубку. У яровых учет повреждений приурочивают к выходу в трубку. В южных районах возделывания озимых (Северный Кавказ, Украина, Молдавия, Центрально-Черноземная зона) проводят дополнительный учет в фазе молочной спелости. Стебли, пораженные гессенской мухой, в это время выглядят угнетенными. Часто они белеют, надламываются или падают. Личинки или ложнококоны гессенской мухи встречаются под влагалищем листа вблизи стеблевого узла (чаще всего нижнего). Поражение шведской мухой учитывают также в отдельных случаях при отборе снопов с пробных площадок.
Учет повреждения злаков пьявицей Жуки (синие или сине-зеленые, длиной 3,5—4,8 мм) выгрызают продолговатые отверстия на листьях, а личинки их (желтые, шестиногие, покрытые слизью) выедают ткани листа, оставляя нижний эпидермис. Повреждения имеют вид длинных полос. Учет проводят при заметных повреждениях. Определяют глазомерно степень повреждения листьев в процентах.
Учет повреждения пшеницы трипсами Трипсы (мелкие крылатые насекомые черного цвета) и их личинки (киноварно-красные) повреждают колосковые и цветковые чешуи, а также зерно. Чешуи при этом обесцвечиваются, а зерно приобретает мелкую морщинистость. Учет проводят во время налива зерна по выборке, взятой вторым способом. В пробу отбирают колосья. Рассчитывают процент поврежденных колосьев и глазомерно определяют среднюю степень повреждения по трехбалльной системе: слабо, средне, сильно.
Учет повреждения пшеницы хлебными пилильщиками Личинка вредителя (желто-бурого цвета со светло-бурой головой) питается тканями стебля, постепенно спускаясь по нему к основанию. Перед созреванием пшеницы она надгрызает стебель изнутри у основания. Стебель обламывается и падает. Некоторые стебли остаются стоять, но повреждение легко установить легким подергиванием стебля кверху. Учет повреждения в сортоиспытании ведут по снопам с пробных площадок. Но на малых делянках может быть проведен сплошной учет или дана глазомерная балльная оценка.
Повреждение злаков некоторыми другими вредителями в сортоиспытании также учитывают по снопу, взятому с пробных площадок.
Учет повреждения зерновых бобовых культур долгоносиками Долгоносики — мелкие (длиной 3—5 мм) жуки сероватого или буроватого цвета с удлиненным телом. Признак повреждения ими — фигурное (в виде лунок) объедание краев листьев. Глазомерно определяют степень повреждения растений в процентах. Учет проводят в том случае, если повреждение посева достигает заметного уровня.
Учет повреждения зерновых бобовых культур тлями
Листья, поврежденные тлями, скручиваются, а побеги принимают уродливую форму. Учет ведут при заметном повреждении посева глазомерно, степень повреждения определяя в процентах.
Учет повреждения гороха гороховой зерновкой
Проводят по пробе в 200 семян, взятой из основного образца через месяц после уборки. Семена намачивают и после их набухания разрезают ножом. Внутри может оказаться личинка, куколка или жук. Если жук вышел из горошины, то остается отверстие правильной круглой формы. Рассчитывают процент поврежденных семян.
Учет повреждения клевера клубеньковыми долгоносиками
Долгоносики выгрызают овальные отверстия по краям листьев. Учет проводят при заметном повреждении посева глазомерно, определяя в процентах степень повреждения.
Учет повреждения клевера клеверным семяедом
Личинки семяеда повреждают завязи в головках клевера. Разорвав соцветие, можно обнаружить их в цветоложе. Учет ведут при побурении головок клевера. Определяют процент поврежденных головок. Пробу отбирают вторым способом.
Контрольные вопросы
1. Учёт поражения пшеницы ржавчиной, мучнистой росой и септориозом
2. Учёт болезней ячменя, овса, ржи, зерновых бобовых
В статье представлены и обсуждаются результаты применения различных методов создания инфекционного фона Pyricularia oryzae для проведения фитопатологической оценки устойчивости селекционных материалов риса к пирикуляриозу и отбора болезнеустойчивых сортов и линии риса. Экспериментальным путем установлено, что наиболее эффективным лабораторным методом создания инфекционного фона является инокуляция отрезки листьев растений риса фильтровальной бумагой, пропитанной конидиальной суспензией гриба и инокуляция отрезки листьев растений риса каплями конидиальной суспензии патогена.
Введение
Одним из опасных заболеваний риса во всем мире, в том числе и в Казахстане, является пирикуляриоз, вызываемый несовершенным грибом Pyricularia oryzae Br. et Cav. (синоним Magnaporthe grisea (Hebert) Barr) 1. Впервые оно было описано в Японии в 1704 г., а его возбудитель – в 1896 г. Сейчас пирикуляриоз известен во всех районах возделывания риса [1]. Патоген поражает все надземные органы растения, что приводит к потере урожая на 30-60%, а в годы эпифитотий – на 80-100% 4.
Наиболее практичным и экономичным подходом в борьбе с пирикуляриозом риса является использование сортов, устойчивых к болезни. Определение устойчивости растений к патогену базируется на создании жесткого инфекционного фона и провокационных условий при возделывании культуры. Инфекционный фон может быть естественным и искусственным. При этом естественный инфекционный фон непостоянен и может варьиро-вать в пределах одного года и в разрезе отдельных лет, так как погодные условия не всегда благоприятствуют развитию, интенсивному размножению и распространению возбудителя болезни. В годы с умеренным и слабым развитием болезней гарантированную оценку болезнеустойчивости обеспечивает искусственное заражение растений, которое можно осуществлять как в полевых инфекционных питомниках, так и в условиях искусственного климата – теплицах и климатических камерах [6, 7].
В связи с этим, фитопатологии и селекционеры в своей работе в основном использует искусственный инфекционный фон для определения вирулентности гриба и отбора устойчивых сортов растений. Следовательно, изучение иммунологических свойств исходного и селекционного материала при искусственном заражении растений позволяет выявлять потенциальную и стабильную устойчивость сортообразцов, проводить своевременную браковку и отбор невосприимчивых форм на всех этапах селекции, что значительно ускоряет селекционный процесс, сокращая сроки выведения новых сортов культуры [8].
Успешная инокуляция может быть осуществлена при наличии ряда благоприятных условий [9]:
- оптимальная температура для прорастания спор, конидии или развития мицелия гриба;
- высокая влажность на поверхности листьев для прорастания спор;
- качество и интенсивность освещения;
- растения должны быть в достаточно восприимчивой физиологической стадии развития;
- инокулюм должен быть наиболее эффективно распределен на растении.
К настоящему времени разработаны различные способы и методы создания инфекционного фона возбудителем P.oryzae. Однако не все известные методы являются эффективными для оценки устойчивости сортов риса к болезни. Прежде чем провести массовый скрининг сортов риса на устойчивость, необходимо выбрать эффективного метода по созданию инфекционного фона, что сказывается на качестве проведения эксперимента. Кроме того, проведение фитопатологических и иммунологических исследований в Казахстане лимитируется отсутствием коллекции изолятов возбудителя пирикуляриоза, не разработанностью полевых и лабораторных методик оценки болезнеустойчивости с использованием современных методов.
В качестве инфекционного материала использована смесь из казахстанских изолятов возбудителя P. oryzae, которые выделены в 2013-2014 гг. и культивированы на картофельно-декстрозном агаре. Для приготовления суспензии культуру гриба с поверхности агара соскабливали шпателем и суспензировали в стерильной воде. Полученную суспензию фильтровали и разводили водой до необходимой концентрации. Для проведения инокуляции растений были использованы Твин 80 и желатин.
Эксперименты по созданию инфекционного фона пирикуляриоза риса проводили в тепличных и лабораторных условиях. Семена риса перед закладкой опыта в течение суток замачивали в воде с добавлением регулятора роста (0,2% янтарная кислота). В последующем семена раскладывали равномерно на дно чашки Петри с увлаженной фильтровальной бумагой и ставили в термостат на 3 сут, при температуре 28-30 °С. После 3 сут проростки растений риса посадили в пластмассовые горшки, заполненные смесью почвы. Следует отметить, что почву привезли из Кызылординской области.
На основании анализа литературных данных подобраны четыре метода инокуляции растений риса возбудителем P. oryzae, которые были использованы в данной работе:
- метод опрыскивания [2, 10, 11];
- смазывания листьев суспензией гриба [12];
- инокуляция отрезки листьев каплями суспензией гриба [13];
- инокуляция отрезки листьев фильтровальной бумагой пропитанной суспензией гриба [14].
Количество спор в суспензии (на 1 см2 площади колонии) определяли с помощью камеры Горяева по формуле:

Микроскопические работы проводили с помощью цифрового микроскопа (MC 300TS, Австрия), анализ микроскопических изображений проведен по компьютерной программе Motic Images 2000-1.3. Освещенность измеряли люксметром Ю-116.
На основе полученных результатов, можно считать, что метод заражения каплями конидиальной суспензии патогена имеет ряд преимуществ. Во-первых, данный метод позволяет, определит патогенность гриба в контролируемой среде, т.к. эксперименты выполняются в лабораторных боксах, и поэтому нет риска распространения гриба. А во- вторых метод экономичен во времени, не требует много растительного материала, изолята гриба, много места в лаборатории. Кроме того, использование данного метода позволяет одновременно заразить одних и тех же образцов несколькими изолятами болезни. Результаты исследований показаны на рисунке 1.


Результаты лабораторных экспериментов показали, что конидии пирикуляриоза риса можно поместить на растения разными способами. При этом дана характеристика к четырем методам заражения сортов риса возбудителем P. oryzae (суммировано в таблице 1).
Таблица 1 – Основные параметры методов заражения риса возбудителем P. Oryzae

Как видно из данных таблицы 1, что почти все применяемых методов можно использовать с водным носителем. Чтобы сохранить конидии в суспензии, необходимо добавит нефитотоксичный смачивающий агент, такой как Tвин 20 и желатин, а так же для заражения может быть использован опрыскиватель, щетка, фильтровальная бумага, шприц или микропипетка. Установлено, что процесс инфицирования проростков риса возбудителем P. oryzae происходит в интервале температур 22-28 оС с удлинением влажного периода до 48 ч. По литературным данным [12] наиболее благоприятной можно считать температуру, близкую к 26 оС, при которой первые признаки заражения проявляются уже после 4 сут заражения. Чем больше температура воздуха отклоняется от оптимальной (26 оС) в ту или иную сторону, тем требуется больший период увлажнения для инфицирования и проявления признаков пирикуляриоза на растениях.
Следует отметить, что для освещения растений мы использовали световую установку, состоящую из ртутно-дуговых люминесцентных ламп высокого давления (ДРЛ-2000), следовательно, в опытах освещенность была в пределах 10-20 тыс. люкс. При использовании отдельных методов затраты времени и труда значительны, но риск контаминации минимален и в научном плане высокоэффективен. В любом случае выбранный метод зависит от цели инокуляции, количества инокулируемых растений, количества пригодного инокулюма и материально-технической возможности экспериментатора.
Работа выполнена в рамках программы грантового финансирования Республики Казахстан на 2013-2015 гг. (грант №2495/ГФЗ).
Методы создания инфекционных фонов многообразны. В зависимости от особенностей патогена заражают почву, поверхность того или иного органа растения, вводят инфекцию в орган (не в ткани), инокулюм в ткани, используют для заражения насекомых, клещей и других переносчиков инфекции. Здесь описаны только некоторые приемы.
Если споры намечено использовать в течение ближайшего месяца, то их можно хранить в чашках Петри или в открытых бюксах в эксикаторе над раствором серной кислоты, создающем влажность 30 %, при температуре 10—12 °С. Для длительного хранения споры помещают на сутки в эксикатор над прокаленным гипсом. Медицинский гипс смачивают водой, месят из него тесто, делают лепешку и после затвердения раскалывают ее щипцами. Куски прокаливают па железном противне в течение 6—8 ч при 180 °С. Высушенные споры помещают в пробирку, изображенную на рисунке 19 (5 г спор на пробирку). К воронке пробирки, горлышко которой нужно предварительно заткнуть комочком ваты, приставляют толстый резиновый шланг от работающего на отсос насоса Комовского, а тонкое горлышко пробирки нагревают на газовой горелке и запаивают. Таким образом, споры оказываются в вакууме. В холодильнике при температуре плюс 5 °С они могут храниться неограниченно долго.
На участке инфекционного фона перед посевом яровой пшеницы вносят 100 кг азота на 1 га. Для внесения под озимую пшеницу эту норму делят поровну: половину применяют перед посевом, а половину — при весенней подкормке. Участок обсевают восприимчивым сортом. При испытании яровой пшеницы можно посеять озимый сорт, который обеспечит раннее накопление инфекции. Заражение ведут в начале колошения. На 5 г спор берут 0,8 л талька или муки, тщательно перемешивают, засыпают в мешочек из двойного слоя марли и встряхивают над делянками. Указанное количество спор вносят на 0,12 га посева. Заражение ведут в вечерние часы (с 17 ч).
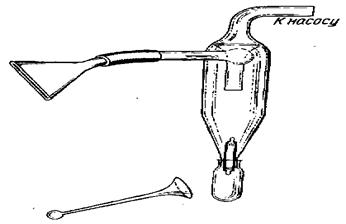
Рисунок 18 - Циклон для сбора спор, внизу – пробирка для хранения спор
Если погода сухая, то перед заражением проводят полив дождеванием. Если площадь инфекционного фона невелика, то можно опрыснуть посевы водой из ранцевого опрыскивателя. Заражают посевы спустя 0,5 ч после полива. Если есть возможность, делянки после заражения укрывают пленкой, натягивая ее на металлический каркас. В этом случае создается парниковый эффект, и, кроме того, споры не могут быть смыты дождем. В противном случае дождь, прошедший в течение суток после заражения, смоет споры, и заражение придется повторять.
Заражение пшеницы и ячменя мучнистой росой
В тех местностях, где мучнистая роса наносит существенный вред посевам, обычно нет необходимости в специальном заражении этой болезнью: она проявляется ежегодно в достаточно сильной степени. Однако бывают годы, когда необходимо создавать инфекционный фон этой болезни. Обильное азотное удобрение и обсев восприимчивым сортом, как и при заражении ржавчиной, создают провокационный фон. Выращивают в теплице восприимчивый сорт (здесь инокулюм присутствует всегда). Инфекцию вносят, срезая с растений пораженные листья, встряхивая их над посевами и разбрасывая по полю.
Заражение пшеницы и ячменя твердой головней
Материал для заражения готовят, измельчая колосья, пораженные твердой головней, в ступке непосредственно перец, заражением. До этого колосья хранят в лаборатории в бумажных пакетах. На 100 семян требуется 0,05—0,2 г (до 0,5 г при сильных инфекционных нагрузках) спор.
При массовом заражении нагрузку точно не дозируют. Берут кончиком ножа столько спор, сколько примерно необходимо для заражения, и высыпают их в пакет с семенами. Все образцы должны содержать стандартное число семян (в Краснодарском НИИ сельского хозяйства — 200 семян озимой пшеницы). Пакет закрывают и хорошо встряхивают его содержимое, чтобы споры перемешались с семенами. Так же ведут заражение ржи стеблевой головней.
У ячменя, как у пленчатой культуры, более эффективного заражения можно добиться, используя водную суспензию спор: 2 г спор на 1 л воды (способ Тапке). Семена выдерживают в суспензии 15 мин, а затем помещают в матерчатый мешочек. Мешочек кладут в деревянный ящик с плотно прилегающей крышкой и отверстиями на дне для стока избытка суспензии. Ящик укрывают мокрой мешковиной. Семена оставляют в нем на сутки при температуре 18— 20 °С. Затем их высушивают в тени до состояния сыпучести и высевают. Ранний посев сглубокой заделкой способствует заражению. Для заражения озимой пшеницы, напротив, необходим поздний посев, когда температура воздуха понизится примерно до 10 °С.
Заражение пшеницы и ячменя пыльной головней. Самым простым способом является посев сильно восприимчивого сорта на участке заражения. Через две полосы, засеянные изучаемыми образцами, размещают полосу восприимчивого сорта. Можно также развешивать пораженные колосья на участке заражения, помещая их на полметра выше колосьев испытываемых образцов.
Лучшие результаты дают способы, облегчающие проникновение спор внутрь цветка. Однако в этом случае нет возможности выявить такие формы устойчивости, как устойчивость, связанная с закрытым цветением, морфологией цветка. В Краснодарском НИИСХ для заражения пшеницы используют водную суспензию спор. Ее готовят, опуская в полулитровую банку с водой 45 зараженных колосьев смывая с них споры. На делянке каждого образца у 5 колосьев подрезают наполовину цветковые чешуи. Окунают кисточку или зубную щетку в суспензию и проводят ею по колосу сверху вниз с одной и другой стороны. После созревания срезают эти колосья, а также 5 контрольных, обмолачивают те и другие раздельно и семена используют для посева и сравнения.
Сильный инфекционный фон можно создать, внося споры головни кисточкой в каждый цветок. В этом случае в колосе предварительно удаляют нижние и верхние колоски, а также третьи цветки и цветки более высокого порядка, как при гибридизации. Способ довольно трудоемок и применяется только в том случае, когда хотят выявить абсолютно устойчивые (иммунные) формы. Мур предложил использовать для заражения вакуум-метод. В нашей стране онприменяется в модификации В. И. Кривченко.
Прибор, предложенный В. И. Кривченко, состоит из камеры, в которой происходит заражение, насоса, сосуда для суспензии спор и соединительных шлангов (рис. 19). Камера представляет собой стеклянный цилиндр, открытый снизу и заканчивающийся наверху двумя патрубками. Один служит для присоединения резинового шланга от насоса, работающего на отсос, другой для сообщения с атмосферой. Нижнее отверстие цилиндра закрывается резиновой пробкой с ограничителем. В средней части пробки вклеен слой пористой резины. Вдоль этого слоя пробка разрезана, но не до конца, так чтобы ее половинки могли расходиться как створки двери. В пробке имеется сквозное отверстие, в которое вставляется трубка. На выступающий наружу конец трубки надевают резиновый шланг, другой конец которого опускают в резервуар с суспензией. В разрез вставляют соломины 5—10 колосьев, смыкают половинки пробки и помещают колосья в камеру для заражения, затыкая пробкой ее нижнее отверстие. У колосьев ячменя срезают ости, а у пшеницы подрезают, кроме того, цветковые чешуи на 1 /3. Пальцем перекрывают отверстие, соединяющее камеру с атмосферой, и, откачивая воздух из нее насосом, добиваются, чтобы колосья целиком погрузились в суспензию. В этот момент пальцами сжимают шланг, по которому суспензия подается в цилиндр, и продолжают откачивать воздух в течение 5—10 с. Над поверхностью суспензии появляется туман — следствие быстрого испарения, что свидетельствует о достаточной степени разрежения. Открывают отверстие, соединяющее камеру с атмосферой, и дают суспензии стечь обратно в сосуд. Суспензию готовят непосредственно перед заражением, беря 0,4—0,5 г спор на 1 л воды. Указанное количество высыпают в 200—300 см 3 воды, энергично встряхивают и доливают воду до л.
Можно также вводить суспензию в каждый цветок с помощью медицинского шприца.
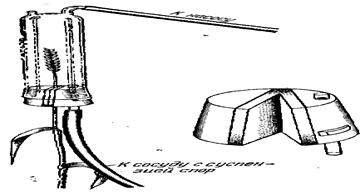
Рисунок 19 - Прибор В.И. Кривченко для заражения пыльной головней; справа – разрезная пробка прибора
Оценки устойчивости к вредителям
Селекция на устойчивость к некоторым вредителям (гессенской мухе, пилильщикам, подсолнечниковой моли и т. д.) ведется довольно успешно. В связи с этим оценкам на устойчивость к вредителям придается большое значение. Как и при оценках на поражение болезнями, наиболее полная характеристика дается образцам в конкурсном сортоиспытании. При этом используется методика государственного сортоиспытания.
Оценивают распространенность повреждений, если растения погибают или не дают продукции (например, при повреждении хлебными пилильщиками), и степень повреждения, если оно охватывает часть растения (например, повреждение пьявицей). В первом случае определяют процент поврежденных растений, во втором — процент поврежденной площади органа (например, листовых пластинок). Кроме того, практикуют учет заселенности вредителем (число особей, яйцекладок и т. д. на растение, единицу площади). Повреждение может оцениваться в баллах. При грубых оценках используют трехбалльную шкалу: повреждение слабое, среднее, сильное. Может быть использована международная система.
В конкурсном сортоиспытании оценку проводят в двух несмежных повторениях, но если повреждения распространены неравномерно, то оценивают делянки во всех повторениях. Учет ведут путем осмотра делянок или путем осмотра некоторой части растений (выборки) или даже отбора проб с последующим анализом. Общий принцип выборки заключается в том, что ее берут 5 местах по диагонали делянки. В каждом месте осматривают площадку 50x50 см (первый способ) или 10 растений в ряду подряд (второй способ).
Если вредитель повреждает посев пятнами (например, пьявица), то определяют процент площади, занятой этими пятнами, и средний процент повреждений в самих пятнах. Общую оценку дают в виде дроби: первый показатель в знаменателе, второй — в числителе. При глазомерной оценке процента распространения или повреждения (без подсчета) ее ведут с точностью до 10 %.
Учет повреждения злаков гессенской, шведской и яровой мухами, стеблевой блохой
Все эти вредители относятся к скрытостебельным. Личинки гессенской мухи находятся глубоко за влагалищем листа. Они молочно-белые с зеленым пятном в середине. Верхний лист отстает в росте, остальные листья имеют более темную окраску, они более широкие, чем у неповрежденных растений. Личинки шведской и яровой мух и стеблевой блохи вгрызаются в стебель. Верхний лист засыхает. Личинки яровой мухи окукливаются в почве, поэтому ложнококоны ее в растениях не встречаются. Личинка шведской мухи желто-белая, задний конец ее имеет два широко расставленных отростка. Личинка яровой мухи крупнее, и отростков на заднем конце у нее нет, он тупой мелкобугорчатый. Личинка стеблевой блохи имеет хорошо развитую голову и три пары ног.
Учет проводят по выборке, взятой вторым способом. Растения отбирают в пробу и анализируют. Те побеги, у которых при внешнем осмотре обнаруживаются признаки повреждения, исследуют более подробно. Отгибают влагалища листьев, чтобы установить, находятся ли там личинки или ложнококоны гессенской мухи. Препаровальной иглой вскрывают стебель сверху до узла кущения, чтобы обнаружить личинки и ложнококоны других вредителей и установить их видовую принадлежность. Рассчитывают процент поврежденных растений и процент поврежденных стеблей по каждому виду вредителя отдельно.
У озимых культур первый учет проводят осенью перед окончанием вегетации, второй — во время весеннего кущения до начала выхода в трубку. У яровых учет повреждений приурочивают к выходу в трубку. В южных районах возделывания озимых (Северный Кавказ, Украина, Молдавия, Центрально-Черноземная зона) проводят дополнительный учет в фазе молочной спелости. Стебли, пораженные гессенской мухой, в это время выглядят угнетенными. Часто они белеют, надламываются или падают. Личинки или ложнококоны гессенской мухи встречаются под влагалищем листа вблизи стеблевого узла (чаще всего нижнего). Поражение шведской мухой учитывают также в отдельных случаях при отборе снопов с пробных площадок.
Учет повреждения злаков пьявицей Жуки (синие или сине-зеленые, длиной 3,5—4,8 мм) выгрызают продолговатые отверстия на листьях, а личинки их (желтые, шестиногие, покрытые слизью) выедают ткани листа, оставляя нижний эпидермис. Повреждения имеют вид длинных полос. Учет проводят при заметных повреждениях. Определяют глазомерно степень повреждения листьев в процентах.
Учет повреждения пшеницы трипсами Трипсы (мелкие крылатые насекомые черного цвета) и их личинки (киноварно-красные) повреждают колосковые и цветковые чешуи, а также зерно. Чешуи при этом обесцвечиваются, а зерно приобретает мелкую морщинистость. Учет проводят во время налива зерна по выборке, взятой вторым способом. В пробу отбирают колосья. Рассчитывают процент поврежденных колосьев и глазомерно определяют среднюю степень повреждения по трехбалльной системе: слабо, средне, сильно.
Учет повреждения пшеницы хлебными пилильщиками Личинка вредителя (желто-бурого цвета со светло-бурой головой) питается тканями стебля, постепенно спускаясь по нему к основанию. Перед созреванием пшеницы она надгрызает стебель изнутри у основания. Стебель обламывается и падает. Некоторые стебли остаются стоять, но повреждение легко установить легким подергиванием стебля кверху. Учет повреждения в сортоиспытании ведут по снопам с пробных площадок. Но на малых делянках может быть проведен сплошной учет или дана глазомерная балльная оценка.
Повреждение злаков некоторыми другими вредителями в сортоиспытании также учитывают по снопу, взятому с пробных площадок.
Учет повреждения зерновых бобовых культур долгоносиками Долгоносики — мелкие (длиной 3—5 мм) жуки сероватого или буроватого цвета с удлиненным телом. Признак повреждения ими — фигурное (в виде лунок) объедание краев листьев. Глазомерно определяют степень повреждения растений в процентах. Учет проводят в том случае, если повреждение посева достигает заметного уровня.
Учет повреждения зерновых бобовых культур тлями
Листья, поврежденные тлями, скручиваются, а побеги принимают уродливую форму. Учет ведут при заметном повреждении посева глазомерно, степень повреждения определяя в процентах.
Учет повреждения гороха гороховой зерновкой
Проводят по пробе в 200 семян, взятой из основного образца через месяц после уборки. Семена намачивают и после их набухания разрезают ножом. Внутри может оказаться личинка, куколка или жук. Если жук вышел из горошины, то остается отверстие правильной круглой формы. Рассчитывают процент поврежденных семян.
Учет повреждения клевера клубеньковыми долгоносиками
Долгоносики выгрызают овальные отверстия по краям листьев. Учет проводят при заметном повреждении посева глазомерно, определяя в процентах степень повреждения.
Учет повреждения клевера клеверным семяедом
Личинки семяеда повреждают завязи в головках клевера. Разорвав соцветие, можно обнаружить их в цветоложе. Учет ведут при побурении головок клевера. Определяют процент поврежденных головок. Пробу отбирают вторым способом.
Контрольные вопросы
1. Учёт поражения пшеницы ржавчиной, мучнистой росой и септориозом
2. Учёт болезней ячменя, овса, ржи, зерновых бобовых
3. Учёт болезней картофеля
4. Создание инфекционного фона
5. Оценки устойчивости к вредителям
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Читайте также:


