Методы исследования на дирофиляриоз
дирофиляриоз плотоядный собака болезнь
По данным многих авторов при постановке диагноза на дирофиляриоз необходимо учитывать следующие показатели:
• Анамнестические данные - прибытие из эндемической области или нахождение в ней.
• Клинические признаки болезни,
• Выделение микрофилярий из крови животного.
• Дополнительные лабораторные исследования
Личинок дирофилярий в крови можно обнаружить следующими лабораторными методами:
· Прямая микроскопия капли свежей крови под малым увеличением микроскопа наиболее легкий, удобный и быстрый метод диагностики дирофиляриоза. Подвижные личинки паразита заметны по их активному движению между эритроцитами. Этот метод дает надежные результаты только при высокой интенсивности инвазии. Недостатками этого метода являются: трудность диагностирования дирофиляриоза при низкой интенсивности инвазии, необходимость иметь под рукой микроскоп в рабочем положении и предметные стекла, исследование необходимо проводить сразу же после взятия крови, что создает неудобства в работе. Кроме того, при малой подвижности микрофилярий их бывает трудно обнаружить среди большого количества эритроцитов. При высокой температуре окружающего воздуха, свежий мазок крови быстро высыхает, что создает дополнительные трудности в исследовании.
· Исследование цельной сыворотки крови - для исследования сыворотки крови в пробирку берут несколько миллилитров венозной крови от собаки. Кровь сворачивается, и микрофилярии мигрируют в сыворотку. Сыворотка со сгустком должна постоять в пробирке несколько часов. После этого пастеровской пипеткой берут несколько капель сыворотки со дна пробирки или из места на границе сыворотки и сгустка крови. Эти капли помещают на предметное стекло, накрывают покровным и исследуют под малым увеличением микроскопа на наличие подвижных микрофилярий. Если кровь до исследования находилась в холодильнике, то предметное стекло с каплями сыворотки выдерживают несколько минут при комнатной температуре для того, чтобы личинки дирофилярий восстановили свою подвижность. Недостатками этого метода диагностики являются: возможность постановки диагноза только через определенное время (около двух часов необходимо для отстаивания сыворотки крови). Преимущества метода: исследованиями на дирофиляриоз можно заниматься в свободное время, не отвлекаясь от основной работы; так как личинки дирофилярий сохраняют свою подвижность в сыворотке крови при комнатной температуре до трех суток, а в холодильнике при температуре +2. +4°С до одной недели. Даже после их гибели, при наличии определенного опыта, микрофилярии легко можно обнаружить в сыворотке крови. При сворачивании крови образуется сыворотка, объем которой почти в два раза меньше цельной крови, это способствует концентрации микрофилярий и облегчает их обнаружение при невысокой интенсивности инвазии. Кроме того, в сыворотке легче обнаружить микрофилярии, чем в цельной крови, так как в данном случае отсутствуют форменные элементы крови, мешающие исследованию.
· Метод Куликова - 20 мл венозной крови смешивают с 2 мл 3,8% водного раствора лимоннокислого натрия (цитрата натрия) и отстаивают 20-30 минут. По истечении этого времени в пробирке образуется 3 слоя: внизу - эритроциты, в середине - лейкоциты и микрофилярии, вверху - плазма крови. Берут пипеткой средний слой, каплями наносят на предметное стекло, накрывают покровным стеклом и исследуют при малом и среднем увеличении.
· Архиповой Д.Р. разработан количественный метод прижизненной диагностики дирофиляриозов собак основанный на применении меланжера для подсчета количества лейкоцитов и счетной камеры Фукс-Розенталя. Меланжер до метки I заполняют кровью и до метки II раствором, состоящим из ледяной уксусной кислоты, раствора фуксина и дистиллированной воды в соотношении 3:4:93. Для равномерного смешивания меланжер с кровью и раствором кладут на вибратор на 2-3 минуты. К чистой и сухой камере Фукс-Розенталя притирают покровное стекло до появления колец Ньютона. Затем раствор в меланжере встряхивают, и каплю (но не первую) раствора наносят на среднюю часть пластинки камеры и при увеличении микроскопа в 100 раз подсчитывают количество микрофилярий во всех квадратах. Полученное количество личинок умножают на 6,23, так как для 20 мм 3 раствора потребовалось бы 6,23 объема камеры. Для определения количества микрофилярий в 1 мл крови число выявленных микрофилярий в 20 мм 3 умножается на 50.
· Исследование крови для обнаружения микрофилярий может быть облегчено добавлением вещества, вызывающего гемолиз. При этом методе периферическую кровь собак исследуют сразу после взятия (на месте). Каплю крови помещают на предметное стекло, добавляют две капли дистиллированной воды или 1%-ного водного раствора уксусной кислоты, накрывают покровным и исследуют под малым увеличением микроскопа.
· При использовании метода с применением уксусной кислоты к 1 мл венозной крови сразу же приливают 5 мл 2%-ного раствора уксусной кислоты. Смесь центрифугируют при 1000 об/мин. В течение 3-5 минут. Надосадочную жидкость выливают, а осадок микроскопируют для обнаружения микрофилярий. При этом методе личинки погибают, и их бывает трудно обнаружить в исследуемом материале.
· Метод Руже-Мюленса - к крови добавляют пятикратный объем раствора: 5%-ный формалина 95 мл, уксусной кислоты 5 мл и концентрированного спиртового раствора генцианвиолета 2 мл. Смесь центрифугируется, надосадочная жидкость сливается, а осадок опять центрифугируют с водой и смотрят под микроскопом. Этот метод можно упростить: каплю крови помещают в пробирку с раствором и микроскопируют на следующий день.
· Метод Шуффнера - 10 капель крови помещают в 10 мл физиологического раствора, к которому предварительно добавили несколько капель раствора сапонина. После гемолиза, производят центрифугирование. Живые, подвижные личинки обнаруживаются в осадке.
· Модифицированный метод Кнотта дает хорошие результаты при практической постановке диагноза на наличие микрофилярий у собак, Метод заключается в следующем: к 1 мл венозной крови добавляют 10 мл 2%-ного раствора формалина. Этот раствор хорошо перемешивают и центрифугируют при 1500 об/мин. в течение 5 минут. Надосадочную жидкость удаляют, а осадок смешивают с равным объемом метиленового синего в разведении 1:1000 и оставляют для окрашивания на 5 минут. Окрашенный осадок микроскопируют для обнаружения фиксированных микрофилярий.
К дополнительным методам исследования относятся следующие:
1. Морфологические и биохимические исследования крови - не позволяют поставить точный диагноз на дирофиляриоз, но помогают определить патологические изменения в органах и тканях, которые могут быть связаны с дирофиляриозом. Наиболее часто при дирофиляриозе отмечают нормоцитарную, нормохромную или гипохромную анемию (гематокрит
D. Immitis паразитируют в легочных артериях и полостях сердца у собак D. Repens паразитируют в подкожной клетчатке собак и человека. До недавнего времени микрофиляремия т.е. наличие личинок в организме у человека не регистрировалась и обнаружение у человека более одного паразита D. repens крайне редко, последние исследования выявили случаи размножения D. repens в организме человека.
Это заболевание, характеризуется медленным развитием и длительным хроническим течением.
Возбудитель дирофиляриоза относится к классу круглых червей Nematoda, отряду Spirurina, подотряду Spiruromorpha, семейству Filarioidea, роду Dirofilaria.
Всего описано несколько видов червей, из которых наибольшее распространение имеют: D. Immitis и D. Repens. Именно заболевания, вызываемые, этими двумя видами паразитов часто регистрируем при исследовании собак.
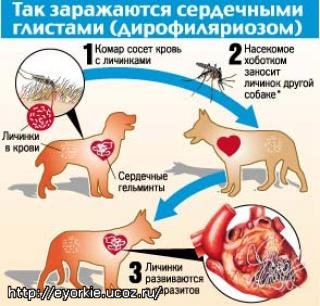
Дирофилярии развиваются с двойной сменой хозяев. Половозрелые оплодотворенные самки отрождают в кровь дефинитивного хозяина микрофилярии, которые, не изменяясь морфологически, циркулируют в кровеносной системе до 2,5 лет или до того момента, когда попадут к кровососущему насекомому(чаще всего комару) при этом сначала микрофилярии попадают с кровью в кишечник комара, затем они мигрируют в полость тела и развиваются до инвазионной стадии (L 3) в мальпигиевых сосудах. Личинки L 3 концентрируются в головном отделе и нижней губе насекомого, при последующем кровососании они активно внедряются в кожу животного и продолжают развиваться до половозрелой стадии. Период развития от микрофилярии до взрослой дирофилярии составляет в среднем 270- 320 дней
Размеры взрослых гельминтов D.immitis – самки 180 - 300 мм, самцы 100 - 110 мм,самки D. repens имеют длину тела 135 - 150 мм, самцы 50-58 мм.
В организме животных паразиты живут (по разным данным) от 4-5 месяцев до 2-х лет. Микрофилярии циркулируют в крови дефинитивного хозяина до 3-х лет.
Заболевание чаще регистрируют в районах с тёплым и влажным климатом, характеризуется сезонностью. Плотоядные животные заражаются возбудителем дирофиляриоза в период лета и нападения комаров. Пути распространения дирофиляриоза непосредственно связаны с комарами родов Aedes, Culex, Anophies. Экологическую нишу дирофилярий представляют, прежде всего, собаки. Возможно также заболевание лис, хорьков, кошек, а также человека.
На территории республики Башкортостан впервые дирофиляриоз был установлен случайно в 2003 году при вскрытии внезапно павших собак.
Длительное время дирофиляриоз считался заболеванием, характерным для районов с жарким климатом. Его часто регистрировали в Ростовской области, Краснодарском крае, на Кавказе, но в последние годы даное заболевание распространилось практически по всей территории России.
Исследования служебных собак, проведенные в Уфимской школе по подготовке специалистов-кинологов МВД России подтверждают данный факт.
За период 2009-2011 гг, нами обследовано более 500 служебных собак, прибывших в школу для обучения, выявлено более 70 (более 14%) собак зараженных дирофиляриозом из более чем 20-ти регионов России.
Для диагностики дирофиляриоза использовали достаточно простые способы: 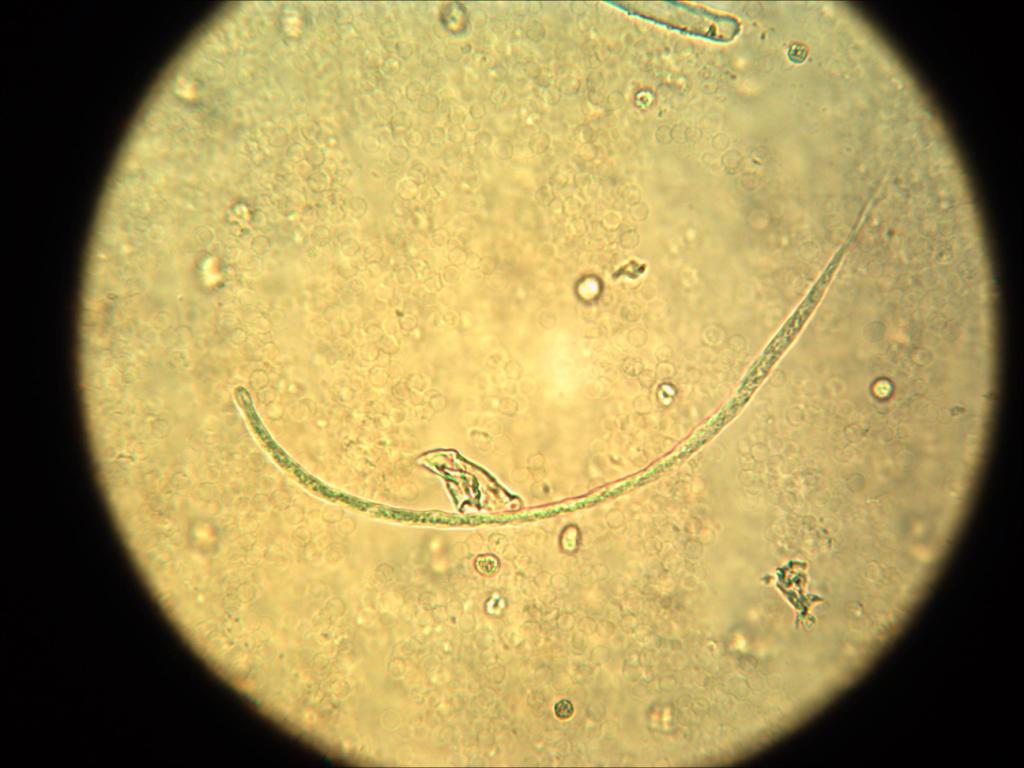
Метод обогащения Кнотта: 1-2 мл. венозной крови смешать в пробирке с 10 мл. 2% раствора формалина, центрифугировать 5 мин. при 1-1,5тыс. об./мин., надосадочную жидкость слить, небольшую каплю ресуспендированного осадка поместить на предметное стекло, накрыть покровным стеклом, микроскопировать при малом увеличении х40-х100 и опущенном конденсоре. Результат: микрофилярии погибшие, прямолинейно вытянуты, с хорошо различимыми внутренней структурой, головным и хвостовым концами, ширина примерно равна диаметру лейкоцита.
Метод обнаружения микрофилярий в нативной сыворотке: несколько миллилитров венозной крови поместить в чистую пробирку или пробирку с активатором свертывания, центрифугировать 5-10 мин. при 1,5-2,7тыс.об./мин., пипеткой аспирировать несколько капель сыворотки на границе со сгустком с захватом верхнего слоя эритроцитов, поместить на предметное стекло, накрыть покровным стеклом, микроскопировать при малом увеличении х40-х100 и опущенном конденсоре. Результат: микрофилярии живые, хорошо заметны по активному движению.
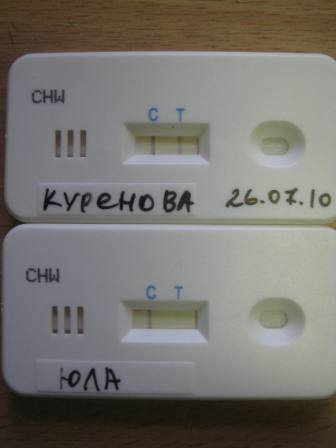
Экспресс - тесты (иммунохроматография) (выявление антигена Dirofilaria immitis экспресс - методом), позволяет дифференцировать заболевание, вызванное Dirofilaria immitis от заболевания вызванное Dirofilaria repens. В своих исследованиях мы использовали бесприборные экспресс - тесты по диагностике заболеваний собак Dignostica Fennica (Финляндия).
Верхний тест - положительный на наличие Dirofilaria immitis.
Нижний тест - отрицательный
По результатам лабораторных исследований из 500 собак выявлено 70 собак с микрофиляремией, из них у 25 собак антигенным тестом выявлено наличие взрослых гельминтов D.immitis, у 2 собак выявлено одновременное паразитирование D.immitis и D.repens.
В связи с тем, что большинство исследованных собак были в возрасте от 1 года до 3 лет, клинические признаки дирофиляриоза практически не выявляются. Только у двух собак выявлены признаки правосторонней сердечной недостаточности (увеличение правых отделов сердца, кашель, одышка при физических нагрузках и в покое), обе собаки старше 5-ти лет. При рентгенологическом исследований собак с подтвержденным диагнозом на наличие в крови D. Immitis, у трех собак выявлено незначительное увеличение правых отделов сердца.
Гематологические и биохимические исследовани крови зараженных собак не показали наличие каких-либо lдостоверных отклонений от нормы.
Дирофиляриоз подкожной клетчатки чаще всего протекает бессимптомно - D. repens у собак обнаруживаются редко, при локализации паразитов в подкожной клетчатке характерно наличие длительно не заживающих язв, гнойников, ран, появление расчесов и т.д. При вскрытии подкожных гнойников обнаруживаются живые половозрелые гельминты. При локализации гельминта в подкожной клетчатке век или под конъюнктивой возникает опухолевидная ограниченная припухлость с маловыраженными воспалительными явлениями.
Микрофилярии обладают многокомпонентным повреждающим действием на органы и ткани организма, что и определяет многочисленные клинические проявления (от хромоты до перфорации легких с развитием пневмоторакса).
Микроскопические исследования паренхиматозных органов и тканей собак, а также исследования проб крови животных показали, что под воздействием паразита в организме собаки происходят серьёзные изменения. Стенки сосудов, в которых, обитают микрофиллярии, утолщены, просветы капилляров — сужены, нередко вокруг капилляров встречаются кровоизлияния. Часто регестрируется развитие нефритов. В мышечной ткани наблюдается зернистое перерождение, в большинстве случаев поперечная исчерченность нарушена.
В больших количествах микрофиллярии обнаруживаются в просветах сосудов лёгочных тканей, что порой приводит к кровоизлияниям размером в одну-две альвеолы. Сосудистая сеть печени сильно гиперемирована, в просветах сосудов обнаружено много распавшихся эритроцитов.
Патоморфологические изменения мы регистрировали у всех больных собак в виде переплетения нитей возбудителей в полостях правого желудочка и предсердия. Их количество достигало от 15 до 22. Отдельные экземпляры гельминтов в длину достигали 33 см, находились в крови свободно. Редкие экземпляры гельминта располагались в полости левого желудочка сердца. Правые полости сердца расширенны, содержали не свернувшуюся или с наличием рыхлых сгустков кровь густой консистенции темно-красного или красновато-черного цвета с синюшным оттенком. Пребывание отдельных экземпляров возбудителей в легочной артерии сочеталось с состоянием застойного полнокровия или отека легких.
Миокард дрябловатой консистенции, волокнистое строение сглажено. В некоторых участках эндокарда и в трехстворчатых клапанах имели место кровоизлияния, у некоторых больных – утолщения или изъязвления в краевых участках. Приведенные изменения в сердце сопровождались нарушением кровообращением во всех других органах в виде венозного полнокровия, цианоза.
У трех животных сердечная форма дирофиляриоза сочеталась с подкожной, проявляющейся в виде образования узелков и бугорков в местах локализации D. repens. В одном случае такие паразитарные узелки и очаги были осложнены гнойным воспалением и развитием хронического сепсиса, признаками которого были гиперплазия селезенки, системный лимфаденит.
Лечение дирофиляриоза является не простой задачей для врача. Это обусловлено многокомпонентным, тотальным поражением органов и тканей, а также возможностью развития тяжелых осложнений в ходе терапевтических манипуляций. Самым грозным и тяжелым осложнением являются тромбоэмболии крупных сосудов и полостей сердца, что может привести практически к мгновенной смерти животного. Каждый конкретный случай требует индивидуального подхода к разработке тактики лечения. Среди препаратов, используемых, для лечения дирофиляриоза преобладают т.н. микрофилярицидные, препараты которые убивают личинок дирофилярий. Эти препараты одновременно тормозят репродуктивную функцию взрослых особей, давая возможность избавиться от прямого негативного действия микрофилярий на достаточно продолжительный период времени.
Применяемые препараты: Тиацетарсамид, Филарсен, Меласормин, Immiticide и др.
- Высокая токсичность препаратов
- Аллергическик реакции
- Эмболия (закупорка сосудов) мертвыми паразитами
- Необходимо длительно и тщательно готовить собаку к лечению и контролировать состояние после проведенного лечения.
- Смерть животного в случае начала лечения может наступить быстрее, чем без лечения, в свете вышеперечисленного нами не используется данный способ лечения дирофиляриоза.
Проводится в первую очередь для устранения повреждающего действия микрофилярий на органы и ткани организма, о которых было сказано раннее, собака больная дирофиляриозом останется инвазионной (заразной) по отношению к другим собакам, кроме того, диагноз будущих заразных болезней может быть искажен постоянной микрофиляриемией.
Выявленные в процессе лабораторных исследований больные собаки подвергались микрофилярицидной терапии разными препаратами, для определения их эффективности:
Препараты ивермектина подкожно в дозе 0,2- 0,3 мг действующего вещества на 1 кг массы животного (Отодектин, Ивертин) – гибель микрофилярий (отсутствие личинок в исследуемой крови и сыворотке) через 24-48 часов, исследования крови и сыворотки проводилось ежедневно, до момента исчезновения микрофилярий, затем каждые 7 дней – повторное обнаружение микрофилярий в среднем через 4-5 недель.
Препараты мильбемицина орально (Мильбемакс) – гибель микрофилярий (отсутствие личинок в исследуемой крови и сыворотке) через 48 часов, исследования крови и сыворотки проводилось ежедневно, до момента исчезновения микрофилярий, затем каждые 7 дней – повторное обнаружение микрофилярий в через 5 недель.
Препараты селамектина наружно (Стронгхолд) – через 48 часов уменьшение количества микрофилярий, снижение их активности в сыворотке повторное исследование через 7 и 14 дней показало наличие большого числа микрофилярий в крови и сыворотке.
Предварительных мероприятий перед проведением микрофилярицидной терапии (антигистаминные препараты, антикоагулянты и др.), рекомендуемые многими ветеринарными специалистами, не проводилось. В день проведения терапии собаки освобождались от физических нагрузок и находились под наблюдением ветеринарного врача на протяжении 5-8 часов. Все собаки после проведенного лечения чувствовали себя хорошо, никаких отклонений не выявлено. У одной собаки образовались множественные ограниченные припухлости, при вскрытии которых обнаруживались живые гельминты.
Профилактика дирофиляриоза должна проводиться комплексно.
В первую очередь должны быть уничтожены очаги размножения. Важное мероприятие в профилактике дирофиляриоза - недопущение контакта животных с кровососущими насекомыми, переносчиками дирофиляриоза - комарами.
В противном случае распространение этого гельминтоза будет продолжаться. Необходимо также регулярно обрабатывать собак от наружных и внутренних паразитов.
- Дирофиляриоз выявляется у собак практически во всех регионах России.
- В республике Башкортостан зараженность среди служебных собак достигает 25-30 %, при содержании собак в вольерах на ограниченной территории и отсутствии профилактических мероприятий, зараженность достигает 90%.
- Диагностика дирофиляриоза (обнаружение микрофилярий) достаточно простая, затруднения может вызвать дифференциация паразита т.к. необходима ПЦР диагностика или использование экспресс-тестов.
- Клинические признаки заражения D. Immitis выявляются у собак в возрасте старше 5-ти лет.
- Лечение таких собак очень сложное.
Профилактика дирофиляриоза необходима, для недопущения дальнейшего распространения заболевания в регионе.
Похожие темы научных работ по ветеринарным наукам , автор научной работы — Ястреб В.Б.
Vital diagnosis of Dirofilaria spp. infection
One discussed the methods of vital diagnosis of Dirofilaria spp. infection.
Acute toxicity of insectoacaricide drops “Bars”.Yarovaya N.V., Salnikova O.G. Nizhegorodsk Reference Centre of Rosselhoznadzor.
Summary. One determined the following acute toxicity parameters of “Bars®” at peroral administration to mice and at application on skin to rats: LD50 = 1900 and LD50 = 3700 mg/kg of body weight respectively.
ПРИЖИЗНЕННАЯ ДИАГНОСТИКА ДИРОФИЛЯРИОЗА
ВНИИ гельминтологии им. К.И. Скрябина
В настоящее время активно продолжается поиск эффективных и экологичных методов прижизненной диагностики дирофиляриоза как в ветеринарной, так и медицинской практике.
К прижизненной диагностике относят прямое исследование крови, методы концентрации, фильтрации, количественной и дифференциальной диагностики, а также иммунологические и молекулярные методы.
Метод толстой раздавленной капли крови является самым простым и быстро выполнимым. Кровь перед исследованием тщательно перемешивают, наносят 3 капли на предметное стекло, накрывают покровным и исследуют при малом увеличении микроскопа. Движущиеся микрофилярии хорошо заметны в поле зрения микроскопа. Этот метод не требует химреактивов и лабораторного оборудования, но эффективен только при высокой микрофиляриемии.
Метод концентрации. J.D. Knott (10) предложил метод, сущность которого заключается в том, что в пробирку с 1 мл крови добавляют 10 мл 2%-ного раствора формалина и смесь центрифугируют в течение 5 минут при скорости 1500 об./мин. Надосадочную жидкость удаляют, осадок смешивают в
равных частях с 0,1%-ным раствором метиленовой сини. Из окрашенного осадка делают влажный мазок и исследуют под микроскопом.
Метод фильтрации через миллипоровые фильтры предложен J.P. Wylie (19). В шприц набирают 1 мл крови, смешивают с гепарином и добавляют 10 мл гемолизирующего раствора. Полученный раствор гемолизированной крови пропускают через миллипоровый фильтр с размером пор 8 мкм. Затем через фильтр медленно пропускают 5 - 10 мл раствора толуидинового синего. Далее фильтр промывают, отсоединяют от держателя и исследуют под микроскопом. В.Г. Супряга и А.И. Андреенков (4) предложили для медицинской практики метод диагностики филяриатозов у лиц с низкой плотностью микрофилярий в крови. Авторы предложили модификацию, с помощью которой микрофилярии обнаруживают на окрашенных ультрафильтрах отечественного производства, через которые пропускают под вакуумом гемолизированную кровь.
Методы количественной диагностики. Для практикующих врачей и научных целей в химиотерапевтических опытах необходимо проводить выявление микрофилярий с учетом их количества и жизнеспособности. Для этого используют метод концентрации крови с дистиллированной водой по В.Б. Ястребу (5).
J.R. Lindsey (11) предложил для подсчета микрофилярий метод, при котором кровь набирают в шприц с гепарином и смешивают. Затем делают 3 мазка, высушивают и окрашивают раствором Гимза. Если в мазке в среднем обнаруживают менее 1 микрофилярии, то считают, что в 1 мл цельной крови меньше 50 микрофилярий.
Еще один метод количественной диагностики предложили Д.Р. Архипова и И.А. Архипов (1) с использованием меланжера и счетной камеры Фукса-Розенталя. Кровь берут из ушной вены в смесительную пипетку (меланжер) до метки I и до метки II заполняют раствором, состоящим из ледяной уксусной кислоты, раствора фуксина и дистиллированной воды в соотношении 3:4:93. Для равномерного смешивания меланжер с кровью и раствором кладут на вибратор на 2 - 3 минуты. К чистой и сухой камере Фукса-Розенталя притирают покровное стекло до появления так называемых колец Ньютона. Затем раствор в меланжере встряхивают, и каплю (но не первую) наносят на среднюю часть пластинки камеры и под микроскопом подсчитывают количество микрофилярий во всех квадратах. Подсчитанное количество микрофилярий делят на степень разбавления (10) и емкость камеры (3,2 мм3) и умножают на 20. Получают количество микрофилярий в 20
Методы дифференциальной диагностики. Поскольку виды дирофилярий и дипеталонем обладают разной степенью патогенности по отношению к собакам, очень важна дифференциальная диагностика микрофилярий на видовом уровне.
A.E.R. Taylor (15) детально изучала морфологию микрофилярий с использованием специального окрашивания и ультрафиолетового микроскопирования и установила следующие различия для D. immitis и D.
repens в мкм: длина - 260±5 и 290±10; ширина - 4,5 и 6,0; расстояние от головного конца тела до: а) нервного кольца - 20 и 23; б) экскреторной поры -30 и 30; в) экскреторной клетки - 40 и 33; г) анальной поры - 74 и 70 соответственно.
Для идентификации микрофилярий L. Chalifoux и R.D. Hunt (6) использовали их реакцию на действие кислой фосфатазы. Микрофилярии имеют разные места окрашивания энзимных клеток в результате нафтол ASTR-фосфатной реакции. Активность кислой фосфатазы у двух видов филярий различна: у микрофилярий D. immitis четко окрашиваются энзимные клетки в области экскреторной и анальной пор, тогда как у микрофилярий D. repens четко окрашиваются энзимные клетки только в области анальной поры. M.A. Peribanez et al. (13) предложили для дифференциации микрофилярий D. immitis и D. repens коммерческий тест Leucognost-SP®. Он также основан на реакции микрофилярий к действию кислой фосфатазы, как и предыдущий метод, но является более быстрым и простым.
Микрофилярии D. immitis и D. repens различаются по форме головного и хвостового концов. Головной конец микрофилярий D. repens имеет округлую форму, короткий и прозрачный, а у D. immitis - конической формы и темного цвета. Хвостовой конец у микрофилярий D. immitis заострен, а у D. repens - нитевидный, вытянутый, загнутый на конце в виде ручки зонтика.
G. Favia et al. (7), Ю.Г. Бескровная, С.А. Нагорный (2) предложили дифференцировать D. immitis и D. repens на молекулярном уровне, используя полимеразную цепную реакцию (ПЦР).
Недостатки описанных выше методов послужили стимулом к дальнейшим исследованиям, направленным на разработку более эффективных альтернативных методов диагностики дирофиляриоза собак.
G.J. Weil et al. (16) показали возможность диагностики инвазии D. immitis по присутствию специфических антигенов этого паразита в циркулирующей крови. При смешивании сыворотки крови зараженной собаки и стандартизированной антисыворотки происходит иммунологическая реакция, свидетельствующая о присутствии паразита. Получены и описаны гибридомные клеточные линии, образующие моноклональные антитела к этим антигенам. Разработана и запатентована иммунологическая тест-система (17), которая выпускается под коммерческим названием FILAROCHEK™ CANINE HEARTWORM ANTIGEN TEST KIT производства MALLINCKRODT Inc., Нью-Йорк.
В настоящее время для диагностики дирофиляриоза собак в основном используют тесты, которые позволяют определять циркулирующие в крови антигены, выделяемые взрослыми самками гельминтов, но инвазия выявляется непостоянно, а только в тех случаях, когда в организме животных обитает от трех и более самок, возраст которых старше 7 месяцев. Наборы, основанные на определении антигенов с помощью тестов ELISA, иммунохроматографии и гемагглютинации, применяют для индивидуального и группового исследования. Сравнение эффективности всех трех диагностических тестов с использованием 108 положительных и 100 отрицательных на D. immitis проб сывороток собак показало, что чувствительность и специфичность были очень высокими, а статистические различия между тестами отсутствовали (12).
Torre A. et al. // Parasitology. - 1996. - V. 113, N 6. - P. 567 - 571. 8. Gillis J.M., Smith R.D., Todd K.S. // Aver. J. Vet. Res. - 1984. - V. 45, N 11. - P. 2288 - 2292. 9. Kato K.H. U.S.A. Patent. Immunoassay. - 1982. - N 4,322,495. 10. Knott J.I. // Trans. Roy. Soc. Trop. Med. Hyg. - 1939. - V. 33. - P. 191 - 196. 11. Lindsey J.R. // J. Amer. Vet. Assoc. - 1965. - V. 146. - P. 1106 - 1114. 12. McCall J.W. // Abstracts the 18th Intern. Conf. WAAVP, Stresa, Italy. - 2001. - P. 184. 13. Peribanez M.A., Lucientes J., Arce S. et al. // Vet. Parasitol. - 2001. - V. 102, N 12. - P. 173 - 175. 14. Schrey C.F., Trautvetter E. // Waltham Focus. - 1998. - V. 8, N 3. - P. 23 - 30. 15. Taylor A.E.R. // J. Helminthol. - 1960. - V. 34, N 1-2. - Р. 27 - 38. 16. Weil G.J., Malane M.S., Powers K.G. // Am. J. Trop. Med. Hyg. - 1984. -V. 33. - P. 425 - 430. 17. Weil G.J. U.S.A. Patent. Circulating antigens of Dirofilaria immitis, monoclonal antibodies specific therefore and methods of preparing such antibodies and detecting antigens. - 1985. - N 4,839,275. 18. Wilkins R.J., Ciurea D. // Vet. Med. - 1985. - V. 80, N 6. - P. 42 - 45. 19. Wylie J.P. // J. Amer. Vet. Med. Assoc. - 1970. - V. 156, N 10. - P. 1403 - 1405.
Vital diagnosis of Dirofilaria spp. infection. Yastreb V.B. All-Russian K.I. Skryabin Scientific Research Institute of Helminthology.
Summary. One discussed the methods of vital diagnosis of Dirofilaria spp. infection.
Для исследования сыворотки крови в пробирку берут несколько миллилитров венозной крови от собаки. Кровь свертывается и микрофилярии мигрируют в сыворотку. Сыворотка со сгустком должна постоять в пробирке несколько часов. После этого пастеровской пипеткой берут несколько капель сыворотки со дна пробирки или из места на границе сыворотки и сгустка крови. Эти капли помещают на предметное стекло, накрывают покровным и исследуют под малым увеличением микроскопа на наличие подвижных микродирофилярий. Если кровь до исследования находилась в холодильнике, то предметное стекло с каплями сыворотки выдерживают несколько минут при комнатной температуре для того, чтобы личинки дирофилярий восстановили свою подвижность.
Модифицированный метод Кнотта дает наилучшие результаты при практической постановке диагноза на наличие микрофилярий у собак. Метод заключается в следующем: к 1 мл венозной крови добавляют 10 мл 2%-ного раствора формалина. Этот раствор хорошо перемешивают и центрифугируют при 1500 об/мин в течение 5 мин. Надосадочную жидкость удаляют, а осадок смешивают с равным объемом метиленового синего в разведении 1:1000 и оставляют для окрашивания на 5 мин. Окрашенный осадок микроскопируют для обнаружения фиксированных микрофилярии.
Точность этих тестов, обычно используемых в практике, повышается при их комплексном применении. Модифицированный метод Кнотта и миллипоровая фильтрация более чувствительны, потому что они концентрируют L1, повышая точность диагноза. Однако ни один из этих методов не может исключать дирофиляриоз окончательно из-за распространенности амикрофиляриемической формы болезни и при небольшом количестве циркулирующих в крови личинок 1. Амикрофиляриемическая форма дирофиляриоза встречается примерно у 25% больных собак и связана, очевидно, с развитием иммунологических реакций, приводящих к лизису микрофилярий. При амикрофиляриемической форме врач вынужден ставить диагноз на основании клинических, клинико-патологических, иммунологических, и рентгенографических результатов.
Приблизительно в 25 % случаев дирофиляриоза наблюдается амикрофиляриемическая форма инвазии эффективность тестов, описанных выше в подтверждении диагноза ограничена. Метод непрямой иммунофлюоресценции используется, чтобы обнаружить антитела к микрофиляриям, и имеет специфическую полноценность при диагностике истинного дирофиляриоза и тех случаев, в которых L1 отсутствуют из-за иммунного разрушения. Также разработан метод иммуноферментного анализа при диагностике дирофиляриоза (ELISA), при помощи которого можно обнаружить антитела к дирофиляриям или сам антиген. Тесты,обнаруживающие непосредственно дирофиляриозный антиген антиген, являются более предпочтительными. Метод непрямой иммунофлюоресценции и ИФА разработаны за рубежом, где стали широко использоваться из-за их точности, чувствительности, специфичности и быстроты исполнения. После успешной терапии дирофиляриоза метод IFA (1 год) и ELISA (6 месяцев) дают положительный результат при определении антител.
Рентгенография грудной полости хотя и не является хорошим методом для обнаружения - дирофилярий, но позволяет косвенно определить степени инвазии по оценке легочных паренхиматозных изменений. Рентгенографические изменения, которые развиваются на ранних стадиях болезни, присутствуют приблизительно в 85% случаев. Рентгенографическные изменения включают увеличение правого желудочка (60% случаев), расширение легочной артерии в месте ее выхода из сердца 70%, расширение и увеличение рентгенографической плотности легочных артерий (50)%, а также извитость легочной артерии 50%. Если при этом присутствует сердечная недостаточность, то отмечается увеличение синуса полых вен, печени и селезенки, а также наблюдается плевральный выпот или асцит.
Электрокардиография позволяет обнаружить аритмии, но по сравнению с рентгенографией не дает возможности выявить увеличение полостей сердца.
Если по результатам рентгенографии нельзя предположить дирофиляриоз, то маловероятно, что электрокардиограмма поможет установить эту инвазию. Обнаружение увеличения правого желудочка позволяет заподозрить дирофиляриоз.
Эхокардиография относительно более чувствительна в обнаружении индуцированного гельминтами увеличения правого отдела сердца. Перекрестная эхокардиография может время от времени демонстрировать гельминтов в легочной артерии.
Гематологические и биохимические изменения крови не позволяют поставить диагноз дирофиляриоза, но они позволяют определить параллельное заболевание, которое может или не может быть связано с дирофиляриозом.
Наиболее часто при дирофидяриозе встречаются гипохромная нерегенеративная анемия, нейтрофилия ( 20-80% случаев), эозинофилия (85% случаев) и базофилия (60%). В тяжелых случаях, особенно, если порок присутствует сердечная недостаточность повышается активность АлАТ и АсАТ (10% случаев), иногда отмечается гипербилирубинемия. Азотемия, наблюдаемая только в 5% случаев, может быть внепочечного происхождения, если присутствуют дегидратация или порок сердца, или может быть вторична при гломерулонефрите. Гломерулонефрит может усложнять клиническую картину. При исследовании мочи редко выявляют изостенурию, чаще наблюдается альбуминурия (10-30% случаев).
Читайте также:


