Микоплазменная инфекция у свиней
Энзоотическая пневмония свиней – микоплазменная пневмония, респираторный микоплазмоз, микоплазмоз свиней (pneumonia enzootica suum) – хроническое инфекционное заболевание, характеризующееся воспалением легких, серозных покровов и нарушением воспроизводительной функции у свиноматок.
Этиология. Возбудителем болезни являются микоплазмы. Наиболее часто она вызывается M. suipneumoniae – M. hyopneumoniae, реже – другими видами этих микроорганизмов. M.suipneumoniae по морфологическим и ферментативным свойствам имеет некоторое сходство с другими видами микоплазм, но отличается от них высокой требовательностью к питательным средам и медленной репликацией, которая длится до 30 дней.
На плотной питательной среде растут в виде мелких, размером до 10-25 нм, бесцветных колоний без центрального уплотнения, врастающие в агар всей поверхностью. M. hyopneumoniae ферментирует глюкозу, не гидролизует аргин, не продуцируют фосфатазу, слабо образуют пленки и пятна.
Эпизоотологические данные. Источником инфекции является больные и переболевшие животные, в организме которых микоплазмы могут сохраняться до 13-15 месяцев. Выделяется возбудитель с истечениями из носа, молоком, мочой и другими секретами. Заражение происходит воздушно-капельным путем и внутриутробно. К болезни восприимчивы свиньи всех возрастов, но более чувствителен молодняк. Заболевание протекает в виде энзоотии, поражая до 60-80% поросят. Летальность достигает до 10-15%. Зараженность стада сохраняется годами. У поросят сосунов симптомы болезни часто отсутствуют и наблюдаются они в 2-3-месячном возрасте.
На широту распространения, интенсивность энзоотии и тяжесть течения болезни существенно влияют микроклимат помещений, условия содержания и кормления. Выраженной сезонности не выявлено, но наиболее массово проявляется в осенне-зимний период.
Течение и симптомы. Инкубационный период длится от 7 до 30 дней. Болезнь проявляется в основном в респираторной форме. Температура тела может повышаться до 40,1-40,5 °С. Затем ухудшается общее состояние, аппетит. У поросят отмечается чихание, слизистое истечение из носа, кашель, вначале сухой и редкий, а затем в виде длительных приступов. Дыхание учащено до 70 -80 движений в минуту. Кашель особенно усиливается в утренние часы во время кормления или при перемещении животных.
При осложнении основного патологического процесса бактериальной микрофлорой у больных поросят болезнь протекает более тяжело. Дыхание становится затрудненным, аппетит понижен, отмечается истощение, слизистые оболочки цианотичны. На конечной стадии болезни поросята сидят на задней части тела с сильной одышкой и пытаются ударами живота выдохнуть воздух из хронически воспаленных легких.
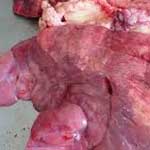
Патологоанатомические изменения. При вскрытии отмечают катаральное воспаление верхушечных, сердечных и добавочной долей легких. Воспаленные участки уплотнены, серого цвета и имеют выраженную дольчатую структуру. С поверхности разреза стекает мутная сероватая жидкость. Средостенные лимфоузлы несколько увеличены, на разрезе сочные, серого цвета, местами покрасневшие.
Дыхательные пути обычно без видимых изменений. Обнаруживается лишь умеренная очаговая гиперемия слизистой оболочки трахеи и крупных бронхов. В их просветах содержится относительно небольшое количество вязкой, сероватой, реже кровянистой жидкости.
Почка, селезенка, печень и головной мозг без видимых изменений.
В хронических случаях, когда воспалительный процесс осложняется бактериальной микрофлорой, развивается перитонит, плеврит и гнойно-некротические процессы в легких.
Гистологически у поросят обнаруживается умеренный отек и инфильтрация клеточными элементами подслизистой оболочки трахеи и бронхов, распространяющаяся на перибронхиальную и периваскулярную ткань, образуя вокруг них инфильтраты в виде муфт.
Диагноз. Ставят с учетом эпизоотологических, клинических, патологоанатомических данных, результатов обнаружения антигена микоплазм МФА, выделения микоплазм и обнаружения к ним специфических антител. В лабораторию направляют кусочки пораженных легких, взятых на границе со здоровыми, средостенные и бронхиальные лимфатические узлы и сыворотку крови больных поросят. Изолят относят к виду M.suipneumoniae на основании определения антигенных свойств. Для ретроспективной диагностики используют РСК, РНГА, латекагглютинации и иммуноферментный анализ.
Энзоотическую пневмонию исключают от гриппа, хламидиоза, пастереллеза, сальмонеллеза, антинобациллярной плевропневмонии, пневмонии аскаридозной и метастронгилезной этиологии.
Лечение.Применяют линкомицин, спирамицин, тетрациклин, тиамугин, тилозин. Тиамулин применяют в дозе 50 мг/кг, тилозин (фрадизин, формазин) – 2-10 мг/кг, антибиотики тетрациклинового ряда – 10 тыс. ЕД./ кг живой массы. В виде аэрозолей можно назначать хлорную известь (1 г) и скипидар (0,75 г/1 м3 помещения), йодистый алюминий (на 1 м3 помещения – 0, 2 г йода, 0,02 алюмиевой пудры и 0, 06 хлористого аммония), 5%-ный раствор хлорамина Б в дозе 3 мл/м3, йодином – 2 мл/м3, йодтриэтиленглюколь из расчета 0,15-0,2 йода на 1 м 3 помещения.
Одновременно назначают препараты патогенетической терапии и иммуностимулирующие средства.
В качестве профилактики энзоотической пневмонии предложена схема применения антибактериальных средств, которая включает: в 1-ый день жизни и на 8-10-й день поросятам назначают по 50 мг основания тилансодержащего препарата или по 20-30 мг сульфонамид-триметоприма; на 16-й 100 мг тилозинового основания или по 40-60 мг сульфонамид-триметоприна на поросенка.
Профилактика и меры борьбы. Основаны на проведении комплекса ветеринарных, санитарных и зоотехнических мероприятий, направленных на недопущение заноса инфекции, обеспечение оптимальных условий содержания и кормления животных, повышение их естественной резистентности организма. Специфические средства профилактики окончательно не разработаны.
В наших опытах положительные результаты получены при применении сыворотки крови реконвалесцентов, которая в зависимости от вида микоплазм содержит специфические антитела в титре 1:8 – 1:128. Двух-, трехкратная обработка поросят сывороткой в дозе 2 мл/м3 помещения в первые дни после заполнения секции, с последующим применением в течение 5 дней йодинола в виде аэрозолей из расчета 2 мл/м3, предохраняет от заболеваемости 92% поросят, снижает вынужденный убой на 1,5, падеж – на 0,9% и повышает прирост массы тела животных на 2,9 – 3,6 кг.
Поливалентная сыворотка, полученная путем гипериммунизации свиней на откорме смесью инактивированных 4-х видов микоплазм и 2-х видов ахолеплазм, содержала специфические антитела в титре 1:128 – 1:1024. Применение ее в форме аэрозолей в первый день после заполнения сектора поросятами снижало заболеваемость до 19,3% вынужденный убой – до 1,9 и падеж до 2,0%. Средний прирост массы тела животных возрос на 2,4 кг.
Иммунизация поросят сконструированной нами поливалентной противомикоплазменной вакциной, которую вводили в 10 – 12-дневном возрасте в дозе 1 мл, а через 10 дней инъекцию повторяли в дозе 2 мл, снизила заболеваемость поросят на доращивании до 3,1%, вынужденный убой – 1,2 и падеж – до 1,5. Средняя масса тела одного животного у вакцинированных животных была на 4,2 кг выше, чем в контрольных животных.
В случае возникновения болезни меры борьбы с микоплазмозом свиней основываются на разрыве эпизоотической цепи, предотвращении контракта между больными и здоровыми животными, улучшении условий содержания, кормления и исключении стрессовых факторов, снижающих резистентность организма. Больных животных изолируют и лечат, а имевших контакт с ними обрабатывают антибактериальными средствами. При широком распространении болезни допускается замена маточного поголовья новым, завезенным из благополучного хозяйства.
Данное инфекционное заболевание относят к наиболее опасным и распространенным на территории РФ. Чаще всего диагностируют микоплазмоз КРС и свиней, однако также патология может поражать птиц. Особенность заболевания в том, что его возбудителями являются микроорганизмы, у которых отсутствует стенка клетки. Из-за этой особенности микоплазмоз плохо лечится традиционными антибиотиками предыдущих поколений, а потому требует применения новейших эффективных препаратов. Отсутствие своевременного ветеринарного вмешательства чревато развитием множества осложнений, приводящих хозяйства к крупным экономическим убыткам. Летальность может составлять 10-15% от общего числа больных особей.
Причины микоплазмоза животных
В природе существует более 10 видов микоплазм – микроорганизмов, схожих с бактериями, однако отличающихся по структуре.
К основным причинам, вызывающим заболевание, относят:
- нарушение гигиены в месте содержания животных;
- сырость, повышенная влажность воздуха в помещениях;
- снижение иммунитета отдельных особей из-за плохого микроклимата, питания;
- покупка в стадо зараженной особи со скрытыми клиническими проявлениями болезни (инкубационный период микроорганизмов достигает 27 дней).
Заражение происходит аэрогенным путем – при дыхании. Особенно чувствительны молодые особи. Чаще всего болеют поросята в возрасте от 3 до 10 недель. Микоплазмоз телят обычно развивается в 15-60-дневном возрасте.
Симптомы микоплазмоза
Среди общих проявлений патологии выделяют:
- воспаление, болезненность коленных и запястных суставов с образованием свищей;
- хромота;
- покраснение глаз;
- апатия, отсутствие аппетита;
- повышение температуры тела до 40,1-40,5°С;
- чихание, слизистые выделения из носа;
- кашель, затрудненное дыхание (чаще у поросят).
У взрослых коров болезнь поражает вымя, поэтому молоко приобретает желтый цвет, его консистенция становится неоднородной, а объем удоев падает.
Заражение приводит к многочисленным осложнениям:
- у коров – маститам, эндометритам, вульвовагинитам, преждевременному прерыванию беременности, рождению слаборазвитого потомства;
- у телят – артритам, пневмониям, менингитам, ринитам, конъюктивитам;
- у быков – эпидидимитам, орхитам;
- у свиней – воспалению легких, респираторным заболеваниям.
При отсутствии лечения у коров может развиться бесплодие. Поросята с респираторными осложнениями могут погибнуть от удушия.
Диагностика
Диагноз ставят на основе внешнего осмотра, клинических проявлений и лабораторных исследований тканей, выделений, абортированных или мертворожденных плодов. В лаборатории для обнаружения возбудителя используют метод ПЦР.
Лечение микоплазмоза
Единственным эффективным методом лечения является применение антибиотиков. При микоплазмозе используют препараты последнего поколения, так как к традиционным антибиотикам у микроорганизмов, вызывающих микоплазмоз, вырабатывается резистентность.
Компания NITA-FARM предлагает использовать при микоплазмозе препарат Лексофлон – антибиотик последнего поколения фторхинолонов.
- В основе – левофлоксацин, вещество, относящееся к фторхинолонам ІІІ поколения.
- Лечение широкого спектра инфекций, имеющих резистентность к антибиотикам предыдущего поколения.
- Биодоступность препарата составляет 99%.
- Уже через 2 часа после применения он достигает максимальной эффективности, хорошо проникая в ткани.
- 100% результативность в течение 24-48 часов.
- Одинаково эффективен при лечении микоплазмоза свиней и КРС.
- Достаточно одной ежедневной инъекции в течение 3-5-дневного курса.
- В течение 2 суток полностью выводится из организма, в основном, с мочой.
- Уже через 48 часов после применения препарата молоко можно использовать в пищевых целях.
Эффективность подтверждена клиническими исследованиями и соответствующими документами. Заказать Лексофлон можно непосредственно в компании NITA-FARM.
Профилактика
Ветеринарам и работникам хозяйств следует соблюдать следующие рекомендации:
- поддерживать чистоту в местах содержания животных;
- выпаивать телят молоком, проверенным на отсутствие микоплазм;
- особое внимание уделять случаям мастита, ринита и проверять животное на наличие инфекции;
- заботиться о полноценном рационе для повышения иммунитета;
- избегать стрессовых факторов в виде повышения влажности, перепадов температуры.
Гемофилезная плевропневмония свиней (грипп свиней, вирусная пневмония, микоплазменная пневмония, респираторный микоплазмоз свиней) Pleuropneumonia haemophilosis suum) — инфекционная хроническая болезнь свиней всех возрастов, характеризующаяся при остром течении геморрагическим воспалением легких и фибринозным плевритом, а при подостром и хроническом — развитием очаговой гнойной некротизирующей пневмонии и фибринозным плевритом.
Историческая справка. Гемофилезная плевропневмония была описана в начале прошлого столетия (У. Грипс, 1903). Возбудитель болезни был открыт практически одновременно американскими и английскими учеными (Маре, Швитцер, 1965; Гудвин с соавторами 1965), которые дали ему равноценные названия: соответственно M. hyopneumoniaeu M. Suipneumonia. Как самостоятельная нозологическая единица впервые описана Х.Оландером (1963) в Калифорнии.
Гемофилезная плевропневмония распространена повсеместно и постоянно обнаруживается практически почти во всех крупных свиноводческих хозяйствах Европы, Америки, Азии и Африки. На территории бывшего СССР болезнь появилась в 1963году.
Экономический ущерб. Гемофилезная плевропневмония свиней вызывает значительные экономические потери свиноводческим хозяйствам, которые складываются от замедления роста и развития поросят из-за плохой усвояемости корма (зараженные животные расходуют на единицу при росте живой массы на 18-20% потребляемых кормов больше, чем здоровые). Потери от смертности доходят от 2 до 15%.
Этиология. Возбудитель болезни (Нaemophilus pleuropneumoniae) по культурально — морфологическим и ферментативным свойствам имеет сходство с другими микоплазмами. Морфологически характеризуется выраженным полиморфизмом; грамположителен, хорошо окрашивается по Романовскому – Гимза и Динсу, обладает выраженным тропизмом к легочной ткани, в мазках-отпечатках из легких имеет вид кокков, кольцеобразных сферических образований, образует капсулу, продуцируют бета-гемолизин и фермент уреазу; растет в анаэробных условиях на питательных средах, содержащих свежую кровь животных, или дрожжевой экстракт (10-15 % к объему), которые содержат ростовый V-фактор.
На МПА с баккормилкой возбудитель формирует колонии только вблизи штриха питающей культуры, выделяющей V-фактор (саттелитные колонии).
Различают 8 серологических вариантов (с 1 по 8), из которых заболевание чаще вызывают 1-й и 2-й. Патогенен для свиней при интраназальном и интратрахеальном, а также для кроликов- при интраназальном заражении.
Устойчивость возбудителя. При температуре 5-10°С и влажности воздуха 75-80% возбудитель сохраняется во внешней среде до 28 суток, в соломенной подстилке -1-5 суток, при температуре -20°С- месяцами, а при 50°С погибает моментально. Высушенный на стекле возбудитель сохраняет жизнеспособность в течение 4 суток. Возбудитель чувствителен к действию тилозина и тетрациклина, которые ингибируют ее рост. Обычные дезсредства, применяемые на свинарниках быстро убивают его.
Патогенез. Попав в легкие аэрогенным путем, бактерии в течение 2 недель после заражения активно размножаются в слизистой оболочке трахеи, бронхов и бронхиол, вызывая у свиней в легких образование очажков серозно-катаральной бронхопневмонии. Спустя 3 недели бактерии проникают постепенно в более глубокие части дыхательных путей и в альвеолы. Наступившая лимфоидно — моноцитарная инфильтрация в стенках альвеол и интерстициальной ткани приводит к сжатию альвеол и сужению бронхов, в результате у больных свиней нарушается нормальное дыхание. У заразившихся свиней в это время начинают появляться первые клинические признаки болезни. Воспаление в легких чаще всего развивается в вентилируемых участках — по краям верхушечных долей легких в виде лобулярной пневмонии, причем чаще с правой стороны, что обусловлено топографией регионарных лимфатических узлов.
Пораженные участки эпителиальных клеток слизистой оболочки становятся восприимчивыми к воздействию других микоплазм, бактерий, стрептококков, а иногда риккетсий и вирусов. В сочетании между собой, а также с возбудителями гельминтозов они обуславливают развитие смешанной или вторичной инфекции и инвазии, приводя к утяжелению возникшего у свиней патологического процесса и ускоряют течение болезни.
Вследствие ослабления резистентности организма заболевшего животного и усиления воздействия секундарной микрофлоры возникший патологический процесс на последних стадиях болезни может перейти в лобарную катарально-гнойную и даже гнойно-некротическую или фибринозную пневмонию. Легочная ткань часто подвергается гепатизации. В начале болезни возникшую гипоксию больные свиньи компенсируют за счет учащенного дыхания, а при вовлечение в воспалительный процесс значительных участков легкого, у заболевших животных наступает декомпенсация, которая клинически проявляется сердечной слабостью, одышкой, что в итоге приводит к истощению животных, появлению на свинарнике заморышей и их падежу.
Эпизоотологические данные. К гемофилезной плевропневмонии свиней восприимчивы только свиньи. Учитывая, что клинические признаки, а также поражение легких у заболевших животных во многом зависят от возраста животных и условий их содержания в помещении свинарников, воздействие разнообразных стрессовых факторов, гемофилезную плевропневмонию ученые относят к группе факторно- инфекционных болезней. Чаще болеют поросята-сосуны 2-3 недельного возраста, отъемыши в возрасте 2-3 месяца и подсвинки 6-8 месячного возраста. Взрослые свиньи устойчивы к заражению, заболевают сравнительно редко и переносят заболевание сравнительно легко.
Источником возбудителя инфекции при гемофилезной плевропневмонии свиней служат больные, переболевшие и племенные животные -скрытые бактерионосители, в течение длительного промежутка времени выделяющие возбудителя в окружающую среду с частицами слизи при кашле и чихании, а также с молоком и влагалищным секретом. У отдельных животных бактерионосительство может длиться от 80 дней до года, а иногда может быть и пожизненным. Часто здоровые животные заражаются возбудителем болезни через предметы ухода и обслуживающий персонал.
В благополучных свиноводческих хозяйствах гемофилезная плевропневмония свиней может возникнуть после завоза клинически здоровых, но зараженных поросят, свиноматок и хряков- производителей.
Время появления первых клинических признаков болезни у свинопоголовья зависит от дозы, степени заражения и интенсивности репликации возбудителя болезни в респираторных органах свиней. Инкубационный (скрытый период болезни) может быть от 5 месяцев до нескольких лет. В свиноводческих хозяйствах, полностью свободных от возбудителя болезни, и в откормочных хозяйствах первая эпизоотическая вспышка имеет взрывной эпизоотический характер и протекает с высокой летальностью.
В стационарно неблагополучном по гемофилезной плевропневмонии свиней хозяйстве инфекция распространяется медленно, и варьирование интенсивности эпизоотического процесса сопровождается от спорадических случаев до эпизоотии с широким распространением болезни.
В неблагополучном стаде свиней возбудитель болезни распространяется аэрогенным (воздушно-капельным) и контактным путем. Подсосные поросята обычно заражаются от своих матерей при сосание через молоко и при контакте с больными животными.
На обострение тяжести течения и распространения болезни влияют частые перегруппировки и особенно послеотъемное смешивание поросят; скученное содержание в сырых, холодных, плохо вентилируемых помещениях с цементными полами, неполноценное кормление, наличие в хозяйстве смешанных и вторичных инфекционных заболеваний (инфекционный атрофический ринит, пастереллез), гельминтозов и других сопутствующих заболеваний. При неудовлетворительных ветеринарно-санитарных условиях заболеть может 85% от всего свинопоголовья, при падеже -15%.
В хозяйствах имеющих хорошие ветеринарно-санитарные условия для содержания свиней и при попадании малых доз возбудителя в организм поросят, животные чаще переболевают бессимптомно. Несмотря на это владельцы животных отмечают снижение рентабельности ведения свиноводства на 20-30%, в результате низкого прироста живой массы у животных и высокой себестоимости выращенной свиноводческой продукции.
Клинические признаки. Инкубационный период от 1дня до 10 месяцев, в среднем 10-16 дней. Болезнь протекает остро и хронически. Моноинфекция при благоприятных условиях кормления и содержания свиней может протекать бессимптомно. Молодняк свиней заболевает чаще и болезнь у них протекает более тяжело, чем у взрослых животных. Болезнь на свинарниках протекает остро и хронически.
При остром течении, которое бывает обычно в первые дни вспышки, (чаще у подсвинков 5-6 месяцев), отмечаем угнетение общего состояния животного, лихорадку постоянного типа, повышение температуры тела до 41-42°С, отказ от корма, частый, сухой и поверхностный кашель, у животного появляется одышка, толчкообразный выдох. Больное животное стремится лечь на бок, живот или же принимает позу сидячей собаки. Незадолго до падежа у свиней появляются кровянистые истечения из носовых отверстий и ротовой полости. При таком течении болезни поросята гибнут в первые 24 часа после начала заболевания. Острая форма заболевания обычно длится у поросят 14 дней.
При хроническом течении гемофилезная плевропневмония в своем развитии проходит две стадии. В первой стадии болезни, первые признаки заболевания в виде незначительного повышения температуры тела до 40,5-41°С, чихания и редкого поверхностного кашля появляются между 3-й и 10-й неделе после заражения. При этой стадии, которая продолжается до 2-х недель поросята хорошо поедают корм, общее состояние их не нарушается.
Вторая стадия хронического течения болезни несколько недель и даже месяцев, но начало ее приходится на 6-10-недельный возраст животных. Для второй стадии болезни характерен у поросят редкий, но глубокий и болезненный кашель, особенно проявляющийся по утрам при подъеме животных, во время кормления, перемещения и выгона их на прогулку. Подобные больные животные часто останавливаются, тяжело и учащенно дышат (абдоминальное дыхание 70-80 в 1 минуту), стоят на широко расставленных конечностях, а иногда принимают позу сидящей собаки, стараются зарыться в подстилку, плохо едят. При пальпации межреберных промежутков отмечается болезненность, температура тела держится в пределах 40,8-41,5°С. Больные животные отстают в росте и развитии. У больных поросят при клиническом осмотре отмечаем взъерошенность щетины, тусклую окраску кожи, экзематозные поражения кожи и слизисто-гнойный конъюнктивит.
Патологоанатомические изменения. Патологоанатомические изменения являются наиболее характерными для гемофилезной плевропневмонии. При остром течении болезни трупы еще не истощены, кожа во многих местах имеет багрово-красный цвет. В грудной полости — кровянистая жидкость. Обнаруживаются признаки одно- или двухстороннего воспаления и отека легких. Паренхима легкого вишнево — красного цвета, плотная, легко разрывается при надавливании. В центральной части пораженной доли находим 1-2 первичных очага, в зоне которых пульмональная и костальная плевры соединены фибринозными тяжами. Лимфатические узлы увеличены, серо-розового цвета, гиперемированы, поверхность разреза влажная. Печень кровенаполнена. У многих трупов отмечают фибринозный перикардит, очаговый катаральный энтерит и гастрит. При хроническом течении легочная ткань уплотнена, за счет окружения соединительной тканью, в легких выявляем инкапсулированные очаги размером 1×2-3×4см; в зоне очага — фибринозный плеврит.
Диагноз. Предварительный диагноз на гемофилезную плевропневмонию ставится на основании анализа эпизоотологических, клинических данных и результатов патологоанатомического вскрытия павших животных. Для окончательного подтверждения диагноза проводится обязательное бактериологическое исследование. Ветспециалисты хозяйства в ветеринарную лабораторию должны направлять кусочки пораженных легких, бронхиальные и средостенные лимфатические узлы. В ветеринарной лаборатории проводят:
- микроскопическое обнаружение возбудителя в легких (методами прямой и непрямой РИФ, окраску по Граму и Гинса);
- выделение чистых культур на средах МПА с глюкозой, шоколадном агаре и индентификацию его по культурально-морфологическим и биохимическим тестам;
- определение антигенных свойств (ПЗР, РА);
- выявление специфических антител;
- постановка биопробы на поросятах 2-2,5-месячного возраста из хозяйств, благополучных по плевропневмонии свиней.
Патогенность выделенной культуры определяют внутрибрюшинным заражением белых мышей массой по 18-20г.
Дифференциальный диагноз. При проведении дифференциальной диагностики необходимо исключить следующие заболевания — чуму свиней, пастереллез, сальмонеллез, болень Ауески, листериоз, лептоспироз, легочные гельминты аскаридиозной и метастронгилезной этиологии, протозойные болезни, грипп свиней, а также острые бактериальные секундарные инфекции, хронически протекающую актинобацилярную пневмонию, бордетеллиоз, инфекцию вызываемую M. hyorhinis; пневмонии, обусловленные энтеро- и аденовирусами; гемофилезный полисерозит.
Иммунитет. У переболевших гемофилезной плевропневмонией свиней установлена устойчивость к повторному заражению возбудителем, связь иммунитета с высоким титром комплиментсвязывающих антител, прямая зависимость между освобождением организма свиней от возбудителя и интенсивностью РА и РСК.
Лечение. Лечение гемофилезной плевропневмонии будет эффективно только при условии создания нормальных зоогигиенических условий содержания и организации полноценного кормления животных, а также устранение в хозяйстве всех стрессовых воздействий которые приводят к возникновению заболевания. Для лечения применяют антибиотики широкого спектра действия (окситетрациклин, тетрациклин, линкомицин, тиамутин, спирамицин, хлорамфеникол, фосфат тилозина и современные антибиотики цефалоспоринового ряда), сульфаниламидные препараты (норсульфазол, этазол, сульфадиметатоксин, сульфадимезин и др.), одновременно проводят симптоматическую терапию. Практическим ветеринарным врачам необходимо помнить, что применение лечения предупреждает лишь развитие клинических признаков болезни, но не предотвращает попавшую на свинарник инфекцию и не освобождает организм свиней от возбудителя инфекции. Тяжелобольных животных с экономической целесообразности необходимо выбраковывать.
Профилактика и меры борьбы. Профилактика гемофилезной плевропневмонии включает в себя строгое соблюдение владельцами животных технологии содержания, организация полноценного сбалансированого кормления, внедрение высокой ветеринарно-санитарной культуры ведения свиноводства.
Больных животных изолируем и подвергаем лечению. Тяжелобольных свиней направляем на убой на санитарную бойню. Выздоровевших свиней содержим изолированно, после откорма данных свиней сдаем на убой. Запрещается выздоровевших животных использовать для племенных целей.
Клинически здоровым свиньям неблагополучного свинарника вводят антибактериальные средства в течение 2-х дней. Проводится тщательная механическая очистка и дезинфекция свиноводческих помещений 2%-ным раствором едкого натра; вакцинацию всех свиноматок в неблагополучном хозяйстве с целью создания колострального иммунитета инактивированной эмульгированной вакциной из вирулентного штамма (за 20-25 дней до опороса), вновь поступающих ремонтных свинок за 20- 25 дней до перевода в основное стадо, затем — перед опоросом. Поросят вакцинируют дважды – в 35-40 и 45-50 дневного возраста.
Аннотация научной статьи по ветеринарным наукам, автор научной работы — Ефанова Л. И., Степанов А. В., Свиридов М. М., Манжурина О. А.
Представлены результаты ретроспективного мониторинга циркуляции патогенных микоплазм у свиней , проведенного методами иммуноферментного анализа и полимеразноцепной реакции, в 26 свиноводческих хозяйствах Белгородской, Воронежской, Курской, Липецкой, Мурманской, Орловской, Ростовской, Рязанской, Тамбовской и Ярославской областей. Исследованы биологические пробы (сыворотка крови, сперма и влагалищные смывы) и патматериал (мертворожденные, павшие и вынужденно убитые животные), полученные от свиней различных технологических групп и возраста (хряки, свиноматки, поросята до 1, 2-х, 3-х и старше 3-х месячного возраста, ремонтные свинки). Установлена широкая циркуляция патогенных микоплазм (96, 2 %), в том числе Mycoplasma hyopneumoniae (88,5 %) в обследованных свиноводческих хозяйствах. ДНК патогенных микоплазм выделяли из патматериала от поросят 2.3-х месячного возраста (60. 85 %), реже от поросят до 1-го и старше 3-х месячного возраста, ремонтных свинок 30.47 %, а также из влагалищных смывов свиноматок с репродуктивной патологией (9,1 %) и спермы хряков (2 %). Антитела к Mycoplasma hyopneumoniae обнаружены в сыворотках крови 43,2 % хряков, 56 % свиноматок, 27,7 % ремонтных свинок; 43,8 % поросят до 1 месяца, 66 % молодняка от 2-х до 3-х месяцев и 33,2 % животных старше 3-х месяцев. Патогенные микоплазмы среди свиней передаются вертикальным и горизонтальным путем, участвуют в репродуктивной патологии, а также в пренатальной (54,1 %) и постнатальной (55,8 %) гибели животных.
Похожие темы научных работ по ветеринарным наукам , автор научной работы — Ефанова Л. И., Степанов А. В., Свиридов М. М., Манжурина О. А.
MYCOPLASMA INFECTION IN PIGS
All-Russian Veterinary Pathology Pharmacology and Therapy Research Institute Results of retrospective monitoring of circulation of pathogenic mycoplasmas at the pigs , spent by methods enzyme immunoassay and polimerazno chain reaction, in 26 pig-breeding economy of the Belgorod, Voronezh, Kursk, Lipetsk, Murmansk, Oryol, Rostov, Ryazan, Tambov and Yaroslavl areas are presented. Biological tests (blood whey, sperm and vaginal washouts) and рathological material (deadborn, fallen and forcedly killed animals) received from pigs of various technological groups and age (male pigs , sows, pigs to 1, 2, 3 and are more senior 3 monthly age, repair pigs ) are investigated. Wide circulation of pathogenic mycoplasmas (96,2%), including Mycoplasma hyopneumoniae (88,5%) in the surveyed pig-breeding economy is established. DNA of pathogenic mycoplasmas was allocated from рathological material from pigs 2 3 monthly age (60-85%), is more rare from pigs to 1st and is more senior 3 monthly age and repair pigs 30-47%, and also from vaginal washouts of sows with a reproductive pathology (9,1%) and sperms of male pigs (2%). Antibodies to Mycoplasma hyopneumoniae were found out in whey of blood in male pigs 43,2%, sows 56%, repair pigs 27,7%; pigs till 1 month 43,8%, from 1 about 2 months 0%, from 2 about 3 months 66% also are more senior 3 months 33,2%. Vertical and horizontal transfer of pathogenic mycoplasmas among pigs , their participation in a reproductive pathology, and also in the pre-natal 54,1%) and postnatal (55,8%) is shown their destruction.
МИКОПЛАЗМЕННАЯ ИНФЕКЦИЯ У СВИНЕЙ
Л.И. ЕФАНОВА, кандидат ветеринарных наук, зав. лабораторией
А.В. СТЕПАНОВ, кандидат биологических наук, старший научный сотрудник
М.М. СВИРИДОВ, кандидат биологических наук, старший научный сотрудник
О.А. МАНЖУРИНА, кандидат ветеринарных наук, ведущий научный сотрудник
ВНИВИ патологии, фармакологии и терапии Рос-сельхозакадемии
Резюме. Представлены результаты ретроспективного мониторинга циркуляции патогенных микоплазм у свиней, проведенного методами иммуноферментного анализа и полимеразноцепной реакции, в 26 свиноводческих хозяйствах Белгородской, Воронежской, Курской, Липецкой, Мурманской, Орловской, Ростовской, Рязанской, Тамбовской и Ярославской областей. Исследованы биологические пробы (сыворотка крови, сперма и влагалищные смывы) и патматериал (мертворожденные, павшие и вынужденно убитые животные), полученные от свиней различных технологических групп и возраста (хряки, свиноматки, поросята до 1, 2-х, 3-х и старше 3-х месячного возраста, ремонтные свинки). Установлена широкая циркуляция патогенных микоплазм (96, 2 %), в том числе Mycoplasma hyopneumoniae (88,5 %) в обследованных свиноводческих хозяйствах. ДНК патогенных микоплазм выделяли из патматериала от поросят 2. 3-х месячного возраста (60. 85 %), реже от поросят до 1-го и старше 3-х месячного возраста, ремонтных свинок - 30.47 %, а также из влагалищных смывов свиноматок с репродуктивной патологией (9,1 %) и спермы хряков (2 %). Антитела к Mycoplasma hyopneumoniae обнаружены в сыворотках крови 43,2 % хряков, 56 % свиноматок, 27,7 % ремонтных свинок; 43,8 % поросят до 1 месяца, 66 % молодняка от 2-х до 3-х месяцев и 33,2 % животных старше 3-хмесяцев. Патогенные микоплазмы среди свиней передаются вертикальным и горизонтальным путем, участвуют в репродуктивной патологии, а также в пренатальной (54,1 %) и постнатальной (55,8 %) гибели животных.
Ключевые слова: свиньи, микоплазменная инфекция, иммуно-ферментный анализ, полимеразная цепная реакция.
Микоплазменная инфекция у свиней широко распространена в странах с развитым свиноводством и служит одной из причин экономических потерь при производстве мяса этого вида животных. Ущерб от заболевания связан с затратами на лечение, снижением производственных показателей у поросят на доращивании и откорме, более низкой рыночной ценой туши при реализации. Занос патогенных микоплазм в благополучные хозяйства происходит преимущественно с инфицированным поголовьем и спермой при нарушении карантинных мероприятий и требований к хозяйствам поставщикам [4,5,7].
В этиологии микоплазмоза свиней принимают участие M.suis, M.hyopneumoniae, M.hyosynoviae, M.hyorhinis, M.granularum, M.fermentas и M.pneumoniae, вызывающие поражение эпителиальных клеток у животных с развитием респираторной патологии, артритов, серозитов и оказывающие иммуносупресивное действие. Тяжесть заболевания и спектр его клинических проявлений в большей степени обусловлены не только вирулентностью самих микоплазм, но и ассоциативным характером инфекции, а также иммунологическим потенциалом организма [4,6].
Достижения науки и техники АПК, №1-2012 __
Основная форма взаимодействия микоплазм и макрор-ганизма - длительная персистенция патогена, что приводит к развитию хронических рецидивирующих инфекций. Микоплазмы идеально приспособлены к персистенции, благодаря своим биологическим свойствам. Отсутствие клеточной стенки, адсорбция на эпителиальных клетках и клетках крови, способствует их дессиминации и сохранению в наиболее благоприятных нишах. С другой стороны, внутриклеточное сосредоточение делает микоплазмы менее доступными для антител и комплемента [8].
В последние годы в связи интенсивным развитием промышленного свиноводства в нашей стране, ввозом большого количества животных и их биологического материала, борьба со смешанными вирусно-бактериальными инфекциями с участием микоплазм приобретает все большее значение для отрасли. В медицине и ветеринарии достаточно широко используют современные методы молекулярной биологии, в частности ПЦР-диагностику, которая позволяет получать результаты в течение одного рабочего дня, отличается высокой чувствительностью (30.. .100 копий генома микоплазм в исследуемой пробе) и максимальной специфичностью анализа [2].
Цель наших исследований - изучить широтуциркуляции патогенных микоплазм у свиней разных технологических групп с использованием современныхметодов диагностики
- полимеразной цепной реакции (ПЦР) и иммуноферментного анализа (ИФА).
Условия, материалы и методы. В ходе исследований мы провели ретроспективное обследование на микоплаз-менную инфекцию 26 свиноводческих хозяйств Белгородской, Воронежской, Курской, Липецкой, Мурманской, Орловской, Ростовской, Рязанской, Тамбовской и Ярославской областей. Материалами служили биологические пробы (сыворотка крови, сперма и влагалищные смывы) и патматериал (мертворожденные, павшие и вынужденно убитые животные) полученные от свиней различных технологических групп и возраста (хряки, свиноматки, поросята до 1, 2-х, 3-х и старше 3-х месячного возраста, ремонтные свинки). Всего было изучено 519 проб.
Полученные количественные показатели обрабатывали методами вариационной статистики с использованием стандартного пакета статистических программ Windows (StatSoft).
Результаты и обсуждение. Мы установили, что во всех обследованных хозяйствах циркулируют патогенные микоплазмы. В 25 (96,2 %) предприятиях был выделен геном патогенных микоплазм и в 23 (88,5 %) - специфические антитела к M.hyo. Это свидетельствует не только о широкой циркуляции патогенных микоплазм в свиноводческих хозяйствах, но и о значительной роли в развитии инфекции M.hyopneumoniae.
Анализ выделения ДНК патогенных микоплазм из биологических образцов от свиней, отобранных в разных технологических группах, показал (см. рисунок), что наиболее часто они определяются в патматериале от поросят
иммунологической недостаточности у этой части поросят (уровень серопозитивности свиноматок - 56,1 %). Наличие ДНК патогенных микоплазм во влагалищных смывах, абортированных плодах и патматериале от поросят до месячного возраста указывает на их участие в репродуктивной патологии свиней и вертикальной передаче.
Исследование методом ПЦР образцов патматериала от абортированных плодов (пренатальная смертность, n=45) и от погибших свиней разных возрастных групп (постнатальная смертность, n=138) показало наличие ДНК патогенных микоплазм соответственно в 54,1 % и 55,8 % случаев, что дает возможность предполагать широкое участие патогенных микоплазм, как в пренатальной, так и постнатальной смертности свиней.
Выводы. Таким образом, результаты молекулярногенетического и серологического исследований, эпи-зоотологического анализа ситуации в свиноводческих хозяйствах, указывают на широкую циркуляцию патогенных микоплазм среди свиней и их участие в пре- и постнатальной смертности. Основные пути передачи
- вертикальный и горизонтальный. Главный источник микоплазменной инфекции в хозяйствах - свиноматки, у которых патогенные микоплазмы участвуют в развитии репродуктивных нарушений , что приводит к инфициро-ванности поросят-сосунов и дальнейшему распространению микоплазменной инфекции среди них на фоне угасания колострального иммунитета. Наиболее подвержены инфицированию поросята от рождения до 3-х месяцев, заражение которых происходит внутриутробно, во время родов и в подсосный период.
В связи с широкой циркуляцией патогенных микоплазм в свиноводческих хозяйствах необходима организация плановых комплексных лабораторных исследований на микоплазмоз, включающих молекулярно-генетический и серологический мониторинг всех технологических групп животных для определения стратегии проведения лечебно-профилактиких и санитарных мероприятий.
1. Ефанова Л.И., Манжурина О.А., Давыдова В.В., Рубцова Ю.А., Адодина М.И., Фролова Т.А. Характер инфекционной патологии у поросят и безопасность использования для них кормов. //Труды МНПК ВИЭВ г.Москва, 2011. - С. 175-179.
2. Малкова Е.М., Гришаева О.Н. Диагностика внутриутробных инфекций у новорожденных детей методом полимеразной цепной реакции. // Методические рекомендации для врачей (Под ред. Помогаевой А.П.). Томск, Кольцово, 2004. - С. 38.
3. Ефанова Л.И., Давыдова В.В., Рубцова Ю.А., Рубцова Ю.А., Пасько Н.В., Адодина М.И. Характер контаминации спермы хряков, половых путей больных эндометритом свиноматок и абортированных плодов. //Труды МНПК посвященной 100-летию
В.А. Акатова. Воронеж, 2009. - С. 157-164.
4. Микоплазмы в патологии животных //Под ред. Г.Ф.Коромыслова, Я.Месарома, Л.Штипковича. - М.Агропромиздат. -1987. - С. 255.
5. Fano E., Pijoan C., Dee S. Effect of Mycoplasma hyopneumoniae colonization at weaning on disease severity in growing pigs. // Canadian Journal of Veterinary Research. - 2007. - V. 71. - P. 195-200.
6. Meyns T., Maes D., Dewulf J., Vicca J., Haesebrouck F., De Kruif A. Quantification of the spread of Mycoplasma hyopneumoniae in nursery pigs using transmission experiments. //Preventive Veterinary Medicine. - 2004. - V. 66. - P. 265-275.
7. Sibila M., Nofrarias M., Lopez-Soria S. Exploratory field study on Mycoplasma hyopneumoniae infection in suckling pigs. //Veterinary Microbiology. - 2007. - V. 121. - P. 352-356.
8. Baseman J., Tully J. (1997): Colonization of humans by Mycoplasma canis. // Emer.Infect.Dis. - 1997. - V. 3. - P. 21-32.
MYCOPLASMA INFECTION IN PIGS L.I. Efanova, A.V. Stepanov, M.M. Sviridov, О.А. Manzhurina
Summary. All-Russian Veterinary Pathology Pharmacology and Therapy Research Institute Results of retrospective monitoring of circulation of pathogenic mycoplasmas at the pigs, spent by methods enzyme immunoassay and polimerazno chain reaction, in 26 pig-breeding economy of the Belgorod, Voronezh, Kursk, Lipetsk, Murmansk, Oryol, Rostov, Ryazan, Tambov and Yaroslavl areas are presented. Biological tests (blood whey, sperm and vaginal washouts) and рathological material (deadborn, fallen and forcedly killed animals) received from pigs of various technological groups and age (male pigs, sows, pigs to 1, 2, 3 and are more senior 3 monthly age, repair pigs) are investigated. Wide circulation of pathogenic mycoplasmas (96,2%), including Mycoplasma hyopneumoniae (88,5%) in the surveyed pig-breeding economy is established. DNA of pathogenic mycoplasmas was allocated from рathological material from pigs 2 - 3 monthly age (60-85%), is more rare from pigs to 1st and is more senior 3 monthly age and repair pigs - 30-47%, and also from vaginal washouts of sows with a reproductive pathology (9,1%) and sperms of male pigs (2%). Antibodies to Mycoplasma hyopneumoniae were found out in whey of blood in male pigs - 43,2%, sows - 56%, repair pigs - 27,7%; pigs till 1 month - 43,8%, from 1 about 2 months - 0%, from 2 about 3 months - 66% also are more senior 3 months - 33,2%. Vertical and horizontal transfer of pathogenic mycoplasmas among pigs, their participation in a reproductive pathology, and also in the pre-natal 54,1%) and postnatal (55,8%) is shown their destruction.
Key words: pigs, mycoplasma infection, enzyme immunoassay, polymerase chain reaction.
Рисунок. Выявление генома микоплазм (ПЦР) и специфических антител к М.Ьіуо (ИФА) у разных технологических групп свиней: □ - ПЦР - патматериал, сперма, влагалищные смывы; ■ - ИФА - сыворотка крови
2. 3-месячного возраста (60. 85 %), реже от поросят до 1-го и старше 3-х месячного возраста, ремонтных свинок -30.47 %. Высок уровень выявления патогенных микоплазм из абортированных плодов (44,6 %, против 9,1 % - во влагалищных смывах от свиноматок с признаками репродуктивной патологии). В наименьшей степени контаминирована микоплазмами сперма хряков (2 %), причем их ДНК выделена только у производителей из одного хозяйства.
С другой стороны, при выявлении антител к М.ґіуо в сыворотках крови методом ИФА, уровень серопозитивности у хряков составил 43,2 %, свиноматок - 56, ремонтных свинок - 27,7, поросят до 1 месяца - 43,8, 1.2 месяцев - 0, 2.3 месяцев - 66, старше 3 месяцев - 33,2 %.
Полученные результаты указывают на интенсивную циркуляцию возбудителя микоплазменной инфекции в хозяйствах среди свиней от рождения до 3-х месячного возраста. Наличие антител у поросят до 1 месяца и их отсутствие у животных 1. 2 месяцев указывает на коло-стральное происхождение антител у новорожденных поросят. Рост в этот же период выделения ДНК патогенных микоплазм из патматериала, на наш взгляд, свидетельствует об активизации инфекционного процесса на фоне
Читайте также:


