Микоплазменный артрит у свиньи
Хотя микоплазма (Mycoplasma hyorhinis) представляет собой комменсал, она может вызвать серьезные внутренние заболевания через механизмы, которые до сих пор не до конца изучены.
Полисерозит и артрит являются главными тяжелыми заболеваниями, поражающими свиней, выкормивших поросят. Как правило, гемофилёз и стрептококк считаются главной причиной таких случаев поражения животных. Однако за последние годы было замечено, что микоплазма (М. hyorhinis) также играет роль в развитии полисерозита и артрита, увеличивая процент заболеваемости и смертности. Эту бактерию часто обнаруживают на свинофермах, связывая ее с поражением верхней части респираторного тракта свиней. Считается, что поросята инфицируются от свиноматок или от старших поросят. Хотя микоплазма hyorhinis представляет собой комменсал, она может вызвать серьезные внутренние заболевания через механизмы, которые до сих пор не до конца изучены. Как полагают, различие между породами, сопутствующие инфекции и определенные условия содержания усугубляют болезнь, способствуя ее прогрессированию.


Рис. 1. Хромота после отъема поросят от свиноматки – частый клинический признак, наблюдаемый при внутреннем поражении микоплазмой hyorhinis.
Клинически выявленные симптомы включают жар, одышку, хромоту, нежелание двигаться у поросят в возрасте от 3 до 15 недель (Рис. 1) Клинические симптомы и поражения были значительно выражены в результате экспериментальных прививок. Острые поражения характеризуются плевритом, фибринозным перикардитом и перитонитом (Рис.2). Хронические поражения характеризуются плевральными и перикардиальными спайками. В итоге микоплазма hyorhinis вызывает главным образом артрит, который зачастую поражает задние ноги поросят. Суставы могут содержать большее количество жидкости и фибрина, при этом синовиальная мембрана - утолщенная и красная. Грубые поражения и те, что наблюдались по гистопатологии, оказались идентичными поражениям, вызванным болезнью Глассера, поэтому требуется выполнить ПЦР-тест или попытку бактериальной изоляции, чтобы правильно диагностировать этиологию болезни и определить соответствующие антибиотики для лечения пострадавшего поголовья скота.
Рис. 2. Поражения полисерозитом, обнаруженные при системном заболевании микоплазмозом hyorhinis
Приблизительно 55% и 12% случаев заболевания полисерозитом и артритом, данные о которых были получены за 2010 г. Ветеринарной Диагностической Лабораторией Университета Миннесоты, были проверены и показали положительный результат ПЦР-теста на наличие микоплазмы hyorhinis. Эти данные доказывают влияние микоплазмы hyorhinis на процент заболеваемости и смертности свиноматок после отъема поросят. Роль микоплазмы hyorhinis как причины пневмонии не совсем понятна; однако, некоторые исследования выявили, что микоплазма hyorhinis чаще встречается по сравнению с пневмонией легких в отличие от нормальных легких. Несколько экспериментальных прививок гнотобиологическим поросятам совместно с усиливающими эффект приемами привели к умеренным пневмонических поражениям. По грубым подсчетам в 45% пневмонии легких ПЦР-тесты , проведенные Ветеринарной Диагностической Лабораторией Университета Миннесоты, показали наличие микоплазмы hyorhinis, но как оказывается, микоплазма hyorhinis играет второстепенную роль в случаях заболевания пневмонией.
Как диагностировать микоплазму hyorhinis?
Выявить микоплазму hyorhinis относительно легко, это зависит от цели анализа. Если цель заключается в отслеживании динамики колонизации микоплазмы hyorhinis на ферме, уместно сделать серию собранного материала в виде жидкости из ротовой полости, мазков из носовой полости или полости ротоглотки. у поросят с момента опороса до поставки на рынок (Рис. 3-4). Количество образцов и частота сбора материала для анализа определит чувствительность протокола наблюдения. Важно помнить, что выявление микоплазмы hyorhinis в каком-либо из этих образцов не является показателем заболевания, поскольку эта бактерия является комменсалом верхнего тракта поросенка. Понимание динамики колонизации существенно для определения идеального времени для осуществления вакцинации антибиотиками.
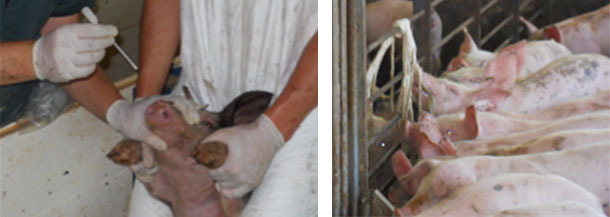
Рис. 4. Сбор ротовой жидкости у молочных поросят на выявление микоплазмы hyorhinis
С одной стороны, если цель заключается в определении является ли микоплазма причиной полисерозита или артрита, образцы тканей или мазков должны быть собраны с плевральных, перикардиальных или перитонеальных повреждений, где наличие агента не считается нормой. Ткань связок или синовиальная жидкость должны быть собраны в случае артрита. Образцы должны быть собраны у поросят в стадии обострения, не под воздействием антибиотиков. Все образцы должны быть заморожены и немедленно отправлены в диагностическую лабораторию для обработки.
За короткий период времени можно достичь изолирования микоплазмы hyorhinis в модифицированной среде для микоплазм Хейфлика (бульоне с агаром). Колонии наблюдают на сухой площадке 4-15 дней после засева. На данном этапе не существует общедоступных иммунологических исследований, посвященных микоплазме hyorhinis. Опубликован ряд протоколов ПЦР о ДНК микоплазмы hyorhinis; тем не менее, они не в состоянии подсчитать количество ДНК бактерий в образце, так как были разработаны в основном для выявления микоплазмы hyorhinis в клеточных культурах, поскольку эта бактерия является обычным загрязняющим веществом клетки.
Лечение и контроль
Микоплазма hyorhinis восприимчива к линкомицину, клиндамицину, фуральтадону, канамицину и всем сульфонамидам. Поскольку микоплазмы не имеют клеточной стенки, пенициллины и цефалоспорины не оказывают влияния на этого патогенна. Управление курсом лечения до или сразу после может способствовать успешному лечению антибиотиками. Информация об эффективности антибиотиков в условиях данного контекста не представляется доступной. На данном этапе нет распространенных общедоступных вакцин. Ветеринары говорят о пользе автогенных вакцин, однако, эффективность этих продуктов еще не была оценена. Предотвращение сопутствующих инфекций (таких, как вирус гриппа и вирус РРСС) могут помочь сократить системное распространение микоплазмы hyorhinis.
Аннотация научной статьи по ветеринарным наукам, автор научной работы — Ефанова Л. И., Степанов А. В., Свиридов М. М., Манжурина О. А.
Представлены результаты ретроспективного мониторинга циркуляции патогенных микоплазм у свиней , проведенного методами иммуноферментного анализа и полимеразноцепной реакции, в 26 свиноводческих хозяйствах Белгородской, Воронежской, Курской, Липецкой, Мурманской, Орловской, Ростовской, Рязанской, Тамбовской и Ярославской областей. Исследованы биологические пробы (сыворотка крови, сперма и влагалищные смывы) и патматериал (мертворожденные, павшие и вынужденно убитые животные), полученные от свиней различных технологических групп и возраста (хряки, свиноматки, поросята до 1, 2-х, 3-х и старше 3-х месячного возраста, ремонтные свинки). Установлена широкая циркуляция патогенных микоплазм (96, 2 %), в том числе Mycoplasma hyopneumoniae (88,5 %) в обследованных свиноводческих хозяйствах. ДНК патогенных микоплазм выделяли из патматериала от поросят 2.3-х месячного возраста (60. 85 %), реже от поросят до 1-го и старше 3-х месячного возраста, ремонтных свинок 30.47 %, а также из влагалищных смывов свиноматок с репродуктивной патологией (9,1 %) и спермы хряков (2 %). Антитела к Mycoplasma hyopneumoniae обнаружены в сыворотках крови 43,2 % хряков, 56 % свиноматок, 27,7 % ремонтных свинок; 43,8 % поросят до 1 месяца, 66 % молодняка от 2-х до 3-х месяцев и 33,2 % животных старше 3-х месяцев. Патогенные микоплазмы среди свиней передаются вертикальным и горизонтальным путем, участвуют в репродуктивной патологии, а также в пренатальной (54,1 %) и постнатальной (55,8 %) гибели животных.
Похожие темы научных работ по ветеринарным наукам , автор научной работы — Ефанова Л. И., Степанов А. В., Свиридов М. М., Манжурина О. А.
MYCOPLASMA INFECTION IN PIGS
All-Russian Veterinary Pathology Pharmacology and Therapy Research Institute Results of retrospective monitoring of circulation of pathogenic mycoplasmas at the pigs , spent by methods enzyme immunoassay and polimerazno chain reaction, in 26 pig-breeding economy of the Belgorod, Voronezh, Kursk, Lipetsk, Murmansk, Oryol, Rostov, Ryazan, Tambov and Yaroslavl areas are presented. Biological tests (blood whey, sperm and vaginal washouts) and рathological material (deadborn, fallen and forcedly killed animals) received from pigs of various technological groups and age (male pigs , sows, pigs to 1, 2, 3 and are more senior 3 monthly age, repair pigs ) are investigated. Wide circulation of pathogenic mycoplasmas (96,2%), including Mycoplasma hyopneumoniae (88,5%) in the surveyed pig-breeding economy is established. DNA of pathogenic mycoplasmas was allocated from рathological material from pigs 2 3 monthly age (60-85%), is more rare from pigs to 1st and is more senior 3 monthly age and repair pigs 30-47%, and also from vaginal washouts of sows with a reproductive pathology (9,1%) and sperms of male pigs (2%). Antibodies to Mycoplasma hyopneumoniae were found out in whey of blood in male pigs 43,2%, sows 56%, repair pigs 27,7%; pigs till 1 month 43,8%, from 1 about 2 months 0%, from 2 about 3 months 66% also are more senior 3 months 33,2%. Vertical and horizontal transfer of pathogenic mycoplasmas among pigs , their participation in a reproductive pathology, and also in the pre-natal 54,1%) and postnatal (55,8%) is shown their destruction.
МИКОПЛАЗМЕННАЯ ИНФЕКЦИЯ У СВИНЕЙ
Л.И. ЕФАНОВА, кандидат ветеринарных наук, зав. лабораторией
А.В. СТЕПАНОВ, кандидат биологических наук, старший научный сотрудник
М.М. СВИРИДОВ, кандидат биологических наук, старший научный сотрудник
О.А. МАНЖУРИНА, кандидат ветеринарных наук, ведущий научный сотрудник
ВНИВИ патологии, фармакологии и терапии Рос-сельхозакадемии
Резюме. Представлены результаты ретроспективного мониторинга циркуляции патогенных микоплазм у свиней, проведенного методами иммуноферментного анализа и полимеразноцепной реакции, в 26 свиноводческих хозяйствах Белгородской, Воронежской, Курской, Липецкой, Мурманской, Орловской, Ростовской, Рязанской, Тамбовской и Ярославской областей. Исследованы биологические пробы (сыворотка крови, сперма и влагалищные смывы) и патматериал (мертворожденные, павшие и вынужденно убитые животные), полученные от свиней различных технологических групп и возраста (хряки, свиноматки, поросята до 1, 2-х, 3-х и старше 3-х месячного возраста, ремонтные свинки). Установлена широкая циркуляция патогенных микоплазм (96, 2 %), в том числе Mycoplasma hyopneumoniae (88,5 %) в обследованных свиноводческих хозяйствах. ДНК патогенных микоплазм выделяли из патматериала от поросят 2. 3-х месячного возраста (60. 85 %), реже от поросят до 1-го и старше 3-х месячного возраста, ремонтных свинок - 30.47 %, а также из влагалищных смывов свиноматок с репродуктивной патологией (9,1 %) и спермы хряков (2 %). Антитела к Mycoplasma hyopneumoniae обнаружены в сыворотках крови 43,2 % хряков, 56 % свиноматок, 27,7 % ремонтных свинок; 43,8 % поросят до 1 месяца, 66 % молодняка от 2-х до 3-х месяцев и 33,2 % животных старше 3-хмесяцев. Патогенные микоплазмы среди свиней передаются вертикальным и горизонтальным путем, участвуют в репродуктивной патологии, а также в пренатальной (54,1 %) и постнатальной (55,8 %) гибели животных.
Ключевые слова: свиньи, микоплазменная инфекция, иммуно-ферментный анализ, полимеразная цепная реакция.
Микоплазменная инфекция у свиней широко распространена в странах с развитым свиноводством и служит одной из причин экономических потерь при производстве мяса этого вида животных. Ущерб от заболевания связан с затратами на лечение, снижением производственных показателей у поросят на доращивании и откорме, более низкой рыночной ценой туши при реализации. Занос патогенных микоплазм в благополучные хозяйства происходит преимущественно с инфицированным поголовьем и спермой при нарушении карантинных мероприятий и требований к хозяйствам поставщикам [4,5,7].
В этиологии микоплазмоза свиней принимают участие M.suis, M.hyopneumoniae, M.hyosynoviae, M.hyorhinis, M.granularum, M.fermentas и M.pneumoniae, вызывающие поражение эпителиальных клеток у животных с развитием респираторной патологии, артритов, серозитов и оказывающие иммуносупресивное действие. Тяжесть заболевания и спектр его клинических проявлений в большей степени обусловлены не только вирулентностью самих микоплазм, но и ассоциативным характером инфекции, а также иммунологическим потенциалом организма [4,6].
Достижения науки и техники АПК, №1-2012 __
Основная форма взаимодействия микоплазм и макрор-ганизма - длительная персистенция патогена, что приводит к развитию хронических рецидивирующих инфекций. Микоплазмы идеально приспособлены к персистенции, благодаря своим биологическим свойствам. Отсутствие клеточной стенки, адсорбция на эпителиальных клетках и клетках крови, способствует их дессиминации и сохранению в наиболее благоприятных нишах. С другой стороны, внутриклеточное сосредоточение делает микоплазмы менее доступными для антител и комплемента [8].
В последние годы в связи интенсивным развитием промышленного свиноводства в нашей стране, ввозом большого количества животных и их биологического материала, борьба со смешанными вирусно-бактериальными инфекциями с участием микоплазм приобретает все большее значение для отрасли. В медицине и ветеринарии достаточно широко используют современные методы молекулярной биологии, в частности ПЦР-диагностику, которая позволяет получать результаты в течение одного рабочего дня, отличается высокой чувствительностью (30.. .100 копий генома микоплазм в исследуемой пробе) и максимальной специфичностью анализа [2].
Цель наших исследований - изучить широтуциркуляции патогенных микоплазм у свиней разных технологических групп с использованием современныхметодов диагностики
- полимеразной цепной реакции (ПЦР) и иммуноферментного анализа (ИФА).
Условия, материалы и методы. В ходе исследований мы провели ретроспективное обследование на микоплаз-менную инфекцию 26 свиноводческих хозяйств Белгородской, Воронежской, Курской, Липецкой, Мурманской, Орловской, Ростовской, Рязанской, Тамбовской и Ярославской областей. Материалами служили биологические пробы (сыворотка крови, сперма и влагалищные смывы) и патматериал (мертворожденные, павшие и вынужденно убитые животные) полученные от свиней различных технологических групп и возраста (хряки, свиноматки, поросята до 1, 2-х, 3-х и старше 3-х месячного возраста, ремонтные свинки). Всего было изучено 519 проб.
Полученные количественные показатели обрабатывали методами вариационной статистики с использованием стандартного пакета статистических программ Windows (StatSoft).
Результаты и обсуждение. Мы установили, что во всех обследованных хозяйствах циркулируют патогенные микоплазмы. В 25 (96,2 %) предприятиях был выделен геном патогенных микоплазм и в 23 (88,5 %) - специфические антитела к M.hyo. Это свидетельствует не только о широкой циркуляции патогенных микоплазм в свиноводческих хозяйствах, но и о значительной роли в развитии инфекции M.hyopneumoniae.
Анализ выделения ДНК патогенных микоплазм из биологических образцов от свиней, отобранных в разных технологических группах, показал (см. рисунок), что наиболее часто они определяются в патматериале от поросят
иммунологической недостаточности у этой части поросят (уровень серопозитивности свиноматок - 56,1 %). Наличие ДНК патогенных микоплазм во влагалищных смывах, абортированных плодах и патматериале от поросят до месячного возраста указывает на их участие в репродуктивной патологии свиней и вертикальной передаче.
Исследование методом ПЦР образцов патматериала от абортированных плодов (пренатальная смертность, n=45) и от погибших свиней разных возрастных групп (постнатальная смертность, n=138) показало наличие ДНК патогенных микоплазм соответственно в 54,1 % и 55,8 % случаев, что дает возможность предполагать широкое участие патогенных микоплазм, как в пренатальной, так и постнатальной смертности свиней.
Выводы. Таким образом, результаты молекулярногенетического и серологического исследований, эпи-зоотологического анализа ситуации в свиноводческих хозяйствах, указывают на широкую циркуляцию патогенных микоплазм среди свиней и их участие в пре- и постнатальной смертности. Основные пути передачи
- вертикальный и горизонтальный. Главный источник микоплазменной инфекции в хозяйствах - свиноматки, у которых патогенные микоплазмы участвуют в развитии репродуктивных нарушений , что приводит к инфициро-ванности поросят-сосунов и дальнейшему распространению микоплазменной инфекции среди них на фоне угасания колострального иммунитета. Наиболее подвержены инфицированию поросята от рождения до 3-х месяцев, заражение которых происходит внутриутробно, во время родов и в подсосный период.
В связи с широкой циркуляцией патогенных микоплазм в свиноводческих хозяйствах необходима организация плановых комплексных лабораторных исследований на микоплазмоз, включающих молекулярно-генетический и серологический мониторинг всех технологических групп животных для определения стратегии проведения лечебно-профилактиких и санитарных мероприятий.
1. Ефанова Л.И., Манжурина О.А., Давыдова В.В., Рубцова Ю.А., Адодина М.И., Фролова Т.А. Характер инфекционной патологии у поросят и безопасность использования для них кормов. //Труды МНПК ВИЭВ г.Москва, 2011. - С. 175-179.
2. Малкова Е.М., Гришаева О.Н. Диагностика внутриутробных инфекций у новорожденных детей методом полимеразной цепной реакции. // Методические рекомендации для врачей (Под ред. Помогаевой А.П.). Томск, Кольцово, 2004. - С. 38.
3. Ефанова Л.И., Давыдова В.В., Рубцова Ю.А., Рубцова Ю.А., Пасько Н.В., Адодина М.И. Характер контаминации спермы хряков, половых путей больных эндометритом свиноматок и абортированных плодов. //Труды МНПК посвященной 100-летию
В.А. Акатова. Воронеж, 2009. - С. 157-164.
4. Микоплазмы в патологии животных //Под ред. Г.Ф.Коромыслова, Я.Месарома, Л.Штипковича. - М.Агропромиздат. -1987. - С. 255.
5. Fano E., Pijoan C., Dee S. Effect of Mycoplasma hyopneumoniae colonization at weaning on disease severity in growing pigs. // Canadian Journal of Veterinary Research. - 2007. - V. 71. - P. 195-200.
6. Meyns T., Maes D., Dewulf J., Vicca J., Haesebrouck F., De Kruif A. Quantification of the spread of Mycoplasma hyopneumoniae in nursery pigs using transmission experiments. //Preventive Veterinary Medicine. - 2004. - V. 66. - P. 265-275.
7. Sibila M., Nofrarias M., Lopez-Soria S. Exploratory field study on Mycoplasma hyopneumoniae infection in suckling pigs. //Veterinary Microbiology. - 2007. - V. 121. - P. 352-356.
8. Baseman J., Tully J. (1997): Colonization of humans by Mycoplasma canis. // Emer.Infect.Dis. - 1997. - V. 3. - P. 21-32.
MYCOPLASMA INFECTION IN PIGS L.I. Efanova, A.V. Stepanov, M.M. Sviridov, О.А. Manzhurina
Summary. All-Russian Veterinary Pathology Pharmacology and Therapy Research Institute Results of retrospective monitoring of circulation of pathogenic mycoplasmas at the pigs, spent by methods enzyme immunoassay and polimerazno chain reaction, in 26 pig-breeding economy of the Belgorod, Voronezh, Kursk, Lipetsk, Murmansk, Oryol, Rostov, Ryazan, Tambov and Yaroslavl areas are presented. Biological tests (blood whey, sperm and vaginal washouts) and рathological material (deadborn, fallen and forcedly killed animals) received from pigs of various technological groups and age (male pigs, sows, pigs to 1, 2, 3 and are more senior 3 monthly age, repair pigs) are investigated. Wide circulation of pathogenic mycoplasmas (96,2%), including Mycoplasma hyopneumoniae (88,5%) in the surveyed pig-breeding economy is established. DNA of pathogenic mycoplasmas was allocated from рathological material from pigs 2 - 3 monthly age (60-85%), is more rare from pigs to 1st and is more senior 3 monthly age and repair pigs - 30-47%, and also from vaginal washouts of sows with a reproductive pathology (9,1%) and sperms of male pigs (2%). Antibodies to Mycoplasma hyopneumoniae were found out in whey of blood in male pigs - 43,2%, sows - 56%, repair pigs - 27,7%; pigs till 1 month - 43,8%, from 1 about 2 months - 0%, from 2 about 3 months - 66% also are more senior 3 months - 33,2%. Vertical and horizontal transfer of pathogenic mycoplasmas among pigs, their participation in a reproductive pathology, and also in the pre-natal 54,1%) and postnatal (55,8%) is shown their destruction.
Key words: pigs, mycoplasma infection, enzyme immunoassay, polymerase chain reaction.
Рисунок. Выявление генома микоплазм (ПЦР) и специфических антител к М.Ьіуо (ИФА) у разных технологических групп свиней: □ - ПЦР - патматериал, сперма, влагалищные смывы; ■ - ИФА - сыворотка крови
2. 3-месячного возраста (60. 85 %), реже от поросят до 1-го и старше 3-х месячного возраста, ремонтных свинок -30.47 %. Высок уровень выявления патогенных микоплазм из абортированных плодов (44,6 %, против 9,1 % - во влагалищных смывах от свиноматок с признаками репродуктивной патологии). В наименьшей степени контаминирована микоплазмами сперма хряков (2 %), причем их ДНК выделена только у производителей из одного хозяйства.
С другой стороны, при выявлении антител к М.ґіуо в сыворотках крови методом ИФА, уровень серопозитивности у хряков составил 43,2 %, свиноматок - 56, ремонтных свинок - 27,7, поросят до 1 месяца - 43,8, 1.2 месяцев - 0, 2.3 месяцев - 66, старше 3 месяцев - 33,2 %.
Полученные результаты указывают на интенсивную циркуляцию возбудителя микоплазменной инфекции в хозяйствах среди свиней от рождения до 3-х месячного возраста. Наличие антител у поросят до 1 месяца и их отсутствие у животных 1. 2 месяцев указывает на коло-стральное происхождение антител у новорожденных поросят. Рост в этот же период выделения ДНК патогенных микоплазм из патматериала, на наш взгляд, свидетельствует об активизации инфекционного процесса на фоне
Развитие животноводства предусматривает большие требования к ветеринарным специалистам, диктует необходимость все время быть в курсе современных достижений науки и передовой практики по всем вопросам лечебной и профилактической работы, в частности по вопросам фармакотерапии и фармакопрофилактики.
Эффективные мероприятия по предупреждению заболеваний животных и оказанию заболевшим своевременной научно обоснованной помощи возможны при проведении хорошо разработанных и апробированных передовой практикой животноводства лечебно-профилактических схем.
Рациональное лечение должно быть строго индивидуальным, с учетом всех особенностей больного животного, характера патологического процесса, условий его содержания и т.д. Знания в области терапии приобретаются и совершенствуются только при постоянной практической работе и систематическом изучении передовых достижений в разработке новых лекарственных средств.
Успех фармакотерапии во многом зависит от выбора врачом соответствующего лекарственного препарата и комплексного применения его с сопутствующими лекарственными средствами.
Наукой разработаны и предложены лекарственные препараты, а практикой - схемы лечения и профилактики, дающие наивысший эффект в отношении тех или иных болезней. В то же время, результаты последних научных разработок, представленные в виде статей в ведущих журналах, не всегда доступны работникам практической ветеринарии. Информация о новых разработках крайне необходима как молодому начинающему ветеринарному врачу, так и опытному специалисту, а также студентам, изучающим ветеринарную медицину. В связи с этим, издание данного методического пособия является своевременным и актуальным.
В зарубежной ветеринарной практике тиамулин широко используется для лечения и профилактики у свиней и птицы респираторных и кишечных заболеваний (дизентерия, пневмония, микоплазмозы и др.). Известно, что терапевтическая эффективность тиамулина у животных при микоплазмозном поражении значительно выше, чем у макролидов, спирамицинов, тетрациклинов.
Тиамулин является полусинтетическим антибиотиком, производным плевромутилина, одним из немногих представителей уникальной дитерпеновой группы с высокой противомикробной активностью по отношению к микрофлоре, устойчивой к другим антибиотикам и безопасным для организма животных.
Рис. 1 – Строение молекулы тиамулина
Впервые тиамулин был обнаружен при исследовании противомикробной активности близкого родственника гриба вешенки, а в 1979 году был утвержден за рубежом для использования в ветеринарной практике и на протяжении многих лет относился к группе макролидов из-за некоторых общих с ними свойств. Позже плевромутилины были выделены в отдельную группу антибиотиков и в настоящее время, кроме тиамулина, в нее входят также валнемулин (утвержден для использования в ветеринарной практике в 1999г.) и ретапамулин, первый представитель этой группы, используемый в медицине.
Тиамулин более растворим в жирах, чем макролиды и даже линкозамиды (например, линкомицин). Клетки, выстилающие кишечник и кровеносные сосуды, а также стенки бактериальных организмов примерно на 80% состоят из жира или липидов, поэтому тиамулин в большей степени всасывается из кишечника и глубже проникает в бактериальные клетки, чем любой из макролидов. За счёт повышенной жирорастворимости Тиамулин имеет высокую активность в отношении возбудителей микоплазменной этиологии.
Механизм действия тиамулина, как и других плевромутилинов и макролидов, на микробную клетку обусловлен подавлением синтеза протеинов бактерий путем связывания с 70 S- субъединиц рибосом микроорганизмов и нарушения процесса формирования комплекса "мРНК-тРНК".
Особенности строения молекул тиамулина приводят к повышенной лабильности, склонности к изомеризации, циклизации и полимеризации. Изомеризация и трансформация нередко проходит в мягких условиях, под действием света, кислорода воздуха, паров воды и т.п.
Для предотвращения перечисленных выше химических процессов в препарате Тиалонг используют в качестве растворителя растительное масло, которое обеспечивает, кроме того, пролонгированное действие. Пролонгированными (от лат. Prolongore - удлинять) называются лекарственные формы с замедленным высвобождением. Вследствие замедления высвобождения лекарственного вещества обеспечивается увеличение продолжительности его действия. Основными достоинствами пролонгированных лекарственных форм являются: возможность снижения кратности применения, устранение раздражающего действия лекарственного вещества на организм, уменьшение проявления побочных эффектов.
Инъекционная форма препарата обеспечивает удобство в применении и способствует точному достижению терапевтической концентрации лекарственного средства. Действующее вещество – тиамулин, избирательно накапливается в легких и кишечнике. Это свойство позволяет весьма эффективно профилактировать, и лечить инфекции респираторной и желудочно-кишечных систем.
Благодаря масляной форме раствора эффективные терапевтические концентрации тиамулина сохраняются в легочной ткани более 48 часов, а в кишечнике - более 72 часов (рис. 2).
Рис. 2 - Фармакокинетика тиамулина в плазме крови,
легких и кишечнике.
После инъекции тиамулин быстро и полностью всасывается из места введения и проникает в большинство органов и тканей организма. Тиамулин подвергается биотрансформации в печени, выделяется с желчью и выводится из организма преимущественно с фекалиями, в меньших количествах с мочой. Период полувыведения составляет 3-6 часов. Также тиамулин хорошо всасывается из желудочно-кишечного тракта, достигая терапевтических концентраций в сыворотке крови в течение 30 минут и максимальной концентрации - через 2-3 часа после введения. В дельнейшем наблюдается постепенное снижение количества антибиотика и через 9 часов его уровень уменьшается почти в три раза (0,4-0,6 мкг/мл). Через 12 часов после введения препарата концентрация снова повышается до 0,7-0,9 мкг/мл, и затем плавно снижается до 0,2 мкг/мл через 24 часа. Появление второго подъема уровня тиамулина в крови связано с выделением антибиотика с желчью в кишечник и повторным его всасыванием в кровь.
При изучении субхронической токсичности препаратов на основе тиамулина в опыте на поросятах было установлено, что введение в терапевтической дозе с содержанием тиамулина 6,5 мг/кг в течение 1 месяца не оказывает негативного влияния на организм подопытных животных. Но учитывая, что наиболее чувствительными органами при передозировке препарата являются печень и почки, в случае развития патологии в этих органах следует назначать препараты тиамулина с осторожностью.
Препарат Тиалонг применяют для лечения свиней при энзоотической бронхопневмонии и микоплазменном артрите – 1,5 мл/12,5 кг массы тела однократно в течение 3 суток; при плевропневмонии, вызванной актинобациллюсом – 2,0 мл/12,5 кг массы тела однократно в течение 3 суток; при дизентерии, спирохетозе, энтероколите и пролиферативной энтеропатии в дозе 1,0 мл/12,5 кг массы тела животного однократно, в тяжёлых случаях инъекцию повторяют через 24 часа. В связи с возможной болевой реакцией при введении лекарственного средства в объеме, превышающем для взрослых свиней 5 мл, для поросят 2,5 мл, инъекции следует проводить в несколько мест.
Оценку клинического состояния поросят проводили на 1, 2, 3 и 7 сутки. Биохимические показатели плазмы крови оценивались с использованием биохимического анализатора Clima 15 фирмы RAL (Испания).
В качестве гомеостатических показателей состояния организма подопытных животных оценивали уровень белкового обмена: креатинин; маркерные ферменты: щелочная фосфатаза, аспартатаминотрансфераза, аланинаминотрансфераза; метаболиты: мочевина. Эти показатели состояния гомеостаза имеют большое значение при диагностике целого ряда патологических состояний, в том числе интоксикации.
Животным с диагнозом энтерит применяли препарат Тиалонг в дозе 1 мл/12,5 кг массы тела животного (м. т. ж.), однократно, внутримышечно. На третьи сутки после введения препарата у поросят отмечали полное клиническое выздоровление, что подтверждается результатами биохимического исследования.
После применения препарата регистрировали снижение активности аспартатаминотрансферазы, креатинина и мочевины до уровня физиологической нормы. Показатели аланинаминотрансферазы и щелочной фосфатазы до введения лекарственного средства были в 1,5 и 1,9 раза соответственно выше показателей нормы. К концу эксперимента наблюдали снижение значений вышеописанных ферментов на 3,4 ед/л и 108,8 ед/л соответственно, что позволяет говорить об уменьшении гепатотоксического состояния на фоне выздоровления животных, больных энтеритом.
У животных, больных бронхопневмонией, после внутримышечной инъекции препарата Тиалонг в дозе 1 мл/12,5 кг м. т. ж. 1 раз/день в течение трёх дней, наблюдали выздоровление поросят на шестой день. Исследования биохимических показателей сыворотки крови животных показали, что значения аспартатаминотрансферазы, мочевины и креатинина находятся в пределах значений физиологической нормы. Показатели аланинаминотрансферазы и щелочной фосфатазы до введения лекарственного средства были на 8,8 и 190,78 ед/л соответственно выше показателей нормы. К концу эксперимента наблюдали снижение значений вышеописанных ферментов на 3,85 и 98,13 ед/л соответственно, что позволяет говорить об уменьшении токсического состояния печени на фоне снижения деструктивных изменений при бронхопневмонии. Полученные результаты биохимического анализа крови подтверждают, что терапевтический эффект достигнут.
При внутримышечном введении препарата Тиалонг у поросят отсутствовали побочные явления, признаки беспокойства. Инфильтраты в месте инъекции не наблюдались.
Таким образом, применение препарата Тиалонг для терапии свиней, больных кишечными и респираторными заболеваниями, позволяет получить устойчивый терапевтический результат, и рекомендуется ветеринарным врачам в качестве высокоэффективного лекарственного средства.
ТИАЛОНГ – ЭФФЕКТИВНЫЙ ПРЕПАРАТ ПРИ ТЕРАПИИ НЕСПЕЦИФИЧЕСКОЙ БРОНХОПНЕВМОНИИ СВИНЕЙ
Респираторные заболевания свиней широко распространены и наносят свиноводству значительные экономические потери. Заболеваемость свиней болезнями органов дыхания составляет от 30 до 70% и более, а летальность достигает 40%. Одним из распространенных заболеваний дыхательной системы является бронхопневмония, которая возникает у свиней в возрасте от 60 до 150 дней и может охватывать до 90% поголовья животных. Экономический ущерб от этого заболевания складывается из снижения продуктивности, удлинения сроков откорма, увеличения расходов кормов, потерь от падежа и вынужденного убоя.
Система органов дыхания является одной из важнейших и многофункциональных систем организма и выполняет функции газообмена; иммунной защиты; поддержания баланса внутриклеточных гормонов - простагландинов.
В легочной ткани происходит: биохимическая коррекция веществ, участвующих в регуляции функции почек, обменных процессов, кровяного давления; дозревание молодых клеток крови (эритроцитов, моноцитов); синтез тромбопластина и гепарина; процесс липидного обмена, а также синтез фосфолипидов и глицерина. Легкие принимают непосредственное участие в водном обмене и в поддержании кислотно-основного состояния в организме.
Многочисленные отрицательные факторы внешней среды изменяют морфофункциональные процессы дыхательной системы, что приводит к возникновению патологий органов дыхания. На основании анализа причин респираторных заболеваний было разработано 6 различных вариантов классификации пневмонии. Учеными нашей страны разработана схема классификации пневмонии свиней, представленная П.И. Притулиным на Генеральной сессии Международного эпизоотического бюро в Париже (1974 г.), где она была одобрена к практическому применению (схема).
Предложенная классификация пневмонии используется и в настоящее время, тем самым облегчая диагностику, подбор эффективных методов лечения и профилактики данного заболевания, а также помогая прогнозировать возникновение этого заболевания у свиней.
Неспецифическая бронхопневмония - дольковое воспаление бронхов и легких, сопровождающееся образованием катарального экссудата и заполнением им просвета бронхов и полостей альвеол. Этиологией заболевания является несоблюдение зоогигиенических норм кормления и содержания.
При обследовании больных животных, условий их содержания и кормления установлено, что бронхопневмонией поражено, в среднем, не менее 65% свиней на откорме. Моцион свиней отсутствует, так как не предусмотрен технологией. Имеются нарушения в кормлении (замена отдельных кормов рациона происходит одномоментно), рацион не сбалансирован. Не работает система приточно-вытяжной вентиляции.
Выявленные нарушения в содержании и кормлении животных способствуют снижению естественной резистентности организма у свиней. В результате нарушается функция мерцательного эпителия и функция однослойного плоского эпителия, нарушается выработка сурфактанта.
Снижение защитной функции организма создает благоприятные условия для развития неспецифической бронхопневмонии, в отсутствии своевременной терапии принимающей затяжной характер.
Клинические признаки бронхопневмонии проявлялись: отказом от корма, в редких случаях рвотой; кашлем, чиханием, выделением слизи из носовых ходов; учащением пульса, дыхания до 47-53 движений в минуту; незначительным подъемом температуры тела на 0,5-0,7 °С; общим угнетением. Животные вяло реагировали на раздачу корма; у больных свиней наблюдали кифозное положение, отсутствие иерархической борьбы в группе, хаотичное передвижение животных по клетке. В период приступа кашля, особенно утром, наблюдали посинение пятачка, кончиков ушей, низа живота, копытец, а иногда в этот период наступала гибель животного. Через 2-3 дня у животных отмечали в основном абдоминальный тип дыхания. При аускультации легких прослушивали жесткое везикулярное дыхание. В передних участках прослушивали жесткое бронхиальное дыхание.
Первые клинические признаки болезни продолжались 7-9 дней, затем состояние животных несколько стабилизировалось (улучшилась реакция на корм, коротким по продолжительности становился кашель), но аппетит полностью не восстанавливался.
При вынужденном убое животных отмечали катаральное поражение легких у 95% животных (рис. 3), в основном верхушечных и срединных долей, а в 5-10% случаев отмечали крупозное поражение легких в той или иной стадии.
Рис. 3 - Катаральное воспаление лёгкого
крупного рогатого скота
В случае гибели при вскрытии отмечали тотальное поражение лёгкого (рис. 4), ателектазы и нередко фибринозный плеврит. Средостенные лимфатические узлы увеличены в размере, упругой консистенции, сочные, на разрезе серо-белого цвета.
Рис. 4 – Тотальное поражение лёгкого
Из многочисленных лабораторных исследований патологического материала (легкое, сердце, лимфоузлы, трубчатая кость, селезенка, печень), взятого от павших или вынужденно убитых свиней, лишь в одной пробе была выделена Pasteurella myltocida очень слабой степени вирулентности. Других сопутствующих специфических возбудителей не обнаружено, что подтверждает неспецифическую этиологию бронхопневмонии. В связи с отсутствием специфического возбудителя, путем дифференциальной диагностики, исключили симптоматическую и инфекционную бронхопневмонию (таблица 1).
Для исключения инфекционного начала заболевания дополнительно провели биологическую пробу больных и здоровых свиней в тех же условиях содержания. С этой целью провели подсадку 10 больных поросят к 10 здоровым животным одного возраста. Здоровые животные не заболели до конца откорма, что дополнительно подтвердило диагноз неспецифическая бронхопневмония.
В крови больных животных отмечали снижение эритроцитов, гемоглобина; увеличение количества лейкоцитов за счет юных и палочкоядерных нейтрофилов, а при затяжном течении количество лейкоцитов приближалось к норме, но увеличивалось количество эозинофилов; комплементарная и лизоцимная активность сыворотки была снижена.
Читайте также:


