Микробиологическая диагностика гонококковых инфекций
Возбудителем гонореи является Neisseria gonorrhoeaе, вызывающая острые и хронические воспалительные поражения мочеполовых органов, слизистой оболочки ротоглотки и конъюнктивы глаза.
Материалом для исследования является гнойное отделяемое мочеполовых органов, прямой кишки или конъюнктивы глаз (при бленорее), суставной и перитонеальный экссудат. Строго регламентированными методами лабораторной диагностики гонореи являются микроскопическое и бактериологическое (культуральное) исследование. Методы микробиологической диагностики гонореи отражены в схеме 18 .
Схема 18. Методы микробиологической диагностики гонореи
Микроскопический метод заключается в исследовании мазков из исследуемого материала, окрашенных по Граму и метиленовым синим. При окрашивании препаратов на гонорею используют модификацию метода Грама (краситель генциан-виолет заменяют кристал-виолетом, а вместо фуксина применяют нейтральный красный; промывку препарата осуществляют после каждого этапа окраски). В мазках при острой гонорее обнаруживают большое количество полиморфноядерных лейкоцитов, внутри и вне которых расположены бобовидные грамотрицательные диплококки; сопутствующая микрофлора либо минимальна, либо отсутствует вовсе (рис. 25). При хронической гонорее в ряде случаев типичный гонококк в мазках не выявляется, либо выглядит нетипично в виде мелких пылевидных или крупных шарообразных образований, нередко 2 клетки гонококка располагаются под углом друг к другу, при этом обнаруживается обильная сопутствующая микрофлора, лейкоциты, эпителиальные и другие клетки. В качестве экспресс-метода диагностики может использоваться ИФМ.
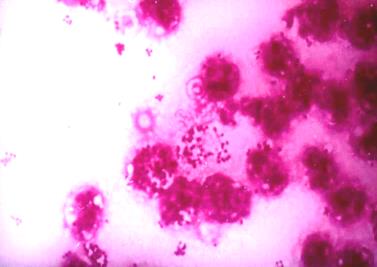
Рис. 25. Возбудитель гонореи(Neisseria gonorrhoeaе) в мазках из уретры больного острой гонореей. Внутри и внеклеточно расположенные грамотрцательные диплококки, обилие лейкоцитов.
Бактериологический метод.Гонококк отличается высокой чувствительностью к различным неблагоприятным факторам, поэтому культуральное исследование необходимо проводить сразу после отбора материала. Посев производят на специальные питательные среды. Основой этих сред является МПА из кроличьего мяса с добавлением дрожжевого аутолизата, гидролизата казеина или гемогидрализата и сыворотки крупного рогатого скота. Асцитическая жидкость и яичный желток в качестве добавок к среде для культивирования гонококка в настоящее время не применяются. Второй тип питательных сред является селективным и включает в свой состав, помимо вышеуказанных компонентов, антибиотики (полимиксин, линкомицин, а для диагностики фарингеальной гонореи – оротовую кислоту). Посевы выращивают при 37 0 С в течение 24-72 часов в атмосфере с повышенным содержанием СО2. Колонии гонококков круглые, прозрачные, в виде капелек росы. Типичные для гонококков колонии пересевают в пробирки со средой для культивирования гонококка для получения чистых культур, которые идентифицируют по морфологическим и сахаролитическим свойствам на средах "пестрого" ряда (полужидкий агар с сывороткой и углеводом) или с помощью микротест-систем. В мазках из чистых культур гонококки располагаются не попарно, а отдельно. В биохимическом отношении гонококки малоактивны и ферментируют только глюкозу с образованием кислоты, вырабатывают оксидазу. Для выявления оксидазы применяют пробу с 1% водным раствором диметилпарафенилендиамина или диэтилпарафенилендиамина, которые окрашивают колонии гонококка сначала в розовый, затем в красный, а через несколько минут – в черный цвет. Исследуют также чувствительность гонококков к антибиотикам и его бета-лактамазную активность.
Серологический метод (определение антител к гонококку в крови пациентов с помощью РСК и ИФА) не является строго регламентированным, не представляет диагностической ценности, не является методом контроля эффективности проводимого лечения и в реальной практике в настоящее время не используется.
Генодиагностика. Направлена на обнаружение специфических фрагментов ДНК гонококка с помощью ПЦР и может быть использована в качестве дополнительного высокоинформативного метода диагностики гонореи.
[youtube.player]Читайте также:
|
(подробнее см. в теме ЗППП)
Neisseria gonorrhoeae является возбудителем гонореи и бленнореи, лишь в редких случаях, вызывает воспаление слизистых глотки и прямой кишки.
Гонококки представляют собой диплококки размером 1,2 х 0,8 мкм, состоящие из двух бобовидных кокков, располагающихся вогнутыми сторонами друг к другу. Спор не образуют, имеют нежную капсулу, жгутиков не имеют, грамотрицательны.
Гонококки - факультативные анаэробы, на простых питательных средах не растут. Оптимальная температура роста 35-36°С. Биохимические свойства гонококков выражены слабо: ферментируют глюкозу с образованием кислоты, обладают цитохромоксидазной активностью.
Материал для исследования. У мужчин - отделяемое из уретры, сок предстательной железы, сперма, осадок мочи. У женщин - отделяемое влагалища, шейки матки, моча. В необходимых случаях берут соскобы со слизистых других возможных очагов поражения (прямой кишки, глотки, конъюнктивы глаз). Материал отбирают стерильной петлей,
ватным тампоном или ложечкой не ранее чем через 2 часа после последнего мочеиспускания или спринцевания и доставляют в лабораторию максимально быстро во избежание аутолиза гонококков.
Бактериоскопическое исследование. Готовят два мазка из исследуемого материала, фиксируя их 96% спиртом в течение 3 минут. Один из мазков окрашивают метиленовым синим, другой - по Граму, При положительных результатах в мазках обнаруживают грамотрицательные диплококки бобовидной формы, находящиеся внутри лейкоцитов. Положительный бактериоскопический диагноз ставится с основном при острой форме гонореи до начала антибиотикотерапии. При хронической форме заболевания гонококки либо вовсе не обнаруживаются в мазках, либо имеют атипичную форму (в виде шаров или очень мелких образований).
Бактериологическое исследование. Метод является обязательным при диагностике хронической гонореи, а также для контроля по окончании лечения больных гонореей, при диагностике заболевания у детей, по требованию судебно-медицинской экспертизы.
Среды готовят на основе МПА из мяса кроликов или свежих бычьих сердец с добавлением сыворотки крови, дрожжевого гидролизата, казеина. Материал инкубируют при 37°С в течение 24-72 часов в атмосфере, содержащей 10-20% углекислого газа.
Гонококки растут в виде круглых прозрачных колоний, напоминающих капли росы. При идентификации гонококков проводится определение биохимической активности. В завершении исследования обязательно определяют чувствительность культуры к антибиотикам.
Иммунологические исследования. Самостоятельного значения не имеют. При хронической гонореи и в сомнительных случаях ставят РСК (реакция Борде-Жангу) с сывороткой крови больного. В качестве антигена используют взвесь гонококков, убитых формалином. В настоящее время применяется иммунофлюоресцентное исследование, ИФА.
Генодиагностика - (ПЦР).
Принцип метода заключается в естественной репликации ДНК, включающей тепловую денатурацию нуклеиновой кислоты (плавление), ее отжиг с синтетическими олигонуклеотидными праймерами и удлинение цепи (элонгация). Смена этих этапов происходит в результате простого изменения температуры реакционной смеси. Метод ПЦР обеспечивает многократное приумножение (амплификацию, amplification - усиление, увеличение) в условиях in vitro фрагментов генома и быстрое накопление практически в любых количествах определенной, интересующей исследователя последовательности ДНК, которая первоначально может быть представлена всего лишь одной молекулой. В результате получают количество материала, достаточное для проведения анализа обычными методами детекции (рис. 12).
Сущность метода ПЦР составляет многократный циклический процесс, попеременно включающий полимеразную реакцию и денатурацию синтезированного фрагмента двунитевой ДНК и отжиг праймеров, что, в конечном счете, может привести к неограниченному увеличению исходного материала.
[youtube.player]Гонококки (Neisseria gonorrhoeae) относятся к грамотрицательным кокам, встречающимся преимущественно парами. Бактерия вызывает триппер (гонорею). Это инфекционный процесс с преимущественным поражением слизистых оболочек мочеполового аппарата.
В редких случаях становится причиной бленнореи – гнойного патологического процесса соединительной оболочки глазного яблока. Диагностика гонококков требуется пациентам после незащищенной сексуальной близости с малознакомым партнером. Либо при подозрениях на инфицирование (иногда патологический возбудитель передается через полотенце или мочалку).
Лабораторная диагностика гонококков состоит из:
- микроскопического метода (окраска двух мазков)
- бактериологического (посев на питательные среды)
- реакции Борде-Жангу (серология)
- ПЦР
Свойства гонококка Neisseria gonorrhoeae
Гонококки – разновидность грамотрицательных диплококков, относятся к роду Neisseria. Для гонококков характерна высокая выживаемость в условиях организма. Вне приемлемой среды обитания для жизнедеятельности (во внешней среде) бактерии гибнут.
Также это происходит в результате высыхания субстрата при температуре от 40 градусов. Быстро погибают под воздействием антисептических и антибактериальных растворов, солей серебра и в мыльной воде.
Как выглядят гонококки?
Две половинки парной бактерии схожи на кофейные зерна, соприкасающиеся друг с другом вогнутой стороной. Под угрозой гибели (к примеру, на фоне антибиотикотерапии) трансформируются в L-форму.

Методы лабораторной диагностики
Инкубационный период длится от 3 до 7-ми дней с момента инфицирования. Дальнейшая клиника проявляется острыми симптомами. Это слизистые, с примесями гноя выделения из половых путей, чувство жжения, болезненность в уретре, в особенности при опорожнении мочевого пузыря).
Либо болезнь принимает бессимптомное течение. Анализ на гонококки Нейссера проводится различными способами.
Наиболее информативным считается ПЦР, так как позволяет обнаружить ДНК-возбудителя уже в первые несколько дней после проникновения бактериального агента в организм. У женщин в несколько раз чаще гонококковая инфекция имеет хроническую форму, при которой симптомы отсутствуют.
Возможность выявить гонококки в мазке ПЦР можно через 2-3 дня после сексуального контакта с зараженным партнером. Также применяются другие методы исследования, не менее информативные и позволяющие дополнительно определить чувствительность бактерий к антибиотику.
Микроскопический (бактериоскопический) метод
Анализ на гонококки проводится с использованием микроскопа и методики окраски двух мазков – по Грамму и с применением 1% жидкого раствора метиленового синего и 1% Эозина.
Для исследования наибольшую ценность представляют патологические жидкости. Забор которых производится из мочеиспускательного канала, влагалища, ануса, глотки или крови.
Метод Грамма
Обнаружить гонококки можно с помощью двойной окраски с применением двух красителей.
Первый – основной, второй считается дополнительным. Помимо красителей используется спирт и различные кислоты. Их действие заключается в обесцвечивании бактериального агента. Для выявления возбудителя гонореи применяются анилиновые красители (кристаллвиолет, метиловый фиолетовый) и дополнительные.

После обесцвечивания грамотрицательных диплококков используется фуксин. Он придает гонококкам красный окрас, определяющего идентифицирующего наличие гонококка.
Ход исследования:
- Биоматериал наносят на предметное стекло тонким слоем
- Следующий этап – сушка
- Проводится окраска анилиновыми красителями, промывка водой и использование раствора Люголя
- После высыхания материал фиксируется – необходимо для того, чтобы бактериальные клетки остались на поверхности стекла и не смылись. Для фиксации применяют один из двух методов – облучение бактериального агента высокими температурами либо применение специальных препаратов, приводящих к коагуляции цитоплазмы
- Далее стекло промывают и дополнительно применяют контрастные краски, после чего бактерии выделяются красным либо розовым цветом, после чего их легко обнаружить
Применение метиленового синего в микроскопическом исследовании
Взятый биоматериал наносится на предметное стекло и фиксируется 96 % этанолом либо над спиртовой горелкой. После полного высыхания мазка выполняется его окрас 1% р-ром метиленовой синьки. Спустя 1 минуту предметное стекло промывают в проточной воде комнатной температуры, подсушивают и помещают под микроскоп для изучения.
Анализ мазка на гонококк позволяет отличить патологическую микрофлору, которая принимает выраженный синий окрас (может иметь различные оттенки). Под микроскопом отличаются бактерии, размещенные парно, их бобовидная форма.
Характерной особенностью остро протекающего инфекционного заболевания является месторасположение возбудителя. То есть внутри гранулоцитарных лейкоцитов, которые выявляются в больших количествах на эпителии и в слизистой.
Для хронического течения характерно отсутствие гонококков при данном исследовании. В единичных случаях бактериальный агент идентифицируется, но в нетипичном для него виде.
Гонококки представлены мелкими или крупными шарообразной формы формированиями. Также выявляется другая патологическая флора, клетки эпителия и белые кровяные клетки (лейкоциты).
Бактериологический способ
Бактериологический или культуральный метод – производится посев биоматериала больного на питательные среды с белками, имеющими нативную пространственную структуру, сыворотку.
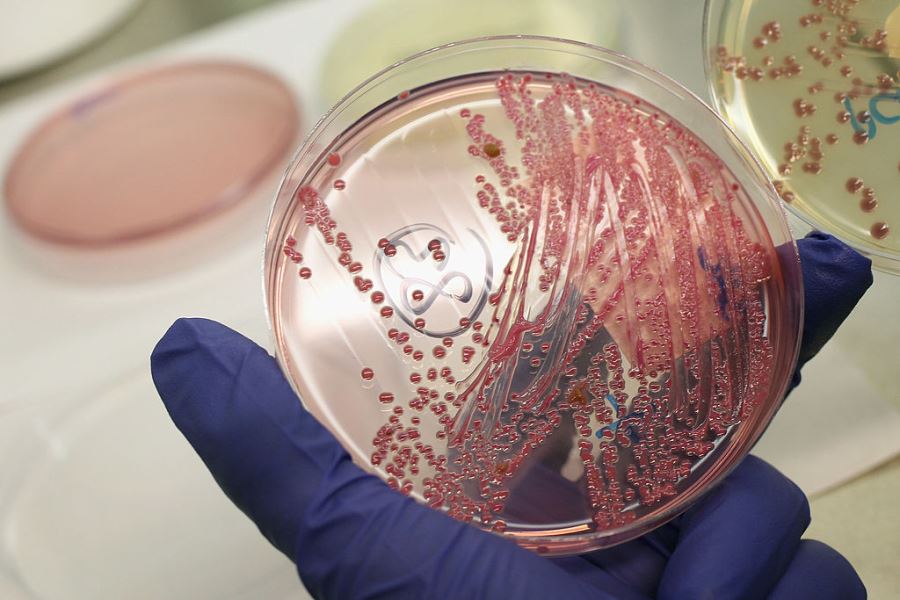
Чаще применяются безасцитные питательные среды. Основой которых является мясопентонный агар (производится из мяса кроликов или бычьих сердец). По результатам посевов на гонококки определяется не только возбудитель инфекции, но и его чувствительность к антибиотикам.
Точность и достоверность исследования во многом зависит от правильности сбора биоматериала. Важно использовать стерильные емкости и соблюдать правила подготовки к сбору анализа.
Сдача крови производится медицинским работником в условиях лаборатории.
Мочу пациенты собирают самостоятельно, используя для этого стерильную емкость.
Доставка биоматериала должна быть быстрой.
Мазки из половых путей или уретры выполняются в лаборатории и сразу наносятся на питательные среды. Очень важно провести диагностику до начала приема антибактериальных средств. В противном случае результативность проведенного анализа дает недостоверные результаты.
Если обследование назначается для контроля проведенной терапии, следует выждать не менее 10-ти дней после приема последней дозы антибиотика. При острой необходимости анализ проводится раньше.
Для исследования, отделяемого из половых путей у женщин производится забор материала через две недели после окончания менструации. За несколько часов запрещается опорожнение мочевого пузыря.
Мужчинам перед сдачей выделяемой слизи на анализ следует удержаться от посещения туалета в течение 4-5 часов.
Через сколько времени будет готов результат?
Культуральный метод занимает от 4-х дней. Все зависит от исследуемого материала – исследование каловых масс занимает от 3-4 дней до недели.
Соскоб из уретры будет готов в течение 7-ми дней, кровь – через 10. Несмотря на длительность диагностики, предварительные результаты анализа озвучиваются на 3-ий день.
Что показывает бактериологическая диагностика?
Расшифровка исследования включает информацию о наличии бактериального агента, а также о его концентрации. Определение количества присутствующей патологической микрофлоры имеет большое значение.
Выделяют 4 степени роста гонококков:
- 1 степень (отсутствует рост бактерий на твердой среде, на жидкой – незначительный рост)
- 2 степень (рост до 10 колоний)
- 3-я (рост от 10 до 100 колоний)
- 4-я (больше 100 колоний)

Первые две степени не являются этиологическими факторами развития болезни.
В данном случае говорят о загрязненности исследуемого биоматериала. Последние две степени (3 и 4) говорят о том, что присутствующие микроорганизмы стали причиной развития инфекционных процессов.
Окончательная расшифровка (подсчет колоний КОЕ/мл) имеет следующий вид:
- 102 – 103/мл – 1 колония
- 104/мл – 0т 2 до 5 колоний
- 105/мл – от 6 до 15 колоний
- 106/мл и более – от 16 колоний
Диагностика имеет весомое значение для контроля проводимой антибиотикотерапии и позволяет оценить ее эффективность.
Серологический метод
Методика основывается на иммунологической реакции выявления антител (Реакция Борде-Жангу) в плазме крови больного с подозрением на заражение гонококковой инфекцией. Зачастую используется для диагностики бессимптомных форм патологии.
В современной исследовательской практике серологический метод мало информативен. Не применяется для контролирования состояния после медикаментозной терапии.
Диагностика методом ПЦР
Определение гонококков при анализе ПЦР наиболее точный метод. Позволяет уже в впервые дни после заражения идентифицировать бактериального возбудителя.
Для получения максимально верных результатов огромное значение имеет подготовка:
- исключить сексуальный контакт за сутки
- после приема антибиотиков должно пройти не менее 7-ми дней
- перед взятием мазка запрещается посещение туалета за 2-3 часа
- не проводится у женщин вовремя месячных
Для диагностики триппера производится забор материала из мочеиспускательного или цервикального канала, можно использовать мочу.

Если в исследуемом биоматериала обнаруживают ДНК гонококков – это говорит о наличии гонореи. Информативность диагностики составляет 98%. Анализ проводится в течение 1-3 дней, что зависит от оснащенности лаборатории и квалификации специалистов.
Основным преимуществом исследования на гонококки является возможность выявления бактериального возбудителя даже при условии его минимальной концентрации в мазке (моче). В лабораторных условиях производится размножение генов возбудителя.
Клонирование ДНК участка, даже если он единичный, позволяет выявить всю имеющуюся патологическую флору в материале. Так, в большинстве случаев исследование на гонококки определяет одновременно диплококков и трихомонад, которые также передаются при половом акте.
Анализ ПЦР высоко информативен на ранних стадиях. Поэтому диагностика рекомендуется пациентам при частой смене половых партнерах или случайной сексуальной связи, в первые дни после интимной связи. Проведенная терапия на начальных стадиях болезни предотвращает развитие неприятных симптомов и возможные осложнения.
Расшифровка анализа ПЦР на гонококки выглядит следующим образом:
- высокий уровень лейкоцитов (свыше 10-ти говорит о присутствии воспалительного очага, свыше 20 – острое воспаление)
- повышенная концентрация клеток эпителия (более 10 в поле зрения)
- наличие грамотрицательных кокков, характерной формы
О чем говорит отсутствие гонококковой инфекции в исследуемом материале?
Если в ходе обследования с применением одного из методов в мазке не были обнаружены гонококки? Это говорит о том, что пациент полностью здоров. Либо о том, что в исследуемом материале, взятом из половых путей или уретры, бактерия отсутствует, но может быть обнаружена в других частях тела.
Для подтверждения диагностики выполняется забор материала из ротовой полости, прямой кишки или конъюнктивы глазного яблока. Если симптоматические проявления локализуются вне половой системы, а присутствие гонококков исключено, выполняются другие методы обследования для идентификации возбудителя патологии.
Диагностика после проведенного лечения
При обнаружении гонококковой инфекции лечащий врач-венеролог назначает комплексное лечение. Его основой является антибиотикотерапия.

Так как бактерии быстро адаптируются к пенициллинам, применяются препараты цефалоспоринового ряда. Чаще назначается Цефтриаксон для инъекций либо перорально Цефиксим.
Длительность лечения составляет 10-14 дней. Спустя 2-3 суток после приема последней дозы исследуют мазок из урогенитального тракта на выявление гонококков. Отрицательные результаты говорят о правильно проведенном лечении.
Диагностика после лечения также проводится второй раз через две недели. Отсутствие бактериального возбудителя означает полное выздоровление, больного снимают с учета у венеролога. Обследованию подлежат все половые партнеры.
Как подготовиться к диагностике гонококков?

Для предотвращения получения в ходе диагностики ложноположительных результатов перед взятием материала пациентам необходимо как следует подготовиться.
Соблюдение подготовительного этапа одинаково требуется представителям женского и мужского пола.
Подготовка
Этап подготовки включает:
- Исключение сексуальной близости за трое суток до забора материала
- Прекращение медикаментозной терапии, не только антибактериальных средств, но и других лекарственных групп, в частности химический средств контарацепции (спермициды). При невозможности прекращения приема некоторых препаратов пациент заранее сообщает об этом врачу
- Исключается использование влагалищных суппозиториев, кремов и спреев
- Исключается спринцевание за 3 дня до процедуры
- Гигиена половых органов выполняется накануне вечером, в утро забора мазка и взятия крови подмывание запрещается
- Опорожнение мочевого пузыря производится за 3 часа до исследования. При наличии незначительного количества бактериальных возбудителей существует вероятность вымывания некоторой части совместно с мочой и получение ложноотрицательных результатов
- У женщин манипуляция проводится за 4-5 дней до начала предполагаемых месячных либо спустя несколько дней по завершению. В острых случаях проводится не зависимо от менструального кровотечения
Анализ мазка на выявление гонококка Нейссера выполняется перед началом медикаментозного лечения и несколько раз после окончания.
Методику исследования выбирает лечащий врач, который занимается расшифровкой результатов и разработкой схемы лечения. Самостоятельный прием антибактериальных средств на фоне возникшей клинической картины искажает результаты обследования.
При подозрении на гонорею обращайтесь к автору этой статьи – венерологу в Москве с многолетним опытом работы.
[youtube.player]Таксономия:отдел Gracilicutes, семейство Neissericeae, род Neisseria, вид Neisseria gonorrhoeae
Свойства возбудителя:
Морфология: Гонококк - это неподвижный грамотрицательный парный кокк (диплококк), обе половинки которого имеют сходство с кофейными зернами, обращенными вогнутой стороной друг к другу.
Культуральные свойства: Гонококки можно выращивать на искусственных питательных средах, они лучше растут при наличии нативного человеческого белка в атмосфере с повышенным содержанием СО2 при 37°.
Эпидемиология:Повсеместно. Передача возбудителей происходит, как правило, половым путем. В основном у 10% инфицированных мужчин и 80% инфицированных женщин болезнь протекает бессимптомно.
Патогенез:Размножаясь на поверхности эпителия, гонококки могут вызывать его деструкцию и попадать в поверхностные лимфатические и кровеносные сосуды. Время, необходимое для проникновения гонококков в подэпителиальный слой и развития воспаления, определяет продолжительность инкубационного периода: от 1-2 дней до 1 мес. и более. Воспалительный процесс, вызванный гонококками, постепенно переходит на новые участки слизистой оболочки. Возможно лимфогенное распространение возбудителей, чем объясняется быстро развивающийся воспалительный процесс в простатической части уретры или развитие аднексита. Ретроградный занос гонококков играет важную роль в происхождении ряда осложнений.
Микробиологическая диагностика:
Бактериоскопический (микроскопический) метод — окраска двух мазков: по Граму; 1 % водным раствором метиленового синего и 1 % спиртовым раствором эозина.
Метод обладает высокой чувствительностью и специфичностью (90-100 %) только при исследовании уретрального отделяемого у мужчин с манифестными проявлениями. Метод микроскопии характеризуется низкой чувствительностью (45-64 %) при исследовании цервикальных, фарингеальных и ректальных проб, а также при бессимптомной инфекции.
Бактериологический метод: посев на питательные среды, содержащие нативные белки крови, сыворотки или асцитической жидкости; используют безасцитные среды (например, среда КДС-1 с гидролизатом казеина, дрожжевымаутолизатом и нативной сывороткой); оптимум роста в атмосфере 10—20 % углекислого газа, при рН 7,2—7,4 и температуре 37 °C. Позволяет оценить чувствительность гонококков к антимикробным препаратам.
Серологический метод: РСК (реакция Борде-Жангу) или РИГА с сывороткой крови больного.
Молекулярно-биологический метод — (амплификация нуклеиновых кислот при помощи ПЦР). Отличается наиболее высокими показателями чувствительности и специфичности. Особенно рекомендован для проб из экстрагенитальных локусов.
Лечение:В случае когда гонококки устойчивы к пенициллину и его дериватам, часто используют Цефтриаксон (антибиотик третьего поколения из цефалоспоринов).
Профилактика:Пациенты также должны проверяться на другие инфекции, передаваемых половым, особенно на хламидию, так как она сопутствует протеканию болезни (до 50% случаев). Очень часто одновременно включают лечение антибиотиками и хламидий.
Вероятность заражения можно уменьшить используя презервативы. А также обработкой половых органов дезинфицирующими средствами (гибитан, цидипол, мирамистин, бетадин) в течение первых 2 часов после полового контакта и сократить количество половых партнеров.
Иммунитет:стойкого иммунитета не вызывает
63. Возбудитель дифтерии. Современные представления о токсинообразовании. Лабораторная диагностика. Иммунитет. Серотерапия. Активная иммунизация и проблема снижения заболеваемости дифтерий.
Таксономия:отдел Firmicutes, семейство Corynebacteriaceae, род Corynebacterium, вид Corynebacterium diphtheriae
Свойства возбудителя:
Культуральные свойства: Хемоорганогетеротроф, факультативный анаэроб. Растут на сложных питательных средах, содержащих сыворотку, например на свёрнутой лошадиной сыворотке по Ру, смеси бычьей сыворотки с сахарным бульоном по Леффлеру. На кровяном агаре с теллуритом (среда Клаубера) колонии приобретают чёрный цвет вследствие восстановления теллурита.
Окрашивание: Грам+, Зёрна волютина окрашиваются метиленовым синим либо по Нейссеру.
Эпидемиология:Дифтерия является антропонозом, то есть резервуаром болезни выступают люди. Заражение здорового человека может произойти от больного дифтерией. Чем более выражена тяжесть, тем больше бактерий выделяет больной.
Здорового носителя бактерии.
Патогенез:Самой частой формой дифтерии (90—95 % всех случаев) является дифтерия ротоглотки. При локализованной форме налёты только на миндалинах. Интоксикация слабо выражена, температура до 38—39°С, головная боль, недомогание, незначительные боли при глотании.
Принципы микробиологической диагностики дифтерии. С целью раннего выявления дифтерии и определения носителей дифтерийной палочки необходимы выделение и идентификация возбудителя, а также определение его способности к токсинообразованию. Материалом для исследования служат дифтеритические плёнки, слизь из носоглотки или отделяемое из подозрительных поражений кожных покровов. Забор материала на дифтерию проводят двумя стерильными тампонами: один используют для посева, с другого делают мазки и окрашивают их по Граму и Найссеру. Взятый материал следует доставлять в лабораторию не позднее чем через 3 ч.
Бактериоскопия. Окраска по Граму не является специфичной, так как дифтерийные палочки сравнительно плохо воспринимают красители, но позволяет косвенно идентифицировать непатогенные коринебактерии, располагающиеся в виде палисада (параллельно) или в виде китайских иероглифов. Окраска по Найссеру позволяет выявить характерные зёрна Бабеша-Эрнста и отличить дифтерийную палочку от ложнодифтерийной палочки С. pseudodiphtheriticum (С. hofmannii), часто обитающей в носоглотке.
Определение токсигенности.
Определение in vivo. Проводят подкожным или внутрикожным заражением 0,5-1,0 мл бактериальной культуры морских свинок массой 250 г. За 24 ч до заражения одно животное иммунизируют дифтерийным антитоксином. При положительном результате неиммунизированные животные погибают в течение 3-5 сут.
Фаготипирование дифтерийной. Для дифференциальной диагностики возбудителей используют набор из 9 кори нефагов. С его помощью можно типировать большинство токсигенных и нетоксигенных штаммов биовара gravis.
Лечение:Главным в лечении всех форм дифтерии (кроме бактерионосительства) является введение антитоксической противодифтерийной сыворотки (ПДС), которая подавляет дифтерийный токсин. Антибиотики не оказывают существенного действия на возбудителя дифтерии.
Профилактика:Специфическая: Основное значение в борьбе с дифтерией имеет активная плановая вакцинация населения вакцинами, содержащими адсорбированный дифтерийный анатоксин (АКДС-вакцина, АКДС-анатоксин, АДС—М-анатоксин), которая проводится в соответствии с календарём профилактических прививок; это позволяет создать длительный и напряжённый антитоксический иммунитет.
Неспецифическая: раннее выявление больных дифтерией.
Иммунитет:После перенесенного заболевания формируется нестойкий иммунитет, и приблизительно через 10-11 лет человек может заболеть вновь. Повторное заболевание носит нетяжелый характер и переносится легче.
Токсинообразование дифтерийной палочкой.
Corynebacterium diphtheriae продуцирует мощный экзотоксин — основной фактор патогенности. Нетоксигенные штаммы дифтерии не вызывают развитие заболевания. Б чистом виде токсин впервые получили; Э. Ру и А. Иерсен (1888), что явилось решающим моментом для установления этиологической роли микроорганизма. Токсин проявляет все свойства экзотоксина (термолабильный, высокотоксичный, иммуногенный белок, нейтрализуемый антитоксической сывороткой). Нативный токсин — полипептид с Мг около 72 000; его образуют фрагменты А (проявляет ферментативную активность) и В (взаимодействует с клеточными рецепторами, облегчая проникновение фрагмента А). Клетки всех чувствительных организмов способны рецептировать В-фрагмент и поглощать молекулу посредством эндоцитоза. В кислой среде эндосом (фаголизосом) дисульфидные связи, объединяющие оба компонента, разрушаются, фрагмент В взаимодействует с мембраной эндосомы, облегчая проникновение фрагмента А в цитоплазму. Последний устойчив к денатурации и длительно сохраняется в цитозоле. Механизм цитотоксического действия токсина дифтерии связан с модификацией белков через АТФ-рибозилирование. Подобным свойством обладают многие токсины, но лишь дифтерийный токсин и токсин A Pseudomonas aeruginosa имеют специфичную мишень — фактор элонгации 2 — трансферазу, ответственную за наращивание (элонгацию) полипептидной цепи на рибосоме. Токсины дифтерии.
Дифтерийный токсин катализирует перенос АТФ-рибозы от цитоплазматического никотин-амиддинуклеотида (НАД) к фактору элонгации 2, приводя к АТФ-рибозилированию гистидиновых остатков в молекуле фактора с необратимым блокированием элонгации полипептидной цепи (то есть любого белкового синтеза). Немодифицированный фактор элонгации 2 образует комплекс с ГТФ и тРНК, связывающийся с мРНК в эукариотических клетках, после чего возможно встраивание аминокислот в синтезируемую белковую молекулу. Токсин дифтерии ингибирует белковый синтез, в том числе и в миокарде, приводя к структурным и функциональным нарушениям, способным вызвать смерть больного. Результат действия токсина дифтерии на нервную ткань — демиелинизация нервных волокон, часто приводящая к параличам и парезам.
Способность к токсинообразованию проявляют лишь лизогенные штаммы Corynebacterium diphtheriae, инфицированные бактериофагом (р-фаг), несущим ген fox, кодирующий структуру токсина дифтерии. Образование последнего наиболее выражено при вступлении бактериальной популяции в стадию отмирания. Переход умеренного фага в литическую форму мало влияет на синтез токсина.
Значительное снижение иммунной прослойки всегда сопровождает рост заболеваемости дифтерией.

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
[youtube.player]Читайте также:


