Микробиологические методы диагностики менингококковых инфекций
Бактериологический – выделяют чистую культуру возбудителя и проверяют её чувствительность к сульфаниламидным препаратам и антибиотикам. Материалом служит ликвор, кровь, экссудат, слизь из зева и носоглотки. Серологические реакции– обнаружение специфические менингококковые антигены или антитела к ним (реакция коагглютинации, латекс-агглютинации, ИФМ и микрометод эритроиммуноадсорбции – для обнаружения антигенов. РПГА и ИФМ – для обнаружения антител).
32. Формы менингококковой инфекции
Соответственно клинической классификации менингококковую инфекцию делят на локализованную и генерализованную. К локализованным формам относят менингококконосительство, острый назофарингит и изолированную менингококковую пневмонию. Генерализованные формы: острая и хроническая менингококкемия, менингококковый менингоэнцефалит, менингококковый менингит. Существуют редкие формы: менингококковый артрит или полиартрит, менингококковый эндокардит и иридоциклит. Частое распространение получили смешанные формы менингококковой инфекции.
33. Патогенез инфекции.
Заражение происходит воздушно-капельным путём. Входными воротами инфекции являются носоглотка, откуда менингококки проникают в лимфатические сосуды и в кровь. Могут вызывать следующие клинические формы болезни: назофарингит, менингококцемия, эпидемический цереброспинальный менингит. В некоторых случаях развивается менингококковый эндокардит. Летальность 60-70%
34. Какие заболевания вызывают пневмококки.Пневмок.явл.основными возбудителями остр.и хронич.воспалит.заболеван.легких, которые занимают одно из ведущих мест в заболеваем., инвалидизации и смертности населения всего мира.
Пневмок.наряду с менинг.явл.главными возбудит.менингита. Кроме того, они вызывают ползучую язву роговицы, отиты, эндокардиты, перитониты, септицелии
35. Бактериологический метод.
При отборе и посеве исследуемого материала следует соблюдать следующие требования: исключить случайную контаминацию материала посторонней микрофлорой и не допустить гибели возбудителя с момента взятия материала для анализа и до начала работы с ним в лаборатории. Первое условие обеспечивают правильным забором материала, точным доступом к очагу инфекции, соблюдением асептики; второе - доставкой образцов или посевов в лабораторию незамедлительно в теплом виде или временное сохранение до доставки в условиях термостата при 37 °С в течение не более чем 12 часов.
Бактериоскопический метод.
Бактериоскопически исследуют соскобы с поверхности геморрагических элементов сыпи, спинномозговую жидкость, кровь, слизь из носоглотки, а в случае смерти внутренние органы. Выделенные кокки идентифицируют по морфологическим, культуральным и серологическим признакам.
Серологическая классификация.
Менингококки классифицируют по составу полисахарида на 12 серологических групп - A, B, C, X, Y, Z, W-135, 29E, K, L, H, I, из которых только первые три серогруппы (А, В, С) отвечают за более чем 90% случаев клинически выраженной генерализованной менингококковой инфекции.38.
Профилактика.
Менингококковая вакцина полисахаридная группы А сухаяпредназначена для профилактики менингококковой инфекции. Состав: капсульный специфический полисахарид менингококка серогруппы А. Способ применения: подкожно однократно в подлопаточную полость или в верхнюю треть плеча.
40. Отличия пневмококков от других стрептококков.
Идентификация пневмококков проводится на основании: морфологических особенностей роста; фенотипических характеристик; антигенной структуры (серологический метод).
41. Факторы патогенности менингококков.
Менингококки обладают адгезивными, токсическими, инвазивными и антифагоцитарными свойствами.
1. Факторы адгезии - пили и белки наружной мембраны клеточной стенки.
2. Инвазию менингококков обуславливают ферменты - гиалуронидаза, протеаза, фибринолизин, нейраминидаза. Протеаза разрушает sIgA, обеспечивающий местный иммунитет на слизистый носоглотки.
3. Основной токсический фактор - это эндотоксин, освобождающийся при гибели менингококков и обладающий пирогенным, некротическим и летальным действием.. Некоторые штаммы менингококков продуцируют гемолизин.
4. Антифагоцитарныей фактор - это полисахаридная капсула ме-нингококков, которая защищает N.meningitidis от гибели в вакуолях фагоцитов, где менингококки беспрепятственно размножаются, как в "инкубаторе", вызывая генерализацию процесса при последующем разрушении фагоцитов. Плазмокоагулаза, вырабатываемая менингококками, также обладает антифагоцитарной активностью.
42. Какие заболевания вызывают гонококки.
Гонококк - возбудитель гонореи - венерического заболевания с воспалительными проявлениями в моче-половых путях (у женщин гонорея может стать причиной бесплодия. Мужчины — носители гонококка — страдают поражением яичек, что тоже — верный путь к бесплодию. Заражение новорождённых часто приходится на слизистые поверхности глаз, а это грозит нарушением зрения и даже полной слепотой).
43. Морфологические, тинкториальные, культуральные свойства гонококков.
Неподвижные аспорогенные грамотрицательные диплококки (средний размер клетки 1,25+1,0x0,7+0,8 мкм), напоминающие кофейные зерна или бобы, прилегающие друг к другу уплощенными сторонами, образующие капсулу. Полиморфны — встречаются более мелкие или более крупные клетки, а также палочковидные формы. Хорошо окра-шиваются анилиновыми красителями (метиленовым синим, бриллиантовым зеленым и др.), цитоплазма имеет включения. Под действием пенициллина образуют. L-формы; под влиянием химиопрепаратов быстро меняют свойства и становятся грамположительными.
Аэробы, хемоорганотрофы; для роста требуют свежеприготовленных влажных питательных сред с добавлением нативных белков крови, сыворотки или асцитической жидкости; широко используют безасцитные среды (например, среда КДС-1 с гидролизатом казеина, дрожжевым аутолизатом и нативной сывороткой); оптимум рН 7,2—7,4, температуры — 37 "С. Не вызывают гемолиза на средах, содержащих кровь; на средах с добавлением молока, желатина и картофеля не растут. Через 24 ч на плотных питательных средах гонококки, содержащие в клеточной стенке протеин II, образуют слегка мутные бесцветные колонии; бактерии, не содержащие протеин II, образуют круглые прозрачные колонии в виде капель росы (1—3 мм в диаметре) с ровными краями. На жидких питательных средах растут диффузно и образуют поверхностную пленку, через несколько дней оседающую на дно.
44. Бактериоскопическая диагностика гонореи.
Бактериоскопическое исследование является основным методом диагностики острой гонореи и бленнореи. Готовят два мазка, один из которых окрашивают по Граму, а второй — метиленовым синим, и микроскопируют. В мазке, окрашенном по Граму, в положительном случае можно обнаружить грамотрицательные диплококки бобовидной формы, а в мазке, окрашенном метиленовым синим, — картину незавершенного фагоцитоза. Окраска по Граму позволяет дифференцировать гонококки с другими бактериями. Для получения более четких очертаний гонококков мазки фиксируют диметилсульфоксидом. В связи с тем, что в исследуемом материале могут находиться и другие грамотрицательные бактерии, морфологически сходные с гонококками, применяют прямой и непрямой варианты РИФ. При прямом варианте мазки обрабатывают флюоресцирующими антителами против гонококков, при непрямом — используют гонококки, сыворотку больного и антиглобулиновую сыворотку.
45. Бактериологическая диагностика гонореи.
Бактериологическое исследование проводят в тех случаях, когда гонококки в мазках не обнаруживают или находят атипичные, измененные формы. Культуральный метод позволяет выявлять гонококки в 1,5—4,0 раза чаще, чем бактериоскопический метод. Особенно показаны посевы при хронической гонорее, гонорейном проктите и контроле на излечение. Из-за низкой устойчивости гонококка в окружающей среде посев производят непосредственно после забора материала на чашки с сывороточным или асцитическим агаром, КДС-1. Добавление к среде ристомицина и полимиксина М (10 ЕД/мл) значительно повышает высеваемость гонококков. Перед посевом питательную среду нагревают в термостате, чашки с посевами инкубируют в эксикаторе в атмосфере, обогащенной 10 % С02. Выделение и идентификацию возбудителя проводят по стандартной схеме.
46. Серологическая диагностика гонореи.
Серологический метод используют при хронической гонорее, при отсутствии у больного выделений. Проводят РСК по Борде—Жангу по стандартной схеме, которая бывает положительной с 3—4-й недели болезни; в острых случаях реакция положительна у 35 % больных, при хронических — у 65 % (слабоположительная у 100 %). В качестве АГ для РСК применяют гоновакцину или АГ из убитых гонококков. Более достоверна люминесцентная диагностика с использованием прямого и непрямого иммунофлюоресцентного анализа.
47. Иммунитет при гонорее.
Иммунитет по своему механизму — нестерильный, после перенесенного заболевания невосприимчивость к вторичным заражениям не вырабатывается, поэтому часто регистрируются повторные заболевания, возможны супер- и реинфекции. Животные резистентны к гонококкам, лишь внутрибрюшинное введение микробов вызывает гибель мелких лабораторных животных.
48. Для каких целей используют гоновакцину.
Лечение: при хронической осложненной гонорее, а также свежей торпидной лечение сводится к специфической или неспецифической иммунотерапии и к местному воздействию на пораженный орган. Чем больше давность гонорейного процесса, чем значительнее выражены соединительнотканные изменения, тем интенсивнее должны быть иммунотерапия и местное лечение. Иммунотерапия, которая может быть специфической (гоновакцина) или неспецифической (пирогенал и т. п.), способствует более быстрому и полному рассасыванию воспалительных инфильтратов. Чаще всего применяют гоновакцину, которую вводят внутримышечно через 1—2 дня; курс лечения состоит из 6—8 инъекций.
49. Факторы патогенности гонококков.
К ним относятся: капсула, пили, эндотоксин, поверхностные белки наружной мембраны, протеазы.
Обычна не просят о них рассказывать, но это на всякий случай!
Все свежевыделенные культуры имеют капсулу, которая обладает антифагоцитарным действием (препятствует прямому контакту микробицидных субстанций с клеточной стенкой, маскирует ее антигенные детерминанты). АТ-опсонины к АГ капсулы стимулируют фагоцитоз гонококков. Полисахариды в капсулах не обнаружены, присущие им функции выполняют высокомолекулярные поверхностные полифосфаты.
Пили обеспечивают адгезию к эпителию. Генетически опосредованная вариабельность строения пилей обеспечивает прикрепление и выживаемость гонококков на клетках эпителия при смене хозяина и воздействии AT. У авирулентных штаммов они отсутствуют.
Клеточная стенка содержит эндотоксин. Это липополисахарид, который состоит из липида А и центрального ядра (антигенной детерминанты) — олигосахарида, не имеющего боковых цепей. Липополисахариды N. gonorrhoeae проявляют сильные иммуногенные свойства. АТ к ним обладают бактерицидной активностью.
Белки клеточной оболочки. Проявляют сильные иммуногенные свойства. На основании их состава выделяют 16 сероваров. АТ к белкам клеточной стенки обусловливают комплементзависимый цитолиз. Поверхностный белок 1 класса обуславливает устойчивость к бактерицидным факторам слизистых оболочек, а также инвазивные свойства бактерий и их способность вызывать системные инфекции. Поверхностный белок П класса образует отдельную белковую фракцию, называемую протеинами мутности или Ора-протеинами (от англ. opacity — мутность). Их считают первичными факторами вирулентности гонококков, и они обуславливают прикрепление к эпителию, а также ингибируют фагоцитарные реакции.
Синтезируют IgA - npomeaзy, действующую внеклеточно и разрушающую пролинтреониновые связи в тяжелых цепях Ig, а также расщепляющую молекулу IgA в шарнирной области. Эти эффекты инактивируют AT, препятствующие адгезии, что облегчает прикрепление к рецепторам эпителиальных клеток, а также защищает бактерии от фагоцитоза, опосредованного AT. Резистентность слизистых оболочек во многом обусловлена местной секрецией IgA.
50. Эпидемиология гонококковых инфекций.
Гонорею относят к наиболее распространенным инфекционным заболеваниям, передаваемым половым путем. Источник инфекции — больной человек, особенно хронической бессимптомно протекающей формой гонореи. Экологической нишей являются слизистые оболочки мочеполовых путей человека. Механизм передачи— контактный, путь — половой, крайне редко — бытовой (например, больная гонореей мать может заразить маленькую дочь при пользовании общей мочалкой, сиденьем унитаза и т. п.). Восприимчивость к гонококкам очень высокая. Устойчивость в окружающей среде. Гонококки очень неустойчивы во внешней среде, что следует помнить при заборе и транспортировке исследуемого клинического материала. Чувствительны к действию обычно применяемых антисептиков и дезинфектантов, особенно к солям тяжелых металлов. Высокочувствительны к пенициллинам, тетрациклинам, стрептомицину
Последнее изменение этой страницы: 2017-01-19; Нарушение авторского права страницы
[youtube.player]стороной друг к другу, позволяет сделать положительное заключение о наличии у пациента менингококковой инфекции (рис. 22).
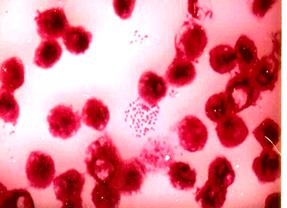
А б
Рис. 22. Менингококк(Neisseria meningitides) в спинно-мозговой жидкости больного эпидемическим цереброспинальным менингитом (а) и в чистой культуре (б). Окраска по Граму. х630
Микроскопическое исследование мазков из носоглотки бактерионосителей дает возможность выявить наряду с менингококком стафилококки, стрептококки и непатогенные нейссерии (Moraxella spp. и др.), дифференцировать которые по морфологическим и тинкториальным свойствам практически невозможно.
Бактериологический метод.Исследуемый материал засевают петлей на чашки с сывороточным МПА, содержащим антибиотики (ристомицин, ванкомицин, колистин и ниста-
тин) для подавления роста сопутствующей микрофлоры (преимущественно кокков). Асцитическая жидкость в качестве добавки к питательным средам в настоящее время не
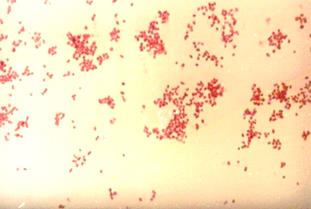
применяется, так как в результате лечения больных в ней накапливаются вещества, ингибирующие рост микроорганизмов (в том числе менингококка). Менингококк на сывороточном МПА вырастает при температуре 37 0 С в атмосфере с повышенным содержанием СО2 (используют СО2 инкубатор, газогенераторные пакеты или эксикатор с зажженной свечой) через 48 часов, колонии величиной с булавочную головку, прозрачные, с голубоватым оттенком и ровными краями. В мазках из чистой культуры менингококка (рис.21) микрокартина иная (полиморфные дипло- и тетракокки), чем в мазках из спинно-мозговой жидкости.
Типичные для менингококка колонии пересевают в пробирку со скошенным сывороточным МПА для выделения чистой культуры. Идентификацию чистой культуры менингококка, ее дифференциацию от сапрофитных нейссерий, обитающих в носоглотке, проводят на основании изучения комплекса биологических свойств (табл. 18).
Таблица 18.Основные биологические свойства нейссерий
| Свойства | Виды нейссерий | ||||
| N.meningitidis | N.subflava | N.flava | N.mucosa | N.sicca | |
| Рост на МПА | - | + | + | + | + |
| Потребность в СО2 | + | - | - | - | |
| Желтый пигмент | - | + | + | ± | ± |
| Ферментация: глюкозы мальтозы сахарозы фруктозы лактозы | К+ К+ - - - | К+ К+ К± К± - | - - - - - | К+ К+ К+ К+ - | К+ К+ К+ К+ - |
| Образование полисахарида из сахарозы | - | ± | + | + | + |
| Нитратредуктаза | - | - | - | + | - |
| РА с менингококковыми сыворотками сероваров А., В, С | + | - | - | - | - |
Обозначения: (+) – наличие признака, (-) – отсутствие признака, (±) – непостоянный признак, К – образование кислоты
Специфический полисахаридный менингококковый антиген можно выявить в спинномозговой жидкости с помощью метода встречного иммуноэлектрофореза в геле. С этой целью в агаровом геле на стеклянных пластинках, размером 9x12 см, вырезают два параллельных ряда лунок диаметром 3 мм. В лунки одного ряда вносят исследуемый ликвор, в лунки другого - преципитирующие сыворотки против менингококков разных серогрупп. Пластинки помещают в аппарат для иммуноэлектрофореза на 40-45 мин при комнатной температуре. Положительный результат характеризуется появлением 1-2 полосок преципитации между лунками со спинномозговой жидкостью и соответствующей антисывороткой.
Генодиагностика. Исследуемый материал используют для обнаружения ДНК возбудителя с помощью ПЦР, что дает основание в случае получения положительного результата поставить предварительный диагноз.
Серодиагностика.Для ретроспективного подтверждения диагноза используют РНГА с парными сыворотками.
Экспресс-методы диагностики.Для выявления антигенов менингококков в мазках из исследуемого материала используют ИФМ, а также непрямую латекс-агглютинацию и РНГА с антительными диагностикумами.
Самостоятельная работа студентов
1. Микроскопический метод. Изучение морфологии менингококка в мазках из ликвора больного с подозрением на менингококковую инфекцию (демонстрация). Типично наличие грамотрицательных диплококков, располагающихся внутри лейкоцитов.
2. Бактериологический метод. Учет культуральных свойств менингококка на сывороточном МПА с ристомицином. Колонии менингококков прозрачные с голубым оттенком, ровные, мелкие (с булавочную головку). Изучить биохимические свойства менингококка в соответствии с таблицей .
3. Учесть демонстрационную РНГАс парными сыворотками больного (7 и 14 дни болезни) с подозрением на менингококковую инфекцию.
4. Биопрепараты для диагностики и профилактики менингококковой инфекции:
· отечественная химическая вакцина полисахаридная менингококковая вакцина групп А и С. Применяется по эпидемиологическим показаниям. В России зарегистрирована также кубинская В+С менингококковая вакцина, состоящая из белков менингококков группы В и полисахаридов менингококка группы С, а также полисахаридная вакцина МенингоА+С фирмы Пастер Мерье Коннот;
· агглютинирующие и преципитирующие сыворотки против менингококка, применяются с диагностической целью для постановки РА с целью серологического типирования менингококка и встречного иммуноэлектрофореза для обнаружения менингококкового антигена в спинно-мозговой жидкости.
· эритроцитарные антительные менингококковые диагностикумы для обнаружения антигенов менингококка в спинномозговой жидкости с помощью РНГА.
Не нашли то, что искали? Воспользуйтесь поиском:
[youtube.player]Менингококковая инфекция носит спорадический характер, однако, несмотря на это, она является одной из самых опасных и непредсказуемых по молниеносности течения. 1/3 всех случаев составляют гипертоксические, молниеносные формы, которые часто заканчиваются смертью больного. Течение менингококковой инфекции зависит от ранней диагностики и адекватной стартовой терапии на всех этапах лечения. Диагностика менингококковой инфекции основана на эпидемиологических данных, данных, полученных в результате опроса больного, общеклинических и лабораторных методах исследования.
При помощи бактериоскопии можно обнаружить возбудитель и провести анализ клеточного состава ликвора. Бактериологическое исследование проводится для получения чистой культуры менингококков (Neisseria meningitidis). Серологический метод позволяет выявить бактериальные антигены и антитела в сыворотке крови.
Материалом для исследования являются слизь из носоглотки, спиномозговая жидкость (ликвор), кровь и гной, соскоб кожи из области геморрагических высыпаний.
Рис. 1. На фото тяжелая форма менингококкового сепсиса у детей.
Диагностика менингококковой инфекции с использованием общеклинических методов исследования
- Менингококковый назофарингит протекает с небольшим лейкоцитозом и нормальной или слегка увеличенной СОЭ. При диагностике менингококкового назофарингита используются эпидемиологические и данные бактериологического обследования. На основании только клинических данных данное заболевание диагностировать чрезвычайно трудно.
- Генерализованные формы заболевания протекают с выраженным нейтрофильным лейкоцитозом и значительным сдвигом в формуле, из периферической крови исчезают эозинофилы, увеличивается СОЭ.
- Токсическая форма менингококцемии протекает с тромбоцитопенией и небольшой анемией. О сгущении крови в сосудистом русле говорит повышенный уровень гематокрита. Развившаяся лейкопения говорит о нарастании тяжелой интоксикации и является плохим прогностическим признаком. В крови падает уровень тромбоцитов, изменяется коагулограмма. Появляются признаки метаболического ацидоза и нарушения электролитного состава крови.
- Появление в моче следов белка, цилиндров и единичных эритроцитов говорит о токсическом поражении почек. Значительное увеличение белка, зернистых цилиндров и эритроцитов говорит о развитии острой почечной недостаточности.
При массовой гибели менингококков выделяются эндотоксины, воздействие которых на внутренние органы и системы организма определяют клиническую картину заболевания, тяжесть которого диктует применение определенного объема исследований.
Рис. 2. На фото менингококцемия у детей.
Исследование спинномозговой жидкости с целью диагностики менингококкового менингита
Исследование спинномозговой жидкости при диагностике менингита имеет решающее значение. Забор спинномозговой жидкости осуществляется при люмбальной пункции.
- При явлениях менингизма клеточный состав спинномозговой жидкости остается нормальным, отмечается ее незначительное повышенное давление.
- В первые часы заболевания (фаза серозного воспаления) ликвор остается прозрачным, отмечается небольшое повышение клеточных элементов (до 50 — 200 клеток) с преобладанием лимфоцитов. Антибиотикотерапия в этот период всегда дает положительный эффект.
- К концу первых суток серозное воспаление переходит в гнойное. Спиномозговая жидкость становится мутной. Цитоз достигает высоких цифр (несколько тысяч в 1 мм 3) . До 90% его клеточного состава составляют нейтрофиллы. Содержание белка невысокое. Показатель уровня сахара умеренно снижен. Уровень глобулинов в ликворе значительно повышен (реакция Нонне-Апельта резко положительная).
Спиномозговая жидкость подлежит общеклиническому, бактериологическому и биохимическому исследованию, для чего готовится 3 пробирки. Ликвор в 4-й пробирке остается в отделении. За ним устанавливается наблюдение на предмет образования пленки, характерной для туберкулезного менингита.
Рис. 3. На фото слева вид ликвора при гнойном менингите. На фото справа менингококки из спинномозговой жидкости (бактериоскопия) больного менингитом.
Диагностика менингококковой инфекции с использованием биохимических методов исследований
При генерализованных формах менингококковой инфекции исследуется кислотно-основное состояние и электролиты плазмы крови. При менингококковом сепсисе контролируются показатели свертывающей системы крови и проводятся почечные тесты.
Диагностика менингококковой инфекции с использованием бактериоскопического метода исследования
Анализ на туберкулез методом прямой бактериоскопии является наиболее простым и быстрым способом обнаружения микобактерий в исследуемом материале. Выявить наличие возбудителя можно в течение одного часа. Данная методика используется для экспресс диагностики.
Для бактериоскопического исследования применяется мазок, взятый из носоглотки, толстая капля крови и ликвор. Мазки окрашиваются по Граму или обрабатываются метиленовым синим.
Менингококки представляют собой диплококки (сдвоенные кокки бобовидной формы) размером от 0,6 до 0,8 мкм. При окрашивании по Граму приобретают розовую окраску (грамотрицательные). Располагаются внутри и внеклеточно.
- Мазок из носоглотки берется натощак специальным стерильным тампоном, укрепленным на алюминиевой проволоке.
- При приготовлении мазков из спинномозговой жидкости обращают внимание на внешний вид биологического материала. При гнойном характере ликвора мазки готовятся из осадка, который получают при центрифугировании материала.
- Кровь для бактериоскопического исследования берется при ее заборе из вены. Далее готовится препарат толстой капли, который окрашивается метиленовым синим.
Рис. 4. На фото Neisseria meningitidis (вид под микроскопом). Окраска по Граму.
Рис. 5. Приготовление мазков толстой капли. В препарате (фото справа) видны менингококки, окрашенные в темно-синий цвет (окраска метиленовым синим).
Рис. 6. Менингококки в цитоплазме нейтрофильного лейкоцита у больного тяжелой генерализованной формой менингококковой инфекции.
Диагностика менингококковой инфекции с использованием бактериологического метода исследования
Анализ на менингококк методом посева биологического материала (культуральный метод) более чувствителен, чем бактериоскопия. Для исследования используются мазки носоглоточной слизи, кровь, плевральная жидкость и ликвор. Ответ врач получает через 4 суток.
Менингококки хорошо растут на средах, которые содержат нативный белок (сыворотка и кровь, асцитическая жидкость, яичный белок). Оптимальная температура роста 38-36 ° С. На простых средах микробы не растут. Neisseria meningitidis являются аэробами (живут и развиваются только в присутствии кислорода). Для получения чистой культуры в питательные среды добавляют антибиотики, которые подавляют рост сопутствующей микрофлоры. После получения роста колоний менингококков проводится тест на чувствительность к антибиотикам.
Рис. 7. Neisseria meningitidis при росте на сывороточном агаре. Колонии менингококков слегка выпуклые, полупрозрачные, с гладкой поверхностью и ровными краями, в проходящем свете имеют голубоватый оттенок.
Диагностика менингококковой инфекции с использованием серологических методов исследования
Серологические исследования используются для выявления антител в организме человека, вырабатываемых против антигенов менингококков. Данная методика используется для ретроспективной диагностики и применяется с интервалом от 7 до 12 дней. С целью обнаружения антигенов возбудителя используются реакции агглютинации.
В последнее время для выявления специфических антител в крови больного или спинномозговой жидкости стали применяться экспресс-методики:
- методика иммунофлюоресценции,
- реакция энзиммеченых антител,
- реакция преципитации в геле,
- иммуноэлектрофорез с групповыми преципитирующими антисыворотками,
- методика встречного иммуноэлектрофореза (ВИЭФ),
- иммуноферментный анализ (ИФА),
- радиоиммунологические методы.
Применение ПЦР для диагностики менингококковой инфекции
Диагностика коклюша с применением ПЦР (полимеразной цепной реакции) является самой перспективной методикой в современных условиях. Высокая чувствительность теста позволяет выявлять ДНК бактерий, даже если в исследуемом материале их несколько десятков и даже единиц. Данный метод является высокоспецифичным. Его особая ценность заключается в том, что выявление менингококков в биологическом материале становится возможным, когда другие методы исследования дают отрицательный результат.
Рис. 8. Методика ПЦР является высокоспецифичной и позволяет выявлять ДНК бактерий, даже если их в исследуемом материале несколько десятков и даже единиц.
Использование дополнительных методов исследования
Из дополнительных методов исследования применяются электрокардиограмма (ЭКГ), фонокардиография (ФКГ), электроэнцефалограмма (ЭЭГ), компьютерная томография головного мозга (КТ), нейросонография (НСГ), цветовое доплеровское картирование и др.
При необходимости к обследованию больных привлекаются врачи разных специальностей — окулисты, отоларингологи, невропатологи.
Рис. 9. Электроэнцефалограмма позволяет выявлять структурные изменения в головном мозге.
Рис. 10. Компьютерная томография головного мозга позволяет выявлять наличие гематом, гидроцефалию и другие объемные поражения, локализующихся в головном мозге.
Рис. 11. Электрокардиограмма позволяет исследовать и регистрировать электрические поля, образующиеся при работе сердца.
Рис. 12. Нейросонография (ультразвуковое исследование) используется для исследования у детей в возрасте до 1-го года структур полости черепа.
Дифференциальная диагностика менингококковой инфекции
- Менингококковый менингит следует дифференцировать с менингитами, вызванными стафилококками, стрептококками, клебсиеллами, синегнойной и гемофильной палочками, грибами, тяжелой формой дизентерии, сальменеллеза и брюшного тифа.
- Менингококцемию, протекающую с сыпью, следует отличать от краснухи, кори, скарлатины, иерсиниоза, геморрагических васкулитов, тромбопенических состояний и сепсиса.
- Менингококковую инфекцию, протекающую с поражением центральной нервной системы, следует дифференцировать от острых респираторных вирусных инфекций, в том числе гриппа, протекающих с явлениями поражения головного мозга и его оболочек.
Рис. 13. На фото менингококцемия у взрослого.
Ранняя диагностика менингококковой инфекции и своевременно начатое лечение обеспечивает благоприятный исход заболевания.
[youtube.player]к приказу Минздрава СССР
от 1 декабря 1986 г. N 858
Методические указания
по микробиологической диагностике менингококковой инфекции и бактериальных менингитов
1. Показания к лабораторному исследованию
Лабораторная диагностика менингококковой инфекции и ГМ осуществляется бактериологическим методом путем выделения и идентификации возбудителя, серологическим - путем выявления специфических антигенов в жидкостях организма (ликвор, кровь, синусоидальная жидкость и др.) или антител в сыворотке крови *(1). Лабораторное обследование проводят с диагностической целью и по эпидемиологическим показаниям. С диагностической целью обследуют больных с клинически выраженной формой заболевания, стертой формой (назофарингит) и с подозрением на менингококковую инфекцию и менингиты иной этиологии.
По эпидемиологическим показаниям обследуют лиц, бывших в контакте с больными менингококковой инфекцией.
2. Микробиологическая диагностика менингококковой инфекции и других гнойных бактериальных менингитов
В связи с тем, что наряду с менингококками, наиболее частыми этиологическими факторами ГМ могут быть пневмококки, а у детей младшего возраста Н. influenzae и др. возбудители, представляется целесообразным изложение основных дифференциально-диагностических признаков и методов выделения этих микроорганизмов. По классификационной систематике бактерий Bergey (1 том, 1984), менингококи # принадлежат к семейству Neisseriaceae роду Neisseria. Род нейссерий включает два вида патогенных микроорганизмов: N. meningitidis и N. gonorrhoeae, остальные представители этого рода являются резидентной флорой слизистых оболочек. К последним относятся пигментообразующие, объединенные в один вид N. subflava, а также N. sicca, N. mucosa, N. flavescens, N. lactamica. Катаральный диплококк выделен в род Moraxella и обозначен как Moraxella (Branhainella) catarrhalis.
Менингококки требовательны к условиям культивирования. При росте требуют повышенной влажности и 5-10% содержания CO2 в воздухе, чувствительны к малейшим отклонениям температуры. В качестве источника пативного белка рекомендуется применять сыворотку крупного рогатого скота, лошадиную или кровь любого другого животного. Основой для приготовления сред могут служить бульоны на основе гидролизата мяса по Хоттингеру, "эритрит-агар", агар АГВ, сухой питательный агар специального назначения, выпускаемый Дагестанским институтом питательных сред или "Аминопептид для микробиологических питательных сред" (жидкий, производства Ставропольского мясоконсервного комбината, ТУ-92-14/356-80).
Идентификация вида N. meningitidis основана на комплексе морфологических, тинкториальных, культурных и биохимических признаков (табл. 1). При первом выделении клеткам менингококков свойственен полиморфизм, который проявляется в различной величине и разной интенсивности окрашивания микробных клеток. Колонии менингококков имеют маслянистую консистенцию, легко снимаются петлей со среды, что отличает их от колоний непатогенных нейссерий, имеющих крошащуюся или тянущуюся консистенцию. Некоторые штаммы, выделенные из СМЖ, могут обладать слабой ферментативной активностью в отношении глюкозы или мальтозы или обоих углеводов. Большинство непатогенных видов нейссерий, в отличие от патогенных, способны при выращивании на сывороточном агаре с 5% сахарозы образовывать крахмалоподобное вещество (полисахарид), выявляемое с помощью водного раствора Люголя, в виде появления бурого окрашивания культуры.
Менингококки делятся на следующие серогруппы: А, В, С, X, Y, Z, 29Е и 135W. Проведение серологического группирования менингококков является обязательным для практических лабораторий, как одна из мер эпидемиологического надзора за менингококковой инфекцией.
Наличие ферментов оксидазы и каталазы присуще всем нейссериям и М. catarrhalis в отличие от гемофилов и пневмококков, что может служить дифференцирующим признаком при их идентификации в сочетании с другими (табл. 2).
Пневмококки и гемофилы, как и менингококки, являются высокотребовательными к культивированию микроорганизмами. В качестве фактора, способствующего их росту используют кровь различного происхождения. Поэтому универсальной средой для всех возбудителей может служить "шоколадный" агар.
Культуральные и биохимические свойства нейссерий и М. catarrhalis
К - образование кислоты; (-) - редко;
** - тест используют как дополнительный при дифференциации непатогенных нейссерий
Примечание: приготовление питательных сред, дифференциально-диагностических (среды с углеводами), приготовление реактивов для исследования редукции нитратов и нитритов, постановка этих реакций и учет. См. приказ МЗ СССР N 535 от 22 апреля 1985 г. "Об унификации микробиологических (бактериологических) методов исследования".
Свойства основных возбудителей менингитов, учитываемые через 24 часа от начала бактериологического исследования
* В каплю 3% раствора КОН вносят петлю (колонию) культуры, эмульгируют. Образование в капле студенистой массы, тянущейся за петлей указывает на наличие грамотрицательной флоры (-), крошащуюся консистенцию образует грамположительная флора (+).
** Постановка реакции на оксидазу, каталазу, уреазу см, приказ МЗ СССР N 535.
3. Бактериологическое исследование спинномозговой жидкости больного
3.1. 1-й день исследования. Спинномозговую жидкость (СМЖ) в количестве 2-5 мл берут у больного сразу же при поступлении в стационар с соблюдением всех правил асептики. Взятие ликвора проводится персоналом в масках.
Первую порцию СМЖ (около 1 мл) берут в отдельную пробирку для проведения общего ликворологического исследования. Вторую порцию, предназначенную для бактериологического исследования, наливают в стерильную центрифужную или агглютинационную пробирку. Касаться руками краев канюли и краев пробирки нельзя. Ватную пробку полагается держать на весу за ее наружную часть. Если немедленно доставить жидкость в лабораторию невозможно, допустимо хранение в течение нескольких часов в термостате при температуре 37° или в термосе. Во время транспортировки СМЖ следует тщательно предохранять от охлаждения (например, доставлять в термосе). СМЖ исследуют немедленно при доставке в лабораторию. Стерильной пастеровской пипеткой со дна пробирки берут 0,3-0,5 мл материала и по 2-3 капли засевают на поверхность 2 чашек Петри с подогретой питательной средой, растирая шпателем. Одна чашка содержит "шоколадный" агар, вторая - сывороточный. Посевы ставят в термостат при 37° и создают условия повышенного содержания CO2 в воздухе.
Спинномозговую жидкость, оставшуюся в пробирке, используют для посева на среду "обогащения" (полужидкий агар) и одновременно в реакции встречного иммуноэлектрофореза *(2.) (п.11.3).
Оставшийся в пипетке материал используют для приготовления мазков. Отношение к окраске по Граму у нейссерий выражено недостаточно четко, поэтому они окрашиваются метиленовой синью или по Граму в модификации Калины. Прямая микроскопия окрашенных мазков спинномозговой жидкости в известной части случаев позволяет установить наличие бактерий, вызывающих гнойный менингит. Морфология менингокков описана выше. Н. influenzae видна в виде мелких полиморфных грамотрицательных палочек и нитей, окруженных еле заметной нежной капсулой. Пневмококки имеют вид ланцетовидных диплококков и коротких цепочек, образуют капсулу. Они грамположительны, хорошо красятся всеми анилиновыми красками, при этом капсула остается неокрашенной и заметна только на окрашенном фоне *(3). Результаты бактериоскопии немедленно сообщают лечащему врачу в виде предварительного ответа. При достаточном количестве исследуемого материала рекомендуется 2-3 капли засеять на чашку с питательной средой для определения чувствительности к антибиотикам.
3.2. 2-й день исследования. Независимо от результатов бактериоскопии ликвора просматривают засеянные чашки. Просмотр чашек ведут визуально и с помощью бинокулярного стереоскопического микроскопа, лупы МБС. Во внимание принимают все колонии. Чашки с отсутствием роста инкубируют дополнительно одни сутки. Готовят препараты-мазки, окрашивают, ставят реакцию с 3% раствором КОН и биохимические тесты - на оксидазу, каталазу, уреазу. Гемофилам присущ резкий специфический запах, исходящий от посевов.
Морфология менингококковых колоний на сывороточном агаре описана во всех руководствах по микробиологии. На "шоколадном" агаре колонии нежные, сероватого цвета, с блестящей поверхностью и ровными краями, имеют маслянистую консистенцию, размерами от 0,1 до 3,0 мм. Менингококки не меняют цвета среды. На основании микроскопии мазков из колоний и результатов первичных биологических тестов возможна выдача предварительного ответа. Если в мазках обнаружены грамотрицательные кокки, это дает право отнести их к роду нейссерий и провести дифференциацию видов.
Гемофилы на "шоколадном" агаре дают довольно обильный рост. Колонии серого цвета, плоские диаметром 0,2-2,0 мм, легко снимаются со среды. В мазках, окрашенных по Граму, видны мелкие короткие грамотрицательные палочки с капсулой разной степени выраженности, а также нити разной длины, и короткие цепочки. На сывороточном агаре Н. influenzae не растет *(4). Крупные (3-5 мм) колонии, содержащие грамотрицательные палочки, подозрительны на энтеробактерии. Candida и P. aeruginosa растут обильно на всех средах, не изменяя цвета "шоколадного" агара.
Колонии пневмококков на обеих средах - мелкие (диаметром 0,1-1,0 мм),иногда плоские, с вдавлением в центре. На "шоколадном" агаре они окружены зоной желто-зеленого гемолиза (тип альфагемолиза). По внешнему виду колонии пневмококков на обеих средах трудно отличить от колоний стрептококков группы В, зеленящих стрептококков, энтерококков (S. feacalis), которые в редких случаях могут вызвать менингит, особенно у детей 1 года. В мазках из колоний пневмококки имеют овальную или шаровидную форму, располагаются парами или в виде коротких цепочек из 2-3 пар.
Если имеется обильный рост одинаковых колоний, то допустим одномоментный отсев на дифференциально-диагностические среды, изучение культуры по ряду признаков и антибиотикочувствительность (табл. 1, 2). Определение чувствительности энтеробактерии и стафилококков проводят на среде АГВ. Эта среда служит основой для определения чувствительности к антибиотикам менингококков, при добавлении 20% сыворотки, Н. influenzae и пневмококков - при добавлении соответствующего количества крови. Приготовление питательных сред и постановка теста на антибиотикочувствительность производится в соответствии с действующими указаниями *(5).
В таблице 2 суммировано минимальное число признаков, достаточное для того, чтобы выделенные из СМЖ бактерии предположительно отнести к тому или иному таксону (от семейства до вида) и избрать дальнейший путь идентификации. На этом этапе возможна выдача предварительного (а для Н. influenzae окончательного) ответа.
Колонии, подозрительные на менингококки, отсевают на скошенный сывороточный агар или сектор этой среды в чашке на бессывороточный агар и помещают в термостат при 37°. Колонии, подозрительные на пневмококки и др. стрептококки, отсевают на 2 сектора кровяного агара (с 5% крови) для последующего определения чувствительности к желчи и постановки тестов на лекарственную чувствительность.
Если число выросших колоний мало (1-2), то их отсевают на чашку с сывороточным или "шоколадным" агаром для накопления микробной массы, а идентификацию микроба проводят еще через одни сутки.
При менингитах новорожденных и детей раннего возраста, а также изредка и в других возрастных группах, помимо трех перечисленных видов микроорганизмов этиологическими факторами могут быть энтеробактерии (Е. cjli, S. marcesctns, К. pneumonift, Salmonella, Citrobacter, Enterobacter), синегнойная палочка (P. aeruginosa, Acinetobacter calcoaceticum, Listeria monocytogenes, различные стрептококки гемолитические группы В, "зеленящие" и энтерококки, а также стафилококки (золотистый и эпидермальный) и грибы рода Candida.
При подозрении на энтеробактерии *(6), синегнойную палочку *(7), стафилококк *(8) и Ac. calcoaceticum проводят исследования в соответствии с имеющимися методическими материалами +.
При подозрении на листерии в этот день, если число колоний позволяет, ставят ряд проб, а также тест на чувствительность к антибиотикам. Для L. monocytogenes помимо признаков, указанных в табл. 2, характерно: подвижность при комнатной температуре, разложение мальтозы, глюкозы, инактивность по отношению к дульциту, манниту, сорбиту и арабинозе. Сахароза и глицерин разлагаются медленно. L. monocytogenes образуют краевую зону гемолиза на arape с 5% бараньей крови, разлитом слоем 3 мм.
Для идентификации Candida albicans делают посев из подозрительных белых выпуклых колоний, состоящих из дрожжевых клеток, на среду Сабуро или мясо-пептонный агар, содержащий по 100 ME/мл пенициллина и стрептомицина.
Если прямой посев на чашки с питательной средой не дал роста колоний, то делается высев на чашки с сывороточным "шоколадным" агаром из инкубированной в термостате смеси ликвора с полужидким агаром (среда "обогащения").
При отрицательных результатах высев со среды "обогащения" повторяют через 1-2 дня в течение 7 дней инкубации в термостате.
При получении роста колоний исследование их проводят тем же путем, что и при прямом посеве спинномозговой жидкости.
3.3. 3-й день исследования. Культуры, отсеянные из отдельных колоний, просматривают под МБС и ставят пробу с 3% раствором КОН. Для оценки чистоты выросшей культуры готовят мазки и просматривают. При обнаружении морфологически типичных грамотрицательных кокков, проводят идентификацию (см. табл. 1), серогруппирование идентифицированной культуры (п. 11), а также используют эту культуру для определения лекарственной устойчивости (если эти тесты не были сделаны на 2-й день).
Учитывают результаты посевов, сделанных на 2-й день исследования. На этом этапе возможна выдача окончательного положительного ответа для менингококков и др. микроорганизмов (кроме пневмококков и стрептококков).
Для дифференциации пневмококков, зеленящих и фекальных стрептококков (энтерококков) после микроскопии чистых культур на секторах кровяного агара учитывают характер гемолиза вокруг выросших колоний и ставят дополнительно пробы *(9) (см. табл. 3).
На одних из двух секторов кровяного агара с ростом колоний накладывают диск из фильтровальной бумаги, пропитанной 20% раствором желчи (на физиологическом растворе), после чего чашку помещают при 37° на 1-2 часа. По истечении этого времени вокруг диска колонии пневмококков лизируются, образуя зону отсутствия роста шириной 1-2 мм, в то время как рост прочих стрептококков остается интактным. При положительной пробе чувствительности к желчи, при условии типичной морфологии клеток и колоний, можно дать положительный ответ о выделении пневмококков. Рост культуры на 2-м секторе кровяного агара используют для постановки пробы на чувствительность к лекарственным препаратам (если это не было сделано ранее).
При отрицательных результатах пробы на чувствительность к желчи, рост на 2-м секторе используют не только для испытания чувствительности к химиопрепаратам, но и для постановки ряда тестов, дифференциирующих # стрептококки (см. табл. 3).
Дифференцирующие свойства стрептококков, вызывающих менингит
| Виды Свойства | S, pneumoniae | S. faecalis (гр. Д) | S. agalactiae (гр. В) | "Зеленя- щие"* |
| Гемолиз на 5% кровяном агаре Лизис на кровяном агаре Рост после прогрева при Читайте также:
|


