Микропрепараты спирохет окрашивают по методу
Большинство красок, применяемых в микробиологии, принадлежат к производным бензола и добываются из каменноугольной смолы.
Красители применяемые в микробиологии, являются солями двух типов: 1) кислые красители – это те, у которых ион, придающий окраску (хромофор), является анионом (примером может служить эозин); 2) основные красители – те, у которых роль хромофора играет катион (примером может служить метиленовый синий).
Красители первого типа являются кислыми потому, что хромофор, будучи кислотой, при образовании придающей окраску соли, связывается с основанием (NaOH).
Красители второго типа называются основными потому, что хромофор, будучи основанием, при образовании соли связывается с кислотой (HCl)/
Как правило, кислые красители связываются более интенсивно с цитоплазменными (основными) компонентами клетки, а основные – с ядерными (кислыми).
Действие некоторых красителей не зависит от образования солей или других химических соединений с окрашиваемым материалом. Они просто покрывают поверхность, адсорбируясь, растворяясь или осаждаясь в материале.
В процессе окрашивания играют роль как физические, так и химические факторы
Существуют простые и сложные методы окрашивания микропрепаратов.
Для простого метода окрашивания микропрепаратов чаще всего пользуются основными анилиновыми красителями. Очень широко применяют метиловый синий, основной фуксин, кристаллический фиолетовый, тионин.
Простой метод окрашивания может быть применен как для окрашивания убитых микробных клеток в фиксированных микропрепаратах, так и для прижизненной окраски микроорганизмов.
Прижизненной окраской следует считать лишь такую, при которой окрашенные организмы длительное время остаются живыми и способными к размножению. Существует несколько способов прижизненной окраски, в том числе и способ Nakanischi.
При этом способе чистое предметное стекло обливают насыщенным водным раствором метиленовой сини, высушиваю и обтирают сухой тряпочкой до тех пор, пока налет краски не примет светло – голубого оттенка. На покровном стекле приготовляют мазок из исследуемых микробов, после чего не высохший до конца препарат накладывают на предметное стекло с красителем. При помощи микроскопа можно наблюдать, как микробы, оставаясь живыми, не теряя своей активной подвижности (если таковой обладают), постепенно окрашиваются в синий цвет.
Этот метод ценен тем, что при его применении отсутствует опасность образования искусственных продуктов обработки, в возможности выявления некоторых функциональных особенностей микробной клетки.
Среди простых методов окраски существуют как позитивные, так и негативные способы окрашивания.
К простым позитивным методам окраски относится окраска по методу Лнеффлера, а к негативным – окрашивание по методу Бури.
Для окраски по методу Леффлера (Loffler) можно применить раствор метиленового синего (краситель Леффлера), который позволяет выявить многие детали формы и структуры микроорганизмов. Краситель Леффлера представляет собой смесь двух растворов А и Б.
Раствор А: метиловый синий – 0,3г, этиловый спирт – 30,0мл.
Раствор Б: КОН (0,01%) – 100мл.
Смесь хорошо сохраняется во флаконе с притертой стеклянной пробкой.
Для получения более чистых препаратов, краску можно наливать на мазок покрытый фильтровальной бумагой, или использовать фильтровальную бумагу заранее пропитанную красителем и высушенную. В таком случае на фиксированный мазок накладывают полоску сухой пропитанной красилелем фильтровальной бумаги, а затем на бумагу пипеткой наносят несколько дистиллированной воды и пинцетом или шпателем прижимают фильтровальную бумагу к стеклу. Краситель вымывается из бумаги и окрашивает мазок. По истечении времени окрашивания, фильтровальную бумагу снимают, препарат промывают осторожно струей воды, высушивают и микроскопируют.
В правильно окрашенном и хорошо промытом препарате поле зрения остается светлым и чистым, а окрашенными будут только микробные клетки.
Помимо позитивных способов окраски в некоторых случаях применяются негативные (контрастные) способы. В этом случае микроорганизмы, в которые краситель не проникает, выглядят как светлые частички на равномерно окрашенном фоне.
По способу Бури фон препарата заливают жидкой тушью. Тушь не является истинным красителем, поэтому тела микробов остаются неокрашенными; вследствие чего получается как бы негативное их изображение.
При этом способе тушь разбавляют водой в соотношении 1:9, 1:1 или 1:2.
Поскольку тушь сама по себе может содержать бактерии, ее стерилизуют, добавляя несколько капель формалина или автоклавируют 30 минут при 110 градусах. Перед употреблением подготовленная тушь (разбавленная и стерильная) должна в течение двух – трех недель сохраняться в спокойном состоянии, чтобы осели взвешенные в ней частицы. При приготовлении тушевых препаратов используется верхняя часть отстоявшейся жидкости.
Каплю черной туши наносят на предметное стекло и тщательно смешивают с каплей микробной взвеси. Смесь тонким слоем размазываю по поверхности предметного стекла краем покровного стеклышка. Когда темный слой высохнет, препарат фиксируют и исследуют с помощью микроскопа. Микробные клетки видны в виде бесцветных телец а темном фоне препарата.
Кроме жидкой туши для негативного окрашивания можно использовать водные растворы конгорот (3%0, нигрозина (10%) и некоторых других красителей. Окрашивание негативными красителями можно проводить двумя способами: либо раствор красителя наносить на сухой фиксированный мазок, после промывки водой и высушивания микроскопировать; либо каплю исследуемой суспензии микробов смешивают с красителем, накрывают покровным стеклом и микроскопируют. И в том, и в другом случае микробные клетки будут бесцветными.
Простой метод позитивного или негативного способа окраски микроорганизмов очень удобен для самых разнообразных целей (изучение формы и расположения клеток, определение размеров, обнаружение капсул у микробных клеток в мазках – отпечатках из органов инфицированного организма и пр.).
Однако простой метод окраски не позволяет дифференцировать микроорганизмы (в том числе и бактерии) сходные по форме и размерам, но принадлежащие к различным видам, простой метод окраски не позволяет обнаружить зрелые споры и цисты, высыпавшиеся из клетки в окружающуюся среду, простой метод окраски не позволяет обнаружить клетки со сложной структурой оболочки и пр.
В силу этого большую ценность представляют сложные методы окраски, позволяющие получить представление не только о форме, размерах, расположении клеток друг относительно друга, по позволяющие дифференцировать микробы и определять структурные детали микробных клеток.
Этот способ окраски называют дифференциальной окраской. В основе дифференциации микробов по Грамму лежит свойство клеточной оболочки и цитоплазматической мембраны.
Основой клеточной стенки грамположительных и грамотрицательных микроорганизмов является пептидогликан. У грамположительных микробов пептидогликан имеет несколько слоев, у грамотрицательных - он однослоен.
У грамположительных микробов, обладающих плотным и многослойным пептидогликаном, образовавшийся комплекс при окраске кристаллическим фиолетовым и последующей обработке йодным раствором не вымывается спиртом, и клетки не обесцвечиваются и сохраняют фиолетовый цвет. В то время как грамотрицательные микробы, имея тонкий слой пептидогликана, обесцвечиваются спиртом. При дополнительной окраске фуксином или сапранином грамотрицательные клетки окрашиваются в сиреневато – красный цвет.
Показатели дифференциации грамположительных и грамотрицательных микроорганизмов:
Грамположительные микроорганизмы не чувствительны к действию желудочного сока, имеют не сложную структуру. Резистентные к щелочам, чувствительны к лизоциму, пенициллину, йоду. Иммуногенные свойства выражены слабо, оптимум роста при относительно высоком рН. В живом состоянии более проницаемы для красителей, чувствительны к электролитам. Могут быть кислотоустойчивыми и могут образовывать споры. Имеют многослойный пептидогликан и могут содержать тейхоевые кислоты. Клеточная стенка пористая, содержит мало белков, пептиды по составу аминокислот однообразны. Липидов мало, много гликопротеидов (99%).
Грамотрицательные микроорганизмы в большинстве случаев растворяются под действием желудочного сока, растворяются в 1% растворе КОН, чувствительны к кислотам. Малочувствительны к лизоциму, пенициллину, йоду. Хорошо выражены иммуногенные свойства. Оптимум роста при низком рН среды. В живом состоянии плохо проницаемы для анилиновых красителей. Резистентны к слабым электролитам, спор не образуют. Основой клеточной стенки является однослойный пептидогликан, тейхоевая кислота отсутствует. Клеточная стенка малопористая, имеет сложную структуру, содержит все аминокислоты. Липидов много (до 22%), гликопротеидов мало (5 – 9%).
Растворы для окраски по методу Грамма:
1. Раствор А – кристаллический фиолетовый – 2,0г, этиловый спирт 95% - 20,0мл.
2. Раствор Б – щавелевокислый аммоний – 0,8г, дистиллированная вода – 80,0 мл.
Раствор А разводят дистиллированной водой (1:5) и затем смешивают его с равным объемом раствора Б.
3. Раствор Люголя – йод кристаллический – 1г, йодистый калий – 2,5г, дистиллированная вода – 80,0мл. Эту смесь оставляют на 24 часа для растворения йода.
4. Раствор для дополнительной окраски – сапранин или фуксин (2,5% раствор в 95% спирте) – 25 мл. Дистиллированная вода – 75мл.
Методика окраски по методу Грамма:
1. Фиксированный мазок, содержащий микробные клетки, окрасить генцианвиолетом (2 минуты).
2. Слить генцианвиолет, после чего нанести на препарат раствор Люголя (2 минуты).
3. Осторожно слить раствор Люголя и промыть препарат 95% этиловым спиртом (30 секунд. Клетки с многослойным пептидогликаном останутся окрашенными генцианвиолетом, с однослойным пептидогликаном – обесцветятся).
4. Препарат осторожно промыть струей воды.
5. Мазок окрасить раствором фуксина или сапранина (1 – 2 минуты).
6. Препарат осторожно промыть струей воды, высушить на воздухе при комнатной температуре или в потоке теплого воздуха над пламенем горелки, или осторожно промокнуть фильтровальной бумагой.
7. Препарат исследовать при помощи микроскопа.
К сложным дифференциально – диагностическим методам окраски относится также и окраска по методу Циль – Нильсена (Ziehl – Naelsen), позволяющая отличить кислотоустойчивые микроорганизмы от других, не обладающих этим свойством.
Этот метод применяется главным образом для выявления кислотоустойчивых микроорганизмов, имеющих своеобразный химический состав, а именно – высокое содержание в клетке липидов. Окраска по Циль – Нильсену применяется для окраски микобактерий туберкулеза и родственных им микроорганизмов из рода Mycobacterium.
Приготовление и окраска микопрепарата по Циль – Нильсену проводится следующим образом:
1. Готовят обычным способом фиксированный мазок из исследуемого материала (мокрота больного или чистая культура).
2. На фиксированный мазок кладут фильтровальную бумагу и на нее наливают раствор карболового фуксина. Предметное стекло зажимают в пинцет Корне и препарат в течение 4-х минут нагревают над пламенем горелки (по мере испарения жидкости раствор красителя добавляется).
3. Через 4 минуты (по окончанию прогревания) фильтровальную бумагу осторожно снимают с препарата и на мазок на 30 секунд наносится 5 – 10% раствор серной или соляной кислоты приготовленный на 95% этиловом спирте.
4. Через 30 секунд препарат осторожно промывают струей холодной воды и дополнительно докрашивают раствором метиленовой сини.
Механизм окраски кислотоустойчивых микроорганизмов по Циль – Нильсену можно объяснить следующим образом: во время нагревания препарата воск, входящий в состав оболочки, размягчается, и благодаря этому краситель проникает в бактериальную клетку. Остывая, этот воск удерживает краситель, поэтому спирт, с кислотой вымывают краситель только из клеток, не обладающих кислотоустойчивостью. При дополнительной окраске метиленовым синим окрашиваются обесцвеченные клетки и на этом синем фоне будут отчетливо видны кислотоустойчивые бактерии, окрашенные в красный цвет.
Растворы для окраски по Циль – Нильсену:
1. Раствор А – основной фуксин – 0,3г, этилдовый спирт 95% - 10,0мл.
2. Раствор Б – фенол (расплавленные кристаллы) – 5,0г, дистиллированная вода – 95,о мл.
3. Раствор метиловой сини Леффлера или бриллиантовой зелени.
Растворы А и Б смешивают (карболовый фуксин). Смесь хорошо сохраняется.
В микроскопической практике при изучении мазков – отпечатков из органов, мазки из крови, при изучении спирохет, простейших, хламидий, культур тканей широко применяется еще один сложный метод окраски – окраска по Романовскому – Гимза.
Методика окраски по Романовскому – Гимза:
1. Препарат высушивается, фиксируется в жидком фиксаторе (метанол 3 – 5 минут).
2. Препарат высушивают и помещают в стаканчик с рабочим раствором красителя (экспозиция 20 25 минут при 37 градусах , концентрация раствора краски и экспозиция должны быть титрованы). Перекрашенный мазок дифференцируется этиловым спиртом (50 – 60 градусным), споласкивается осторожно водой, высушивается и микроскопируется.
Растворы красителей для окраски по Романовскому – Гимза:
1. Вариант А. Готовят раствор – 3,8г сухой краски, состоящей из смеси эозина и метиленовой сини, растворяют в 250 мл чистого метилового или этилового спирта. Раствор оставляют на несколько дней, часто взбалтывая для лучшего растворения краски. Затем добавляют 250 мл чистого глицерина и оставляют на 3 – 5 дней часто взбалтывая. Полученный раствор – краска Романовского – Гимза.
Перед употреблением краску оттитровывают в разведениях 1:1, 1:2, 1:3 и т.д., приготовленных на дистиллированной воде в течении 20 – 25 минут.
2. Вариант Б. Применяют окраску азур – эозином.
а) 1 г сухой краски Романовского – Гимза (азур и метиленовая синь) растворяют в одном литре дистиллированной воды.
б) 1 г эозина растворяют в одном литре дистиллированной воды.
Эти два раствора хранят отдельно в темном месте в стеклянных емкостях с притертыми пробками.
Для окрашивания препаратов ex tempore готовят рабочий раствор:
10 мл дистиллированной воды
4 мл раствора эозина
8 мл раствора краски Романовского
Необходимым условием для получения хорошей окраски препаратов является качество воды (рН воды должно быть нейтральным).
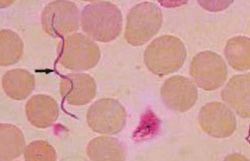
Микроорганизмы – спирохеты – в организме больного человека находятся в межтканевом пространстве, между соединительнотканными волокнами, окружают русла лимфатических и кровеносных сосудов. Чтобы точно определить наличие возбудителя сифилиса, необходимо забрать материал для исследования именно оттуда. Конечно, забирать материал имеет смысл только элементов сыпи (в особенности с эрозий и язвочек), с поверхности шанкров и со слизистых оболочек гениталий, ротовой полости и прямой кишки. Кроме того, существуют и альтернативные способы, например, пункция лимфатических узлов.
Чтобы мазок на сифилис получился удачным, перед взятием диагностического материала с поверхности язвы или эрозии нужно убрать все лишние загрязнения с помощью марлевого тампона, пропитанного физиологическим раствором. После подсушивания поверхности элемента на его поверхность начинает просачиваться жидкость, в большом количестве содержащая возбудителя болезни. Ускорить процесс можно с помощью мягкого надавливания на элемент (разумеется, в резиновых перчатках). После этого с помощью предметного стекла изготовляется мазок на сифилис, который после обработки микроскопируется. Чтобы получить материал из неподверженных эрозии высыпаний, используется метод поскабливания их скальпелем или стерильной бритвой.
Одним из наиболее перспективных и дешевых методов диагностики сифилиса является микроскопия трепонем в темном поле. При этом препарат не высушивается, исследование проводят в капле обычного изотонического раствора соли. На предметное стекло направляют узким пучком яркий свет (его получают с помощью специального прибора – конденсатора). Свет при этом падает на препарат практически сбоку, в объективе при этом видно темное поле. Однако микробные тела, находящиеся в препарате, преломляют и отражают свет – в результате возникает крайне интересный оптический эффект (основанный на феномене Тиндаля) – трепонемы начинают выглядеть как светящиеся подвижные спирали с несколькими завитками.
Данный способ (в отличие от окраски по Граму) позволяет получить хорошо различимое изображение микробного тела при микроскопии – это один из наиболее достоверных методов диагностики сифилиса. Исследование проводится следующим образом: полученный мазок на сифилис фиксируют в реактиве Никифорова (смесь равных долей этилового спирта и эфира), затем окрашивают с помощью пигмента Романовского – Гимзе в течение 2-5 часов. После прокрашивания мазка его сушат при температуре 25-28 градусов и исследуют под микроскопом в иммерсионной среде (специальном иммерсионном масле, практически не преломляющем лучи света). В результате окраски по Романовскому – Гимзе возбудитель сифилиса приобретает розовый оттенок цвета, в то время как остальные спирохеты окрашиваются в синие и фиолетовые тона.
Пожалуй, один из наиболее быстрых методов микроскопической диагностики сифилиса. Для своего осуществления требует нескольких реактивов:
- первый – уксусная кислота (охлажденная), формалин 40% и 100 мл стерильной воды;
- второй – танин, сто мл карболовой кислоты и столько же дистиллированной воды;
- третий – сто мл раствора нитрата серебра в воде.
Импрегнацию трепонем серебром (серебрение по Морозову) проводят следующим образом: мазок высушивают, заливают первым реактивом на одну минуту, после чего предметное стекло промывают водой. Затем наступает очередь второго реактива – стекло при этом нагревают на 1 минуту в пламени спиртовки (умеренно). После промывания стекло вновь нагревают до окраски мазка в коричневый цвет. Затем снова следует тщательное отмывание, сушка и исследование в иммерсионной среде. Бледные трепонемы после серебрения по Морозову выглядят черными или темно-коричневыми неподвижными микробными телами. Все морфологические свойства их сохраняются в достаточной степени для достоверной идентификации.



После того, как фиксация препарата в формалине или спирте проведена, перед тем как приступить к микроскопированию значимым оказывается следующий этап подготовки материала. Окраска микропрепаратов проводится для детального изучения структуры клеток при наблюдениях в микроскоп . Этот процесс может применяться и к микроорганизмам. Бывают простые и сложные дифференциальные способы окрашивания, о которых поговорим в настоящей статье.
Окраска микропрепаратов основана на действии химических реагентов и необходима для контрастирования участков образца, его областей, структурных элементов. Микробиологи обычно используют следующие типы: кислые и основные красители. Первые наиболее эффективно окрашивают цитоплазму, а вторые – ядерные компоненты. Существует и третий вид красящих веществ: они не способствуют образованию солей, а выстилаются осадком на поверхности биоматериала.
Метод простой окраски микропрепаратов. Используемые соединения (кристаллы):
- Генцианового фиолетового;
- Метиленового синего;

Техника для мазков и отпечатков:
- Над металлическим лотком расположить параллельно стеклянные или пластиковые палочки;
- Положить на них фиксированный препарат;
- Накрыть его фильтровальной бумагой;
- Покрыть одним из вышеуказанных красителей (поливать) и ожидать до трех минут.
- Промывать, пока не станет бесцветной стекающая вода.
- Высушить.


Метод прокраски гематоксилин-эозином широко употребляется в гистологии – науке, изучающей ткани организмов.
- Тонирование в гематоксилине. Максимальная продолжительность – четверть часа. Клеточные ядра становятся темно-синими;
- Промывка в дистиллированной (без примесей) воде;
- Обработка дифференцирующим растворителем – соляной кислотой.
- Смачивание эозином (его получают воздействием брома на флуоресцеин). В результате белки изменяют цветовой тон на розовый;
- Окончательно промыть и обезводить.

Экспрессный метод Грама устанавливает наличие микробов и дифференцирует их как грамоотрицательные и грамоположительные, что актуально при диагностике бактериального заражения и поисках его очага. Шаги для лаборанта:
- Продезинфицировать рабочее место и руки, проветрить помещение;
- Одеть медицинские перчатки;
- Пипеткой нанести на чистое предметное стекло каплю исследуемой жидкости;
- Капнуть несколько капель кристаллвиолета и ждать полминуты, пока ионы проникнут через мембрану и оболочку клеток;
- Добавить капельку йода и спустя 40-50 секунд смыть;
- Добавление смешанных в равной пропорции ацетона и этанола, незамедлительное промывание;
- Нанесение фуксина;
- Высушивание.
Рекомендации: указанные методики не подходят для домашнего обучения, они применимы исключительно в лабораториях. Следите за безопасностью при работе с реактивами. При любительском использовании микроскопа или в общеобразовательных целях применяйте простейшее окрашивание ботанических срезов зеленкой (бриллиантовый зеленый) или раствором Люголя.
Важно: если опыта, условий и инструментария нет, для повышения контрастности микропрепарата и придания ему оттенков можно задействовать светофильтры.
Приготовление мазка
1) с жидкой питательной среды 2) с плотной питательной среды
культуру берут петлей и каплю наносят на предметное стекло наносят
непосредственно на стекло (без NaCl) небольшую каплю NaCl, в которой
эмульгируют исследуемый материал
и распределяют на площади около 2 см 2
Высушивание
на воздухе высоко над пламенем спиртовки
Фиксация
в процессе фиксации микробные клетки погибают, этим достигается безопасность работы с ними; убитые микроорганизмы лучше воспринимают красители, чем живые; в фиксированном мазке клетки прикрепляются к стеклу и не смываются при последующей обработке.
- над пламенем спиртовки мазком - более щадящий по сравнению
вверх (3 раза круговыми движениями) с физическим: мазок погружают
в фиксатор (этанол, ацетон, формалин
и др.) на определенное время
Окраска
1) окрашивают одним красителем 1) используют несколько красителей
анилинового ряда - основным или (основная и вспомогательные краски,
кислым: - кислый фуксин обесцвечивающие жидкости (этанол)
- эозин - метод Грама
- метиленовый синий - Нейссера
- генциановый фиолетовый - Гинса-Бурри
2) используются для изучения 2) используются для определения
морфологии микроорганизмов морфологии, химического состава,
структуры микробных клеток
Краситель наливают на поверхность мазка на определенное время, затем мазок промывают до тех пор, пока струи воды не станут бесцветными, осторожно высушивают фильтровальной бумагой. Если мазок правильно окрашен и промыт, то поле зрения абсолютно прозрачно, а клетки микробов интенсивно окрашены.
Методика окраски по Граму:
2 этап. Обработка этанолом (дифференциация)
одни микробыдругие микробы
сохраняют комплекс генциановый теряют комплекс генциановый
фиолетовый + йод, не обесцвечиваются фиолетовый + йод, обесцвечиваются.
3 этап. Окраска фуксином
одни микробыдругие микробы
остаются сине-фиолетовыми, окрашиваются в красный цвет,
грамположительные: грамотрицательные:
1. Все кокки за исключением 1. Гонококки и менингококки
гонококков и менингококков
2. Все спорообразующие палочки 2. Большинство неспорообразующих
3. Из неспорообразующих бактерий 3. Спириллы
туберкулезная и дифтерийная палочки
4. Актиномицеты 4. Риккетсии
5. Грибы 5. Микоплазмы
Окраска по методу Грама не используется при изучении спирохет, простейших и вирусов.
Сущность метода окраски по Граму: отношение бактерий к окраске по Граму определяется их способностью удерживать образовавшийся в процессе окраски комплекс генцианового фиолетового и йода. У Гр+ бактерий на поверхности клеток есть магниевые соли рибонуклеиновой кислоты, которые прочно связывают комплекс генцианового фиолетового с йодом и препятствуют его вымыванию спиртом. Кроме того, Гр+ бактерии имеют более выраженный пептидогликановый слой (содержание пептидогликана до 90%), в котором после обработки спиртом сужаются поры, что также делает невозможным вымывание красителя. В результате Гр+ бактерии окрашиваются в фиолетовый цвет.
У Гр- бактерий отсутствуют магниевые соли рибонуклеиновой кислоты, пептидогликановый слой значительно тоньше, располагается в глубине клеточной стенки, значительно больше содержится белков и липидов, которые вместе с полисахаридами образуют поверхностные слои в виде мозаики, размеры пор шире. Поэтому при обработке спиртом краситель легко вымывается, бактерии обесцвечиваются и при использовании дополнительного красного красителя грамотрицательные бактерии окрашиваются в красный цвет.
К самостоятельной работе
Методы выявления спирохет (трепонем, боррелий, лептоспир)
Оболочка спирохет тонкая, эластичная, содержит большое количество липопротеидов до 70 - 80% и тонкий фрагментированный слой пептидогликана. Обычными методами трепонемы не окрашиваются, так как при фиксации спиртом оболочка легко разрушается, и клетка не в состоянии удерживать красители. Спирохеты, так же как и простейшие, плохо окрашиваются анилиновыми красителями. Для их дифференцирования применяют краску Романовского-Гимзы. Лучше окрашиваются боррелии (в синий цвет), хуже лептоспиры (в розовый), еще хуже трепонемы (в слабо - розовый). Бледная трепонема покрыта мукополисахаридным чехлом, под клеточной стенкой имеется скопление протеолитических ферментов, с их помощью она способна активно внедряться в цитоплазму и даже ядро клеток организма хозяина.
Методика окраски по методу Романовского-Гимзы:
Краска Романовского-Гимзы состоит из метиленового синего, эозина и азура.
1. На мазок наносят рабочий раствор красителя (2 капли красителя на 1 мл дистиллированной воды) на 10-20 мин.
2. Препарат промывают водой и высушивают на воздухе.
Трепонемы окрашиваются в бледно-розовый цвет, боррелии - в фиолетовый цвет, лептоспиры - в розовый цвет. Сапрофитные (непатогенные) формы окрашиваются в синий цвет. Морфологию спирохет изучают также в живом состоянии в фазово-контрастном или темнопольном микроскопе. Хорошим методом выявления спирохет является серебрение по Морозову.
Методы выявления актиномицетов
По химическому составу оболочка актиномицетов близка к оболочке бактерий, поэтому они окрашиваются анилиновыми красителями. Обычно их окрашивают простыми методами, по Граму или Цилю-Нильсену. Актиномицеты являются грамположительными микроорганизмами.
С помощью прокаленного и остуженного скальпеля отрезают небольшой кусочек культуры актиномицета на плотной питательной среде и помещают его в каплю воды на предметном стекле. Каплю накрывают вторым чистым предметным стеклом. Стекла плотно придавливают друг к другу, растягивают и таким образом получают два мазка, которые высушивают, фиксируют обычным способом и окрашивают водным фуксином.
При микроскопии видно сплетение тонких нитей, истинное ветвление их и большое количество свободно лежащих экзоспор - конидий. В гистологическом срезе из органа при актиномикозе центральная часть друзы актиномицета представляет сплетение тонких нитей, окрашенных в темно-фиолетовый цвет. Отходящие на периферию концевые нити образуют колбовидные вздутия, окрашенные в розовый цвет
Окраска по Цилю-Нильсену
Применяют для дифференциации кислотоустойчивых и некислотоустойчивых микроорганизмов (микобактерий, актиномицет). Кислотоустойчивость бактерий обусловлена повышенным содержанием в клеточной стенке и цитоплазме липидов, воска и оксикислот. Принцип основан на том, что кислотоустойчивые бактерии, за счет содержания указанных веществ, прочно связывают карболовый фуксин при нагревании (т.е. окрашиваются в красный цвет) и не обесцвечиваются кислотой. Некислотоустойчивые бактерии обесцвечиваются серной кислотой и при использовании дополнительного красителя – метиленового синего – окрашиваются в синий свет.
Методика окраски по методу Циля - Нильсена:
1. На фиксированный препарат – мазок нанести карболовый раствор фуксина через полоску фильтровальной бумаги и подогреть до появления паров в течение 3-5 мин.
2. Снять бумагу, промыть мазок водой.
3. Нанести 5% раствор серной кислоты или 3% раствор смеси спирта с хлороводородной кислотой на 1-2 мин до обесцвечивания.
4. Промыть водой.
5. Докрасить мазок водным раствором метиленового синего в течение 3-5 мин.
6. Промыть водой, высушить, микроскопировать.
Читайте также: