Моноклональные антитела при ревматоидном артрите отзывы

Входит в перечень (Распоряжение Правительства РФ № 2782-р от 30.12.2014):
ЖНВЛП
Фармакодинамика:
Адалимумаб представляет собой рекомбинантное моноклональное антитело, пептидная последовательность которого идентична IgG1 человека. Адалимумаб селективно связывается с фактором некроза опухоли альфа и нейтрализует его биологические функции за счет блокады взаимодействия с поверхностными клеточными р55 и р75 рецепторами к фактору некроза опухоли альфа.
Фактор некроза опухоли альфа - это естественный цитокин, который принимает участие в регуляции нормального воспалительного и иммунного ответа. Повышенную концентрацию фактором некроза опухоли альфа обнаруживают в синовиальной жидкости у больных ревматоидным артритом, ювенильным идиопатическим артритом, псориатическим артритом и анкилозирующим спондилитом. Фактор некроза опухоли альфа играет важную роль в развитии патологического воспаления и разрушения суставной ткани, характерных для этих заболеваний. Повышенные концентрации фактором некроза опухоли альфа также обнаруживаются в псориатических бляшках. При бляшечном псориазе лечение адалимумабом может привести к уменьшению толщины бляшек и уменьшению инфильтрата в клетках воспаления. Взаимосвязь данного клинического эффекта адалимумаба с механизмом его действия не установлена.
Адалимумаб модулирует также биологические ответные реакции, которые индуцируются или регулируются фактором некроза опухоли альфа, включая изменения уровней молекул адгезии, вызывающих миграцию лейкоцитов.
У больных ревматоидным артритом адалимумаб вызывает быстрое снижение концентраций острофазных показателей воспаления (С-реактивного белка и скорости оседания эритроцитов) и сывороточных концентраций цитокинов (интерлейкин-6). Уменьшение концентраций С-реактивного белка также наблюдалось у пациентов с ювенильным идиопатическим артритом или болезнью Крона. Кроме того, отмечается снижение сывороточной активности матриксных металлопротеиназ (ММП-1 и ММП- 3), вызывающих ремоделирование тканей, которое лежит в основе разрушения хряща.
Фармакокинетика:
Адалимумаб всасывается и распределяется медленно, и достигает Cmax примерно через 5 дней. Абсолютная биодоступность препарата при однократном подкожном введении 40 мг адалимумаба составляет 64 %.
У пациентов с болезнью Крона, которым назначают препарат в стартовой дозе 160 мг на 0-й неделе и последующую дозу 80 мг на 2-й неделе, Cmax адалимумаба достигается на 2-й и 4-й неделе и составляет примерно 12 мкг/мл.
Vd (объем распределения) при однократном внутривенном введении составляет от 4,7 до 6 л, что указывает на практически одинаковое распределение адалимумаба в крови и во внесосудистых жидкостях.
Концентрация адалимумаба в синовиальной жидкости больных ревматоидным артритом составляет от 31 до 96 % от сывороточной.
Css адалимумаба при подкожном применении в дозе 40 мг 1 раз в 2 недели у больных ревматоидным артритом в конце интервала дозирования составляет около 5 мкг/мл (без одновременного приема метотрексата) и 8-9 мкг/мл (на фоне одновременного применения метотрексата). При увеличении дозы адалимумаба в интервале 20 мг, 40 мг и 80 мг 1 раз в 2 недели и 1 раз в неделю подкожно отмечено почти линейное увеличение сывороточных концентраций адалимумаба в конце интервала дозирования.
При назначении адалимумаба в дозе 40 мг в монотерапии 1 раз в 2 недели средняя Cmin препарата у пациентов с псориазом составила 5 мкг/мл.
У пациентов с болезнью Крона Css составляет приблизительно 7 мкг/мл и наблюдается на 24-й и 56-й неделях поддерживающей терапии с применением адалимумаба в дозе 40 мг 1 раз в 2 недели.
Адалимумаб выводится медленно, клиренс обычно не превышает 12 мл/ч. Период полувыведения составляет в среднем 2 недели и варьирует от 10 до 20 дней. Клиренс и период полувыведения существенно не меняются при введении препарата в дозе 0,25-10 мг/кг, а период полувыведения сходен при внутривенном и подкожном введении препарата.
При длительном применении (более 2-х лет) к
Современное лечение ревматоидного артрита
Терапия данного недуга выражается в применении следующих препаратов:
- противовоспалительных;
- базисных.
Нестероидные противовоспалительные препараты снимают боль и другие его симптомы.
Базисные препараты помогают замедлить прогрессирование патологии или переводят ее течение в состояние ремиссии, регулируя непосредственно механизмы развития заболевания, подавляют работу иммунной системы.
Современное применение препаратов нового поколения генной инженерии при ревматоидном артрите позволяет влиять на функцию иммунитета, а именно – подавлять выработку клеток цитокинов, провоцирующих воспалительные процессы и эрозивные поражения суставов.
Основным преимуществом биологических агентов является их способность воздействовать исключительно на одну группу иммунных компонентов, не затрагивая другие механизмы.
Такие лекарства позволяют получить положительные результаты лечения намного быстрее, чем при помощи средств, применяемых ранее. Эффективность таких препаратов заметна через несколько недель с начала приема. В то время, как, применяемые ранее препараты приходится пить месяцами или даже годами.
Лекарства действуют на главный патогенетический фактор заболевания — подавляют аутоиммунную активность и оказывают прямое противовоспалительное действие. Обычно фармакотерапия в ревматологии включает приём следующих групп лекарств:
- Базисные противовоспалительные препараты – самый главный элемент медикаментозного лечения, медленно (в течение одного-трёх месяцев), но верно подавляющий активность заболевания, применяемый длительно (порой годами).
- Глюкокортикоиды — гормональные средства, обладающие мощным быстрым противовоспалительным действием. Применяются чаще кратковременно, до начала проявления эффекта базисных препаратов.
- Нестероидные противовоспалительные препараты – применяются короткими курсами, главным образом, с целью уменьшения или снятия боли.
Детальные исследования механизмов развития аутоиммунного воспалительного процесса в последние 10-летия позволили создать новый класс лекарств – генно-инженерные биологические препараты, оказывающие избирательное точечное воздействие на ключевые звенья воспалительного процесса.
Медицинские биологические препараты, применяемые в ревматологии, представляют собой антитела человека или животных к медиаторам воспаления — молекулам передающим воспалительные сигналы (фактору некроза опухолей-α — ФНО-α, интерлейкинам, цитокинам и др. ), либо к белкам избыточно активных T и B-лимфоцитов (клеток иммунной системы).
Медиаторы воспаления – это вещества, избыточно образующиеся в организме при аутоиммунном заболевании и поддерживающие воспалительный процесс, в том числе в суставной оболочке (синовиит), сосудах (васкулит), коже. Биопрепараты блокируют их, останавливая воспаление и эрозирование хряща, разрушение прилежащей костной ткани. Позволяют гораздо быстрее (уже через несколько дней) достичь всех позитивных эффектов базисной противовоспалительной терапии (подавления аутоиммунной агрессии, стихания воспаления, прерывания обострения, сохранения суставной поверхности). Каждый препарат блокирует одно конкретное звено в воспалительном каскаде. Точечность воздействия определяет лучшую переносимость лечения и меньшее количество побочных эффектов.
Биопрепараты вводят внутривенно или в виде подкожной инъекции 1-2 раза в месяц на протяжении длительного периода (до года и больше).
Производство этих лекарств требует сложных биотехнологий и генной инженерии, что обусловливает высокую стоимость. Однако эффективность биологических препаратов стоит затраченных средств.
Елена Малышева: Прорыв в медицине! Восстановить суставы полностью за 1 курс — возможно.
Здравствуйте, дорогие мои!
Уже много лет я ежедневно появляюсь на экранах ваших телевизоров, и не раз мы говорили о проблемах суставов. Болезнь суставов очень распространена в мире.
Было много сказано о методах лечения суставов. В основном — это медикаментозное либо хирургическое вмешательство в организм.
Мы, в нашей передаче, говорим о хирургии и медикаментозных процедурах, но очень редко затрагиваем другие методы лечения. Причем не просто рецепты от бабушек, а то, что признали в научной среде, ну и, конечно же, признанное нашими телезрителями.
Сегодня мы поговорим об исцеляющем воздействии нативных остеобластных и хондроцитных клеток пантов алтайского марала, обогащенный млечным соком лекарственных растений.
Они и многие другие вещества входят в состав новейшего средства — “Артропант”.
Для чего рекомендованы биологические препараты
Причины ревматоидного артрита окончательно не установлены. В рекомендациях по лечению указано, что базисная терапия должна быть назначена как можно раньше после верификации диагноза. В таком случае пациент попадает в терапевтическое окно, когда противовоспалительные препараты будут максимально эффективны.
Метотрексат в первую очередь рекомендован для лечения ревматоидного артрита. Однако ревматологи советуют применять не монотерапию, несколько средств одновременно с длительностью лечения от 6 месяцев. В схему включают нестероидные противовоспалительные средства, кортикостероидные гормоны, различные цитостатики. Оптимальная длительность курса при хорошем ответе на лечение – до 3 лет.
Как работают генно-инженерные средства
В организме любого человека вырабатываются определенные вещества (медиаторы), которые участвуют в воспалении. При аутоиммунных процессах комплексы антиген-антитело запускают избыточную реакцию и приводят к возникновению хронического воспаления.
В таблице приведены основные точки приложения препаратов генной инженерии при ревматоидном артрите, их названия.
| На что действует | Наименование (международное непатентованное) |
| Ингибиторы фактора некроза опухоли альфа (или ФНО) | Инфликсимаб, Адалимумаб, Этанерцепт, Голимумаб |
| Блокаторы CD20-рецепторов B-лимфоцитов | Ритуксимаб |
| Ингибирующие рецепторы к интерлейкину-6 | Тоцилизумаб |
| Блокаторы ко-стимуляции T-клеток | Абатацепт |
Препаратам первого ряда борьбы с симптомами ревматоидного артрита считают ингибиторы ФНО. Их и назначают при неэффективности базисной терапии. Другие средства используют лишь при невозможности применения ингибиторов ФНО.
Использование их у пациентов с устойчивостью к базисной терапии обусловлено быстрым и мощным клиническим эффектом. Генно-инженерные средства не рекомендуют при артрозах ввиду другой природы заболевания.
- уменьшают проявления заболевания (облегчают боли, снимают припухлость суставов);
- улучшают качество жизни пациента;
- увеличивают шансы на развитие ремиссии у пациента;
- объективно замедляют развитие ухудшения (по картине на рентгене).
Что они собой представляют?
- иммунизация лабораторных животных,
- стимуляция у них продукции иммунных факторов, противостоящих конкретным чужеродным антигенам,
- выделение клонов клеток, которые будут способны самостоятельно синтезировать эти вещества при введении их в организм человека.
Для чего рекомендованы биологические препараты
Показания к применению Инфликсимаба:
- Ревматоидный артрит;
- Язвенный колит;
- Анкилозирующий спондилит;
- Болезнь Крона;
- Псориатический артрит.
- Аллергия на компоненты препарата;
- Период лактации;
- Сепсис и абсцесс;
- Возраст (до 18 лет не применяется);
Существует вероятность развития психозов и нервозности, обострения инфекционных поражений и хронических болезней.
Средняя стоимость Инфликсимаба – это 4500 евро.
ГИБП для ревматоидного артрита, относящееся к группе иммунодепрессантов, воздействует на интерлейкиновые рецепторы.
Применяется средство при ревматоидном артрите в комбинации с базисными препаратами (исключено сочетание с TNF- ингибиторами).
Противопоказания к применению:
- Индивидуальная непереносимость;
- Острые инфекционные заражения.
Для лечения ревматоидного артрита назначают подкожные инъекции (бедро или живот) с высшей суточной и разовой дозой – это 100 мг.
Абатасепт представляет собой рекомбинантный белок на основе клеток млекопитающих, способствующий активации Т-лимфоцитов.
Допустимо назначение препарата детям от 6 лет и взрослым для уменьшения симптомов заболевания и улучшения общего самочувствия.
Недопустимо одновременное введение препарата при помощи инфузий с другими лекарственными средствами.
Средняя стоимость препарата – это 18000 руб.
В основе препарата находятся мышиные и человеческие антитела, воздействующие на В-лимфоциты.
Применение Ритуксимаба необходимо при лечении лимфом и ревматоидного артрита, когда другие методы терапии малоэффективны.
Противопоказание к назначению и применению – аллергия на белок мыши или другие компоненты препарата.
К побочным действиям относятся:
- Гиперкалиемия;
- Гипоксия;
- Кардиогенный шок;
- Инфаркт миокарда.
Допустимо сочетание препарата с Преднизолоном, Винкристином, Доксорубицином и Циклофосфамидом.
В аптеках стоимость препарата колеблется от 12000 до 20000 рублей за флакон.
Георгий, 44 года, Астрахань.
- Инфликсимаб (Ремикейд)
- Голимумаб (Симпони)
- Адалимумаб (Хумира)
- Цертолизумаб пэгол (Симзия)
- Этанерцепт (Энбрел)
Снижающие активность интерлейкинов
- Анакинра (Кинерет)
- Тоцилизумаб (Актемра)
- Устекинумаб (Стелара)
- Канакинумаб (Иларис)
- Ритуксимаб (Мабтера)
- Белимумаб (Бенлиста)
Анти-T-клеточная терапия
- Быстрое действие — купируют воспаление и тормозят разрушение сустава после нескольких дней применения (по сравнению с 1-3 месяцами до явного клинического эффекта при обычной базисной терапии).
- Возможность комбинации с традиционными препаратами, ускорение и усиление их действия.
- Эффективность в ряде резистентных к традиционной терапии случаев (до 84%). Раннее начало лечения обеспечивает лучший результат. Комбинированная терапия биопрепаратов с метотрексатом (препаратом базисной терапии) эффективнее, чем лечение одним препаратом.
- Эффективность подтверждается клиническими, лабораторными и инструментальными методами: снижением уровня воспалительных показателей (СОЭ, СРБ), РФ (ревматоидного фактора);
- улучшением состояния хрящевой ткани по данным рентгенологических исследований – отсутствием новых эрозий, тенденцией к заживлению старых;
- повышением двигательной активности и качества жизни пациентов, сохранением их трудоспособности.
- Подавление иммунитета, повышение опасности инфекционных осложнений.
- Возможность развития аллергических реакций на сами препараты (чужой белок).
- Дорогое лечение.
Противопоказания к биотерапии:
- Наличие у пациента активного туберкулёза, гепатитов В и С, герпетической и ВИЧ- инфекции.
- Пневмония, бронхит, синусит, рожистое воспаление, инфекция мочевыводящих путей, дивертикулит, локальные инфекции, септический артрит, сепсис и т.д.
- Злокачественные новообразования.
Важно! Данные противопоказания (особенно инфекционные) актуальны исключительно в активный период болезни. После проведения эффективной антибактериальной или противовирусной терапии возможно применение биологических препаратов.
В лечении ревматоидного артрита новые генно-инженерные препараты дают надежду многим пациентам с упорным, резистентным (устойчивым) к обычной терапии течением болезни.
применяют самые современные схемы лечения ревматологических заболеваний. Все новейшие препараты, прошедшие необходимую проверку и доказавшие высокую эффективность, немедленно используются в нашей лечебной практике.
Сделайте выбор в пользу профессиональной медицины!
- 4959
- 4,1
- 0
- 5
Моноклональные антитела — новая надежда в лечении ревматических заболеваний.
![]()
Анна Огородник
![]()
Антон Чугунов![]()
Андрей Панов




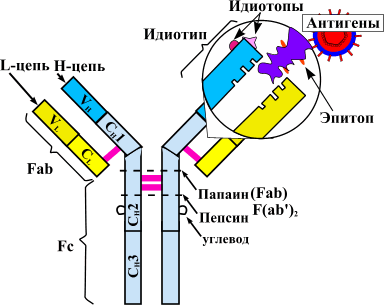
Теорию аутоиммунитета сформулировал еще столетие назад немецкий исследователь Пауль Эрлих. За последующие годы описано множество аутоиммунных заболеваний. К ним относятся ревматоидный артрит, системная красная волчанка (СКВ), системная склеродермия, миопатии, васкулиты и прочие патологии .
Болезни, ассоциированные с аутоиммунным компонентом, — серьезная проблема современного общества . Их распространенность в мировой популяции составляет примерно 5%. Заболевания быстро переходят в хроническую форму, из-за чего снижается качество жизни пациентов. Аутоиммунные патологии часто приводят к инвалидизации больных [1], [4].
Несмотря на многолетний поиск новых путей фармакотерапии, современная медицина не может предложить способов лечения, непосредственно влияющих на причину возникновения аутоиммунитета. Врачи способны лишь замедлить прогрессирование патологии и снизить выраженность клиники — провести патогенетическое и симптоматическое лечение. Для этого разработана базисная терапия, которая применяется уже многие годы. Однако не всегда проверенные препараты работают так, как надо.
Почему необходимо искать новые способы лечения?
Для лечения аутоиммунных заболеваний используют широкий арсенал противоревматических лекарств. Классическая терапия включает нестероидные противовоспалительные средства, глюкокортикоиды, цитостатики. В зависимости от особенностей развития заболевания подбирают препараты из той или иной группы [4].
- Большие иммунодепрессанты:
- глюкокортикоиды (преднизолон, дексаметазон);
- антибиотики (циклоспорин, такролимус);
- антиметаболиты (метотрексат, азатиоприн, меркаптопурин);
- цитостатики (циклофосфан).
- Малые иммунодепрессанты:
- плаквенил, хингамин;
- купренил;
- препараты золота (ауронофин);
- гепарин;
- нестероидные противовоспалительные средства.
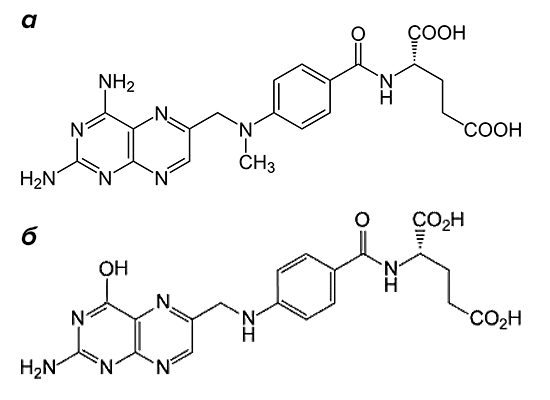
Рисунок 2. Структурные формулы метотрексата и фолиевой кислоты. Препарат (а) по строению похож на фолиевую кислоту (б). Он состоит из птеридиновых групп и парааминобензойной кислоты. Действующий компонент метотрексата отличается от структуры фолата отсутствием гидроксильной группы (–OH) и наличием дополнительного метильного радикала (–CH3).
По механизму действия метотрексат относится к антиметаболитам. Препараты этой группы тормозят физиологические реакции в организме, связываясь с ферментами и выключая их активность. Вещество, которое в норме участвует в реакции, уже не может попасть в биохимический круговорот из-за повышенной конкуренции с компонентами лекарства. Основной мишенью для действия метотрексата является фермент, расщепляющий фолиевую кислоту, — дигидрофолатредуктаза (ДГФ). Этот белок воздействует на поступающий в организм фолат, переводя его в активную форму. При этом образуется тетрагидрофолиевая кислота. Она участвуют в синтезе строительного материала для ДНК — пуриновых оснований и тимидилата.
Метотрексат вклинивается в цепочку реакций благодаря структурному сходству с молекулой фолиевой кислоты (рис. 2). Конкуренция за фермент приводит к тому, что содержание активного фолата в ткани значительно снижается. Нет строительного материала — нет и новых молекул ДНК, без которых клетки не могут размножаться. Повышенной чувствительностью к воздействию лекарства обладают те ткани, структурные элементы которых постоянно делятся. К ним относятся и компоненты костного мозга, из которых формируются будущие иммунные клетки.
Еще один важный момент в работе метотрексата связан с активностью его полиглутамированных метаболитов. Эти молекулы формируются после активации препарата непосредственно в клетках человеческого организма. Они ингибируют другие ферменты, которые взаимодействуют с фолиевой кислотой. В эту группу входят тимидилсинтетаза и АИКАР-трансамилаза. Активность производных метотрексата запускает процесс выработки аденозина. Он оказывает мощное противовоспалительное действие, благодаря чему снижается выраженность симптомов ревматоидного артрита [7].
Метотрексат удобно использовать — он легко дозируется и может назначаться длительными курсами. Кроме того, важное преимущество этого препарата — низкая цена, в сравнении с современными лекарствами импортных фармкомпаний [8]. Несмотря на все достоинства, лечение метотрексатом не всегда приводит к снижению активности заболевания. У многих пациентов использование препарата неэффективно даже в комбинации с другими классическими средствами [5]. Это подтверждается при анализе статистики. Исследования показали, что при проведении лечения метотрексатом и комбинациями базисных препаратов только половина пациентов достигла ремиссии [9], [10].
Несостоятельность классической терапии заставляет ученых искать новые способы лечения ревматоидного артрита. Стоит отметить, что, несмотря на новые разработки, борьбу с заболеванием все же начинают с назначения метотрексата и его аналогов. Дополнительные препараты используют только при высокой активности аутоиммунного процесса. У таких пациентов применение одного лекарства часто бывает неэффективно [7]. В зависимости от особенностей течения патологии подбирают подходящую схему терапии (рис. 3).
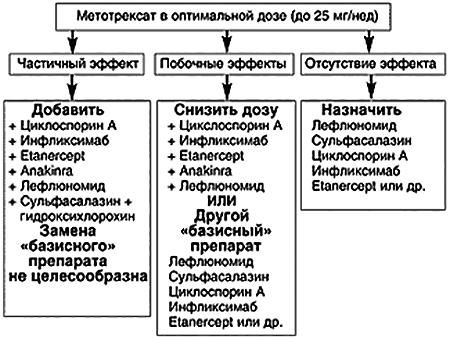
Рисунок 3. Тактика ведения пациента с ревматоидным артритом при неэффективности использования метотрексата.
Неэффективность препаратов базисной терапии встречается не только при ревматоидном артрите, но и при других заболеваниях аутоиммунного происхождения (системной красной волчанке, склеродермии, болезни Бехтерева). Это мотивирует специалистов-ревматологов разрабатывать другие лекарства и подбирать новые схемы терапии.
Генно-инженерные препараты: дополнение к базисной терапии
По-новому взглянуть на лечение аутоиммунных заболеваний позволила разработка терапевтических моноклональных антител [11]. Принципиально новый класс препаратов получен благодаря достижениям генной инженерии. Для понимания механизма действия этих лекарств стоит вспомнить о том, как работают иммунные клетки в норме и при патологии [1], [12].
При аутоиммунных заболеваниях можно подавлять сразу весь сложный механизм иммунитета, что и делают препараты классической терапии. Но это оставляет человека без защиты от вражеских агентов — бактериальных инфекций, вирусов и прочих патогенов. Поэтому предпочтительнее сохранить активность иммунной системы в целом, избавив человека от аутоагрессии определенных ее компонентов. Именно так работают новые препараты — моноклональные антитела.
- Ингибиторы ФНО (фактора некроза опухолей) — инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
- Блокаторы интерлейкиновых рецепторов — тоцилизумаб (ИЛ-6R), канакинумаб (ИЛ-1R), секукинумаб (ИЛ-17R).
- Анти-В-клеточные антитела (антитела к мембранным молекулам CD20) — ритуксимаб, белимумаб [17].
- Анти-Т-клеточные антитела (антитела к молекулам CD80 и CD86) — абатацепт [18].
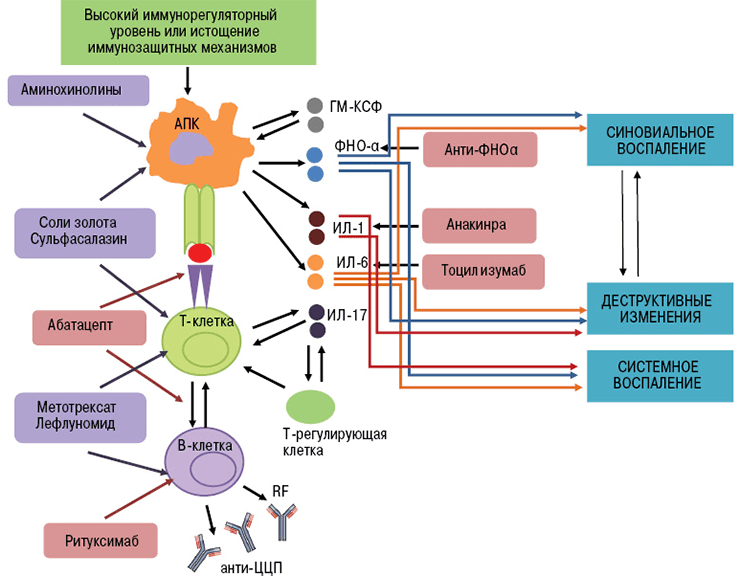
Ингибиторы фактора некроза опухолей — это первые моноклональные антитела, внедренные в ревматологическую практику. В эту группу входят инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
Фактор некроза опухолей (ФНО) — это провоспалительный цитокин (вещество, которое стимулирует развитие воспалительной реакции). В норме при его выделении происходит пролиферация клеток сосудов, активация макрофагов, лизис опухолевых агентов. Эти эффекты играют важную роль в защите организма от патогенов. Воспаление можно считать ответной реакцией на воздействие повреждающих факторов.
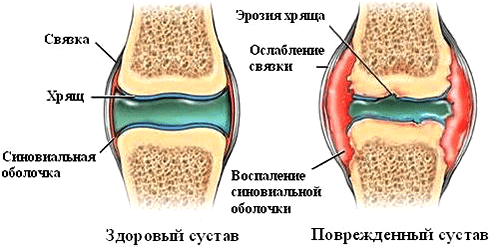
Рисунок 5. Патологические изменения в суставе при ревматоидном артрите. Аутоиммунный процесс вызывает появление эрозий, синовит (воспаление синовиальной оболочки), разрушение суставного хряща.
Такое строение связано с механизмом получения препарата. Первоначально синтезируют антитело к фактору некроза опухолей в организме мыши. Полученный иммуноглобулин специфичен к ФНО и уже может его обезвреживать, но полностью чужеродные белки вводить в организм пациентов, конечно, нельзя. Это вызовет активную иммунную реакцию — выработку антител уже против терапевтических агентов. Поэтому домены мышиного иммуноглобулина заменяют сходными участками человеческих белков. Антитела, имеющие фрагменты разного происхождения, называются химерными. Фактически, они берут лучшие качества своих предшественников. Мышиная часть обеспечивает высокую чувствительность к ФНО, а человеческие фрагменты снижают иммуногенность — вероятность развития иммунного ответа.
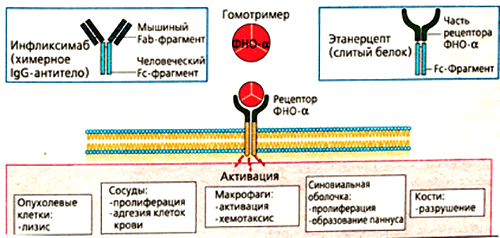
Рисунок 6. Основные эффекты ФНО и блокирующие его моноклональные антитела (инфликсимаб и этанерцепт). Мишенями для моноклональных антител являются свободная и мембраноассоциированная формы фактора некроза опухолей. Лекарства препятствуют связыванию цитокина с рецептором, благодаря чему снижается активность ревматоидного артрита.
В развитии аутоиммунного воспаления важную роль играют интерлейкины, которые, как и ФНО, относятся к провоспалительным цитокинам (рис. 7). Основными представителями этой группы являются ИЛ-6, ИЛ-1, ИЛ-17. Функция интерлейкинов — это контроль процессов дифференцировки, пролиферации и гибели (апоптоза) иммунных клеток, который осуществляется через соответствующие гены-мишени [20].
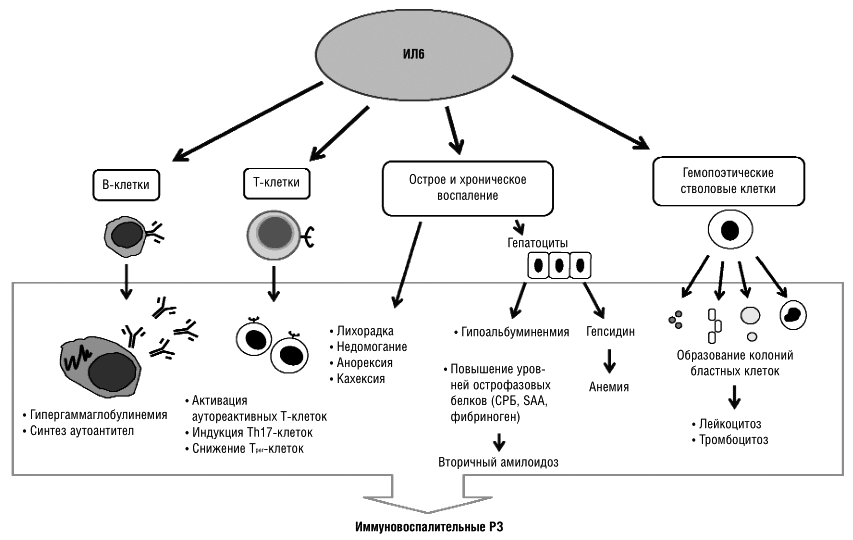
Рисунок 7. Механизм действия интерлейкинов при аутоиммунном воспалении (на примере ИЛ-6). Цитокин влияет на T- и B-лимфоциты, гемопоэтические клетки, гепатоциты. Он стимулирует выработку аутоантител В-клетками, а также формирование аутореактивных Т-клонов, которые непосредственно участвуют в аутоиммунном процессе. Влияние на костный мозг заключается в стимуляции выработки новых клеток крови — повышается число лейкоцитов и тромбоцитов. Воспаление сопровождается ответной реакцией клеток печени, появлением характерных симптомов аутоиммунного заболевания.
Тоцилизумаб — это препарат, который блокирует работу ИЛ-6. Рецептор этого вещества состоит из двух компонентов — мембранного ИЛ-6R (α-цепь) и гликопротеина g130 (β-цепь). Мембранная часть рецептора связывается с ИЛ-6, образуя устойчивый комплекс. Вместе они активируют компонент g130, вызывая изменение его структуры (гомодимеризацию). Образуется рецепторный комплекс из двух молекул g130, который в свою очередь активирует JAK1-киназу. Этот фермент запускает каскад реакций в клетке, который приводит к появлению биологического эффекта цитокина — развитию воспаления. В некоторых случаях ИЛ-6 связывает не мембранная, а растворимая форма α-цепи (рис. 8). Механизм действия рецептора при этом не меняется [21].
В основе работы тоцилизумаба лежит конкуретное ингибирование. Сигнальные молекулы активно связываются с моноклональным антителом. Вакантное место занято — интерлейкин не может образовать комплекс с рецептором, а значит, он не способен активировать процесс воспаления.
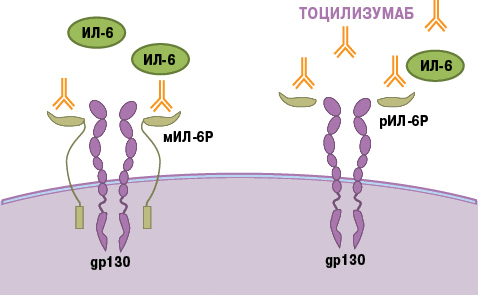
Рисунок 8. Механизм действия тоцилизумаба. Препарат связывает растворимые и мембранные рецепторы ИЛ-6, блокируя передачу сигналов.
Тоцилизумаб считается одним из самых безопасных препаратов, входящих в группу моноклональных антител. Это позволяет применять его при ювенильном идиопатическом артрите, который возникает в возрасте до 16 лет. Дети особенно остро реагируют на токсические воздействия, поэтому препараты, которые используют при их лечении, должны иметь минимальное число побочных реакций. Применение тоцилизумаба позволяет достигнуть необходимого эффекта лечения, не вызвав тяжелых осложнений.
Препараты из группы анти-B-клеточной терапии (ритуксимаб и белимумаб) блокируют активность В-лимфоцитов путем связывания их мембранных молекул CD20. Эти вещества есть только у определенных категорий В-клеток. Они специфичны для пре-В-лимфоцитов и зрелых В-лимфоцитов. CD20 нет у стволовых элементов и про-В-клеток, из которых будут образовываться новые лимфоцитарные элементы. Мембранные молекулы данного типа не содержатся и у плазматических клеток, которые вырабатывают иммуноглобулины [22].
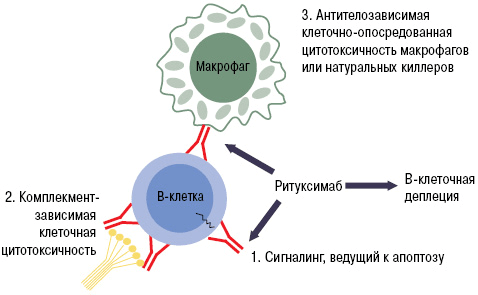
Рисунок 9. Механизм работы ритуксимаба. Fab-фрагмент моноклонального антитела связывается с CD20 на поверхности B-лимфоцита. Это запускает лизис клетки, который может осуществляться несколькими путями: через систему комплемента, программу апоптоза или агрессию натуральных киллеров и макрофагов.
Блокировка действия Т-лимфоцитов возможна благодаря особенностям их активации. Чтобы Т-лимфоцит вступил в аутоиммунный процесс и связался с антигеном, он должен получить два сигнала от антигенпрезентирующих клеток (АПК). Первый сигнал обеспечивает распознавание специфического аутоантигена Т-клеточными рецепторами. Второй сигнал — это неспецифический процесс связывания мембранных молекул CD80 и CD86 на поверхности АПК с рецептором CD28 лимфоцита. Сочетание этих взаимодействий вызывает активацию Т-клеток, которые в свою очередь стимулируют выработку провоспалительных цитокинов. Это и есть основной вклад Т-лимфоцитов в аутоиммунный процесс.
Знания о механизме активации Т-клеток использовали при разработке моноклональных антител. Основной представитель анти-Т-клеточных агентов — это абатацепт. Препарат представляет собой белок, состоящий из двух частей. Специфическая часть образована молекулой CTLA-4 (антиген 4 цитотоксических лимфоцитов). Неспецифическая область — это Fc-фрагмент человеческого иммуноглобулина G1 [23].
Воздействие абатацепта направлено как раз на неспецифический (костимулирующий) сигнал. Компонент CTLA-4 связывает белки CD80 и CD86 на поверхности антигенпрезентирующих клеток. Рецептор лимфоцита CD28 уже не может взаимодействовать с ними, из-за чего активация Т-клетки не завершается (рис. 10).
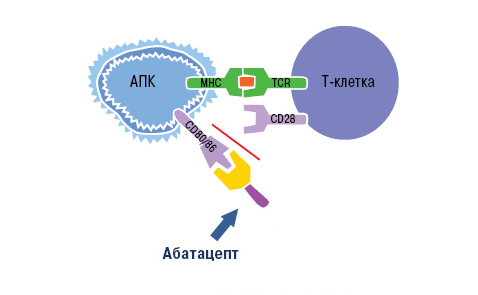
Рисунок 10. Механизм действия абатацепта. Абатацепт модулирует иммунный ответ через связывание с CD80/CD86 на антигенпрезентирующих клетках. Это препятствует связыванию CD80/CD86 с CD28 T-клеток, то есть активация Т-клеток отменяется через блокировку костимуляции.
Не всё так просто: возможные проблемы при использовании моноклональных антител
Например, одна пачка метотрексата стоит примерно 200 рублей. Цена упаковки инфликсимаба — около 43 тыс. рублей. Разница очевидна. За год лечения метотрексатом даже в максимальной дозировке пациент потратит на лекарство 1–2 тыс. рублей (в зависимости от фирмы-производителя, схемы лечения и стоимости препарата в местных аптеках). Цена годовой терапии инфликсимабом составляет примерно 700 тыс. рублей. Понятно, что самостоятельно обеспечить себя этим лекарством сможет только очень ограниченная группа пациентов.
Использование биологических препаратов допустимо в тех случаях, когда к базисным средствам у пациента развивается непереносимость. Больные испытывают тяжелое побочное воздействие лекарства, которое еще сильнее ухудшает их состояние. Применение препаратов с другим механизмом действия, в том числе и моноклональных антител, позволяет минимизировать побочные эффекты [18].
Другая сложность, с которой можно столкнуться при использовании биологических препаратов, — это побочные реакции. Параллельно с накоплением данных об эффективности использования лекарств выявляют все новые нежелательные эффекты от их применения. Большая часть таких реакций связана с процессом иммуносупрессии. Подавляя активность иммунных клеток, моноклональные антитела снижают защитную функцию организма. В первую очередь страдают противоинфекционный и противоопухолевый иммунитеты [18], [24].
Парадоксально, но применение новых лекарств против аутоиммунитета может вызвать острые аутоиммунные реакции. Все биологические препараты представляют собой белковые молекулы, которые в той или иной степени чужеродны для организма. Поэтому при проникновении терапевтических агентов в тело больного иммунитет может распознать их как антигены. Появляется активный иммунный ответ — вырабатываются антитела уже против компонентов препарата.
Несмотря на все возможные сложности, моноклональные антитела прочно вошли в регистр лекарств, применяющихся в ревматологии. Перспектива использования биологических препаратов и их место в ревматологии будет зависеть от результатов многолетних исследований, которые еще предстоит провести. Но даже сейчас можно сказать, что разработка терапевтических моноклональных антител является важным шагом на пути к победе над аутоиммунным воспалением.
Читайте также:





