Мрт костного мозга при лейкозе
а) Терминология:
1. Сокращения:
• Экстрамедуллярные лейкемические опухоли (ЭЛО)
• Экстрамедуллярная миелобластома, экстрамедуллярные миелоидноклеточные опухоли (ЭМКО)
2. Синонимы:
• Гранулоцитарная саркома, хлорома
3. Определения:
• Солидная опухоль, состоящая из миелобластов/миелоцитов/промиелоцитов:
о У пациентов с миелопролиферативным заболеванием
• Множественные иные внутричерепные проявления лейкоза/осложнений терапии:
о Синдром задней обратимой энцефалопатии (СЗОЭ):
о Инвазивный микоз
о Развитие кавернозных ангиом в позднем периоде после проведения лучевой терапии
о Посттрансплантационная лимфопролиферативная болезнь (ПЛБ) после трансплантации костного мозга
о Венозный тромбоз в сочетании с химиотерапией (L-аспараги-наза)
о Васкулит:
- Основное проявление лейкоза
- Развивается в ответ на терапию (транс-ретиноевая кислота)
- Развивается в ответ на инфекцию (например, аспергиллез)
б) Визуализация:
1. Общие характеристики лейкоза головного мозга:
• Лучший диагностический критерий:
о Гомогенная контрастируемая опухоль(и) у пациентов с диагностированным или предполагаемым миелопролиферативным заболеванием
о Наиболее частое осложнение острого миелоидного лейкоза (ОМЛ)
• Локализация:
о Менингеальные (с основанием в твердой или мягкой мозговой оболочке) > интрапаренхиматозные поражения
2. КТ при лейкозе головного мозга:
• Бесконтрастная КТ:
о Изо-/гиперденсное по отношению к мозговым тканям образование
- Быстро может стать гиподенсным (некротические изменения, расплавление)
о Может проявляться в виде гематомы (или имитировать ее)
о Оцените вовлечение основания черепа/околоносовых пазух
• КТ с контрастированием:
о Гомогенный характер контрастирования:
- Повышенная КТ-плотность или наличие кровоизлияния могут маскировать накопление контраста
о Может наблюдаться кольцевой характер контрастирования, имитирующий абсцесс
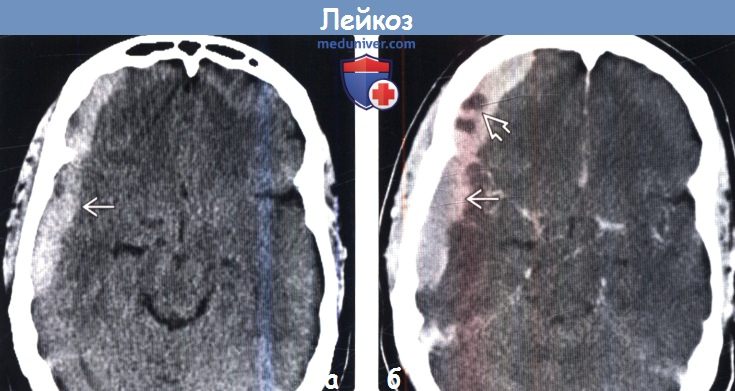
(а) Бесконтрастная КТ, аксиальный срез: у пациента с острым миелоцитарным лейкозом определяется гиперденсное объемное образование с основанием в твердой мозговой оболочке, которое имитирует субдуральную гематому.
(б) КТ с контрастированием, аксиальный срез: определяется гомогенное контрастирование образования, что исключает кровоизлияние. Мелкие неконтрастируемые участки обусловлены скорее некротическими изменениями/расплав-лением, чем интенсивным кровотечением. Подобные находки характерны для лейкозных инфильтратов с основанием в твердой мозговой оболочке у пациентов с ОМЛ.
3. МРТ при лейкозе головного мозга:
• Т1-ВИ:
о Гипо-/изоинтенсивный по отношению к мозговой ткани сигнал о Может позволить дифференцировать острую гематому от негеморрагического объемного образования
• Т2-ВИ:
о Вариабельный сигнал, может быть гипоинтенсивным
о Поражение мягкой мозговой оболочки может распространяться по периваскулярным пространствам, визуализируется как очаги гиперинтенсивного сигнала в БВ
• FLAIR:
о Более чувствительно к образованиям мягких мозговых оболочек, чем Т2-ВИ
• Т2* GRE:
о Полезно для определения кавернозных ангиом-крайне поздних осложнений лечения лейкоза
• ДВИ:
о Возможно ограничение диффузии (гиперинтенсивное на ДВИ, гипоинтенсивное на ИКД)
о Помогает дифференцировать ишемические осложнения от ЗЭО
• Постконтрастные Т1-ВИ:
о Гомогенный характер контрастирования:
- Может стать гетерогенным при некротических изменениях/расплавлении
о Контрастирование мягких мозговых оболочек или периваскулярного пространства
о Методики подавления жира крайне важны для оценки поражений основания черепа
• МР-ангиография:
о Возможен вазоспазм при наличии СЗЭО
о Позволяет определить наличие васкулита сосудов среднего калибра
• МР-венография:
о Необходима для оценки геморрагических образований
о Оцените наличие или выраженность венозного тромбоза
4. Радионуклидная диагностика:
• Сцинтиграфия костей:
о Tc-99m MDP используется при поражении костей при лейкозе
о Поглощение мягкими тканями обычно является проявлением гиперкальциемии, а не хлоромы
• ПЭТ:
о Интенсивное поглощение ФДГ при проведении ПЭТ
5. Рекомендации по визуализации:
• Лучший инструмент визуализации:
о МРТ с контрастным усилением
• Советы по протоколу исследования:
о МРТ с получением постконтрастных Т1-ВИ в режиме подавления сигнала от жира
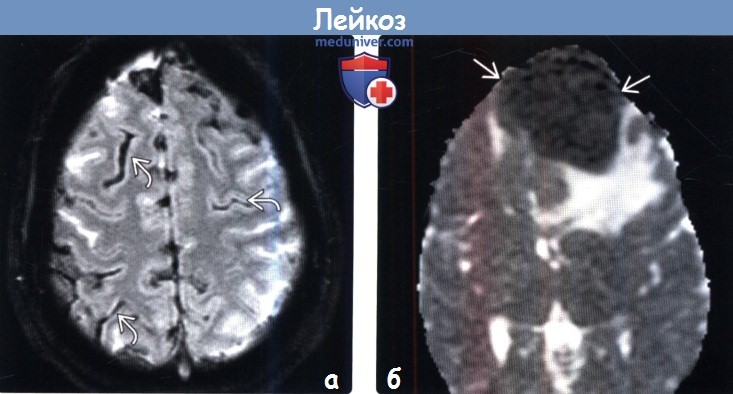
(а) MPT, Т2* GRE, аксиальный срез: у пациента с острым миелобластным лейкозом (ОМЛ) и бластным кризисом определяется гипоинтенсивный сигнал от лептоменинкс. При исследовании СМЖ были выявлены кровоизлияние и лейкоцитарные инфильтраты.
(б) МРТ, ИКД, аксиальный срез: у девочки 13 лет с синуситом и отеком кожи головы определяется выраженно гипоинтенсивное ограничивающее диффузию объемное образование, которое было гиперденсным при КТ и интенсивно накапливало контраст (изображения не представлены). При биопсии и исследовании крови был выявлен острый лимфобластный лейкоз (ОЛЛ) высокой степени риска.
в) Дифференциальная диагностика лейкоза головного мозга:
3. Внемозговая гематома:
• Отек внечерепных мягких тканей или перелом черепа
• При отсутствии характерного анамнеза предполагайте возможность жестокого обращения с ребенком
4. Экстрамедуллярный гематопоэз:
• Выражение гипоинтенсивный на Т2-ВИ сигнал
• Одинаковая популяция пациентов по группе риска
5. Гистиоцитоз из клеток Лангерганса (ГКЛ):
• Деструкция без периостальной реакции
• Несахарный диабет
6. Саркома Юинга:
• Агрессивный характер роста
• Деструкция прилегающей кости
7. Нейросаркоидоз:
• Имитирует поражение лептоменинкс
• Менее часто проявляется в виде объемных образований с основанием в твердой мозговой оболочке
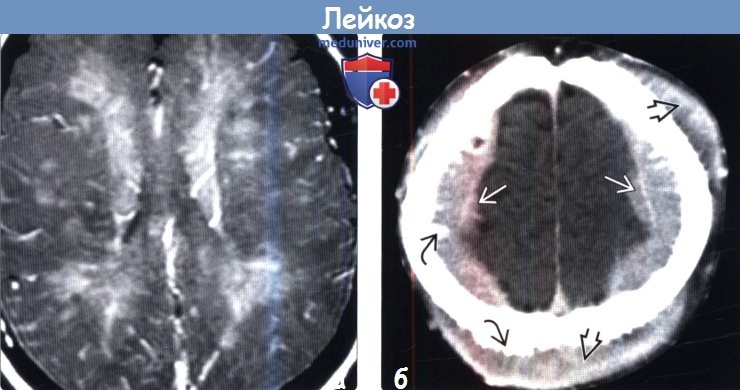
(а) МРТ, постконтрастное Т1-ВИ, аксиальный срез: у пациента с лейкемией и прогрессирующей энцефалопатией определяются множественные контрастируемые интра- и периваскулярные инфильтраты. Карциноматозный энцефалит является редким осложнением лейкоза.
(б) КТ с контрастированием, аксиальный срез: у пациента с лейкозом и поражением костей черепа определяются крупные двусторонние, конвекситальные, эпидуральные лейкозные объемные образования. Обратите внимание на поднадкостничную локализацию опухолей. Игольчатый вид наружной и внутренней пластинок костей свода черепа является признаком экстенсивного вовлечения костного мозга.
г) Патология:
г) Клиническая картина:
1. Проявления лейкоза головного мозга:
• Наиболее частые признаки/симптомы:
о Появление клинических симптомов может опережать диагностику лейкоза по анализу костного мозга
о В 50% случаев диагностируются только при аутопсии
о Для поражений ЦНС характерна клиническая манифестация
о Очаговая симптоматика вследствие локального масс-эффекта
о Головная вследствие кровоизлияния
• Клинический профиль:
о Ребенок с ОМЛ, у которого появились новые неврологические симптомы
2. Демография:
• Возраст:
о 60% пациентов африканских детей
3. Течение и прогноз:
• Общая выживаемость при ОМЛ - 40-50%
• Хлорома как часть другого миелопролиферативного синдрома:
о Предполагается бластная трансформация
о Признак неблагоприятного прогноза
4. Лечение:
• Индукционная химиотерпия:
о Цитарабин (Ара-С)
о Антрациклин
• Трансплантация костного мозга с целью консолидации ремиссии
• Обратите внимание: лечение метотрексатом может приводить к развитию инсультоподобных симптомов:
о МРТ → округлые поражения БВ с ограничением диффузии
д) Диагностическая памятка:
1. Обратите внимание:
• Экстрамедуллярный гемопоэз может быть в той же популяции пациентов со схожими проявлениями
• Геморрагические поражения у детей с ОМЛ могут являться манифестацией хлоромы или осложнениями терапии
2. Советы по интерпретации изображений:
• Множественные поражения множественной локализации позволяют поставить диагноз
• Хлоромы с кольцевым характером контрастирования (редко) могут имитировать абсцесс
е) Список литературы:
- Bar М et al: Central nervous system involvement in acute myeloid leukemia patients undergoing hematopoietic cell transplantation. Biol Blood Marrow Transplant. 21 (3):546-51, 2015
- Cheng CL et al: Risk factors and clinical outcomes of acute myeloid leukaemia with central nervous system involvement in adults. BMC Cancer. 15(1):344, 2015
- Bhojwani Detal: Methotrexate-induced neurotoxicity and leukoencephalopathy in childhood acute lymphoblastic leukemia. J Clin Oncol. 32(9):949—59, 2014
- Rozovski U et al: Incidence of and risk factors for involvement of the central nervous system in acute myeloid leukemia. Leuk Lymphoma. 1-6, 2014
- Morioka S et al: Effects of chemotherapy on the brain in childhood: diffusion tensor imaging of subtle white matter damage. Neuroradiology. 55(10):1251—7, 2013
- Spataro R et al: Neurological picture. Petechial brain haemorrhages in acute lymphoblastic leukaemia. J Neurol Neurosurg Psychiatry. 84(8):908, 2013
- Farad M et al: Magnetic resonance imaging in childhood leukemia survivors treated with cranial radiotherapy: a cross sectional, single center study. Pediatr Blood Cancer. 57(2):240-6, 2011
- Dicuonzo F et al: Posterior reversible encephalopathy syndrome associated with methotrexate neurotoxicity: conventional magnetic resonance and diffusion-weighted imaging findings. J Child Neurol. 24(8): 1013-8, 2009
- Koenig MK et al: Central nervous system complications of blastic hyperleukocytosis in childhood acute lymphoblastic leukemia: diagnostic and prognostic implications. J Child Neurol. 23(11): 1347-52, 2008
- Hakyemez В et al: Parlak M. Intracranial myeloid sarcoma: conventional and advanced MRI findings. Br J Radiol. 80(954):e109-12, 2007
Редактор: Искандер Милевски. Дата публикации: 5.4.2019
Отвечаем на самые важные вопросы про лейкоз
" title="Показать лейкоз может исследование периферической крови
" itemprop="contentUrl">
Показать лейкоз может исследование периферической крови
Фото: Сергей Яковлев
В сентябре мы познакомились с архангелогородкой Вероникой Рожновской, жизнь которой изменилась, когда у её дочери Даши диагностировали лейкоз. Девочка в тот момент училась в пятом классе, а на недомогания врачи не обращали должного внимания. Специалисты отмечают, что рак крови действует тем агрессивнее, чем моложе организм, который поражает болезнь. На другие важные вопросы об этом раке отвечают профессор кафедры онкологии и медицинской радиологии Уральского государственного медицинского университета Сергей Берзин и гематолог из Уфы Нэлли Янтурина.
Лейкоз — опухолевое заболевание клеток крови. При лейкозе происходит патологическая трансформация лейкоцитов и их бесконтрольное деление. В итоге они замещают собой нормальные клетки костного мозга, из которых образуются циркулирующие в крови лейкоциты, эритроциты и тромбоциты.
При хронических лейкозах деление клеток идёт медленнее, и клиника тоже развивается с меньшей скоростью. Лейкозный клон током крови разносится по всей кроветворной ткани. Органами-мишенями, где откладываются метастазы, становятся почки и кости. Оседая в костной ткани, эти клетки, по-другому они называются миеломные, нарушают ее структуру. Это может проявляться частыми переломами, болью в позвоночнике, ребрах. Хронические лейкозы могут годами протекать без каких-либо явных отклонений в самочувствии, тогда выявить их можно только при исследовании крови.
Начало заболевания нередко протекает без выраженных симптомов. Больные отмечают общую слабость, утомляемость, неопределенную боль в костях, непостоянную температуру по вечерам в пределах 37,1–38 градусов. Но уже в этот период у некоторых больных можно обнаружить небольшое увеличение лимфатических узлов, селезенки. В анализе крови тоже будут изменения — повышение или снижение количества лейкоцитов, анемия.
Лейкоз может проявляться разнообразными симптомами. При острой форме пациенты могут жаловаться, что стали часто простывать, у них возникли инфекционные осложнения или синяки на теле, а кого-то будет беспокоить резкая потеря веса, появление шишек на теле или увеличение лимфоузлов.
Симптомы лейкоза неспецифичны, они таковы:
- слабость;
- головокружения;
- высокая температура без явных на то причин;
- боли в руках и ногах;
- кровотечения.
При замещении патологически размножающимися лейкоцитами других клеток крови на первое место выходят анемии и кровотечения из-за уменьшения числа других клеток крови — эритроцитов и тромбоцитов. Из-за накопления лейкоцитов в лимфоузлах, печени или селезёнке эти органы могут увеличиться, но обнаружить эти симптомы уже может только врач.
При лейкозе субстратом опухоли является костный мозг, который находится во всех трубчатых и плоских костях. Здесь же развиваются предшественники крови: эритроциты, лейкоциты и тромбоциты. Когда в ткани начинают развиваться опухолевые клетки, места для нормальных здоровых клеток крови просто не остается. Если в случае с раком желудка пораженный участок можно удалить, вовремя провести химиотерапию и добиться длительной ремиссии, то при раке крови такая тактика не приемлема.
Есть формы острого лейкоза, которые могут развиваться с первых дней жизни человека. Хроническим формам лейкоза подвержены люди старшего возраста. Чем моложе возраст, тем агрессивнее протекает болезнь, но при современных методиках лечения больной может жить до 5–7 лет. На течение хронического миелолейкоза (и это научно доказано) большое влияние оказывает состояние нервной системы больного — если есть стрессы, депрессии, люди сгорают буквально на глазах.
Лечение лейкоза — это достаточно длительный процесс. В среднем на достижение ремиссии при острых лейкозах уходит от 3 месяцев до 2–3 лет.
Первый и самый сложный этап в лечении острого лейкоза — это интенсивная химиотерапия, с помощью которой мы должны убить опухолевые клетки. Пациенты должны находиться в специальном асептическом блоке, в котором созданы стерильные условия, чтобы исключить их контакт с любой инфекцией. Больные в этот момент не имеют никаких собственных факторов защиты, потому что кроветворение у них пострадало от самой болезни и применяемых химиопрепаратов. Для закрепления результатов терапии после этапа восстановления (или поддержки ремиссии) принимается решение о необходимости трансплантации костного мозга.
Пересадку можно делать, если пациента ввели в ремиссию. Она бывает двух видов: аутотрансплантация, когда пересаживается костный мозг самого больного, и аллотрансплантация, в этом случае ткани забирают у донора.
В первом случае у пациента из вены берется периферическая кровь, из нее при помощи сепаратора извлекают стволовые клетки, консервируют и передают на хранение в банк. Затем пациенту проводят сильнейшую химиотерапию, а следом проводят пересадку — так же, через вену, вводят стволовые клетки, и они начинают творить новое потомство. Технически это выглядит как переливание крови. Пересадка может быть сделана и при хроническом лейкозе.
Аллотрансплантация дает хорошие результаты, если доноры — родные сестра или брат, у них самый близкий фенотип. Пересадка даже от двоюродных родственников не всегда бывает столь успешна, но все равно это шанс на то, что человек будет жить.
Лучшие доноры костного мозга — это мужчины в возрасте 30–40 лет, семейные, имеющие постоянное место работы. Желательно — на промышленном производстве, на заводах. Практика показывает, что именно такие люди относятся к донорству с наибольшей ответственностью.
Женщина тоже может стать донором костного мозга. Но здесь важно учесть, что после родов и беременностей в крови у женщин циркулируют антитела, и их лейкоциты уже настроены бороться с чужеродными антигенами. Поэтому результат пересадки может оказаться хуже.
Казалось бы, о состоянии системы крови можно и нужно судить по общему анализу – с детства известной рутинной медицинской процедуре. Но на самом деле, данные этого анализа — отражение процессов, происходящих в кроветворной системе, и ее главном органе – костном мозге. Поэтому при подозрении на болезнь кроветворной системы анализируют состояние костного мозга. Пункция костного мозга – это вмешательство, которое позволяет получить 0,5-1мл. этой субстанции для дальнейшего исследования.
Что такое костный мозг и зачем его изучают?
Красный костный мозг находится в плоских костях – ребрах, грудине, позвонках, костях черепа и таза – и в эпифизах (концевых частях) трубчатых костей. Он состоит из двух типов клеток – стромы, или, говоря простым языком, основной структуры, и кроветворных ростков из которых, собственно, и формируются форменные элементы: эритроциты, лейкоциты и тромбоциты.

Все элементы крови развиваются из одинаковых стволовых клеток-предшественников. Созревая (в медицине этот процесс называется дифференцировкой), клетки формируют два ростка кроветворения: лимфоидный, из которого потом созревают лимфоциты и миелоидный, создающий остальные форменные элементы. Незрелые клетки крови называются бластами. Обычно 90% всех стволовых клеток находятся в состоянии покоя.
В организме взрослого мужчины в сутки созревает 300г. форменных элементов крови, то есть 9 кг за год и около 7 тонн за 70 лет жизни. Новые клетки формируются взамен состарившихся или погибших по другим причинам (например, в борьбе с инфекциями).
В норме количество вновь созревших клеток строго равно числу погибших. При гемобластозах (лейкозах) клетки кроветворного ростка мутируют, перестают реагировать на регуляторные сигналы организма, и начинают бесконтрольно делиться. Если активность этого процесса настолько велика, что вновь сформированные клетки не успевают созреть, лейкоз называется острым. Если преобладают зрелые формы – хроническим.
Прежде чем выйти в кровоток, измененные лейкозные клетки накапливаются в красном костном мозге. И только инфильтрировав (заполонив) его, поступают сосуды. Изменения в анализе крови далеко не всегда соответствуют происходящему в костном мозге: на некоторых стадиях развития лейкоза количество форменных элементов в крови может не только не увеличиваться, но и уменьшаться.
Именно по этим причинам пункцию костного мозга и миелограммы выполняют при подозрении на любые болезни кроветворной системы.
Как и для чего выполняют пункцию костного мозга?
Чтобы получить материал для исследования, нужно проткнуть (пунктировать) кость там, где она находится близко к коже. В зависимости от возраста (а количество костного мозга в разных анатомических структурах изменяется со временем), это могут быть:
- у детей младше 2 лет – пяточная или большеберцовая кость;
- у детей старшего возраста – гребень подвздошной кости;
- у взрослых – грудина или гребень подвздошной кости.
Прокол делают специальной иглой с ограничителем – иглой Кассирского. 
Она может выглядеть по-разному. Но суть в том, что ограничитель позволяет зафиксировать глубину прокола.
Иногда полученный материал бывает неинформативен. Тогда (и при некоторых других показаниях) делается трепанобиопсия – метод, при котором специальной толстой иглой одним блоком забирают не только красный костный мозг, но и участок костного фрагмента над ним. Такую биопсию обычно делают в области гребня подвздошной кости.

Место прокола закрывается стерильной повязкой или пластырем. Боль может беспокоить и некоторое время после процедуры. Если нет противопоказаний, можно принять обезболивающие. Место прокола нельзя мочить в течение суток, соответственно, не рекомендуют принимать душ или ванну. Какого-то дополнительного ухода после пункции костного мозга не требуется.
Процедура эта безопасна, единственное абсолютное противопоказание – тяжелые нарушения свертывающей системы крови, когда любая травма приводит к обширным гематомам. Относительные противопоказания (когда сравнивают возможную пользу и вред), это:
- острый инфаркт миокарда;
- декомпенсированная сердечнососудистая патология;
- декомпенсированный сахарный диабет;
- гнойные поражения кожи в области предполагаемой пункции.
- кровотечение;
- инфицирование;
- аллергия – при непереносимости обезболивающих средств;
- сквозной прокол грудины, перелом (если пункция выполняется из грудины).
Вероятность осложнений невелика – по данным Британского общества гематологов за время с 1995 по 2001 год на 54890 проведенных пункций пришлось 26 осложнений разной степени тяжести.
Расшифровка и оценка результатов: миелограмма.
В первую очередь, в счетной камере подсчитываются мегакариоциты и миелокариоциты.
Мегакариоциты – это крупные клетки с большими ядрами, предшественники тромбоцитов. Их должно быть более 20, но менее 50 в 1 мкл.
Далее в окрашенных мазках подсчитывают процентные соотношения клеток различных рядов кроветворения. Полученный результат называется миелограммой.

Чтобы оценить по миелограмме качество костного мозга, важно знать не только процентное и количественное содержание гемопоэтических (кроветворных) элементов, но и их соотношение. Вот расшифровка некоторых показателей.
Высчитывается по формуле: (Промиелоциты + миелоциты + метамиелоциты) / (Палочкоядерные + сегментоядерные нейтрофилы). Нормальное значение 0,6 – 0,8.
Формула расчета: (Полихроматофильные + оксифильные нормобласты) / (Все ядросодержащие клетки красного ростка этого пунктата). Норма 0.8 – 0.9 и снижение индекса говорит о чрезмерно медленном наполнении гемоглобином эритроцитов (например, при железодефицитной анемии).
Как и у любого инструментального исследования, референсные значения (нормы) миелограммы могут изменяться в зависимости от лаборатории и используемых аппаратов.
Особенности миелограммы при лейкозах.
Как при остром, так и при хроническом лейкозе усиленный рост патологических клеток сопровождается уменьшением количества эритроцитов и тромбоцитов на всех стадиях созревания.
Если в миелограмме видны признаки лейкоза, пунктат костного мозга дополнительно проходит иммуногистохимическое, цитохимическое и генотипическое исследования – они нужны чтобы определить характерные особенности мутации опухолевого клона. Это важно для выбора схемы лечения конкретного пациента.
Что такое лимфобластный лейкоз и почему он развивается
- Мальчики поражаются чаще, чем девочки, в соотношении 1,2:1.
- Наиболее частое злокачественное поражение у детей
- Составляет 27% всех злокачественных поражений
- Возрастной пик - 2-6 лет
- Злокачественное поражение гемопоэтических стволовых клеток
- Нормальный гемопоэтический костный мозг инфильтрирован или вытеснен незрелыми или минимально дифференцированными лимфобластами
- Гиперемия и кровоизлияния в костный мозг
- Деструкция костных трабекул
- Цитоморфологическая подклассификация Французской, Американской и Английской (FАВ) исследовательских групп определяет группы L1-L3
- Цитохимическая дифференциальная диагностика (пероксидаза, эстераза и кислая фосфатаза) оказывает помощь в дифференцировании острого лимфобластного лейкоза от острого миелобластного лейкоза
- Иммунологическая дифференциальная диагностика: с-АLL, Т-АLL, пре-В-АLL, В-АLL
- Частота выше у детей с синдромом Дауна или генетическими транслокациями.
Какой метод диагностики лимфобластного лейкоза у детей выбрать: МРТ, КТ, рентген, УЗИ
Очаговые поражения костей:
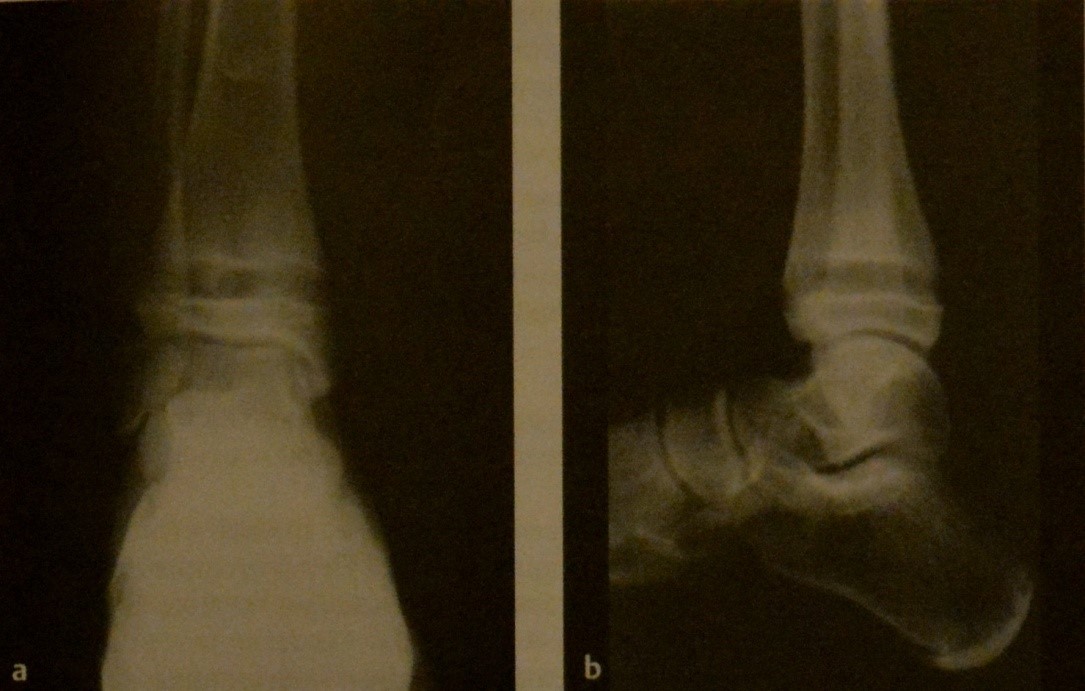
Острый лимфобластный лейкоз у мальчика 12 лет. Рентгенография голеностопного сустава в двух проекциях. Рентгенопрозрачные полосы в метафизе в дистальных отделах большеберцевой кости и малоберцевой кости.
- Необходима только при наличии крупных участков деструкции костей
- Может быть полезна при поражении позвоночника.
- Метод выбора для визуализации распространения поражения костного мозга
- Эффективно при затруднении в установлении диагноза
- Эффективно при наличии осложнений терапии
- МРТ всего тела (с супрессией жировой ткани) не может использоваться как рутинный метод исследования
- Очаговая или диффузная инфильтрация костного мозга обусловливает незначительную или умеренную интенсивность сигнала на Т1-взвешенных изображениях (неотличимо от гемопоэтического костного мозга у детей младшего возраста)
- Т1-релаксационное время инфильтрированного костного мозга удлинено
- Гиперинтенсивное по отношению к нормальному костному мозгу на Т2-взвешенных изображениях.
- Увеличение поглощения радионуклида
- Может привести к переоценке распространенности поражения костного мозга.
- Экстрамедуллярные поражения
- Оценка эффективности терапии.
Клинические проявления
- Часто нехарактерные симптомы
- Пролонгированное клиническое течение
- Бледность
- Повышенная утомляемость
- Потеря аппетита
- Потеря веса
- Повышение температуры тела
- Пациенты имеют склонность к развитию рецидивирующих персистирующих инфекций
- Гематомы и/или петехии на коже и кровоизлияния в слизистые
- Часто имеются боли в костях и суставах
- Выпот в полости суставов
- Головная боль, тошнота и рвота возникают при поражении ЦНС
- Умеренное увеличение лимфатических узлов
- Спленомегалия и/или гепатомегалия
- Синдром Микулича (лейкемическая инфильтрация в слезных и слюнных железах) возникает в редких случаях.
Тактика лечения
- Полихимиотерапия: индукционная терапия
- Профилактика поражения центральной нервной системы
- Реиндукционная терапия с/без профилактического облучения черепа
- Долговременная терапия.
- Поддерживающая терапия: профилактика присоединения инфекционных поражений.
Течение и прогноз
- Прогноз зависит от абсолютного содержания лимфоцитов в периферической крови
- Размеры печени и селезенки определяют отношение пациента к группе риска.
- Неблагоприятные прогностические факторы: плохой ответ на предварительную фазу лечения преднизолоном
- Персистенция лимфобла- стов после 1-го месяца химиотерапии
- Рецидив в течение 18 мес. после установления диагноза.
- Благоприятные прогностические факторы: длительная начальная фаза ремиссии
- 80% вероятность выживаемости при отсутствии рецидивов.
Осложнения
- Патологические переломы
- Остеонекроз во время проведения лечения
- Выпот в суставах
- Кровотечения
- Бактериальные инфекции
- Грибковые инфекции при проведении химиотерапии
- Карциноматоз мозговых оболочек при поражении ЦНС.
Какие заболевания имеют симптомы, схожие с острым лейкозом у ребенка
Метастазы нейробластомы
- более часто у детей возрасте до 3 лет;
- плохо определяемая, обычно прерывистая периостальная реакция.
Эозинофильная гранулема -
- пластинчатая периостальная реакция;
- разрушение кортикального слоя.
Остеомиелит
- разрушение кости может напоминать лейкемоидную инфильтрацию;
Лимфома
- обычно одиночное поражение, иногда многоочаговое;
- часто встречаются плохо определяемые остеолитические поражения;
- паростальный мягкотканный компонент.
Саркома Юинга
- типичное поражение диафизов;
- отсутствие рентгенопрозрачных линий в метафизах;
- агрессивная надкостничная реакция (пластинчатая, игольчатые разрастания, треугольник Кодмана);
- крупный мягкотканный компонент.
Советы и ошибки
- При наличии боли и выпота в суставах, увеличения скорости оседания эритроцитов состояние может быть неправильно интерпретировано как ревматическая лихорадка, ревматоидный артрит или остеомиелит
- Рентгенопрозрачные полосы в метафизе также возникают после рахита, при гипервитаминозе D, врожденном сифилисе, краснухе, цитомегаловирусной инфекции, токсо- плазмозе и цинге.
Острые лейкозы — это системное злокачественное заболевание кроветворной ткани костного мозга, морфологическим субстратом которого выступают бластные клетки (клетки на ранней стадии развития, незрелые), которые поражают костный мозг, вытесняя нормальные клеточные элементы и распространяясь не только по органам кроветворения, но и в другие органы и системы, в том числе ЦНС.
При остром лейкозе в крови накапливается большое количество бластных клеток, что приводит к угнетению нормального кроветворения всех ростков. Такие признаки выявляются в крови более чем в 80% случаев.
Выделяют две основные формы острого лейкоза — острый лимфобластный (ОЛЛ) и острый миелобластный (ОМЛ, часто называется острым нелимфобластным лейкозом). Каждое из этих заболеваний подразделяется на множество подвидов, отличающихся по своими морфологическими, иммунологическими и генетическими свойствами, а также по подходам к их лечению. Подбор оптимальной программы лечения возможен только на основании точного диагноза заболевания.
В 2002 г. в России выявлено 8 149 случаев лейкозов. Из них острые лейкозы составили 3257 случаев. ОЛЛ — самая частая форма острого лейкоза у детей — 85%, у взрослых на его долю приходится 20%). ОМЛ у детей составляют 15%, у взрослых — 80% общего количества острых лейкозов.
Диагностика острого лейкоза
Лейкоз может сопровождаться многими признаками и симптомами, некоторые из которых неспецифичны. Обратите внимание на то, что нижеприведенные симптомы чаще всего бывают при других заболеваниях, а не при раке.
Общие симптомы при лейкозе могут включать повышенную утомляемость, слабость, похудение, повышенную температуру (лихорадку) и потерю аппетита. Большинство симптомов острого лейкоза вызвано уменьшением количества эритроцитов в результате замещения нормального костного мозга, вырабатывающего клетки крови, лейкозными клетками. Как результат этого процесса, у больного снижается количество нормально функционирующих эритроцитов, лейкоцитов и тромбоцитов.
Анемия (малокровие) — это результат уменьшения количества эритроцитов. Анемия приводит к одышке, утомляемости и бледности кожи.
Снижение количества лейкоцитов повышает риск развития инфекционных заболеваний. Хотя у больных лейкозом количество лейкоцитов может быть очень высоким, эти клетки не являются нормальными и не защищают организм от инфекции.
Низкое количество тромбоцитов может вызывать кровоподтеки, кровотечение из носа и десен.
Распространение лейкоза за пределы костного мозга в другие органы или центральную нервную систему может вызывать различные симптомы, такие как головная боль, слабость, судороги, рвота, нарушение походки и зрения.
Некоторые больные могут жаловаться на боли в костях и суставах за счет их поражения лейкозными клетками.
Лейкоз может приводить к увеличению размеров печени и селезенки. При поражении лимфатических узлов они могут быть увеличены.
У больных ОМЛ поражение десен приводит к их опуханию, болезненности и кровотечению. Поражение кожи проявляется наличием мелких разноцветных пятен, напоминающих сыпь.
При Т-клеточном типе ОЛЛ нередко поражается вилочковая железа. Крупная вена (верхняя полая вена), несущая кровь от головы и верхних конечностей к сердцу, проходит рядом с вилочковой железой. Увеличенная в размерах вилочковая железа может сдавливать трахею, вызывая кашель, одышку и даже удушение. При сдавлении верхней полой вены возможен отек лица и верхних конечностей (синдром верхней полой вены). Это может нарушать кровоснабжение головного мозга и быть опасным для жизни. Больным с таким синдромом следует немедленно начать лечение.
Наличие некоторых вышеуказанных симптомом еще не означает, что у больного имеется лейкоз. Поэтому проводятся дополнительные исследования для уточнения диагноза, и при подтверждении лейкоза — его типа.
Изменение количества различных типов клеток крови и их вид под микроскопом может дать основание предположить лейкоз. У большинства больных острым лейкозом (ОЛЛ или ОМЛ), например, имеется слишком много лейкоцитов, мало эритроцитов и тромбоцитов. Кроме того, многие лейкоциты являются бластными клетками (тип незрелых клеток, в норме не циркулирующих в крови). Эти клетки не выполняют свою функцию.
С помощью тонкой иглы забирается небольшое количество костного мозга для исследования. Этот метод применяется для подтверждения диагноза лейкоза и оценки эффективности лечения.
При этой процедуре удаляется лимфатический узел целиком и затем исследуется.
Во время выполнения этой процедуры тонкая игла вводится в области поясницы в спинномозговой канал для получения небольшого количества спинномозговой жидкости, которая изучается для выявления лейкозных клеток.
Для диагностики и уточнения типа лейкоза используются различные специальные методы: цитохимия, проточная цитометрия, иммуноцитохимия, цитогенетика и молекулярно-генетические исследования. Специалисты изучают костный мозг, ткань лимфатического узла, кровь, спинномозговую жидкость под микроскопом. Они оценивают размер и форму клеток, а также и другие характеристики клеток для определения типа лейкоза, степени зрелости клеток. Большинство незрелых клеток относятся к бластным клеткам, неспособным бороться с инфекцией, которые замещают нормальные зрелые клетки.
- Рентгеновские снимки выполняются для выявления опухолевых образований в грудной полости, поражения костей и суставов.
- Компьютерная томография (КТ) является специальным методом рентгенологического исследования, позволяющего обследовать тело под разными углами. Метод применяется для обнаружения поражения грудной и брюшной полостей.
- Магнитно-резонансная томография (МРТ) использует сильные магниты и радиоволны для получения детального изображения тела. Метод особенно оправдан для оценки состояния головного и спинного мозга.
- Ультразвуковое исследование (УЗИ) позволяет отличать опухолевые образование и кисты, а также состояние почек, печени и селезенки, лимфатических узлов.
- Сканирование лимфатической и костной систем: При данном методе радиоактивное вещество вводится внутривенно и накапливается в лимфатических узлах или костях. Позволяет дифференцировать между лейкозным и воспалительным процессами в лимфатических узлах и костях.
Принципы лечения
Больные с различными подтипами лейкоза неодинаково отвечают на лечение. Выбор терапии основывается как на конкретном подтипе лейкоза, так и на определенных характеристиках болезни, которые называются прогностическими признаками. Эти признаки включают: возраст больного, количество лейкоцитов, ответ на химиотерапию и сведений о том, лечился ли ранее этот больной по поводу другой опухоли.
Основное содержание лечения острого лейкоза — это химиотерапия, направленная на уничтожение лейкозных (бластных) клеток в организме больного. Кроме химиотерапии используют ряд вспомогательных методов в зависимости от состояния больного: переливание компонентов крови (эритроцитов, тромбоцитов), профилактику инфекционных осложнений, уменьшение проявлений интоксикации и др.
Некоторым больным назначают химиотерапию очень высокими дозами препаратов для уничтожения всех клеток костного мозга, после чего проводится трансплантация костного мозга или трансплантация стволовых клеток.
Основным путем лечения острых лейкозов является химиотерапия, в основном, цитостатическими (останавливающими рост опухоли) препаратами. Разные клиники пользуются различными протоколами (схемами) лечения.
Продолжительность лечения острых лейкозов приблизительно одинакова независимо от варианта — два года. Терапия делится на стационарный этап — 6–8 месяцев и амбулаторное лечение — до 1,5–2 лет.
По достижении ремиссии лечение еще не закончено — дальнейшая терапия направлена на закрепление полученных результатов. В это время пациента очень часто отпускают домой на некоторое время. Режим и диета должны соблюдаться и дома. Больному нужно выделить отдельную комнату, убрать ковры и живые цветы и не забывать про ежедневную влажную уборку. После закрепляющего курса некоторым пациентам предстоит лучевая терапия на область головного мозга. Доза зависит от возраста и протокола. В период лучевой терапии больному необходимо хорошо питаться, отказаться от телевизора и работы с компьютером, проводить на свежем воздухе не менее 2 часов в день, спать не менее 8 часов, желательно и в дневное время. В пищу желательно употреблять больше так называемых антиоксидантов (зеленый чай, кагор, орехи, мед, B-каротин). Все эти мероприятия необходимы для снижения токсического действия облучения на головной мозг.
После проведения первых двух этапов химиотерапии в организме еще могут оставаться лейкозные клетки. На данном этапе лечения назначаются низкие дозы химиопрепаратов. Пациент выписывается на амбулаторное поддерживающее лечение, которое обычно проводится в течение 1,5–2 лет. То есть это лечение, которое проводится в домашних условиях, с периодическими посещениями гематолога в поликлинике для решения текущих проблем и проведения контрольного обследования или необходимых курсов терапии.
В связи с тем, что ОЛЛ часто распространяется в оболочки головного и спинного мозга, больным вводятся химиопрепараты в спинномозговой канал или назначается лучевая терапия на головной мозг.
Лечение ОМЛ состоит из двух фаз: индукции ремиссии и терапии после достижения ремиссии. В период первой фазы уничтожается большинство нормальных и лейкозных клеток костного мозга. Длительность этой фазы — обычно одна неделя. В этот период и в течение нескольких последующих недель количество лейкоцитов будет очень низким и поэтому потребуются меры против возможных осложнений. Если в результате недельной химиотерапии ремиссия не будет достигнута, то назначаются повторные курсы лечения.
Цель второй фазы — уничтожение оставшихся лейкозных клеток. Лечение в течение недели затем сопровождается периодом восстановления костного мозга (2–3 недели), затем курсы химиотерапию продолжаются еще несколько раз.
Трансплантация костного мозга и стволовых клеток представляет собой процедуру, позволяющую проводить лечение рака очень высокими дозами прежде всего химиотерапевтических средств, но иногда и радиоактивного излучения. Поскольку такое лечение постоянно разрушает костный мозг, оно в принципе представляется неосуществимым, ведь организм утрачивает жизненно важную способность продуцировать клетки крови. Однако, если после лечения в организм вновь ввести здоровые костный мозг (вещество, продуцирующее кровь) или стволовые клетки (клетки-предшественники в костном мозге, которые, развиваясь, превращаются в клетки крови), возможны замена костного мозга и восстановление его способности к кроветворению. Поэтому пересадки костного мозга и стволовых клеток позволяют проводить терапию высокими дозами для излечения конкретного рака, когда более низкие дозы бессильны.
Существуют три вида трансплантации: аутологическая, предусматривающая использование костного мозга или стволовых клеток самого пациента, аллогенная от родственных доноров и от неродственных доноров.
Трансплантацию костного мозга можно назвать классической. Цель удаления костного мозга заключается в получении содержащихся в нем клеток-предшественников (стволовых клеток), которые в процессе развития превращаются затем в различные компоненты крови. До начала любого интенсивного лечения костный мозг удаляют из бедренных костей пациента или донора, после чего замораживают и хранят до использования. Это называется извлечением. Позже после завершения химиотерапии в сочетании с радиотерапией или без нее костный мозг вводят обратно в организм капельным методом, подобно переливанию крови. Мозг циркулирует по организму с кровотоком и в конечном счете оседает в полостях костей, где начинается его рост и возобновляется процесс кроветворения.
Были созданы вещества, известные как факторы роста. Они представляют собой белки, стимулирующие образование больших количеств клеток-предшественников (стволовых клеток), которые проникают в кровь из костного мозга. Использование факторов роста означает, что теперь не всегда требуется извлекать костный мозг и вводить его обратно. Достаточно получить из крови только стволовые клетки. Это имеет много преимуществ. С помощью данного метода можно извлекать и вводить обратно больше стволовых клеток, что обеспечивает более быстрое восстановление количества клеток в крови и, следовательно, сокращает время, в течение которого пациент, перенесший пересадку, подвергается риску инфекции. Кроме того, получать стволовые клетки из крови легче, чем костный мозг из костей, что устраняет необходимость в анестезии.
Стволовые клетки обычно берут после курса химиотерапии (либо во время начального лечения, либо для этой цели пропускают одну дозу). При химиотерапии вводимые препараты вызывают сначала снижение числа клеток в крови. Однако через несколько дней их количество увеличивается и начинается восстановление кроветворения. Врачи используют этот момент для введения факторов роста, чтобы получить максимальный эффект и обеспечить поступление в кровь как можно большего количества стволовых клеток.
Процесс трансплантации состоит из четырех стадий.
- Первоначальное лечение рака химиотерапевтическими и/или радиотерапевтическими методами с целью максимально возможного уменьшения ракового поражения. В идеале лица, которым производится трансплантация, должны находиться в состоянии ремиссии (т.е. у них не должен выявляться рак), поскольку при этом наиболее высока вероятность того, что интенсивное лечение окажется эффективным. Однако оно может быть успешным и при наличии небольшого количества раковых клеток.
- Получение костного мозга или стволовых клеток от пациента или донора производится под общей анестезией. Шприцем из ряда точек над бедренными костями и иногда грудинной костью извлекают около 1 л костного мозга. Это обычно требует кратковременного пребывания в больнице, и после процедуры у пациента могут быть болезненное состояние и ощущение слабости, поэтому в течение нескольких дней ему требуются обезболивающие средства. Стволовые клетки получают методом гемофореза, который проводится в то время, когда количество выделившихся в кровоток стволовых клеток наиболее высоко, что наблюдается после химиотерапии и введения фактора роста, как указывалось ранее. В ходе этого процесса кровь берут из одной руки и помещают ее в центрифугу для отделения стволовых клеток. Затем оставшуюся кровь вводят обратно в другую руку. Вся процедура продолжается около 3–4 ч и абсолютно безболезненна.
- Лечение. Лечение проводится в больнице, длится обычно 4–5 дней и предусматривает введение очень высоких доз химиотерапевтических препаратов и иногда облучение всего организма. Во время пребывания в больнице пациента, как правило, помещают в отдельную палату в связи с повышенной чувствительностью к инфекции. Лечение противораковыми препаратами обычно проводится с помощью трубки Hichman (центральной трубки), которую вводят под анестезией. Эту трубку можно также использовать для вливания жидкостей, взятия проб крови и введения костного мозга или стволовых клеток, что предусмотрено на стадии 4. Для предупреждения тошноты и рвоты пациентам дают противорвотные препараты, а также, возможно, успокоительные средства, чтобы они не ощущали большого дискомфорта.
- Обратное введение костного мозга или стволовых клеток. Костный мозг или стволовые клетки вводят назад капельным методом через центральную трубку, подобно переливанию крови, и они с кровотоком доставляются к костям. Однако нормальное кроветворение восстанавливается лишь через несколько недель, в течение которых за пациентом тщательно наблюдают. Низкое количество лейкоцитов делает пациентов крайне уязвимыми к инфекциям, поэтому им регулярно вводят антибиотики. Даже те присутствующие в коже и кишечнике бактерии, которые оказывают благотворное воздействие на здоровых людей, могут причинить вред и вызвать инфекцию у ослабленных больных. Особенно внимательно необходимо следить за тем, чтобы не была занесена инфекция извне, для чего ограничивают посещения пациента.
Прогноз
Прогноз у детей с острым лимфолейкозом хороший: у 95% и более наступает полная ремиссия. У 70–80% больных проявлений болезни нет в течение 5 лет, их считают излечившимися. При возникновении рецидива в большинстве случаев можно достичь второй полной ремиссии. Больные со второй ремиссией — кандидаты на трансплантацию костного мозга с вероятностью долговременного выживания в 35–65% случаев.
Прогноз у больных острым миелобластным лейкозом относительно неблагоприятный. У 75% больных, получающих адекватное лечение с использованием современных химиотерапевтических схем, достигают полной ремиссии, 25% больных погибают (длительность ремиссии — 12–18 мес). Больным моложе 30 лет после достижения первой полной ремиссии можно проводить трансплантацию костного мозга. У 50% молодых больных, подвергшихся трансплантации, развивается длительная ремиссия.
Читайте также:


