Нарушения развития костно суставного аппарата
#мед_ статьи@medical_books
Ревматология
Остеоартроз. Совокуп ность клинических форм и сопутствующих заболеваний
Никакая другая болезнь так не затрудняет ходьбу, подъем по лестнице и другие движения, выполняемые нижними конечностями, как остеоартроз. Пациенты с остеоартрозом тратят больше времени и сил на выполнение своих ежедневных обязанностей, у них меньше времени остается на отдых. Они очень зависимы от своих родственников и близких и им требуется больше денег на медицинскую помощь и поддержание здоровья, чем людям того же пола и возраста из общей популяции.
Yelin E., Callahan L.F., 1995
Распространение ОА в начале XXI в. достигло размеров широкомасштабной неинфекционной эпидемии, что в первую очередь связано с возрастающими нагрузками на человека, развитием ОА у лиц молодого и среднего трудоспособного возраста, что обусловливает большую социально -экономическую значимость проблемы ОА и поиска новых и эффективных методов его консервативного лечения [3].
Возникновение ОА, выраженность и степень прогрессирования патологических процессов определяются многими факторами: хронической микротравматизацией сустава, врожденными или приобретенными дефектами опорно -двигательного аппарата, пожилым возрастом, генетическими факторами, воспалением, нейрогенными расстройствами, нарушением обмена веществ и др. В настоящий момент укореняется мнение, что ОА – не единая болезнь, а целая группа заболеваний со сходными патоморфологическими процессами, но патогенетическими особенностями развития.
Для гонартроза характерны появление болей в суставе при вставании, спуске по лестнице, локализация боли в медиальной части сустава с иррадиацией в бедро и голень, интраартикулярный хруст при движении. В начальном периоде отмечается ограничение разгибания, позже – сгибания сустава с образованием сгибательной контрактуры. Периодически возникает реактивный синовит, при котором появляются боли в покое, сопровождающиеся припухлостью сустава. Возможно образование подколенных жидкостных кист Бейкера. Постепенно развиваются атрофия мышц бедра и голени, нестабильность коленного сустава, девиация оси голени (О - или Х -образные ноги). При более часто встречающейся О -образной деформации может быть остеонекроз внутреннего мыщелка бедра. В поздних стадиях возможен подвывих большеберцовой кости.
Гонартроз часто развивается у женщин в менопаузальном периоде. В этот же период нередко отмечается ожирение, при этом избыточная масса тела усиливает осевую нагрузку на коленные суставы, ускоряя деструктивные процессы в них и утяжеляя клинику ОА. В целом можно предположить, что в развитии гонартроза немаловажную роль играет возрастной дисбаланс половых гормонов.
Артроз голеностопного сустава, как правило, является вторичным заболеванием после травм, особенно переломов берцовых костей, костей стопы, внутрисуставных переломов. Клинически проявляется болью при ходьбе, увеличением объема сустава за счет стойкого отека мягких тканей, ограничением движений и резким снижением опорности ноги. При диагностике ОА голеностопного сустава, памятуя о частой вторичности данного заболевания, следует подробно расспросить больного о предшествующих травмах нижних конечностей как одной из основных причин развития данной болезни.
Межпозвонковый остеохондроз в немалой степени напоминает ОА. Схожесть с данным заболеванием придают дегенеративные изменения межпозвонковых хрящей, субхондральный остеосклероз, формирующиеся остеофиты на позвонках, зависимость клиники боли от статомеханических перегрузок пораженных отделов. В формировании дорсопатий отдельное место занимает ОА дугоотросчатых суставов позвонков – фасеточных суставов. Это обычные синовиальные суставы, покрытые гиалиновым хрящом. Их капсула богато снабжена нервами. При ОА фасеточных суставов боль, как правило, двусторонняя, локализуется паравертебрально, усиливается при длительном стоянии и разгибании в спине, уменьшается при сидении. Объективные признаки сводятся к выявлению болезненности при глубокой пальпации в проекции дугоотросчатых суставов позвонков. Также пальпаторно определяются напряжение и болезненность паравертебральных мышц спины.
Все больше внимания уделяется суставу не как совокупности костных суставных поверхностей, хрящевых структур, синовиальной жидкости, суставной капсулы и параартикулярного аппарата, а как единому органу с присущими ему общими воспалительными, иммунными, нейротрофическими, метаболическими и функциональными составляющими. До конца не установлен эпицентр поражения при ОА – хрящ или субхондральная кость. Суставной гиалиновый хрящ не имеет нервных окончаний и кровеносных сосудов, и остается открытым вопрос: откуда он получает питание – из внутрисуставной синовиальной жидкости или субхондральной кости. При ОА дегенеративные процессы в хряще и субхондральной кости протекают параллельно. Но причины данных катаболических процессов до конца не известны.
Многочисленные заболевания внутренних органов часто встречаются у больных ОА. Проведен анализ сопутствующих заболеваний у больных ОА, проходивших лечение в поликлинике ЦКБ УД Президента РФ, по листам уточненных диагнозов. ОА верифицировался по критериям Института ревматологии АМН СССР (1983). Манифестный, клинически значимый ОА определялся с помощью критериев Американской коллегии ревматологов (ACR) для коленных, тазобедренных суставов и суставов кистей, которые имеют высокую чувствительность и специфичность (Altman et al., 1991; Hartz A.J. et al., 1991; Bellamy N. et al., 1999). При выявлении клинических признаков ОА у всех больных диагноз верифицировался рентгенологически с оценкой стадии заболевания по Н.С. Косинской (1971), I. Kellgren, J.S. Lawrence (1966) в модификации M. Leuquesne (1982).
Сопутствующая патология у больных ОА определялась на основании компьютерной системы с базой данных о заболеваемости контингента поликлиники. Диагнозы как ОА, так и сопутствующих заболеваний приведены в соответствии с нормами МКБ-10 (Всемирная организация здравоохранения, 1995 г.).
На момент исследования контингент пациентов поликлиники составил 13 512 человек. Среди них выявлено 522 больных ОА, из которых ОА коленных суставов страдали 175 человек. Средний возраст больных ОА коленных суставов – 68,2±5,8 года. Средний возраст пациентов поликлиники – 53,1±6,7 года. Таким образом, средний возраст больных ОА практически в 1,3 раза выше среднего возраста пациентов поликлиники.
В таблице 1 представлены частота основных заболеваний у пациентов с гонартрозом как в абсолютных числах, так и в процентном соотношении к количеству больных ОА коленных суставов, а также распространенность этих заболеваний среди всего контингента поликлиники. Рассчитано соотношение частоты сопутствующей патологии у больных гонартрозом по отношению к распространенности их среди контингента пациентов поликлиники.
У больных ОА совокупность заболеваний (основные нозологические формы) больше по сравнению с таковой у контингента поликлиники в 1,8 раза, причем ожирение, старческая катаракта, артериальная гипертензия (АГ), ишемическая болезнь сердца (ИБС), жировая дегенерация печени встречаются более чем в 2 раза чаще, чем у контингента поликлиники [4].
Обилие коморбидной патологии при ОА подтверждают и другие работы. По результатам исследований зарубежных и отечественных ученых, проблема сочетания ОА с метаболическим синдромом (МС) и АГ является важной и актуальной в мировой медицине. Согласно литературным данным, ОА – патология, которая часто сочетается с разными заболеваниями и синдромами. Ведущая роль в развитии и прогрессировании ОА у пациентов среднего и преклонного возраста принадлежит таким компонентам МС, как АГ и ожирение [5].
Пациенты с ОА имеют больший риск смертности в сравнении с общей популяцией. Оценен риск смертности у 1163 пациентов с ОА коленных или тазобедренных суставов старше 35 лет, верифицированным рентгенологически. Сопутствующие ОА заболевания, такие как диабет, онкология, сердечно-сосудистые заболевания, отягощают состояние больных наряду со снижением двигательной активности, что приводит к высокому риску смертности в сравнении с популяцией в целом, независимо от возраста [6].
Суставной синдром —, это не самостоятельное заболевание, а характерный симптом, указывающий на развитие воспалительного ответа, дегенеративно-дистрофических изменений в суставах и близ расположенных анатомических единицах.
Суставной синдром реализуется в клиническом разнообразии признаков и может имитировать другие болезни. Поэтому грамотно сформулировать диагноз, выстроить терапевтическую тактику с учетом выявленных у пациента суставных и внесуставных изменений может исключительно специалист —, ревматолог, ортопед-травматолог, артролог.
Что такое суставной синдром
Суставным синдромом (СС) называют симптомокомплекс полиэтиологического типа, обусловленный поражением структур костно-мышечной системы. Клиника СС складывается из боли, припухлости, локального повышения температуры, гиперемии, изменений функций и формы суставов.
Суставной синдром – ведущий признак в клинической картине разнородных заболеваний костно-мышечной системы и соединительной ткани:
- артрита,
- остеоартроза,
- анкилозирующего спондилита,
- псориаза,
- подагры,
- болезни Рейтера,
- псориатического артрита,
- периартикулярных поражений (тендинита, эпикондилита, бурсита, туннельного синдрома).
Суставной синдром чаще возникает в крупных суставах – плечевых, локтевых, тазобедренных, коленных, реже место локализации определяется в средних и мелких суставах – межфаланговых, лучезапястных, голеностопных.
На практике преимущественно наблюдается суставной синдром при ревматоидном артрите и остеоартрозе. Также болезненные проявления и скованность движений может быть признаком внесуставных патологий ЖКТ, кожных покровов, сердца и сосудов, органов дыхания, зрительной системы.
Справка! При поражении элементов одного сустава диагностируют моноартрит, двух или трех суставов —, олигоартрит, свыше четырех – полиартрит.
Причины развития
В патогенезе суставного синдрома ведущее значение принадлежит воспалению и дегенеративно-дистрофическим процессам, протекающим в тканях, суставах, мышцах, сухожилиях. Данный патологический дефект свойственный артрозам, ревматоидному и псориатическому артриту, анкилозирующему спондилиту, васкулитам, системной красной волчанке.
К облигаторным факторам появления острого суставного синдрома относят:
Статистические перегрузки: занятия спортом, тяжелый физический труд, лишний вес.
Среди причин суставного синдрома у детей целесообразно рассматривать рахит, интоксикационный синдром на фоне гельминтоза, паразитарных заболеваний, сопутствующие хронические инфекции (кариес, хронический тонзиллит, аденоидит), врожденную дисплазию суставов.
Симптомы
Клинику суставного синдрома формируют субъективные и объективные признаки. Стабильным симптомом при ревматических патологиях является боль. Болевой синдром отличается местом локализации, продолжительностью, характером, длительностью и временем продолжения.
В зависимости от этиологии заболевания болезненные ощущения преимущественно возникают в утренние часы и становятся интенсивнее ближе к вечеру. Болезненность может усиливаться после физических нагрузок, подъема по лестнице, при длительном фиксированном вертикальном положении тела.
Справка! Выраженность боли оценивают в баллах: 1 балл означает, что боль незначительная, пациент не нуждается в лечении. Максимальная величина показателя в таблице – 5 баллов, расценивается, как нестерпимая боль.
Второй клинический критерий суставного синдрома —, ограничение двигательной активности. Степень выраженности прямо пропорциональна стадии прогрессирования заболевания, тяжести функциональных изменений в структурах костно-мышечной системы.
Объективными признаками патологического процесса служат:
- изменения формы сустава: дефигурация и деформация,
- патологические шумы: треск, хруст, крепитация,
- локальная температура кожи в области суставов,
- припухлость, покраснение кожных покровов над зоной поражения,
- ограничение активных и пассивных движений в суставах.

Клинические формы суставного синдрома нестабильны и разнообразны и зависят от этиологии, активности патологического процесса, стадии прогрессирования.
В каждом конкретном случае врач должен уметь оценить характер дефекта. Так, гипермобильный суставной синдром проявляется избыточной гибкостью суставов и позвоночного столба, при этом пациенты с врожденной патологией считают такую гибкость нормой.
Суставной синдром затрагивает органы зрительной, сердечно-сосудистой, дыхательной и мочевыделительной системы, ЖКТ, и проявляется комплексом фенотипичных признаков. Внесуставными диагностическими критериями будет дисфагия, печеночно-селезеночный синдром, резкая боль в животе, тошнота и рвота, простатит, гломерулонефрит, пневмония, васкулиты, миокардит, конъюнктивит, ирит.
Диагностика
Этапность и установление диагноза у пациентов с суставным синдромом:
- Внешнее обследование больного с изучением жалоб и анамнеза. Задача доктора —, уточнить особенности течения патологии, определить ритм и характер болевого синдрома, провоцирующие факторы, обстоятельства, ослабляющие или усиливающие боль.
- Объективный осмотр. Предназначен для идентификации количества пораженных структур опорно-двигательного аппарата, симметричности/ассиметричности суставного синдрома.
Справка! В случае каждого пациента необходимо провести обследование кожных покровов, сердца и сосудов, мочевыделительной системы, ЖКТ с целью определения внесуставных признаков. При необходимости в диагностический поиск вовлекаются специалисты узкого профиля (окулист, гастроэнтеролог, уролог, гинеколог, сосудистый хирург).
На основании субъективных ощущений пациента, собранного анамнеза и данных объективного исследования врач выставляет предварительный диагноз.
Дифференциальная диагностика суставного синдрома предполагает лабораторно-инструментальные исследования. К числу минимально необходимых относят общий и биохимический анализ крови, цитологический анализ синовиальной жидкости.
Для визуализации состояния периартикулярных тканей и костных структур сустава применяют рентгеновскую компьютерную томографию и МРТ.
Иногда, чтобы прийти к заключению, чем болен пациент, может понадобится длительное наблюдение и повторное обследование.
Лечение
Методика лечения зависит от конкретной клинической ситуации. Вариабельность клинических проявлений предполагает дифференцированный подход к каждому отдельному пациенту. Важным моментом является объяснение больному причин его проблем на доступном языке.
Традиционно считается, что в первую очередь терапевтический подход должен иметь патогенетическую направленность и воздействовать на причинные факторы (воспаление, деструкцию). При лечении суставного синдрома используются хондропротекторы.
Наиболее значимые активные компоненты – хондроитин и глюкозамин, гидрохлорид или сульфат, участвуют в построении костной и хрящевой ткани, нормализуют выработку внутрисуставной жидкости, замедляют разрушение и препятствуют прогрессированию дегенеративных процессов в костно-мышечных структурах. Лечебный эффект заключается в прекращении боли, увеличении подвижности суставов, уменьшении скованности.
Для воздействия на патогенетические механизмы используют миорелаксанты. Они обеспечивают быстрый регресс боли, расслабление мышечной мускулатуры, восстановление функциональных способностей.
В терапии острой боли имеется необходимость быстро избавить пациента от мучительных проявлений. Проблема решается путем применения медикаментов для симптоматического лечения боли.
Базовыми препаратами будут нестероидные противовоспалительные средства (НПВС). Наиболее действенны на ранних стадиях суставного синдрома и должны назначаться лечащим врачом в минимально эффективных дозах с быстрой полной отменой.
Прием обезболивающих препаратов иногда может приводить к серьезным осложнениям, прежде всего, связанным с патологическими изменениями во всех отделах ЖКТ, кардиоваскуляторными катастрофами.
Поэтому, чтобы уменьшить частоту развития побочных эффектов предпочтение остается за селективными формами НПВС:
Дополнительно курс лечения суставного синдрома может включать антибиотики, витамины группы В, глюкокортикостероиды. В период стойкой ремиссии желательно дополнить терапевтическую схему ЛФК, физиотерапевтическими процедурами, массажем, санаторным и курортным лечением.
Полезными будут советы оптимизировать образ жизни. Это предполагает коррекцию рациона и режима питания, приведение в соответствие нагрузок с возможностями костно-мышечной системы, исключение алкоголя и курения.
Совет! Рекомендовано ограничить динамические и статистические нагрузки, вызывающие боль и дискомфорт. Необходимо свести к минимуму возможности травм.
Заключение
В зависимости от этиологии и выраженности суставного синдрома, факторов со стороны пациента в лечении ревматических болезней, протекающих с суставным синдромом, могут быть задействованы разные техники – фармакологическое и физическое воздействие.
Комплексный подход позволяет решить не только проблему боли, но и продлить период ремиссии, минимизировать риск хронизации патологии и развития функциональных нарушений опорно-двигательной системы. Данное условие выполнимо при раннем обращении за врачебной помощью, выполнении рекомендаций лечащего врача.
Врождённая косолапость (эквиноварусная деформация стопы) считается одним из часто встречаемых пороков внутриутробного развития. Согласно статистике, косолапость наблюдается у 1–3 детей на 1000 новорожденных. При этом мальчики страдают данной патологией примерно в два раза чаще, чем девочки. К тому же случаев двустороннего поражения на порядок больше, чем одностороннего.
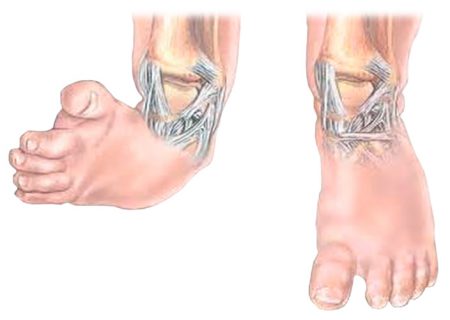
В 10% случаев косолапость у детей сочетается с вывихом бедра, кривошеей и сколиозом.
Причины развития косолапости у новорожденных
Возникновение эквиноварусной деформации стопы связывают либо с генетической аномалией и нарушением первичной закладки плода, либо с воздействием внешнего фактора на плод или с тем и другим одновременно. Наиболее распространенные причины появления врождённой косолапости:
- Сращение водной оболочки (амниона) с нижней конечностью эмбриона.
- Нарушение нормального формирования и развития нижних конечностей в первом триместре беременности.
- Механическое давление амниона или пуповины на стопу плода.
- При маловодии давление матки на наружную часть дистального отдела нижней конечности плода.
- Возможно механическое воздействие опухоли матки на стопу при нормальном количестве околоплодных вод.
- Патология спинномозговых нервов.
- Токсоплазмоз во время беременности.
Классификация косолапости
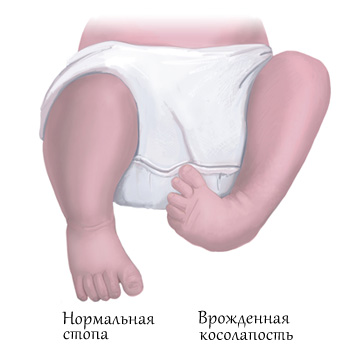
Существует несколько классификаций врождённой косолапости у детей. Однако с учётом последних данных принято выделять четыре формы эквиноварусной деформации стопы исходя из особенностей причины и патогенеза заболевания. Кроме того, отдельно акцентируют внимание на степенях тяжести.
Общепринятой является классификация на основе этиопатогенеза. В зависимости от причин и механизма развития порока различают следующие формы врождённой косолапости у детей:
- Типичная. Точная причина возникновения неизвестна. Характеризуется дисплазией и стойким нарушением расположения всех анатомических структур стопы. Эта патология возникает в период закладки органов и систем. Наблюдается задержка формирования и деформация костей стоп с нарушением формы и локализации их суставных поверхностей. При типичной врождённой косолапости даже у новорождённых детей невозможно осуществить полную одномоментную ортопедическую коррекцию суставов стопы.
- Позиционная. Рассматривается как эмбриональное нарушение развития нижней конечности, при котором наблюдается укорочение мышечно-связочных структур в заднемедиальной области голени и стопы без первоначального поражения костно-суставного аппарата.
- Вторичная. Развивается вследствие врождённых патологических изменений в нервно-мышечной системе. Клиническая симптоматика напрямую зависит от первичного заболевания.
- Артрогрипотическая. Возникает при тяжёлой патологии суставов артрогрипозе.

Симптомы заболевания напрямую зависят от тяжести и обширностии процесса. Выделяют следующие степени:
- Лёгкая форма характеризуется отсутствием ограничения движений в голеностопе и исправляется без приложения значительных усилий.
- При средней тяжести наблюдаются определённые ограничения движений. Вместе с тем при коррекции положения ступни чувствуется пружинистая податливость, но и также некоторое препятствие.
- Для тяжёлой формы характерны выраженные деформации костно-суставного аппарата стопы, которые в большинстве случаев не поддаются коррекции или исправлению при мануальном воздействии.
Клиническая картина косолапости
Независимо от причины и механизма развития эквиноварусной деформации стопы, будут присутствовать общие клинические признаки нарушения функции. Отчётливо определяется характерное положение дистальных отделов нижней конечности:
- подошвенное сгибание стопы в голеностопе;
- поворот вовнутрь подошвенной части ступни с провисанием наружного края;
- приведение переднего отдела ступни.
Ко всему прочему при ходьбе выявляется ограничение движения в голеностопе, атрофия группы мышц голени (больше всего страдает икроножная мышца) и своеобразная переваливающаяся походка.
Односторонне поражение при эквиноварусной деформации стопы может привести к укорочению соответствующей конечности на 1–2 см.
Рентгенодиагностика различных форм косолапости
На сегодняшний день самым информативным инструментальным методом обследования детей с врождённой косолапостью является рентгенодиагностика, позволяющая определиться с правильной тактикой при выборе лечения. Для объективной оценки костно-суставного аппарата применяют методику рентгенографии с установкой стоп в предельных функциональных положениях.
Информативность рентгенодиагностики существенно возрастает при сравнении результатов обследования в динамике.
Лечение различных форм косолапости у детей
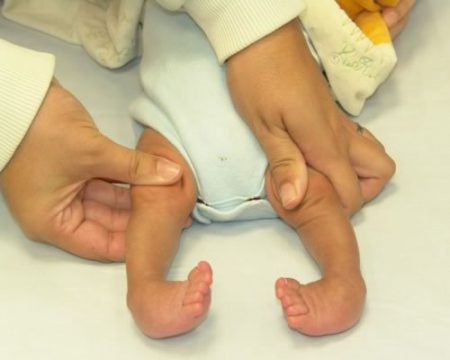
Многие родители всерьез обеспокоены тем, как избавиться от косолапости у ребёнка раз и навсегда. Сразу следует отметить, что это дело не одного дня, недели или даже месяца. Лечение эквиноварусной деформации стопы требует немало усилий, терпения, времени и средств.
Начинать лечить врождённую косолапость у детей необходимо как можно раньше — уже с первых недель жизни. Учитывая выраженность деформации и нарушение функции, комплекс консервативных методов включает:
- редрессирующую гимнастику (принудительное постепенное исправление деформации стопы с последующей фиксацией эластичным бинтом);
- применение гипсовой повязки;
- ортопедическую обувь;
- ЛФК с выполнением специальных корригирующих упражнений;
- массаж.
При средней и тяжёлой формах заболевания с возраста 3 недель переходят на этапное использование гипсовых повязок, смену которых осуществляют 1 раз в 3 недели. Одновременно проводят принудительную коррекцию (исправление) деформаций стопы. В положении гиперкоррекции стопа должна находиться не менее 3–4 месяцев.
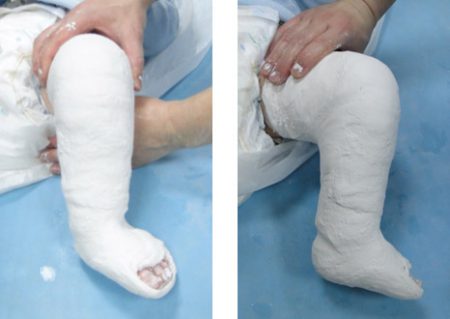
Как утверждает известный детский врач Комаровский, в настоящее время метод Понсети считается оптимальным видом консервативного лечения врождённой косолапости у детей. Если начать лечить до 9 месячного возраста, то шансы исправить большинство деформаций довольно высоки.
Лечение косолапости по методу Понсети оказывается эффективным в 80–90% случаев. Сама техника исправления врождённой косолапости состоит из 3 последовательных этапов:
- Коррекция деформаций стопы гипсовыми повязками. В общей сложности курс состоит из 5–6 гипсований.
- Ахиллотомия. Подкожное рассечение самого крупного сухожилия у человека — ахиллова для его удлинения.
- Ношение специальной обуви – брейсов с целью удержания коррекции и предотвращению рецидивов.
Закрепляют лечение занятиями ЛФК, регулярными физическими упражнениями, массажем и физиотерапией.

При всех видах приобретенной и врожденной косолапости у детей в качестве составной части лечения и профилактики заболевания применяется ортопедическая обувь. Для повышения эффективности рекомендуется использовать ортопедическую обувь вместе с другими видами консервативного лечения (ЛФК, лечебная гимнастика, корригирующие упражнения, массаж, ванны, фиксация стопы с помощью эластичного бинта и т. д.).
По мнению врача Комаровского, родителям следует помнить, что без чётких показаний и назначений врача-ортопеда приобретение и ношение специальной обуви не рекомендуется.
Использование антиварусной обуви позволяет малышу сохранять правильное положение стопы при ходьбе. При этом нагрузка на ножку распределяется предельно равномерно. Отличительная особенность такой обуви – это отсутствие супинатора. Кроме того, в обязательном порядке в детской ортопедической обуви для плотной фиксации ножки должны присутствовать шнурки, регулируемые застёжки или липучки.
Врач-ортопед обязан обучить родителей выполнению в домашних условиях специальной гимнастики, корригирующих упражнений, массажу и правильной фиксации стопы эластичным бинтом.
Ничто так не укрепляет мышечно-связочный и костно-суставной аппарат голени и стопы при косолапости, как лечебная гимнастика и комплекс специальных корригирующих упражнений. В обязанности врача-ортопеда входит подробно объяснить и показать родителям все упражнения для ребёнка, которые необходимо выполнять вне лечебного учреждения или реабилитационного центра.

Массаж при косолапости у детей является обязательным компонентом комплексного лечения детей, как ЛФК, гимнастика и корригирующие упражнения.
По возможности минимальными навыками массажа должны овладеть родители, чтобы сделать курс лечения непрерывным и повысить его эффективность.
При тяжёлых формах врождённой косолапости или отсутствии ожидаемого эффекта от консервативного лечения переходят к оперативному вмешательству. Основная задача хирургического лечения – максимально устранить имеющиеся деформации стопы.
В реабилитационный период после операции рекомендуют назначать ЛФК с силовыми упражнениями, массаж и физиотерапевтические процедуры (электрофорез, лазеротерапия, магнитотерапия).
Лечение косолапости у взрослых людей
Сегодня весьма актуальным остаётся вопрос, как исправить косолапость уже в более взрослом возрасте. Вопреки расхожему мнению, справиться с приобретенной или не до конца вылеченной в детстве косолапостью вполне возможно и без хирургической операции.
Прежде всего, для этого необходимо обратиться к опытному врачу-ортопеду, который сможет оценить степень костно-суставных деформаций и расписать оптимальную схему лечения, включающую мануальную терапию, физические упражнения, массаж и ношение ортопедической обуви.
В статье представлены основные подходы к диагностике и лечению таких заболеваний костно-мышечной системы, как остеоартроз, боль в спине, периартикулярная патология. Отражены принципы нелекарственной и медикаментозной терапии.
The article presents main approaches to the diagnosis and treatment of diseases of the musculoskeletal system like osteoarthritis, back pain, periarticular pathology. The principles of non-pharmacological and pharmacological therapy were reflected.
Костно-мышечные нарушения широко распространены и встречаются во всех возрастных группах населения. Подавляющее большинство пациентов составляют лица среднего и пожилого возраста. Ведущей жалобой являются боли в суставах и спине, связанные с физической нагрузкой, появляющиеся и/или усиливающиеся во второй половине дня/первой половине ночи, уменьшающиеся в покое, при этом локальные и системные признаки воспаления выражены незначительно.
Типичными представителями группы костно-мышечных заболеваний являются остеоартроз (ОА), периартикулярная патология (энтезиты, бурситы, тендиниты и др.), неспецифическая боль в нижней части спины (БНС).
В настоящее время описаны несколько фенотипов ОА [3].
- фенотип, индуцированный ожирением (окислительный стресс, дисрегуляция лептина, дисфункция эндотелия), — ОА позвоночника и опорных суставов;
- фенотип, ассоциированный со спортивными нагрузками, — микротравматизация опорных суставов (плечевые, локтевые, тазобедренные, коленные), в т. ч. на фоне скручивающих нагрузок;
- гиподинамический фенотип — ОА позвоночника (спондилоартроз), плечевых, лучезапястных суставов и суставов кистей (вследствие использования смартфонов и компьютерной мыши);
- фенотип, ассоциированный с нутритивной недостаточностью (в т. ч. гиповитаминоз D, С), — характерно поражение более трех групп суставов (генерализованный ОА).
ОА представляет гетерогенную группу заболеваний различной этиологии, при которых в процесс вовлекается не только суставной хрящ, но и субхондральная кость, связки, суставная капсула, синовиальная оболочка и периартикулярные мышцы.
Прогрессирование ОА — следствие взаимодействия механических, биологических, биохимических и молекулярных факторов, нарушающих нормальный цикл синтеза и деградации хондроцитов суставного хряща, компонентов внеклеточного матрикса (ВМ) и субхондральной кости. В нормальном хряще существует баланс между синтезом и деградацией составляющих ВМ, тогда как при ОА динамическое равновесие нарушается в результате потери коллагена II типа. Помимо нарушений метаболизма хряща, изменений субхондральной кости в патогенезе ОА большая роль отводится воспалению. Воспалительный процесс затрагивает практически все структуры сустава с формированием хондрита, синовита и остеита [4].
Взаимодействия цитокинов, ферментов, продуктов распада матрикса приводят к уменьшению содержания протеогликанов в хряще, нарушению архитектоники матрикса, появлению микротрещин и надрывов хряща. Эти процессы могут усиливаться при прорастании в хрящ сосудов микроциркуляторного русла. В воспалительный процесс вовлекаются синовиальная оболочка и субхондральная кость. На этом этапе возможно появление боли. Поскольку хрящ не иннервируется, боль является признаком вовлечения в патологический процесс периартикулярных тканей. Кроме того, источниками боли при ОА могут быть также синовит, трабекулярные микропереломы, давление на обнаженную субхондральную кость, формирование остеофитов, повышение внутрикостного давления в связи с венозным застоем, спазм близлежащих мышц, дегенеративные изменения связок [4].
Одной из наиболее значимых и инвалидизирующих форм ОА является гонартроз. Его основным симптомом является боль механического типа, возникающая при ходьбе и особенно при спуске или подъеме по лестнице. Боли локализуются в передней или внутренней частях сустава и могут иррадиировать в голень. Основное место отводится оценке болевого синдрома при ОА, клиническая палитра которого обусловлена различными его патогенетическими вариантами:
В качестве диагностических критериев ОА коленного сустава, в наибольшей мере отражающих клинические представления об этом заболевании, используются критерии M. Lequene:
- ограничение и/или боль при пассивном сгибании коленного сустава (сгибание в норме не менее 135°, разгибание — 0°);
- сужение щели бедренно-большеберцового или бедренно-надколенникового суставов;
- остеофиты и/или субхондральный склероз, субхондральные кисты.
Диагноз устанавливается при наличии всех трех признаков и исключении таких заболеваний, как ишемический некроз кости, костная болезнь Педжета, хондрокальциноз (пирофосфатная артропатия), гемохроматоз, охроноз, гемофилия, артриты, инфекции сустава (в т. ч. туберкулез), сустав Шарко (нейроартропатия), пигментный виллезонодулярный синовит, хондроматоз [4].
На современном этапе описаны факторы прогрессирования ОА:
- возраст;
- интенсивность боли > 60 мм по визуальной аналоговой шкале (ВАШ);
- реактивный синовит;
- отек костного мозга по данным магнитно-резонансной томографии (МРТ);
- локальный и системный остеопороз;
- низкий уровень витамина D;
- метаболический синдром;
- мышечная слабость/саркопения — важный фактор риска развития и прогрессирования ОА коленного сустава, а также неблагоприятного исхода и функциональных нарушений.
Бурсит — воспаление синовиальных сумок преимущественно в области суставов (субакромиальный, локтевого отростка, вертельный, препателлярный, сумки гусиной лапки (анзериновый)).
Тендинит — воспаление сухожилия (тендинит) и его влагалища (теносиновит) (двуглавой, надостной мышц, пяточного (ахиллового) сухожилия, инфрапателлярный).
Энтезопатия/энтезит — воспаление в местах прикрепления сухожилий, фасций, связок к костям, чаще всего в местах апофизов, бугристостей, мыщелков, отростков (латеральный и медиальный эпикондилиты).
Основные причины периартикулярной патологии (тендинитов и энтезитов):
- перегрузка (изменение стереотипа физической нагрузки);
- травмы (однократные или повторные микротравмы);
- локальное введение глюкокортикостероидов в толщу сухожилия;
- врожденные аномалии структур сустава, приводящие к нарушению биомеханики;
- дисбаланс мышц, окружающих сустав;
- гиподинамия (иммобилизация);
- нарушение кровоснабжения отдельных зон сухожилий;
- возрастная инволюция опорно-двигательного аппарата.
Характерными клиническими особенностями периартикулярного поражения являются боль при определенных движениях и ее локальный характер (пациент указывает точку максимальной боли), уменьшение объема активных при сохранении объема пассивных движений, асимметрия сустава, связь отечности с конкретной бурсой, сухожильным влагалищем.
Анзериновый тендинит/бурсит (pes anserinus — место прикрепления к большеберцовой кости сухожилий портняжной (m. sartorius), тонкой (m. gracilis) и полусухожильной (m. semitendinosus) мышц. Анатомически находится на 3–4 см ниже проекции щели коленного сустава по медиальной его поверхности). Факторами риска развития тендинита являются спортивные нагрузки (бег), остеоартрит, разрыв мениска, ожирение, длительная ходьба, внезапное увеличение нагрузок на ноги, плоскостопие, сахарный диабет.
Тендинит/бурсит большого вертела (трохантерит) — развивается чаще у женщин в возрасте 40–60 лет, страдающих ОА тазобедренного сустава. Для трохантерита характерна глубокая, жгучая боль по латеральной поверхности сустава и бедра, возрастающая при ходьбе по ровной поверхности и подъеме по лестнице, сидении на корточках, которая сочетается с хромотой у части больных. Постоянный характер боли указывает на вертельный бурсит. Снижение интенсивности боли отмечается в покое, усиливается по ночам, лежа на больной стороне. При осмотре отсутствуют ограничения пассивных и активных движений в тазобедренном суставе, отмечается локальная болезненность в зоне большого вертела при пальпации, при сопротивлении активному отведению бедра возникает боль.
Неспецифическая БНС является универсальной моделью костно-мышечных нарушений у пациентов всех возрастных групп, включающей поражение мышц, связок, суставного аппарата позвоночника. В появлении острой БС важную роль играет локальное повреждение связочного аппарата позвоночного столба, прежде всего коротких связок (желтых, межпоперечных и межостистых), стабилизирующих позвоночник на сегментарном уровне на фоне нефизиологических движений и чрезмерной нагрузки. Развитие мышечной дисфункции, энтезопатий, тендопатий вовлеченных мышц, сочетающихся с ОА дугоотростчатых суставов, спондилезом, лежит в основе развития хронической БС, при этом поддержание болевого синдрома у части больных обусловлено развитием феноменов периферической и центральной сенситизации (рис.) [5].
Миофасциальная дисфункция (миофасциальный синдром, МФС), ассоциированная с физической или позной нагрузкой, характеризуется формированием плотных болезненных тяжей и участков повышенной чувствительности (триггерных точек, ТТ) в пределах пораженной мышцы с воспроизведением паттерна отраженной боли или чувствительных расстройств (парестезий) при пальпации, а также ограничением объема движений.
МФС квадратной мышцы поясницы сопровождается болью в поясничной области глубинного характера с иррадиацией в крестцово-подвздошное сочленение и ягодичную область, при глубоком расположении ТТ — в бедро, область гребня подвздошной кости и паховую область. Формирование ТТ в квадратной мышце поясницы происходит при форсированных движениях, сопровождающихся наклоном и поворотом туловища, подъемом груза, а также при позном напряжении, связанном с садовыми работами. Болевые ощущения в поясничной области возникают и усиливаются при ходьбе, наклонах туловища, поворотах в постели, вставании со стула, кашле, чихании. Наиболее интенсивный характер боль приобретает в горизонтальном положении. Для выявления ТТ необходима глубокая пальпация в положении пациента лежа на здоровом боку. При выполнении наклона туловища в сторону, противоположную локализации спазмированной мышцы, болевой синдром усиливается [6].
МФС грушевидной мышцы характеризуется ноющими, тянущими, мозжащими болями в ягодичной области, в области крестцово-подвздошного сочленения, тазобедренного сустава и по задней поверхности больной ноги. Болевые феномены усиливаются после длительного сидения, в начале ходьбы, в положении стоя, полуприседании на корточках, при попытке приведения бедра. Уменьшение болей происходит в положении лежа, сидя с разведенными ногами, в процессе непродолжительной ходьбы. Объем движений в поясничном отделе позвоночника не изменен, поднимание прямой ноги часто ограничено. ТТ в грушевидной мышце наиболее часто активируются при движениях, связанных с форсированной ротацией на одной ноге, падениях, при длительном отведении ног в тазобедренных и сгибании в коленных суставах во время акушерских и урологических манипуляций.
Боль при спондилоартрозе локализуется в паравертебральной области, носит односторонний или двусторонний характер, может иррадиировать в ногу до уровня колена. Болевой синдром возникает после эпизодов длительной неподвижности, усиливается при разгибании, уменьшается при сгибании и движении, неврологические нарушения не характерны. Переразгибание позвоночника или сочетание разгибания с ротацией провоцирует боль (положительный тест Кемпа) [7].
Скрининговую оценку состояния опорно-двигательного аппарата (GALS — Gait — походка, Arm — рука, Leg — нога, Spine — позвоночник) рекомендуется проводить, учитывая следующие анамнестические сведения [8]:
- Есть ли у Вас боль и скованность в мышцах, суставах, позвоночнике?
- Можете ли Вы самостоятельно полностью одеться?
- Способны ли Вы спускаться и подниматься по лестнице без затруднений?
В диагностике заболеваний суставного аппарата важное значение имеет оценка признаков непосредственного поражения сустава и периартикулярной патологии. В первом случае боль носит постоянный характер, присутствует в покое, усиливается при движении, сопровождается уменьшением объема как активных, так и пассивных движений, при объективном осмотре определяется выпот в суставе (реактивный синовит при ОА), утолщение синовиальной оболочки, интраартикулярный хруст.
Лечебная тактика при ОА, периартикулярной патологии, неспецифической БНС сводится к купированию болевого синдрома в максимально короткий срок с использованием нестероидных противовоспалительных препаратов (НПВП), оценка эффективности которых проводится через 7–14 дней от начала приема полной терапевтической дозы, предпочтителен пероральный способ применения. Для кратковременного лечения очень интенсивной острой боли и/или при невозможности перорального приема рекомендуется использование инъекционных форм НПВП продолжительностью не более трех дней. При слабой или умеренно выраженной боли, высоком риске осложнений при системном приеме НПВП применяются локальные формы НПВП (мази, гели, спреи) [5].
Алгоритм ведения пациентов с ОА включает соблюдение рекомендаций по снижению веса, сбалансированному питанию, лечебной физкультуре. При наличии реактивного синовита показан охранительный режим до купирования воспаления. Для сдерживания прогрессирования ОА показано курсовое применение базисной терапии (симптом-модифицирующие препараты замедленного действия). В качестве физиотерапевтического лечения используются бальнеотерапия, ультразвуковая терапия, магнитотерапия, электрофорез с глюкокортикостероидами (ГКС).
При наличии периартикулярного поражения рекомендуется ограничить активные движения с участием вовлеченных структур в течение 2–3 недель. Проводится периартикулярное введение ГКС при неэффективности НПВП, физиотерапевтические процедуры (фонофорез, электрофорез, криотерапия, магнитные токи, бальнеотерапия), лечебная физкультура. Локальные инъекции ГКС проводятся при наличии локального воспаления в области четко определенной анатомической структуры и отсутствии эффекта при использовании НПВП в течение как минимум 7–14 дней. Интервал между введениями ГКС должен составлять 2–3 недели, показано не более трех инъекций в одну область в течение 12 месяцев [5].
При неспецифической БНС постельный режим должен быть ограничен 72 часами. Медикаментозная терапия в остром периоде может носить многокомпонентный характер (НПВП, миорелаксанты коротким курсом до 10 дней, анальгетики). При наличии МФС предпочтение отдается назначению миорелаксантов, применению мануальных миорелаксирующих методик. Рекомендуется еженедельная оценка состояния при острой БНС или обострении хронической БНС. Коррекция тактики ведения (в т. ч. консультация невролога) при ее неэффективности проводится через 4–6 недель (при хроническом варианте течения — ежемесячный осмотр) [9].
Приоритет в терапии ОА отдается лекарственным средствам замедленного симптоматического действия (SYSADOA — Symptomatic Slow-Acting Drugs for Osteoarthritis). Последние характеризуются природным происхождением, наличием достоверных данных о клинической эффективности и низкой частотой нежелательных эффектов. В лечении ОА используют хондроитин сульфат, глюкозамин, неомыляемые соединения сои и авокадо, диацереин, гиалуроновую кислоту.
В клинической практике на протяжении нескольких десятилетий широко используется многокомпонентный препарат замедленного симптоматического действия, демонстрирующий высокую клиническую эффективность и безопасность, — Алфлутоп — стандартизированный раствор для инъекций на основе биоактивного концентрата из мелкой морской рыбы. В состав препарата входят сульфатированные глюкозаминогликаны, аналогичные матриксу гиалинового хряща: хондроитин-4-сульфат, хондроитин-6-сульфат, дерматансульфат, кератансульфат, глюкуроновая кислота, свободные аминокислоты, макро- и микроэлементы (натрий, калий, кальций, магний, железо, медь, цинк) (табл.).
Согласно новым экспериментальным данным, полученным in vitro, Алфлутоп демонстрирует патогенетический механизм действия при ОА.
Механизм действия препарата Алфлутоп:
- Торможение деградации хряща — ингибиция экспрессии протеаз, гиалуронидазы.
- Усиление катаболических процессов — увеличение синтеза аггрекана и гиалуроновой кислоты.
- Противовоспалительное действие — ингибирование внеклеточного высвобождения интерлейкинов (ИЛ-1β, ИЛ-6, ИЛ-8), сосудистого эндотелиального фактора роста (СЭФР), экспрессии циклооксигеназы-2, регулирование экспрессии генов провоспалительных цитокинов.
- Антиоксидантное действие — торможение выработки супероксидных радикалов, активация ферментов, участвующих в окислительных реакциях.
- Влияние на фосфорно-кальциевый обмен — замедляет резорбцию костной ткани и снижает потерю ионов кальция.
Кроме того, в экспериментальных исследованиях на стандартизированной клеточной линии нормальных костных хондроцитов человека (CHON-001) доказано хондрорепаративное действие препарата Алфлутоп. Изучались пролиферативный статус (показателен для динамической клеточной регенерации) и внеклеточное высвобождение трансформирующего фактора роста бета (ТФР-β) — ключевого белка в гомеостазе внеклеточного матрикса. В ходе исследования Алфлутоп продемонстрировал активацию ТФР-β и улучшение клеточного пролиферативного индекса более чем на 50% по сравнению с контрольными клетками; препарат стимулирует синтез дезоксирибонуклеиновой кислоты и митоз хондроцитов, этот эффект носит дозозависимый характер [10].
Препарат Алфлутоп имеет широкий спектр клинической доказательной базы. С участием сотрудников кафедры факультетской терапии им. акад. А. И. Нестерова РНИМУ им. Н. И. Пирогова проведено двухлетнее многоцентровое слепое рандомизированное плацебо-контролируемое клиническое исследование по изучению симптом- и структурно-модифицирующего действия препарата Алфлутоп при гонартрозе [11]. В исследование были включены 90 больных ОА коленного сустава второй и третьей стадий по классификации Kellgren–Lawrence. Пациентов рандомизировали на две группы по 45 человек в каждой: первая получала внутримышечные инъекции Алфлутопа по 1 мл курсами по 20 дней с интервалом шесть месяцев в течение двух лет (всего четыре курса), вторая — инъекции плацебо (изотонический раствор натрия хлорида) по аналогичной схеме. В качестве сопутствующей терапии назначался ибупрофен в дозе 600–1200 мг/сут. Различия в абсолютной величине снижения интенсивности боли по индексу выраженности остеоартрита университетов Западного Онтарио и МакМастера (Western Ontario McMaster Universities OA Index — WOMAC) между группами оказались достоверными. Достоверное снижение скованности в группе Алфлутопа наблюдалось к третьему визиту (p
Н. А. Шостак, доктор медицинских наук, профессор
Н. Г. Правдюк 1 , кандидат медицинских наук
ФГБОУ ВО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
* Курс лечения целесообразно повторить через шесть месяцев.
Костно-мышечные нарушения в практике интерниста – диагностика, подходы к лечению/ Н. А. Шостак, Н. Г. Правдюк
Для цитирования: Лечащий врач №12/2017; Номера страниц в выпуске: 68-73
Теги: болевой синдром, суставы, позвоночник, миофасциальный синдром
Читайте также:


