Насонов е л бекетова т в анца-ассоциированные системные васкулиты
Полный текст:
- Аннотация
- Об авторе
- Литература
- Cited By
Статья посвящена международным рекомендациям по лечению системных васкулитов (СВ), ассоциированных с антинейтрофиль-ными цитоплазматическими антителами (АНЦА, АНЦА-СВ), представляющих собой группу тяжелых жизнеугрожающих иммуновоспалительных заболеваний. К этой группе относятся гранулематоз с полиангиитом Вегенера, микроскопический полиангиит, эозинофильный гранулематоз с полиангиитом Черджа—Строс. АНЦА-СВ являются одной из важнейших проблем практической ревматологии. Опубликованные в 2016 г. международной группой экспертов рекомендации по лечению АНЦА-СВ, в которых обобщены современные научные достижения и международный клинический опыт, до настоящего времени остаются основополагающими.
Татьяна Валентиновна Бекетова
115522, Москва, Каширское шоссе, 34А
1. Luqmani RA. Treat-to-target in vasculitis: is this a sensible approach? Clin Exp Rheumatol. 2012 Jul-Aug;30(4 Suppl 73): S149-53. Epub 2012 Oct 16.
2. Stone JH, Merkel PA, Spiera R, et al; RAVE-ITN Research Group. Rituximab versus cyclophosphamide for ANCA-associated vasculitis. N Engl J Med. 2010 Jul 15;363(3): 221-32. doi: 10.1056/NEJMoa0909905.
3. Jones RB, Tervaert JW, Hauser T, et al; European Vasculitis Study group. Rituximab versus cyclophosphamide in ANCA-associated renal vasculitis. N Engl J Med. 2010 Jul 15; 363(3):211-20. doi: 10.1056/NEJMoa0909169.
4. Yates M, Watts RA, Bajema IM, et al. EULAR/ERA-EDTA recommendations for the management of ANCA-associated vasculitis. Ann Rheum Dis. 2016 Sep;75(9): 1583-94. doi: 10.1136/annrheumdis-2016209133. Epub 2016 Jun 23.
5. Ntatsaki E, Carruthers D, Chakravarty K, et al; BSR and BHPR Standards, Guidelines and Audit Working Group. BSR and BHPR guideline for the management of adults with ANCA-associated vasculitis. Rheumatology (Oxford). 2014 Dec;53(12):2306-9. doi: 10.1093/rheumatology/ket445. Epub 2014 Apr 11.
6. Guerry MJ, Brogan P, Bruce IN, et al. Recommendations for the use of rituximab in anti-neutrophil cytoplasm antibody-associated vasculitis. Rheumatology (Oxford). 2012 Apr;51(4):634-43. doi: 10.1093/rheumatology/ker150. Epub 2011 May 25.
7. Groh M, Pagnoux C, Baldini C, et al. Eosinophilic granulomatosis with polyangiitis (Churg-Strauss) (EGPA) Consensus Task Force recommendations for evaluation and management. Eur J Intern Med. 2015 Sep; 26(7):545-53. doi: 10.1016/j.ejim.2015.04.022.
8. Jennette JC, Falk RJ, Bacon PA, et al. 2012 revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis Rheum. 2013 Jan;65(1): 1-11. doi: 10.1002/art.37715.
9. Sada KE, Yamamura M, Harigai M, et al; Research Committee on Intractable Vasculitides, the Ministry of Health, Labour and Welfare of Japan. Different responses to treatment across classified diseases and severities in Japanese patients with microscopic polyangiitis and granulomatosis with polyangiitis: a nationwide prospective inception cohort study. Arthritis Res Ther. 2015 Nov 2; 17:305. doi: 10.1186/s13075-015-0815-y.
10. McGregor JG, Hogan SL, Hu Y, et al. Glucocorticoids and relapse and infection rates in anti-neutrophil cytoplasmic antibody disease. Clin J Am Soc Nephrol. 2012 Feb;7(2): 240-7. doi: 10.2215/CJN.05610611.
11. Pagnoux C, Quemeneur T, Ninet J, et al; French Vasculitis Study Group. Treatment of systemic necrotizing vasculitides in patients aged sixty-five years or older: results of a multicenter, open-label, randomized controlled trial of corticosteroid and cyclophosphamidebased induction therapy. Arthritis Rheumatol. 2015 Apr;67(4):1117-27. doi: 10.1002/art.39011.
12. Robson J, Doll H, Suppiah R, et al. Glucocorticoid treatment and damage in the anti-neutrophil cytoplasm antibody-associated vasculitides: long-term data from the European Vasculitis Study Group trials. Rheumatology (Oxford). 2015 Mar;54(3): 471-81. doi: 10.1093/rheumatology/keu366.
13. Silva-Fernandez L, Loza E, Martinez-Taboada VM, et al; Systemic Autoimmune Diseases Study Group of the Spanish Society for Rheumatology (EAS-SER). Biological therapy for systemic vasculitis: a systematic review. Semin Arthritis Rheum. 2014 Feb;43(4):542-57. doi: 10.1016/j.semarthrit.2013.07.010. Epub 2013 Aug 24.
14. Holle JU, Voigt C, Both M, et al. Orbital masses in granulomatosis with polyangiitis are associated with a refractory course and a high burden of local damage. Rheumatology (Oxford). 2013 May;52(5):875-82. doi: 10.1093/rheumatology/kes382. Epub 2013 Jan 4.
15. Pullerits R, Ljevak M, Vikgren J, et al. Off-trial evaluation of the B cell-targeting treatment in the refractory cases of antineutrophil cytoplasmic antibodies (ANCA)-associated vasculitis: long-term follow-up from a single centre. Scand J Immunol. 2012 Oct; 76(4):411-20. doi: 10.1111/j.1365-3083.2012.02747.x.
16. D∅nvik KK, Omdal R. Churg-Strausssyndrome successfully treated with rituximab. Rheumatol Int. 2011 Jan;31(1):89-91. doi: 10.1007/s00296-009-1146-6. Epub 2009 Sep 30.
17. Cartin-Ceba R, Keogh KA, Specks U,et al. Rituximab for the treatment of ChurgStrauss syndrome with renal involvement. Nephrol Dial Transplant. 2011 Sep;26(9): 2865-71. doi: 10.1093/ndt/gfq852. Epub 2011 Feb 16.
18. Munoz SA, Gandino IJ, Orden AO, Allievi A. Rituximab in the treatment of eosinophilic granulomatosis with polyangiitis. Reumatol Clin. 2015 May-Jun;11(3):165-9. doi: 10.1016/j.reuma.2014.08.005. Epub 2014 Dec 15.
19. Mohammad AJ, Hot A, Arndt F, et al. Rituximab for the treatment of eosinophilic granulomatosis with polyangiitis (Churg-Strauss). Ann Rheum Dis. 2016 Feb; 75(2):396-401. doi: 10.1136/annrheumdis-2014-206095. Epub 2014 Dec 2.
20. Aguirre-Valencia D, Posso-Osorio I, Bravo JC, et al. Sequential rituximab and omalizumab for the treatment of eosinophilic granulomatosis with polyangiitis (Churg-Strauss syndrome). Clin Rheumatol. 2017 Sep;36(9):2159-2162. doi: 10.1007/s10067-017-3780-9. Epub 2017 Jul 31.
21. Tesfa D, Ajeganova S, Ha gglund H, et al. Late-onset neutropenia following rituximab therapy in rheumatic diseases: association with B lymphocyte depletion and infections. Arthritis Rheum. 2011 Aug;63(8):2209-14. doi: 10.1002/art.30427.
22. Monach PA, Arnold LM, Merkel PA. Incidence and prevention of bladder toxicity from cyclophosphamide in the treatment of rheumatic diseases: A data-driven review. Arthritis Rheum. 2010 Jan;62(1):9-21. doi: 10.1002/art.25061.
23. Klemmer PJ, Chalermskulrat W, Reif MS, et al. Plasmapheresis Therapy for Diffuse Alveolar Hemorrhage in Patients with Small-Vessel Vasculitis. Am J Kidney Dis. 2003 Dec; 42(6):1149-53. doi:10.1053/j.ajkd.2003.08.015
24. Levy JB, Hammad T, Coulthart A, et al. Clinical features and outcome of patients with both ANCA and anti-GBM antibodies. Kidney Int. 2004 Oct;66(4):1535-40. doi:10.1111/j.1523-1755.2004.00917.x
25. De Groot K, Rasmussen N, Bacon PA, et al. Randomized trial of cyclophosphamide versus methotrexate for induction of remission in early systemic antineutrophil cytoplasmic antibody-associated vasculitis. Arthritis Rheum. 2005 Aug;52(8):2461-9. doi:10.1002/art.21142
26. Langford CA, Talar-Williams C, Sneller MC. Use of methotrexate and glucocorticoids in the treatment of Wegener's granulomatosis. Long-term renal outcome in patients with lomerulonephritis. Arthritis Rheum. 2000 Aug; 43(8):1836-40. doi:10.1002/1529-0131(200008)43:8 3.0.CO;2-R
27. Metzler C, Hellmich B, Gause A, et al. Churg Strauss syndrome-successful induction of remission with methotrexate and unexpected high cardiac and pulmonary relapse ratio during maintenance treatment. Clin Exp Rheumatol. 2004;22(6 Suppl 36): S52-61.
28. Miloslavsky EM, Specks U, Merkel PA, et al. Outcomes of nonsevere relapses in antineutrophil cytoplasmic antibody-associated vasculitis treated with glucocorticoids. Arthritis Rheumatol. 2015 Jun;67(6):1629-36. doi: 10.1002/art.39104.
29. Fortin PM, Tejani AM, Bassett K, et al. Intravenous immunoglobulin as adjuvant therapy for Wegener's granulomatosis. Cochrane Database Syst Rev 2013;1: CD007057. doi:10.1002/14651858.CD007057.pub3
30. Koike H, Akiyama K, Saito T, et al. Research Group for IVIg for EGPA/CSS in Japan. Intravenous immunoglobulin for chronic residual peripheral neuropathy in eosinophilic granulomatosis with polyangiitis (Churg—Strauss syndrome): a multicenter, double-blind trial. JNeurol. 2015 Mar;262(3): 752-9. doi: 10.1007/s00415-014-7618-y. Epub 2015 Jan 11.
31. Stegeman CA, Tervaert JW, de Jong PE, Kallenberg CG. Trimethoprim-sulfamethoxazole (Co-trimoxazole) for the prevention of relapses of Wegener's granulomatosis. N Engl J Med. 1996 Jul 4;335(1):16-20. doi:10.1056/NEJM199607043350103
32. Katsuyama T, Saito K, Kubo S, et al. Prophylaxis for Pneumocystis pneumonia in patients with rheumatoid arthritis treated with biologics, based on risk factors found in a retrospective study. Arthritis Res Ther. 2014 Feb 5; 16(1):R43. doi: 10.1186/ar4472.
33. Jayne DRW, Bruchfeld AN, Harper L, et al. Randomized Trial of C5a Receptor Inhibitor Avacopan in ANCA-Associated Vasculitis. J Am Soc Nephrol. 2017 Sep;28(9): 2756-2767. doi: 10.1681/ASN.2016111179. Epub 2017 Apr 11.
34. Metzler C, Miehle N, Manger K, et al. Elevated relapse rate under oral methotrexate versus leflunomide for maintenance of remission in Wegener's granulomatosis. Rheumatology (Oxford). 2007 Jul;46(7):1087-91. Epub 2007 May 22.
35. Guillevin L, Pagnoux C, Karras A, et al. Rituximab versus azathioprine for maintenance in ANCA-associated vasculitis. N Engl J Med. 2014 Nov 6;371(19):1771-80. doi: 10.1056/NEJMoa1404231.
36. Terrier B, Pagnoux C, Perrodeau E, et al. Long-term efficacy of remission-maintenance regimens for ANCA-associated vas-culitides. Ann Rheum Dis 2018 Aug;77(8): 1150-1156. doi: 10.1136/annrheumdis-2017-21
37. Springer J, Nutter B, Langford CA, et al. Granulomatosis with polyangiitis (Wegener's): impact of maintenance therapy duration. Medicine (Baltimore). 2014 Mar;93(2):82-90. doi: 10.1097/MD.0000000000000020

Контент доступен под лицензией Creative Commons Attribution 4.0 License.












АНЦА-ассоциированные системные васкулиты в клинической практике
Диагностика AНЦА-ассоциированного системного васкулита, включающего легочно-почечный синдром, остается сложной задачей. Она основана на выявлении циркулирующих аутоантител к цитоплазме нейтрофилов (АНЦА) и характерных гистологических изменений сосудистой стенки. В индукции и поддерживающей терапии используются комбинации иммуносупрессивных препаратов (высоких доз циклофосфамида, глюкокортикостероидов), азатиоприна, в исследованиях показана эффективность ритуксимаба. В статье рассматривается клинический случай микроскопического полиангиита.
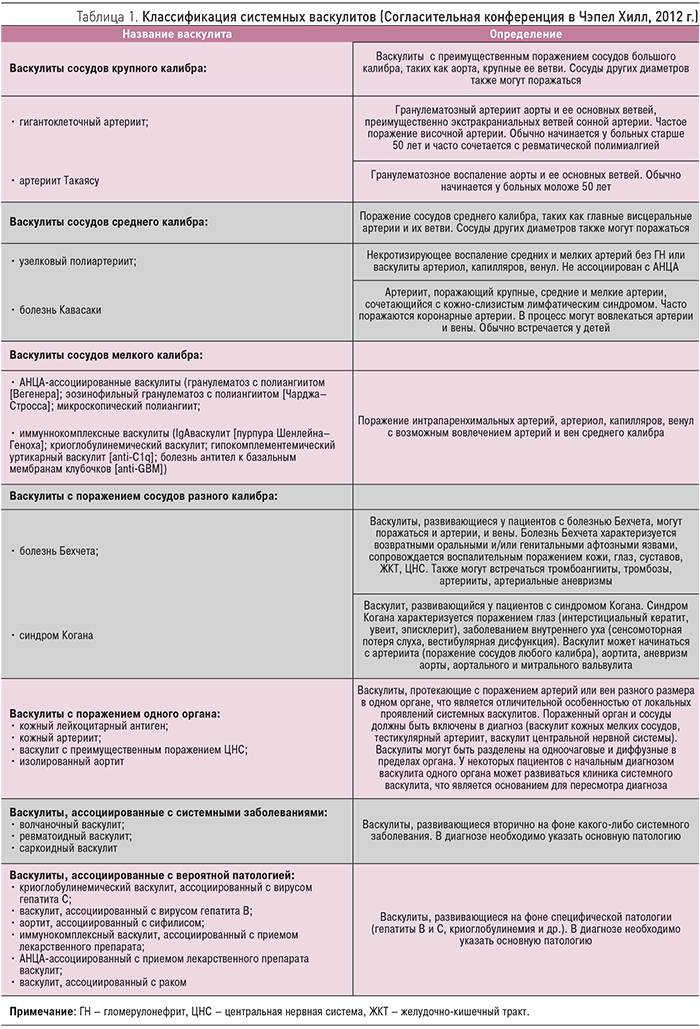
Системные васкулиты (СВ) – гетерогенная группа заболеваний, основным морфологическим признаком которых является воспаление сосудистой стенки, а клинические проявления определяются типом, калибром, локализацией пораженных сосудов и тяжестью иммуновоспалительных изменений [1]. Современная классификация СВ, принятая в 2012 г. на Согласительной конференции в Чэпел Хилл (Chapel Hill, USA), выделяет основные группы СВ в зависимости от калибра пораженных сосудов (крупные, средние, мелкие) и учитывает особенности иммунных механизмов (табл. 1, рисунок) [2].
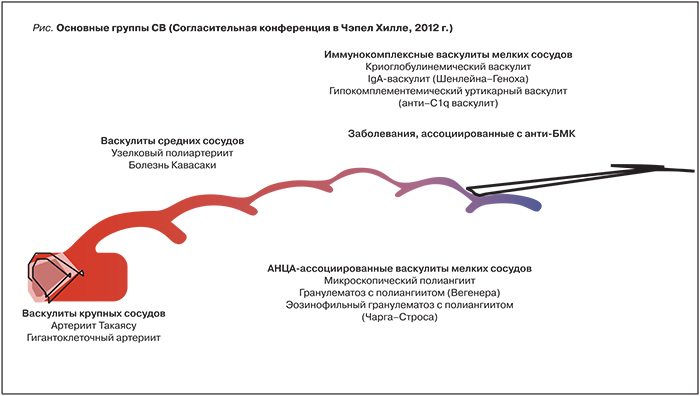
В течение последних лет в лечении АНЦА-СВ наметился значительный прогресс. Это связано не только с расширением возможностей лабораторной диагностики АНЦА-СВ, что позволяет начать активную терапию в ранней стадии заболевания, но и с разработкой новых генно-инженерных биологических препаратов [4, 7]. Вместе с тем, несмотря на внедрение современных лабораторных и инструментальных методов, диагностика АНЦА-СВ остается затруднительной для врачей различных специальностей, что обусловлено полиорганностью поражения и многообразием клинической картины [1, 2, 4, 5] (табл. 2).
За последние десятилетия в мире отмечена тенденция к увеличению распространенности АНЦА-СВ [2–4]. Ежегодная заболеваемость АНЦА-СВ составляет 10–20 на 1 млн в год [2, 3] и различается по регионам. В России, как и в странах Европы, ГПА встречается значительно чаще, чем МПА и ЭГПА, в то время как в Японии, наоборот, выше распространенность МПА [4]. Пик заболеваемости приходится на 45–55 лет, мужчины болеют чаще, чем женщины.
В этиологии АНЦА-СВ, которая продолжает изучаться, вероятно, определенную роль играют носительство золотистого стафилококка (при ГПА), лекарственная терапия (при ЭГПА), полиморфизм генов, кодирующих протеиназу-3 и ее основной ингибитор α1-антитрипсин (SERPIN A1), предрасполагающий к гиперпродукции антител к протеиназе-3 [2, 4].
Поражение почек характерно для всех AНЦА-СВ, но частота вовлечения почек неодинакова: максимальна при МПА (90%) и ГПА (80%), значительно более редка при ЭГПА (20–45%). Клинические проявления поражения почек включают быстропрогрессирующий ГН – наиболее типичный вариант течения, нефротический синдром, остронефритический синдром, бессимптомную протеинурию и микрогематурию, макрогематурию (редко), артериальную гипертензию [4, 6]. ГН в рамках АНЦА-СВ характеризуется очаговым и сегментарным некротизирующим воспалением с выраженной экстракапиллярной реакцией с формированием полулуний в клубочках почек разной степени зрелости [1, 2, 4, 5, 7, 8]. Характерными внепочечными проявлениями АНЦА-СВ являются следующие [1, 2, 4, 5, 8]:
- Поражения ЛОР-органов, глаз, полости рта:
- геморрагический васкулит (ГВ) и МПА – кровянистые выделения из носа, средний отит, мастоидит, поражение придаточных пазух, эписклерит, увеит, кератит;
- ГВ – язвы полости рта, перфорации носовой перегородки, седловидная деформация носа, стеноз трахеи, протрузия глазного яблока, окклюзия сосудов глазного дна;
- МПА – атрофия слизистой (без признаков гранулематозного воспаления);
- ЭГПА – аллергический ринит, полипоз.
- Поражение легких:
- ГПА – узелки, инфильтраты, полости .
- Бекетова Т.В., Насонов Е.Л. Современные представления о классификации и лечении системных васкулитов, ассоциированных с антинейтрофильными цитоплазматическими антителами: итоги 2011 г. Терапевтический архив. 2012;5:68–74.
- Jennette J.C., Falk R.J., Bacon P.A, Basu N., Cid M.C., Ferrario F., Flores-Suarez L.F., Gross W.L., Guillevin L., Hagen E.C., Hoffman G.S., Jayne D.R., Kallenberg G.M., Lamprecht P., Langford C.A., Luqmani R.A., Mahr A.D., Matteson E.L., Merkel P.A., Ozen S., Pusey C.D., Rasmussen N., Rees A.J., Scott D.G.I., Specks U., Stone J.H., Takahashi K., Watts R.A. 2012 revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis Rheum. 2013;65:1–11.
- Scott D.G.I., Watts R.A. Epidemiology and clinical features of systemic vasculitis. Clin. Exp. Nephrol. 2013;17:607–10.
- Национальные рекомендации по диагностике и лечению АНЦА-ассоциированных гломерулонефритов. Научное общество нефрологов России, Ассоциация нефрологов (рабочая группа Н.Л. Козловская, Н.Б. Гордовская, Ю.В. Коротчаева), Москва, 2015 г.
- Есаян А.М., Смирнов А.В. Материалы докладов. Москва, Нижний Новгород, 2015 г. Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова.
- Практические клинические рекомендации KDIGO по лечению гломерулонефритов. Нефрология и диализ. 2014;2(Прил.):127–6.
- Бекетова Т.В., Александрова Е.Н., Новоселова Т.М., Сажина Е.Г., Николаева Е.В., Сороцкая В.Н., Земерова Е.В., Нам И.Ф. Никитина Н.М., Архангельская Г.С., Багаутднова З.Р., Дашков И.Н., Черных С.Ю., Жирова О.В., Лушпаева Ю.А., Маснева Л.В., Афанасьева И.П., Арсеньев А.Е., Кондратенко И.В., Башкова И.Б., Глухова С.И., Насонов Е.Л., Смирнов А.В. Российский опыт применения моноклональных антител к В-лимфоцитам (Ритуксимаб) при системных васкулитах, ассоциированных с антинейтрофильными цитоплазматическими антителами. Научно-практическая ревматология. 2014;52(2):147–58.
- Guillevin L., Pagnoux C., Seror R., Mahr A., Mouthon L., Le Toumelin P. The Five-Factor Score revisited: assessment of prognoses of systemic necrotizing vasculitides based on the French Vasculitis Study Group (FVSG) cohort. Medicine. 2011;90:19–27.
- Guillevin L., Pagnoux C., Seror R., Groot K., Harper L., Jayne D., Suarez L. Pulse versus daily oral cyclophosphamide for induction of remission in аntineutrophil cytoplasmic antibody-associated vasculitis. A randomized trial. Ann. Intern. Med. 2009;150:670–80.
В статье рассматриваются классификация, клинические проявления и критерии диагностики АНЦА-ассоциированных системных васкулитов. Представлены современные методы иммунологической и морфологической диагностики заболеваний, относящихся к данной группе. Особое внимание уделяется возможностям патогенетической терапии глюкокортикостероидами и иммуносупрессорами, а также способам интенсификации лечения с помощью разных вариантов пульс-терапии, экстракорпоральных методов и генно-инженерных биологических агентов. Проанализированы ошибки терапии.
В статье рассматриваются классификация, клинические проявления и критерии диагностики АНЦА-ассоциированных системных васкулитов. Представлены современные методы иммунологической и морфологической диагностики заболеваний, относящихся к данной группе. Особое внимание уделяется возможностям патогенетической терапии глюкокортикостероидами и иммуносупрессорами, а также способам интенсификации лечения с помощью разных вариантов пульс-терапии, экстракорпоральных методов и генно-инженерных биологических агентов. Проанализированы ошибки терапии.
Системные васкулиты (СВ) – группа иммуновоспалительных заболеваний, в основе патогенеза которых лежит иммуноопосредованное воспаление стенок кровеносных сосудов с развитием ишемических изменений в органах и тканях, кровоснабжаемых соответствующими сосудами [1].
Некротизирующие васкулиты с преимущественным поражением мелких сосудов, ассоциированные с антинейтрофильными цитоплазматическими антителами (АНЦА) к миелопероксидазе или протеиназе 3, получили название АНЦА-ассоциированные васкулиты.
АНЦА-ассоциированные системные васкулиты (АНЦА-СВ) являются одной из наиболее важных проблем научной и практической ревматологии. К данной группе заболеваний, в частности, относятся гранулематоз с полиангиитом (ГПА), микроскопический полиангиит (МПА) и эозинофильный гранулематоз с полиангиитом (ЭГПА).
Указанные заболевания характеризуются упорным прогрессирующим течением, сложными патогенетическими механизмами, гетерогенностью клинико-иммунологических форм.
Длительное время АНЦА-СВ считались фатальной патологией, контроль которой представлял сложную задачу. Последние годы наметился значительный прогресс в лечении и, как следствие, существенное улучшение прогноза. Это связано, во-первых, с расширением возможностей диагностики АНЦА-СВ, что позволяет начать активную терапию на ранних стадиях, во-вторых, с разработкой генно-инженерных биологических препаратов (ГИБП). С данным классом препаратов ассоциируется новая эра в лечении АНЦА-СВ и других воспалительных ревматологических заболеваний.
Классификационные критерии системных васкулитов были опубликованы в 1990 г. Американской коллегией ревматологов. В 1994 г. на Международной согласительной конференции представлена их номенклатура и терминология. В 2012 г. на Международной согласительной конференции утверждена новая номенклатура системных васкулитов. В ней прежде всего учитываются калибр пораженных сосудов и основные механизмы их повреждения [2, 3].
В настоящее время системные васкулиты классифицируются следующим образом.
- Поражение сосудов крупного калибра: гигантоклеточный артериит;
- артериит Такаясу.
- Поражение сосудов среднего калибра:
- узелковый полиартериит;
- болезнь Кавасаки.
- Поражение сосудов мелкого калибра:
- АНЦА-ассоциированные системные васкулиты:
- микроскопический полиартериит; гранулематоз с полиангиитом (гранулематоз Вегенера);
- эозинофильный гранулематоз с полиангиитом (синдром Черджа – Стросса);
- иммунокомплексные васкулиты:
- болезни, связанные с наличием антител к базальным мембранам (синдром Гудпасчера);
- васкулиты, ассоциированные с иммуноглобулином (Ig) А (геморрагический васкулит, или пурпура Шенлейна – Геноха);
- криоглобулинемические васкулиты; гипокомплиментарный уртикарный васкулит.
- Васкулиты с поражением сосудов различного калибра (болезнь Бехчета, болезнь Бюргера).
- Васкулиты с моноорганным поражением (кожные системные васкулиты, церебральные васкулиты и т.д.).
- Васкулиты, ассоциированные с диффузными болезнями соединительной ткани (ревматоидный артрит, системная красная волчанка, саркоидоз и т.д.).
- Васкулиты, ассоциированные с этиологическим фактором (в частности, лекарственные средства, онкология, вирусная и бактериальная инфекции).
Классификационные критерии и клинические проявления
Классификационные критерии Европейской антиревматической лиги для ГПА и ЭГПА представлены в табл. 1 и 2. Для МПА таковые пока не разработаны [4–6].
Гранулематоз с полиангиитом – некротизирующее гранулематозное воспаление, обычно с поражением верхних и нижних дыхательных путей, и некротизирующий васкулит с преимущественным поражением мелких и средних сосудов. Часто встречается некротизирующий гломерулонефрит. Для ГПА характерны перфорация носовой перегородки, ретроорбитальные опухоли, прогрессирующие средние и внутренние отиты, некроз мягких тканей ротоглотки, стенозирующий ларингит, рецидивирующие/рефрактерные пневмонии с полостями распада легочной ткани, легочно-почечный синдром (синдром Гудпасчера). Диагноз подтверждается при обнаружении АНЦА (при типичной клинической картине) или результатами морфологического исследования.
Микроскопический полиангиит – некротизирующий васкулит, при котором мало определяются или совсем не определяются депозиты иммунных комплексов и преимущественно поражаются мелкие сосуды. Возможно развитие некротизирующего артериита мелких или средних артерий. Часто встречается некротизирующий гломерулонефрит и легочный капиллярит. Гранулематозное воспаление отсутствует. Для МПА характерны легочно-почечный синдром, рецидивирующие альвеолярные кровотечения, быстропрогрессирующий гломерулонефрит, кожный васкулит (в том числе язвенно-некротический), неспецифический суставной синдром в сочетании с системными проявлениями, поражением периферической нервной системы. Диагноз подтверждается в случае обнаружения АНЦА или по результатам морфологического исследования (биопсия почки, легкого, кожи).
Эозинофильный гранулематоз с полиангиитом – некротизирующее гранулематозное воспаление часто с поражением дыхательных путей и некротизирующий васкулит с преимущественным поражением мелких и средних сосудов, ассоциированные с бронхиальной астмой и эозинофилией. АНЦА чаще определяются при гломерулонефрите. Для ЭГПА характерны тяжелое стероид-зависимое течение бронхиальной астмы, эозинофилия более 10% (1500 клеток/мл, множественные сенсомоторные невриты, частые пневмонии (эозинофильные), артралгии/артриты, миалгии, миокардит/перикардит, пурпура и абдоминальный синдром. Диагноз чаще всего устанавливается по клиническим признакам. Морфологическое подтверждение желательно. Отсутствие АНЦА не исключает ЭГПА [7].
Выделяют несколько форм течения патологий: локализованную, раннюю системную, генерализованную, тяжелую, рефрактерную. Локализованная форма представляет собой поражение верхнего или нижнего дыхательного тракта в отсутствие других поражений и системного воспаления. Ранняя системная – любое системное поражение без угрозы потери органа или жизни. Генерализованная – поражение почек (креатинин менее 500 мкмоль/л (5,5 мг/дл)) и/или других органов с угрозой их тяжелого повреждения. Тяжелая – тяжелое поражение почек (креатинин более 500 мкмоль/л (5,5 мг/дл)) и/или других органов с угрозой их необратимого повреждения. Рефрактерная – прогрессирование болезни на фоне лечения преднизолоном и циклофосфамидом.
Рациональный подход к терапии
Существует две фазы патогенетического лечения АНЦА-ассоциированных васкулитов: индукция ремиссии (от трех до шести месяцев) и поддержание достигнутого эффекта (около двух лет, нередко – пожизненно).
Схема лечения некоторых видов АНЦА-ассоциированных васкулитов представлена в табл. 3 [8–12]. В частности, для индукции ремиссии ГПА используют глюкокортикостероиды (ГКС) и цитостатики (циклофосфамид, метотрексат, азатиоприн).
Монотерапия ГКС не применяется в связи с высокой частотой прогрессирования заболевания. Подавляющая терапия проводится преднизолоном 1 мг/кг/сут в несколько приемов в течение трех-четырех недель. По достижении клинического и лабораторного улучшения доза препарата уменьшается по 5 мг в две недели до поддерживающей дозы (0,15–0,20 мг/кг/сут). Длительность применения препарата в поддерживающей дозе – от одного года до трех – пяти лет.
Циклофосфамид является препаратом выбора при ГПА. Он назначается перорально 1–2 мг/кг/сут или в виде пульс-терапии 15 мг/кг с интервалом две недели между тремя первыми курсами, далее с интервалом три недели. После этого в течение двух-трех месяцев дозу циклофосфамида снижают до 25–50 мг/кг/сут. По достижении ремиссии терапия продолжается около 12 месяцев.
Азатиоприн используется для поддержания ремиссии. Оптимальная доза препарата составляет 1–3 мг/кг/сут, поддерживающая – 50 мг/сут. Метотрексат применяется при непереносимости циклофосфамида и для поддержания ремиссии. Доза препарата составляет 12,5–17,5 мг/нед. Микофенолата мофетил 2 г/сут в сочетании с преднизолоном 10 мг/сут назначают для поддержания ремиссии у больных ГПА при непереносимости или неэффективности метотрексата или азатиоприна.
Для поддержания ремиссии ГПА также используется лефлуномид 40 мг/сут в сочетании с преднизолоном 10 мг/сут.
Ко-тримоксазол/триметоприм 160/800 мг по два раза в день применяют в первую очередь для лечения ограниченных форм ГПА (поражение ЛОР-органов) – в период индукции ремиссии для профилактики инфекционных осложнений, вызываемых Pneumocystis carinii и развивающихся на фоне иммуносупрессивной терапии.
При рефрактерном течении ГПА показана биологическая терапия инфликсимабом и ритуксимабом. Высокая эффективность ритуксимаба отмечена у пациентов с АНЦА-ассоциированными васкулитами, рефрактерными к стандартной терапии. Препарат вводится в/в 500 мг/м 2 один раз в неделю в течение двух недель. Для снижения риска инфузионных реакций его введение осуществляется на фоне премедикации в/в метилпреднизолоном 250–500 мг и антигистаминными препаратами (хлоропирамина гидрохлорида 20 мг в/м). Ритуксимаб применяется совместно с ГКС в стандартной дозе, азатиоприном, микофенолата мофетилом. Рутинного сочетания циклофосфамида и ритуксимаба следует избегать. Однако при тяжелом течении заболевания, в том числе при быстропрогрессирующем гломерулонефрите, возможно одновременное использование ритуксимаба и циклофосфамида в стандартной дозе от одного до нескольких месяцев. По завершении лечения ритуксимабом возможен рецидив АНЦА-СВ. Именно поэтому пациенты должны находиться под наблюдением и периодически (один раз в два – четыре месяца) определять содержание B-лимфоцитарного антигена CD20 в крови.
Надежные предикторы рецидива заболевания не установлены. В случае рецидива после ремиссии, индуцированной ритуксимабом, рекомендован повторный курс такой терапии. При этом могут быть эффективны более низкие дозы препарата (500–1000 мг). Для уменьшения риска рецидива возможно превентивное назначение повторного курса ритуксимаба.
Ритуксимаб предпочтителен у женщин репродуктивного возраста (особенно старше 30 лет), поскольку при лечении циклофосфамидом повышается риск развития бесплодия, а также у пациентов, которые не ответили на терапию циклофосфамидом (шесть – девять инфузий или кумулятивная доза более 10 г) или не переносят такое лечение (например, при развитии геморрагического цистита).
По достижении ремиссии дозу ГКС постепенно снижают (до 7,5 мг или полной отмены), циклофосфамид отменяют и назначают поддерживающую терапию азатиоприном, реже – метотрексатом. При их непереносимости показан лефлуномид или микофенолата мофетил.
Продолжительность иммуносупрессивной терапии при АНЦА-ассоциированных васкулитах:
поддерживающей – ритуксимаб 1000 мг каждые четыре – шесть месяцев не менее двух лет.
Альтернативные препараты назначают больным с рефрактерным или рецидивирующим течением заболевания.
Микофенолата мофетил 1–2 г/сут в один или несколько приемов не менее шести месяцев. Сочетают с преднизолоном в стандартной дозе.
Нормальный иммуноглобулин человека 0,4–2,0 г/кг/сут в/в в течение трех – пяти дней. Возможно проведение повторных курсов один раз в месяц в течение шести месяцев. Является вспомогательным средством.
Плазмаферез от семи до десяти процедур в течение 14 дней с удалением 60 мл/кг плазмы и замещением равным объемом 4,5–5,0%-ного альбумина человека. Добавляют при неэффективности индукционной терапии, активном и тяжелом течении заболевания (уровень креатинина более 500 ммоль/л или геморрагический альвеолит).
Поддерживающее лечение после проведения индукционного курса предполагает пероральный прием преднизолона 5–10 мг однократно утром после еды плюс азатиоприн 2 мг/кг/сут с возможным снижением дозы до 1,5 мг/кг/сут через год. Длительность поддерживающей терапии азатиоприном в сочетании с ГКС должна составлять не менее 24 месяцев. В качестве альтернативы возможно применение лефлуномида 20–30 мг/сут или микофенолата мофетила 1–2 г/сут (в один или несколько приемов) не менее шести месяцев.
При использовании ритуксимаба для поддержания ремиссии необходимо придерживаться следующих общих подходов:
- введение фиксированных доз с фиксированным интервалом (от 500 мг один раз в шесть месяцев до 1000 мг два раза в четыре месяца);
- введение фиксированных доз (обычно 1000 мг) при появлении биомаркеров риска рецидива (увеличение количества CD19+ В-лимфоцитов, титра АНЦА);
- повторение индукционной терапии (2000 мг) по факту развития рецидива.
Симптоматическая терапия, профилактика и лечение осложнений. Для нивелирования симптомов основного заболевания, а также профилактики и лечения осложнений, развившихся вследствие приема иммуносупрессивных препаратов, пациентам с АНЦА-ассоциированными васкулитами показаны антибактериальная (бисептол длительно) и противогрибковая терапия, гастропротективная (ингибиторы H + /K + -АТФазы) и антиостеопоротическая (препараты кальция и витамина D, бисфосфонаты) терапия, антиагреганты и антикоагулянты (варфарин, низкомолекулярные гепарины), антигипертензивная, сахароснижающая, гиполипидемическая терапия, при необходимости – колониестимулирующие факторы роста, месна, фолиевая кислота.
Антимикробные средства (триметоприм/сульфаметоксазол) применяются при ГПА в случае выявления носительства Staphylococcus aureus, для профилактики пневмоцистной инфекции у больных, длительно получающих циклофосфамид.
Активная патогенетическая терапия не препятствует проведению программного гемодиализа. Более того, при успешном лечении впоследствии может исчезнуть потребность в гемодиализе.
Трансплантация почки пациентам с АНЦА-СВ и хронической болезнью почек в стадии терминальной почечной недостаточности имеет ограничения в связи с повышенным риском инфекций на фоне применения иммунодепрессантов и нередко сопутствующим тяжелым поражением дыхательных путей. Частота рецидивов болезни после трансплантации почки снижается до 17%. Рецидивы чаще возникают после пересадки почки от донора, являющегося родственником. Надежные предикторы развития рецидива в пересаженном органе не установлены.
Реконструктивные операции на ЛОР-органах проводятся в специализированных центрах в период полной ремиссии заболевания.
Чтобы избежать ошибок терапии и необоснованных назначений, надо помнить следующее:
- повышение титра АНЦА может предшествовать обострению, однако изолированное его изменение не требует коррекции терапии;
- опыт применения лефлуномида при АНЦА-ассоциированных васкулитах небольшой, что не позволяет рассматривать его как средство первой линии для цитостатической терапии;
- при стойкой эозинофилии на фоне адекватной индукционной иммуносупрессивной терапии по поводу ЭГПА следует исключить гематологические заболевания как миелоидного, так и лимфоидного ростка;
- ритуксимаб не следует применять в качестве препарата первой линии, если преобладают признаки гранулематозного воспаления ЛОР-органов и органов зрения (например, объемное образование в области орбиты);
- ритуксимаб не следует сочетать со стандартными иммуносупрессивными препаратами, однако такая комбинация возможна в отсутствие ответа или при плохом ответе на лечение только иммуносупрессивными препаратами или только ритуксимабом;
- метотрексат нежелательно назначать при уровне креатинина ≥ 1,5 мг/дл (130 мкмоль/л);
- метотрексат противопоказан при уровне креатинина ≥ 2,0 мг/дл (170 мкмоль/л);
- азатиоприн нельзя сочетать с аллопуринолом, поскольку существует риск агранулоцитоза.
Схожесть клинических проявлений в дебюте отдельных видов АНЦА-СВ обусловливала трудности дифференциальной диагностики. Существующие в настоящее время диагностические критерии позволяют своевременно распознавать эти формы иммуновоспалительных заболеваний. Применение иммуносупрессивной и симптоматической терапии, а также новых схем и программ интенсивной терапии с использованием генно-инженерных биологических препаратов позволяет добиваться ремиссии заболевания и значительно улучшать прогноз у данной категории пациентов.
Читайте также:


