Несостоятельность трансплантата передней крестообразной связки
Похожие темы научных работ по клинической медицине , автор научной работы — Ахпашев А. А., Загородний Н. В., Щеголева Н. Н., Гнелица Н. Н., Королев А. В.
сравнению с исходными данными, тогда как во 2-й группе выявляется тенденция к снижению. Уровень мочевины больных ДП 1й группы в исследуемые сроки было увеличено в 1,8 раза, тогда как во 2-й группе отмечен его рост в 1,8-2,8 раза. При этом на 7 сутки у больных 1 группы уровень мочевины достоверно ниже по сравнению со 2 группой в 1,7 раза. Уровень амилазы при поступлении (исход) был увеличен в 2 раза, а к 7 суткам приближался к норме. У больных 1-й группы Кпол/аос увеличивался при поступлении (исход) в 4,2 раза по сравнению с нормой (табл. 4). В группе сравнения (2-я группа) Кпол/аос повышался в 3,5 раза по отношению к норме. Далее Кпол/аос не претерпел существенных изменений и оставался достоверно выше нормы.
Показатели эндогенной интоксикации больных ДП
Норма Группы Сутки исследований
Исход 5-8 - е 10-14 - е
КПОЛ/АОС усл. Ед. 1,1±0,10 1 4,7±0,79 4,53±0,71 4,69±1,05
2 3,92±0,73 5,35±0,62 3,86±0,77
РССА усл. ед. 0,8±0,05 1 0,72±0,022 0,76±0,031 0,75±0,023
2 0,71±0,027 0,70±0,046 0,728±0,021
СМП (усл. ед.) 0,2±0,01 1 0,488±0,036 0,394±0,039 0,29±0,02*'**
2 0,492±0,033 0,493±0,052 0,453±0,073
Примечание: Обозначения - те же; ** - достоверность различий между исходом и 10-14 сутками (р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
11. В.Е. Каган и др. Проблема анализа эндогенных продуктов перекисного окисления липидов.- М.: Наука.- 136 с.
12. Лужников Е.А. и др. Сочетанное применение кишечного лаважа и энтеросорбции при острых пероральных отравлениях. Метод. рек.. - М., 1990.- 8 с.
13.Лужников Е. и др. Кишечный лаваж как метод детоксикации при экзо- и эндотоксикозах: Инф. п-мо №19.-М,2003.-С. 9.
14. Мустафина Ж.Г. и др. //Клин. лаб. диагностика.- 1999.-№ 5.- С. 47-49.
15. Савельев В.С Синдром кишечной недостаточности в экстренной хирургии органов брюшной полости: Усовершенствованная медицинская технология.- М, 2006.- 28 с.
16. Савельев В. и др. //Анналы хир.- 1999.- № 5.- С. 26-29.
17. Шугаев А.И. // Вест. хир. им. Грек.- 1989.- №3.- С. 126.
18. Шуркалин Б.//Вест. хир. им. Грек.- 1989.- № 9.- С. 7-11.
19. Duggan D.EÍÍÍ Arch. Biochem. Biophys.- 1959.- Vol. 84, № 1.- P.116-122.
20. Ravin H. // J Lab. Clin. Med.- 1961.- Vol. 58, №1.- P. 161.
GUT LAVAGE AS A DETOXICATION METHOD IN A COMPLEX THERAPY FOR DESTRUCTIVE PANCREATITIS
G.A.BERDNIKOV, I.VALEXANDROVA, P.A.IVANOV, A.V.GRISHIN, V.A.MATKEVICH, B.V.DAVYDOV, S.B.MATVEYEV, N.V.FEDOROVA, I.N.FEDOTOVA
The study evaluates the efficacy of the body enteral detoxication method that is the gut lavage with enteral saline solution isotonic to the chyme as in the initial small intestine. The method was used in a complex therapy with destructive pancreatitis. The study has demonstrated that a procedure of the gut lavage included in a complex treatment of the patients with destructive pancreatitis is an effective option of the body detoxication providing the reduction of endotoxin release from the gut into the blood, eliminating the signs of bowel insufficiency, reducing the patients' length of stay in the Intensive Care Unit.
Key word: acute pancreatitis; gut lavage, detoxication
МОРФОЛОГИЧЕСКИЕ АСПЕКТЫ НЕСОСТОЯТЕЛЬНОСТИ АУТОТРАНСПЛАНТАТА ПЕРЕДНЕЙ КРЕСТООБРАЗНОЙ СВЯЗКИ
А.А. АХПАШЕВ, Н.В. ЗАГОРОДНИЙ, Н.НЩЕГОЛЕВА,
Н.Н. ГНЕЛИЦА, А.В. КОРОЛЕВ*
Материалом для внутрисуставной пластики передней крестообразной связки (ПКС) является аутотрансплантат из связки надколенника (ВТВ) [1, 7, 10, 23], как и подколенные сухожилия (ПКС, сухожилия полусухожильной и нежной мышц - hamstring) [11, 25, 22]; удовлетворительные результаты оправдывают их использование в виде 2- или 4-пучковых трансплантатов [12, 9].
Кафедра травматологии и ортопедии РУДН, лаборатория клинической морфологии ГУ НИИ морфологии человека РАМН, городская клиническая больница № 31 г. Москвы
Передняя крестообразная связка и сухожильные трансплантаты отличаются друг от друга морфо-функциональными свойствами. Связки, как и сухожилия, представляют собой соединительную ткань, основу которой составляют вода и протеоглика-ны, фибробласты и элементы фиброзной ткани (коллаген, эластин и др.). Макроскопически связки и сухожилия похожи друг на друга, а гистологически и биохимически различны [2, 13, 20].
Рис. 1.Гистологическая картина сухожилия полусухожильной мышцы Здесь и далее - окраска гематоксилином и эозином, ув. 100)
На биологической модели (кролик) показаны различия между сухожилием и связкой [2]. Также были выявлены различия между двумя сухожилиями (ахиллово сухожилие и связка надколенника) и между двумя связками (коллатеральная связка и передняя крестообразная связка). В структуре связок в основном представлены популяции фиброцитов или фибробластов, др. клетки (мезенхимальные клетки, макрофаги и др.) составляют малый объем от общей клеточной массы. В связках по сравнению с сухожилиями активнее протекают метаболические процессы, клетки имеют более массивное ядро. Связки состоят из воды (от 60 до 80% от массы) и коллагена типа I (от 65 до 80% от сухого веса), основная субстанция состоит из протеогликанов, которые связаны с водой. Связки содержат меньшее количество актина, фибронектина и другой неоформленной субстанции. С морфологической точки зрения, связки и сухожилия похожи друг на друга: фибриллы коллагена параллельны друг другу и располагаются вдоль оси связки или сухожилия, фибробласты также ориентированы вдоль оси связки, имеется синусоидальное расположение фибрилл коллагена. При электронной микроскопии видно, что нормальная передняя крестообразная связка состоит из фиброзных волокон диаметром от 20 до 175 нм [20, 26].
Рис. 2. Гистологическая картина нормальной крестообразной связки [11]
Лигаментизация трансплантатата. В течение последних
Признаки реваскуляризации появляются с 3-й недели по периферии трансплантата. Зоны повышенной клеточной плотности с наличием множества фибробластов и клетками, типичными для неспецифического воспаления, растут в размере и объеме. Неосиновиальная оболочка, окружающая трансплантат, определяется с 3-й недели послеоперационного периода. С 2-г12 мес.
продолжается рост числа фибробластов, максимум которых определяется к 4 месяцу после операции. Активность фибробластов высока и коррелирует со степенью активности реваскуляризации трансплантата. Доля первичного коллагена в составе трансплантата мала, зоны дегенерации сухожильной ткани и бесклеточные зоны видимы. В 12^36 мес. трансплантат созревает, число фибробластов и др. клеточных элементов уменьшается, фибриллы коллагена утолщаются, приобретают характерную для нормальной ПКС форму и толщину, васкуляризация трансплантата уменьшается. После 3 лет - полная лигаментизация сухожильного трансплантата: при гистологическом исследовании мало различий между трансплантатом и нормальной ПКС.
Реваскуляризация трансплантата начинается со 2-й недели после операции, к 6-й неделе по его периферии формируется синовиальная оболочка, несущая микроциркуляторное русло.
Рис.3. Аутотрансплантат ПКС покрыт синовиальной оболочкой, в толще которой - кровеносные сосуды (эндоскопическое фото в ходе операции)
Реваскуляризация трансплантата заканчивается к 8-й неделе, что обеспечивает его питательными веществами, необходимыми для синтеза макромолекул [16]. Иннервация ПКС в основном проприоцептивная, обеспечивается 2 типами механорецепторов: быстрые механорецепторы (Пачини), передающие амплитуду движений, медленные рецепторы (Руффуни), анализирующие скорость и ускорение движений. Процесс реиннервации трансплантата изучен [8], показано наличие механорецепторов в трансплантате через 6 месяцев после реконструкции ПКС из связки надколенника у собак. В то же время биопсии трансплантата ПКС у человека, выполненные через 5-37 мес. после операции, не имели признаков реиннервации трансплантата и иммунологической нейропептидной реактивности, хотя гистологически лигаментизация трансплантата была завершена [6].
Материалы и методы. За период 2002^2006 гг. в клинике травматологии и ортопедии ГКБ 31 оперировано 502 пациента, выполнена артроскопическая пластика ПКС, из них 215 (43%) операций - аутотрансплантатом из ВТВ и 287 (57%) операций -из сухожилий полусухожильной и нежной мышц. Возраст оперированных лиц 15-51 год, при этом мужчин - 68%, женщин - 32%. По поводу разрыва аутотрансплантата повторно оперированы 12 лиц (0,02% от всего числа операций), из них 8 (0,03% от суммы операций с использованием ВТВ) случаев разрыва аутотрансплантата ВТВ и 4 (0,013% от суммы операций с использованием hamstring) случая разрыва аутотрансплантата hamstring. Морфологически исследовали случаи повторной нестабильности коленного сустава после артроскопической пластики ПКС, при этом не было повторной травмы. Аутотрансплантат hamstring имел случаи несостоятельности через 1-4 года, ВТВ - через 1,5-10 лет. При ревизионной пластике ПКС через стандартные артроскопические доступы при помощи баскетных кусачек забирали часть несостоятельного аутотрансплантата, фиксировали в р-ре 10% формалина и окрашивали гематоксилином и эозином; препараты исследовали и фотографировали.
Рис.4. Некроз и гиалиноз аутотрансплантата ПКС из связки надколенника (через 6 лет после операции), ув. 200
Рис.5. Коллагеновые волокна без клеточных элементов (несостоятельность аутотрансплантата ВТВ через 10 лет после операции). Ув. 400.
Рис.б. Аутотрансплантат hamstring через 1 год после операции), ув. 100
Результаты. Все случаи несостоятельности объединяет отсутствие повторной травмы после операции, что говорит о том, что никто не застрахован от повторной нестабильности коленного сустава. Надо предупреждать больных о возможности такого итога операции. Гистологическая картина аутотрансплантатов позволяет судить о его клеточном составе: с течением времени число фибробластов и фиброцитов в трансплантате уменьшается, а выраженность дегенеративно-дистрофических процессов растет (рис.4 -5). При более ранней несостоятельности можно видеть большое число фиброцитов и фибробластов наряду с синовиали-зацией трансплантата и массой кровеносных сосудов (рис.6-8).
Рис. 7. Скопление кровеносных сосудов среди некротизированных коллагеновых волокон (hamstring через 1 год после операции). ув. 200
Рис.8 Пролиферация синовиоцитов (ВТВ через 1,5 года). ув. 200
Рис.10. Участок кальциноза среди некротизированных волокон, ув. 100 (аутотрансплантат ВТВ через 6 лет после операции)
Это и является сутью и гистологическим проявлением несостоятельности трансплантата, т. е. нарушением процесса лига-ментизации, к которому ведут ряд факторов. Например, использование шовных нитей, не имеющих достаточной совместимостью с определенными типами живой ткани (рис.11).
Рис.9. Набухание коллагеновых волокон (ВТВ через 4 года после операции). Ув. 400
Рис.П. Некроз коллагеновых волокон, окружающих шовный материал (hamstring через 4 года после операции), ув. 400
Аутотрансплантат, даже при его функциональной несостоятельности, является живой субстанцией, особенно через 3-5 лет после операции, в более поздние сроки объем некротизиро ванной ткани начинает превышать объем функционирующей. Несостоятельность аутотрансплантата ПКС развивается из-за нарушения процесса лигаментизации сухожильно-связочного аутотрансплантата, на который повлияли неблагоприятные факторы.
^Acquitter Y. et al. // Revue de Chirurgie Orthopédique.-2003.- № 89.- Р. 413^22.
2AmielD. et al. // J Orthop. Res.- 1984.- № 1.- Р. 257-265.
3AmielD. et al. // J. Orthop. Res.- 1986.- № 4.- P.90-95.
4AmielD. et al. // Am.J.Sports Med.- 1986.- Vol. 14.- P.449.
5Amiel D, Kuiper S. / In : Knee Ligaments, Structure, Function, Injury, and Repair.- Raven Press:, New York.- 1990.- P. 379-388.
6Aune A.K. et al. // J Orthop Res.- 1996.- Vol.14.- Р. 193.
I.Bach B.R. et al..//J Bone Joint Surg Am.- 1990.- Vol.12A.-P.1299-1306.
8.Barrack R. et al.// Am J Sports Med.- 1997.- Vol.25.- Р. 196.
9.BeardD.J. et al. // Knee.- 2001.- № 8.- P.45-50.
10.Bellier G. et al. La reconstruction du ligament croisé antérieur par greffe à deux faisceaux utilisant les tendons de la patte d’oie. Maîtrise Orthopédique n° 128. Novembre 2003.
II.Colombet P. et al. Il Knee Surg Sports Traumatol Arthrosc.-2005.- № 9.- Р.1-8.
12. Corry IS et al.// Am J Sports Med.- 1999.- Vol.27.- Р. 444.
13.Daniel D. et al. Knee Ligament, Structure, Function, Injury and Repair ; New-York, Raven Press, 1990
14.Eriksson K et al. // Knee Surg. Sports traumatol. Arthrosc. 1999.- №7.- Р. 220-225,
15.Falconiero R. et al.// Arthroscopy.- 1998.- Vol.14.- Р. 197.
16.Kennedy J. et al.H Am J Sports Med.- 1980.- № 8.- Р. 1-8.
17.Lane J.G. et al. // Arthroscopy.- 1993.- №9.- Р. 149-153.
19McFarlandE. // Orthopedics.- 1993, Vol. 16 (4) .- Р. 403.
20.Oakes B.W. / In : The anterior cruciate ligament; current and future concepts.- 1993.- NY: Raven pressChapter 18.- Р. 209-217.
21Rougraff B. et al. // Am J Sports Med.- 1993.- Vol. 21.-Р. 277-284.
22. Sgaglione NA. et al.// Am. J. Sports Med.- 1990.- Vol.18.-P.64-73.
23.Shelbourne K.D. et al.De Carlo M.S.// Am J Sports Med.-1995.- Vol. 23.- Р. 575-579.
25. Siegel M.G., Barber-Westln S.D.// Arthroscopy.- 1998.-Vol. 14.- Р.268-77.
26. Yahia L., Drouin G.// J Mater Sci.-1988.-Vol.23.- Р. 3750.
Целью данной серин исследования являлся анализ разрывов аутотрансплантата ПКС в отдаленные сроки после артроскопической пластики передней крестообразной связки и методы лечения нестабильности оперированного коленного сустава. Из общего количества пациентов, которым была произведена артроскопическая реконструкция ПКС с применением аутотрансплантата из связки надколенника с фиксацией титановыми иитерферентными винтами, с жалобами на нестабильность оперированного колена обратилось 7 пациентов (таблица 13).
Таблица 13. Количество разрывов аутотрансплантата ПКС т связки
Из них 2 пациента отмстили нестабильность коленного сустава, возникшую после адекватной спортивной травмы через 5 месяцев после операции. Сами пациенты отмечали начало спортивной максимальной нагрузки через 4 месяца после операции, тем самым пренебрегали врачебными рекомендациями. У 3 пациентов появились боль и чувство неустойчивости в коленном суставе в результате адекватной спортивной травмы через 8, 10 и 11 месяцев соответственно после операции, и в 2 случаях травма оперированного коленного сустава произошла вследствие контактного столкновения при игре в футбол через 18 и 22 месяца после реконструкции ПКС. Всем пациентам с возникшей нестабильностью в
отдаленные сроки после операции артроскопическая реконструкция ПКС аутотрансплантатом из связки надколенника и послеоперационные реабилитационные мероприятия выполнялись по стандартной методике, интра- и послеоперационных осложнении не было зарегистрировано. До повторной травмы субъективно все пациенты не отмечали болезненности и нестабильности в коленном суставе и были удовлетворены оперированным коленом в плане функциональных нагрузок. При оценке активности пациентов по шкале Tegner выявлено, что до травмы оперированного коленного сустава активность пациентов составила в среднем 6 баллов (от 5 до 7 баллов). Среднее значение уровня активності! по Tegner после травмы составило 3 балла (от 1 до 4).
По шкале Lysholm до повторной травмы колена пациенты набрали в среднем 83 балла (от 75 до 95 баллов), а после повторной травмы средний балловый эквивалент у пациентов с нестабильностью коленного сустава составил 31 бал (от 10 до 45 баллов).
Средний уровень спортивной активности оперированных пациентов по шкале SARS до травмы составил 79 баллов (от 65 до 100 баллов) (1 и 2 уровень). После полученной травмы в послеоперационном периоде пациенты отмечают снижение спортивной активности в среднем до 40 баллов ( от 0 до 55 баллов).
Согласно критериям IKDC на момент повторной травмы вес 7 пациентов были полностью удовлетворены свом коленным суставом и отмечали высокую физическую активность (степень А). После травмы оперированного колена 4 пациента были неудовлетворенны функцией колена (степень D), и 3 нациста оценили свою физическую активность как низкую (степень С).
избыточного переднего смещения голени (> бмм) и мягкая нефиксированная конечная точка на стороне оперированного коленного сустава. Это было расценено как разрыв аутотрансплантата ПКС из связки надколенника. Всем семи пациентам в обязательном порядке были выполнены рентгенограммы в прямой и боковой проекции и МРТ-исследованис оперированного коленного сустава.
На контрольных рентгенограммах ни у одного пациента нс было выявлено остсолитичсских изменений по ходу большеберцового и бедренного костных каналов. Ни в одном случае мы нс наблюдали миграции титановых интерферентных винтов в каналах бедренной и большеберцовой кости, а также патологического смешения проксимального или дистального костных блоков. У всех 7 пациентов диагностированный клинически разрыв аутотрансплантата ПКС был подтвержден МРТ. На МРТ у 5 пациентов обнаружен полный отрыв аутотрансплантата передней крестообразной связки от бедра без миграции бедренного титанового фиксатора и в 2 случаях выявлен полный субсиновиальный разрыв трансплантата ПКС.
Всем пациентам с разрывом аутотрансплантата передней крестообразной связки из связки надколенника рекомендовали ревизионную артроскопичсскую пластику передней крестообразной связки.
Все ревизионные операции проводились в плановом порядке под спинальной анестезией с использованием пневматического турникета.
Для абсолютной уверенности в несостоятельности аутотрансплантата передней крестообразной связки сначала проводили артроскопичсскую оценку состояния оперированного коленного сустава. При ревизии сустава анализировали состояние синовиальной оболочки, менисков, хрящевых поверхностей. При ревизии менисков в 2 случаях обнаружили разрыв заднего рога медиального мениска (лоскутный и продольный) и у 1 пациента радиальный разрыв тела латерального мениска. При артроскопнчсском осмотре хрящевых поверхностей коленных суставов у пациентов с послеоперационной нестабильностью хондромаляции надколенника нс было
выявлено ни в одном случае. Проведенная визуальная и пальпаторная оценка аутотрансплантата ПКС показала наличие у 4 пациентов полного отрыва сухожильной части аутотрансплантата от бедра, и в 3 случаях диагностирован полный субсииовиальный разрыв трансплантата передней крестообразной связки. Все разорванные трансплантаты были расположены изомстрично, кровоснабжаемы и покрыты синовиальной оболочкой.
При оценке мест бедренной фиксации не выявлено ни одного случая миграции проксимального титанового интерфереитного винта. С помощью артромастера или шейвера полностью удаляли волокна разорванного трансплантата, фрагменты волокон обязательно отправляли на гистологическое исследование. В двух случаях производили двустороннюю артроскопию коленных суставов. В коитрлатеральном коленном суставе брали небольшой фрагмент нормальной передней крестообразной связки для морфологического сравнения разорванного аутотрансплантата оперированного коленного сустава и нормальной ПКС здорового колена.
Биоптат нормальной передней крестообразной связки здорового коленного сустава (образец Ksl) и биоптат поврежденного аутотрансплантата ПКС (образец Ks2) окрашивали гематоксилином и эозином, пикрофукенном по Ван-Гизону и проводили сравнительную оценку морфологических показателей.
Гистологическая картина нормальной передней крестообразной связки представлена сухожильной тканыо, в которой видны многочисленные коллагеновые волокна, которые окрашены гематоксилином и эозином в розовый, а пикрофукенном по Ван-Гизону в красный цвет.
Табдииа 14, Бальная оценка морфологических показателей в биопта max нормальной
передней крестообразной связки (образен № 11 и разорванного аутотрансплантата
3.1 Лимфо.чакрофагальиая инфильтрация
Гистологическое изучение аутотрансплантата ПКС из связки надколенника свидетельствует о том, что большая часть трансплантата мало изменена по сравнению с интактной передней крестообразной связкой
здорового сустава. В клетках отсутствуют дистрофические изменения, коллагеновые волокна компактно расположены и нс имеют признаков деструкции. Только непосредственно в зоне разрыва трансплантата в отдельных участках отмечаются очаги разволокнения и истончения коллагеновых волокон, небольшие участки гиалиноза и метаплазии ткани в волокнистый хрящ, а также признаки хронического синовита в синовиальной оболочке. Следовательно, данные морфологические изменения не могут являться причиной несостоятельности аутотрансплантата из связки надколенника, что доказывает травматический фактор разрыва трансплантата ПКС. Необходимо отметить, что в отдельных сухожильных пучках отмечается пролиферация фибробластов с образованием коллагеновых волокон, что следует расценить как репаративно-компенсаторную реакцию трансплантированной ткани.
После резекции волокон разорванного аутотрансплантата для удаления проксимального титанового винта из бедренной кости через переднемедиальный артроскопический порт в полость коленного сустава вводили тонкую направляющую нитиноловую спицу. Кончик спицы вставляли в отверстие канюлированного титанового винта. По направляющей спице проводится отвертка со специальной канюлей. Канюля предназначена для того, чтобы не уронить винт в полость сустава. Затем при сгибании ноги на 120-130° для совмещения осей спицы и проксимального титанового интерфереитного винта производится удаление бедренного фиксатора. Обязательно проводили осмотр места бедренной фиксации аутотрансплантата. Во всех случаях мы выявили полную интеграцию проксимального костного блока в бедренном канале и отсутствие остсолитичсских реакций в месте бедренной фиксации.
Удаление дистального титанового винта производится через вертикальный разрез кожи длиной 2 см в месте расположения большеберцовой фиксации, которое можно определить пальпаторно. С
помощью распатора находим место тибиапьной фиксации аутотрансплантата и удаляем дистальный титановый интерферентный винт.
Выбор трансплантата для ревизионной реконструкции ПКС, а также метод фиксации трансплантата обсуждали с пациентом заранее. В настоящее время в качестве трансплантата для ревизионной артроскопической пластики ПКС используются ауто-, аллотрансплантаты, а также синтетические протезы передней крестообразной связки.
Наиболее часто в качестве трансплантатов для реконструкции ПКС использовали четырехслойный аутотрансплантат из удвоенных сухожилий полусухожильной и нежной мышц.
Забор сухожилий сгибателей бедра проводится из того же доступа, через который удалялся дистальный титановый винт. При недостаточности растяжения тканей для нахождения фиксации сухожилий к большеберцовой кости можно продлить разрез кожи в дистальном направлении. Сухожилия полусухожильной и нежной мышц отсекаем от большеберцовой кости скальпелем и с помощью стриппера производим отсечение сухожилий от брюшка каждой из мышц. Длина выделенных сухожилий составляет от 22 до 29 см.
После выделения и измерения сухожилий отделяем фрагменты мышечной ткани от трансплантата и прошиваем концы сухожилий рассасывающимися нитями, что позволяет улучшить фиксацию трансплантата.
трансплантатом артроскопически и макроскопически в операционной ране, проводим тест на наличие латерального соскальзывания и тест Лахмана.
В 2 случаях несостоятельности аутотрансплантата из связки надколенника в качестве трансплантата для ревизионного восстановления ПКС использовали аллотрансплантат Tutoplast ВТВ (Германия) (рис. 47).
Перед имплантацией в коленный сустав производили вымачивание аллотрансплантата в стерильном физиологическом растворе в течение 30 минут и обработку костных блоков по шаблону до диаметра 10 мм. Создание костных каналов в бедре и большеберцовой кости, а такж*е проведение аллотрансплантата проводили по стандартной методике (рис. 48).
Для бедренной и тибпалыюй фиксации применяли биорассасывающие винты. Дозированную нагрузку на оперированную конечность разрешали через 2 недели после операции, а полна нагрузка на ногу была рекомендована через 4 недели после операции.
Из всех имплантатов, применяемых для ревизионной реконструкции передней крестообразной связки, мы отдаем предпочтение трансплантатам из аутотканей.
К потенциальным преимуществам аутотрансплантата из сухожилий сгибателей бедра относятся высокая прочность, хорошая растяжимость, возможность смены мест бедренной и тибиалыюй фиксации для предотвращения вторичной нестабильности оперированного колена, а также немало важен косметический результат при взятии трансплантата.
При использовании аутотрансплантата из связки надколенника контрлатерального коленного сустава создаем дополнительную травму здорового колена н психологически пациенты не настроены на данный вид ревизионного восстановления передней крестообразной связки.
Применение в качестве ревизионного имплантата ПКС синтетических протезов связки имеет такие преимущества, как высокая прочность протеза, отсутствие необходимости забора трансплантата, уменьшение сроков послеоперационной реабилитации. Отрицательными сторонами таких операций являются риск возникновения тугоподвижности коленного сустава и синовиальная реакция на синтетические материалы с возникновением рецидивирующих синовитов оперированного колена, а также дороговизна
Много надежд мы возлагали на аллоткани для восстановления ПКС коленного сустава, особенно при ревизионных операциях с учетом того, что при использовании аллотрансплантата не требуется забор трансплантата, что сокращает время операции и даст возможность обойтись без дополнительной травмы мышечно-связочного комплекса, стабилизирующего коленный сустав. Но через 7 месяцев после ревизионной пластики передней крестообразной связки с использованием аллотрансплантата Tutoplast ВТВ у одного пациента диагностирован клинически и при МРТ-исследовании разрыв аллотрансплантата ПКС. Нестабильность оперированного коленного сустава у пациента возникла без адекватной травмы. Во время ревизионной
Саратовский государственный медицинский университет им. В.И. Разумовского
Саратовский научно-исследовательский институт травматологии и ортопедии
Введение. Повреждение передней крестообразной связки (ПКС) коленного сустава является одной из самых распространенных связочных травм. По данным зарубежной литературы в США, ежегодно, насчитывается около 200000 травм ПКС [1], в основном , у спортсменов, занимающихся таким спортом как футбол, регби, лыжи. Вероятность повреждения ПКС у них в 10 раз выше, чем у спортсменов других видов спорта. Причем у женщин, которые занимаются футболом, баскетболом, регби происходило повреждение ПКС в 4 раза чаще , чем у мужчин занимающихся этими же видами спорта [2]. В механизме травмы ПКС присутствуют нервно-мышечные и биомеханически е нарушения, трансформация коллагеновых волокон, гормональны е фактор ы, анатомические и структурные факторы [3].
В связи с высокой частотой повреждений ПКС, в США каждый год выполняется около 100000 реконструкций ПКС [4].
Пластика ПКС производится двумя группами трансплантатов: аутоткани (фрагмент сухожилия четырёхглавой мышцы, связки надколенника, сухожилие полусухожильной мышцы и т.д.) и синтетические имплантаты ( LARS-связки, ДОНА-М, лавсан и т.д.). Методика реконструкции для обоих видов трансплантатов идентичная за исключением методик забора материала. Однако получить идеального расположения тоннелей для проведения трансплантата, а также фиксацию его интерферентными винтами удаётся не всегда. Поэтому результаты операции варьируют даже у одного и того же хирурга.
Цель исследования: провести анализ ошибок и осложнений при пластике ПКС.
Всем больным оперативные вмешательства выполнялись двумя хирургами по одной и той же методике.
Методы исследования включали объективную (рентгенологическую) оценку результатов пластики, рентгенологические снимки в двух стандартных проекциях производили сразу после операции и в сроки от 8 месяцев до 1,5 лет после операции.
Исследовались следующие показатели:
- Расположение тоннелей в бедренной и большеберцовой костях в прямой и боковой проекциях.
- Угол проведения тоннелей по отношению к оси конечности.
- Глубина введения интерферентных винтов.
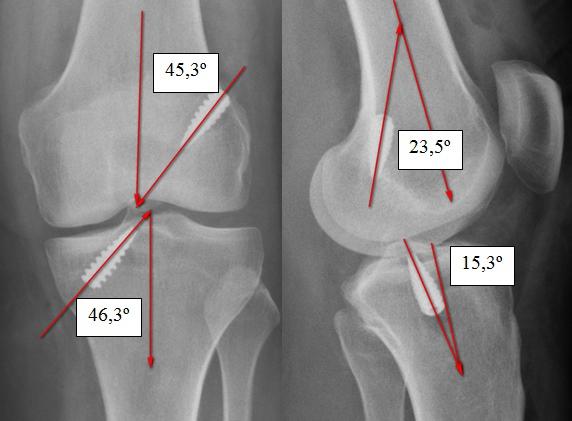
Рис . 1. Углы тоннелей и введение винтов соответствует рекомендации производителя .
Результаты и обсуждени е. Оценка результатов пластики осуществлялась с использованием рентгенографии в стандартных проекциях (прямой и боковой).
Таблица 1. Отклонение расположения тоннелей от нормы
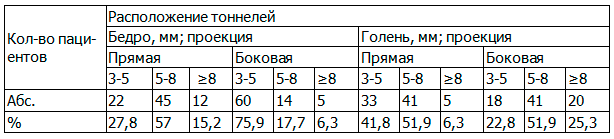
Из табл. 1 следует, что при проведении тоннелей в бедре на снимках в прямой проекции смещение тоннелей от нормы на 5-8мм было у 57% пациентов, а в боковой проекции - у основной массы пациентов (75,9%) отклонение от нормы составляло 3-5 мм. На рентгенологических снимках голени в прямой и боковой проекции тоннели были смещены на 5-8 мм. На рис. 2 представлена рентгенограмма пациента с отклонением расположения тоннелей на 8 и более мм.
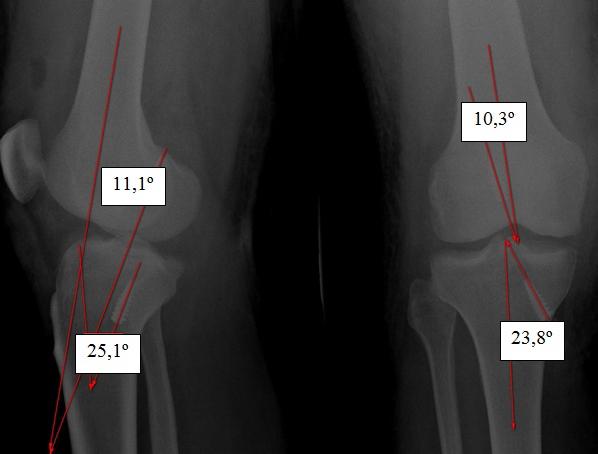
Рис. 2. Тоннели расположены с отклонением от нормы более 8 мм .
Таблица 2. Углы проведения тоннелей
В табл . 2 указано что угол проведения тоннеля в бедре на прямой проекции был смещен на 10-20° у 55,7% пациентов, а в боковой до 10° у 79,7%. Угол проведения тоннеля в голени, так же как и бедре на прямой проекции был смещен на 10-20°, а в боковой до 10°. На рис . 3 представлена рентгенограмма пациента, у которого углы проведенных тоннелей смещены на 20-30°.
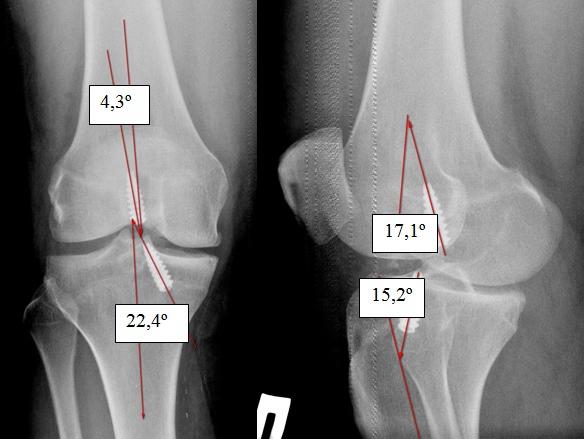
Рис. 3. Смещение углов тоннелей от нормы на 20-30° .
Таблица 3. Положение винта в тоннеле
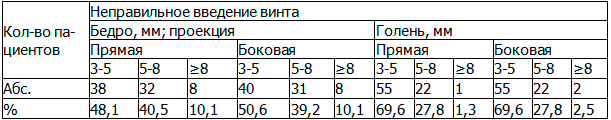
Из табл. 3 следует, что недостаточное введение винта в бедре составляло 3-5 мм на прямой и боковой у 48,1% и 50,6% соответственно. В голени так же составляло 3-5мм в обеих проекциях у 69,6% пациентов.
Как следует из полученных результатов, большинство оперативных вмешательств имело отклонение от стандартной методики в пределах допустимых значений. На рис. 4 предоставлены рентгенограммы пациента с недостаточным введением винтов на >8 мм.c
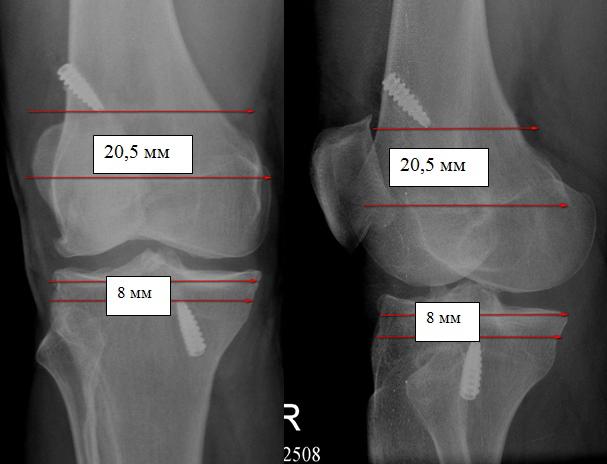
8 мм." width="607" height="464" />
Рис. 4. Недостаточное введение винтов на >8 мм.
Оценку результатов лечения 78 больных проводили через 12 месяцев . Большинство пациентов 85% вернулись к прежнему уровню спортивной активности и трудовой деятельности. При этом внутрисуставной выпот наблюдали у 3 (3,8%) пациентов, причем во всех случаях количество аспирируемой прозрачной синовиальной жидкости не превышало 10-20 мл. Ограничение амплитуды движений более 30° отмечали 9 пациентов (11,5%). Физикальная и инструментальная оценка капсульно-связочного аппарата оперированного коленного сустава показала, что разница в переднем смещении голени не превышала 1-2 мм у большинства пациентов 69 (8 8,4%), переднее смещени е величиной 3-5 мм диагностировали у 3 ( 3,8%) пациентов, смещение на 5 и более мм отмечалось у 1 пациента (1,2%).
При исследовании симптома pivot-shift через 12 месяцев после операции отсутствие ротационного смещения голени на стороне оперированного сустава выявляли у 69 ( 88,5%) пациентов. Плавное соскальзывание наружного мыщелка большеберцовой кости обнаружили у 7 ( 8,9%) пациентов, заметный перескок в 1 ( 1,3%). Грубое перемещение наружного мыщелка голени кзади диагностировали у 1 (1,3%) пациента.
В целом 71 (91%) пациентов смогли вернуться к прежнему уровню физической активности.
Выводы
- При проведении артроскопической пластики ПКС одним из ключевых моментов является правильное формирование тоннелей, соблюдение углов при проведении тоннелей, и максимально близкое расположение интерферентных винтов к суставной поверхности.
- У одного и того же хирурга при выполнении пластики ПКС без применения интраоперационно рентгеноконтроля, возможны отклонения от стандартной методики выполнения до 23,8% случаев.
Читайте также:


