Остеопороз при синдроме иценко кушинга
Болезнь Иценко-Кушинга (БИК) — это тяжелое многосимптомное заболевание гипоталамо-гипофизарного генеза, протекающее с проявлениями клинической картины гиперкортицизма, обусловленное наличием опухоли гипофиза или его гиперплазии и характеризующееся повыше
Болезнь Иценко-Кушинга (БИК) — это тяжелое многосимптомное заболевание гипоталамо-гипофизарного генеза, протекающее с проявлениями клинической картины гиперкортицизма, обусловленное наличием опухоли гипофиза или его гиперплазии и характеризующееся повышенной секрецией адренокортикотропного гормона (АКТГ), увеличением продукции гормонов корой надпочечников.
Причина болезни Иценко-Кушинга точно не установлена. БИК чаще встречается у женщин, редко диагностируется в детском и пожилом возрасте. У женщин заболевание развивается в возрасте от 20 до 40 лет, есть зависимость от беременности и родов, а также от травм головного мозга и нейроинфекций. У подростков БИК часто начинается в период полового созревания.
Установлено, что большинство таких опухолей по своей природе являются моноклональными, что свидетельствует о наличии генных мутаций в исходных клетках.
В онкогенезе АКТГ-продуцирующих опухолей гипофиза важная роль принадлежит аномальной чувствительности гипофиза к гипоталамическим факторам. Усиление стимулирующего действия нейрогормонов или ослабление ингибирующих сигналов имеет значение в процессах образования и роста опухоли гипофиза. Нарушение действия ингибирующих нейрогормонов, таких, как соматостатин и допамин, может сопровождаться усилением деятельности стимулирующих нейрогормонов. Кроме того, имеются данные, свидетельствующие о том, что неконтролируемая клеточная пролиферация опухолей гипофиза может стать результатом нарушения действия ростовых факторов.
Потенциальным механизмом развития кортикотропином может стать спонтанная мутация генов рецепторов КРГ или вазопрессина.
Автономная секреция АКТГ опухолью приводит к гиперфункции коры надпочечников. Поэтому основная роль в патогенезе БИК отводится повышению функции коры надпочечников. При АКТГ-зависимой форме болезни Иценко-Кушинга имеет место повышение функциональной активности всех трех зон коры надпочечников: изменения в клетках пучковой зоны ведут к гиперсекреции кортизола, клубочковой — к повышению альдостерона и сетчатой — к усилению синтеза дегидроэпиандростерона (ДГЭС).
Для болезни Иценко-Кушинга характерно не только повышение функционального состояния коры надпочечников, но и увеличение их размеров. В 20% случаев на фоне гиперплазии надпочечников обнаруживаются вторичные аденомы небольших размеров (1–3 см).
При кортикотропиномах кроме гиперсекреции АКТГ наблюдается нарушение функции гипофизарных гормонов. Так, базальная секреция пролактина у больных с БИК нормальная или незначительно повышена. Соматотропная функция гипофиза у больных с кортикотропиномами снижена. Стимулирующие тесты с инсулиновой гипогликемией, аргинином и L-Допа показали снижение резервов СТГ при болезни Иценко-Кушинга. Уровень гонадотропных гормонов (ЛГ, ФСГ) у больных снижен. Это обусловлено прямым супрессивным действием избытка эндогенных кортикостероидов на секрецию рилизинг-гормонов гипоталамусом.
Содержание калия в эритроцитах и мышечной ткани (в том числе и в миокарде) значительно снижено. Нарушения электролитного обмена (гипокалиемия и гипернатриемия) лежат в основе электролитно-стероидной кардиопатии и миопатии. При БИК нарушения углеводного обмена различной степени выраженности наблюдаются у большого числа больных. При этом у 70–80% пациентов выявляется нарушенная толерантность к глюкозе, а у остальных — сахарный диабет 2 типа. Клинические проявления диабета характеризуются гиперинсулинемией, инсулинорезистентностью и отсутствием склонности к кетоацидозу. Диабет имеет, как правило, благоприятное течение, и для его компенсации достаточно назначения диеты и пероральных сахароснижающих препаратов.
Вторичный иммунодефицит проявляется гнойничковыми (акне) или грибковыми поражениями кожи и ногтевых пластин, трофическими язвами голеней, длительным периодом заживления послеоперационных ран, хроническим и трудно поддающимся лечению пиелонефритом. Энцефалопатия в виде изменения вегетативной нервной системы при БИК ярко выражена и многообразна. Синдром вегетативной дистонии характеризуется эмоционально-личностными сдвигами: от нарушения настроения, сна и до выраженных психозов.
Системный остеопороз представляет собой распространенное и нередко тяжело протекающее проявление гиперкортицизма при БИК в любом возрасте. Остеопороз является причиной болей в позвоночнике, часто приводит к снижению высоты тел позвонков и спонтанным переломам ребер и позвонков.
В зависимости от выраженности гиперкортицизма и формирования клинических симптомов различают несколько степеней тяжести БИК. Легкая форма характеризуется умеренной выраженностью симптомов заболевания; средняя — выраженностью всех симптомов при отсутствии осложнений. Тяжелая форма отличается выраженностью симптомов и наличием осложнений (сердечно-легочная недостаточность, стероидный диабет, прогрессирующая миопатия, патологические переломы, тяжелые психические расстройства). В зависимости от скорости нарастания клинической симптоматики различают быстропрогрессирующее (три–шесть месяцев) и торпидное течение заболевания, которое проявляется сравнительно медленным (от одного года и более) развитием гиперкортицизма.
При подозрении на БИК необходимо проверить, имеется ли у больного гиперкортицизм, затем провести дифференциальную диагностику форм гиперкортицизма (БИК, АКТГ-эктопированный синдром, синдром Иценко-Кушинга), сходных синдромов (ожирение, метаболический синдром, пубертатно-юношеский диспитуитаризм, алкогольное поражение печени) и установить локализацию основного патологического процесса.
При подозрении на болезнь Иценко-Кушинга после сбора анамнеза и клинического осмотра у всех больных с помощью методов лабораторной диагностики необходимо подтвердить наличие гиперкортицизма. На первом этапе выявляется повышенная продукция кортизола. С этой целью определяют суточный ритм секреции кортизола в плазме крови утром (8.00-9.00) и вечером (23.00-24.00). Для больных БИК характерно повышение утреннего уровня кортизола в плазме крови, а также нарушение ритма секреции кортизола, т. е. в ночное или вечернее время уровень кортизола остается повышенным. Определение суточной экскреции свободного кортизола в моче является также необходимым методом лабораторной диагностики для подтверждения гиперкортицизма. Уровень свободного кортизола в моче определяется РИА-методом. Для здоровых лиц содержание кортизола колеблется от 120 до 400 нмоль/с. У больных с БИК экскреция кортизола в суточной моче повышена.
В сомнительных случаях для дифференциальной диагностики между патологическим эндогенным и функциональным гиперкортицизмом проводится малая проба с дексаметазоном. Она основана на подавлении продукции эндогенного АКТГ высокими концентрациями кортикостероидов по принципу обратной связи. Если секреция кортизола не снижается на 50% и более от исходного уровня, это свидетельствует о наличии гиперкортицизма.
Таким образом проводится дифференциальная диагностика патологического и функционального гиперкортицизма.
При выявлении повышенной продукции кортизола необходимо провести следующий этап обследования — дифференциальную диагностику между формами эндогенного патологического гиперкортицизма (БИК, СИК, АКТГ-эктопированный синдром), болезнью Иценко-Кушинга, АКТГ-эктопированным синдромом и синдромом Иценко-Кушинга. Этот этап обследования включает в себя определение ритма секреции АКТГ в плазме крови и проведение большой пробы с дексаметазоном.
Для БИК характерны нормальное или повышенное (до 100 –200 пг/мл) утреннее содержание АКТГ и отсутствие его снижения в ночное время. При АКТГ-эктопированном синдроме секреция АКТГ повышена и может колебаться от 100 до 200 пг/мл и выше, и при этом также отсутствует ритм его секреции. При АКТГ-независимых формах гиперкортицизма (синдром Иценко-Кушинга, макро- или микроузелковая дисплазия надпочечников) утреннее содержание АКТГ, как правило, снижено при отсутствии ритма его секреции.
Большая проба с дексаметазоном в настоящее время широко применяется для диагностики патологического гиперкортицизма.
При БИК, как правило, происходит снижение уровня кортизола на 50% и более от исходного уровня, тогда как при АКТГ-эктопированном синдроме это наблюдается лишь в редких случаях. При АКТГ-независимых формах синдрома Иценко-Кушинга указанного снижения уровня кортизола также не отмечается, так как продукция гормонов опухолью не зависит от гипоталамо-гипофизарных взаимоотношений.
В зарубежной литературе для диагностики БИК широко используется проба с кортиколиберином (КРГ). Введение КРГ приводит к стимуляции секреции АКТГ у больных БИК. При БИК содержание АКТГ в плазме крови увеличивается более чем на 50%, а уровень кортизола на 20% от исходного. При АКТГ-эктопированном синдроме концентрация АКТГ практически не меняется.
Методы топической диагностики при БИК используются для выявления патологического процесса в гипоталамо-гипофизарной области и надпочечниках (диагностика микро- или макроаденомы гипофиза и гиперплазии надпочечников). К таким методам следует отнести рентгенографию костей черепа, КТ или МРТ головного мозга, УЗИ надпочечников и КТ или МРТ надпочечников.
Лечение БИК должно быть направлено на исчезновение основных клинических симптомов гиперкортицизма, стойкую нормализацию уровня АКТГ и кортизола в плазме крови с восстановлением их суточного ритма и нормализацию кортизола в суточной моче.
Все методы лечения болезни Иценко-Кушинга, которые используются в настоящее время, можно разделить на четыре группы: нейрохирургическое (транссфеноидальная аденомэктомия), лучевое (протонотерапия, γ-терапия), комбинированное (лучевая терапия в сочетании с односторонней или двусторонней адреналэктомией) и медикаментозное лечение. Из них основные виды — нейрохирургическое, лучевое и комбинированное; медикаментозная терапия применяется как дополнение к ним.
В настоящее время во всем мире предпочтение отдается транссфеноидальной аденомэктомии. Этот метод позволяет добиться быстрой ремиссии заболевания с восстановлением гипоталамо-гипофизарных взаимоотношений у 84–95% больных уже через шесть месяцев. Показанием к аденомэктомии служит четко локализованная (на основании данных КТ или МРТ) опухоль гипофиза. Аденомэктомия может быть проведена повторно, если имеется подтвержденный на КТ или МРТ продолженный рост аденомы гипофиза, в любые сроки после операции. Этот метод характеризуется минимальным количеством осложнений (около 2–3%) и очень низкой послеоперационной летальностью (0–1%).
Адреналэктомия — тотальная одно- или двусторонняя — применяется только в комбинации с лучевой терапией. При крайне тяжелой и прогрессирующей форме заболевания осуществляется двусторонняя адреналэктомия в сочетании с лучевой терапией для профилактики развития синдрома Нельсона (прогрессирование роста аденомы гипофиза при отсутствии надпочечников). После тотальной двусторонней адреналэктомии пациент пожизненно получает заместительную гормональную терапию.
Из методов лучевой терапии в настоящее время используются протонное облучение и дистанционная γ-терапия, при этом предпочтение отдается протонотерапии. Протонное облучение наиболее эффективно в связи с тем, что энергия выделяется в области аденомы гипофиза и при этом окружающие ткани затрагиваются минимально. Абсолютным противопоказанием к проведению протонотерапии является опухоль гипофиза более 15 мм в диаметре и супраселлярное ее распространение с дефектом полей зрения.
γ-терапия как самостоятельный метод лечения применяется в последнее время редко и только при невозможности проведения аденомэктомии или протонотерапии. Эффективность действия этого метода следует оценивать не раньше, чем через 12–15 и более месяцев после проведения курса облучения.
Медикаментозная терапия при БИК должна использоваться в следующих случаях: подготовка пациента к проведению лечения основным методом, облегчение течения послеоперационного периода и сокращение срока наступления ремиссии заболевания. Фармакологические препараты, применяемые с этой целью, делятся на несколько групп: производные аминоглютетимида (мамомит 250 мг, ориметен 250 мг, средняя суточная доза — 750 мг/сут, максимальная суточная доза — 1000–1500 мг/сут), производные кетоконазола (низорал 200 мг/сут, суточная доза — 400–600 мг/сут, максимальная суточная доза — 1000 мг/сут) и производные пара-хлорфенила (хлодитан, лизодрен, митотан, начальная доза — 0,5 г/сут, лечебная доза — 3–5 г/сут). Принципы медикаментозной терапии следующие: после определения степени переносимости лекарственного средства лечение надо начинать с максимальных доз. На фоне приема препарата необходимо осуществлять контроль за содержанием кортизола в плазме крови и суточной моче не реже чем один раз в 10–14 дней. В зависимости от уровня снижения кортизола в каждом конкретном случае подбирается поддерживающая доза препарата. Передозировка препаратами, блокирующими биосинтез стероидов в надпочечниках, может приводить к развитию надпочечниковой недостаточности.
Из препаратов, ингибирующих действие АКТГ, преимущественно используются бромокриптин-парлодел (в дозе 2,5 –5 мг) или отечественный препарат абергин, (в дозе 4–8 мг).
Коррекцию электролитного обмена необходимо проводить как до начала лечения основного заболевания, так и в ранний послеоперационный период. Наиболее целесообразно применение препаратов калия (раствор хлористого калия или таблеток ацетата калия 5,0 г и более в день) в сочетании с спиронолактонами, в частности верошпироном. Рекомендуемая доза верошпирона до 200 мг/сут перорально.
Подходы к лечению артериальной гипертонии при гиперкортицизме такие же, как и при артериальной гипертонии без повышения функции надпочечников. Надо отметить, что у большинства пациентов с БИК не удается достичь оптимального АД без снижения уровня кортизола.
Патогенетический подход к терапии сахарного диабета при гиперкортицизме предполагает эффективное воздействие на основные звенья: инсулинорезистентность периферических тканей и неспособность инсулярного аппарата преодолеть эту резистентность. Обычно предпочтение отдается сульфаниламидным препаратам второго поколения, так как они обладают большей активностью и меньшей гепато- и нефротоксичностью.
Начинать лечение сульфонилмочевинными препаратами следует с минимальной дозы. При необходимости дозу увеличивают, ориентируясь на результаты измерений уровня глюкозы в крови. Если лечение не дает желаемых результатов, следует сменить препарат. Во время лечения любыми сахароснижающими средствами больной должен соблюдать диету. Если лечение максимальными дозами производными сульфонилмочевины (ПСМ) оказывается безрезультатным, можно использовать их комбинацию с бигуанидами. Теоретическое обоснование необходимости комбинированной терапии основывается на том, что препараты этих групп имеют различные точки приложения своего основного действия. Метформин — 400 мг (cиофор — 500 и 850 мг, глюкофаж — 500, 850 и 1000 мг) — единственный на сегодняшний день препарат бигуанидов, который снижает инсулинорезистентность. Инсулинотерапия показана при БИК в тех случаях, когда не удается нормализовать уровень глюкозы в крови с помощью пероральных сахароснижающих препаратов или планируется хирургическое вмешательство. Применяется инсулин короткого действия, препараты средней длительности и длительного действия и их комбинация. Операция должна планироваться на первую половину дня: перед операцией вводят инсулин короткого действия или средней продолжительности действия п/к. Во время операции проводят инфузию 5% глюкозы в/в с добавлением инсулина короткого действия из расчета 5 — 10 ЕД/л, скорость инфузии — 150 мл/ч. Инфузию 5% глюкозы с инсулином короткого действия продолжают и после операции, пока больной не начнет самостоятельно принимать пищу. Затем пациент переводится на пероральные сахароснижающие препараты и осуществляется контроль сахара крови.
Лечение стероидного остеопороза (СОП) даже после ликвидации гиперкортицизма длительное. Препараты для лечения СОП условно можно разделить на три группы: средства, влияющие на процессы костной резорбции, препараты, стимулирующие костное формирование, и препараты многопланового действия. К препаратам, снижающим резорбцию костной ткани, относится кальцитонин (миокальцик). Этот препарат используется в двух лекарственных формах: в ампулах и в виде назального спрея. Курсы длительностью два месяца следует проводить три раза в год. Бисфосфонаты (фосамакс, ксидифон) относятся к препаратам, которые снижают резорбцию костной ткани. При терапии бисфосфонатами рекомендуется дополнительный прием солей кальция (500–1000 мг в сутки). Одним из наиболее эффективных препаратов, стимулирующих костеобразование и увеличивающих массу кости, являются соли фтора. Лечение продолжают от шести месяцев до одного года.
Считается, что анаболические стероиды уменьшают костную резорбцию и индуцируют положительный кальциевый баланс благодаря увеличению абсорбции кальция из кишечника и реабсорбции кальция почками. Кроме того, по некоторым данным, они стимулируют активность остеобластов и увеличение мышечной массы. Они назначаются в основном парентерально, прерывистыми курсами по 25–50 мг один-два раза в месяц в течение двух месяцев три раза в год.
Препараты активного метаболита витамина Д (оксидевит, альфа Д3-Тева) широко применяются при БИК. При СОП они используются в дозе 0,5–1,0 мкг/дн как в качестве монотерапии, так и в комбинации с другими препаратами (Д3+кальцитонин, Д3+соли фтора, Д3+бисфосфанаты). При комплексном лечении БИК и СОП также возможно применение препарата остеопан, содержащего кальций, витамин Д3, магний и цинк, назначая по две таблетки три раза в день.
Симптоматическое лечение СОП включает в себя обезболивающую терапию: анальгетики, назначение нестероидных противовоспалительных средств, а также центральных миорелаксантов, так как на генез боли при СОП оказывает влияние и спазм параспинальных мышц. Соли кальция самостоятельного значения при лечении стероидного ОП не имеют, но являются обязательным компонентом комплексной терапии. В клинической практике предпочтение в настоящее время отдается быстрорастворимым солям кальция. Кальций форте содержит в одной растворимой таблетке 500 мг кальция-элемента. Препараты кальция следует назначать в один прием, на ночь. При лечении СОП кальций надо применять ежедневно в суточной дозе 500–1000 мг в комбинации с препаратами патогенетической терапии ОП. Абсолютным показанием для назначения корсета при СОП являются боли в спине и наличие компрессионных переломов тел позвонков.
Прогноз БИК зависит от длительности, тяжести заболевания и возраста больного. При небольшой длительности заболевания, легкой форме и возрасте до 30 лет прогноз благоприятный. После адекватного лечения наблюдается выздоровление. При среднетяжелой форме заболевания и при длительном его течении у больных после нормализации функции гипофиза и надпочечников часто остаются необратимые изменения со стороны сердечно-сосудистой системы и костной системы, которые требуют дополнительного лечения. Вследствие двусторонней адреналэктомии у пациентов развивается хроническая надпочечниковая недостаточность. При стабильной надпочечниковой недостаточности и отсутствии тенденции к росту аденомы гипофиза прогноз благоприятный, хотя трудоспособность больных ограничена.
С. Д. Арапова, кандидат медицинских наук
Е. И. Марова, доктор медицинских наук, профессор
Эндокринологический научный центр РАМН, Москва
Патогенез заболевания связывают с нарушением регуляторных механизмов, которые контролируют функцию гипоталамо-гипофизарно-надпочечниковой системы. Эти нарушения происходят в ЦНС на уровне серотониновых и дофаминовых рецепторов. У здоровых людей серотонин повышает активность системы кортикотропин-рилизинг-гормон (КРГ) - АКТГ - кортизол, а дофамин, вероятно, ее тормозит. Отмечено, что при болезни Иценко - Кушинга снижено тормозящее влияние дофаминовых медиаторов. Полагают, что при этом заболевании в ЦНС изменяется не только концентрация серотонина и дофамина, но и чувствительность к ним рецепторов. В результате первичной патологии лимбических структур головного мозга и нарушения медиаторного контроля секреции КРГ возникает избыточная секреция АКТГ, являющаяся патогенетическим фактором заболевания. Гиперпродукция АКТГ усиливает в основном функцию пучковой и сетчатой зон коры надпочечников. При болезни Иценко - Кушинга снижается чувствительность гипоталамо-гипофизарной системы к кортикостероидам, в результате чего происходит одновременное повышение секреции как АКТГ, так и кортизола.
Увеличение продукции глюкокортикоидов вследствие усиления функции пучковой зоны коры надпочечников вызывает мышечную слабость, покраснение, мраморность, истончение и сухость кожных покровов, появление широких полос растяжения кожи (стрии), ожирение, остеопороз, артериальную гипертензию, пониженную резистентность организма к инфекциям, нарушение углеводного обмена вплоть до развития сахарного диабета (стероидного). Считают, что при болезни Иценко - Кушинга мышечная слабость обусловлена атрофией мышечной ткани (катаболическое действие избытка глюкокортикоидов на белок в мышцах) и гипокалиемией. При избытке глюкокортикоидов вследствие нарушения ферментных систем ускоряются процессы диссимиляции и дезаминирования аминокислот, снижается количество аминокислот в мышцах. В результате этого увеличивается скорость распада белков и замедляется их синтез. Генез гипокалиемии при этой болезни связан также с избытком глюкокортикоидов. Последние способствуют задержке натрия в организме, в результате чего усиливается выведение калия. Это приводит к значительному снижению содержания калия в мышечной ткани, мышце сердца, плазме и эритроцитах.
Считают, что сухость и истончение кожи, ее покраснение и мраморность обусловлены атрофией кожных покровов при повышенном катаболизме и снижении синтеза коллагена, ведущих к просвечиванию капилляров, а также полицитемией. Появление полос растяжения (стрии) происходит вследствие истончения кожи и быстрого отложения жира. Характерная окраска стрии обусловлена цветом сосудов, расположенных под истонченной кожей, и полицитемией. Развитие ожирения и его избирательный характер обусловлены избыточной секрецией кортизола. Последний усиливает глюконеогенез с увеличением образования глюкозы, которая используется для синтеза жиров. Процесс липогенеза стимулируется повышенной секрецией инсулина. Вместе с тем при гиперсекреции кортизола утилизация глюкозы на периферии снижается. Генез остеопороза при болезни Иценко - Кушинга объясняют избыточной продукцией глюкокортикоидов. Последнее приводит к нарушению образования белкового каркаса костной ткани с недостаточным отложением вследствие этого солей кальция. Кортизол стимулирует резорбцию кальция из кости. Немаловажное значение в генезе остеопороза имеет и уменьшение абсорбции кальция в желудочно-кишечном тракте, что обусловлено торможением процессов гидроксилирования кальциферола. Наряду с этим повышается выделение кальция с мочой. Таким образом, остеопороз при этой болезни возникает вследствие разрушения белковых компонентов кости и вторичной деминерализации.
Считают, что развитие артериальной гипертензии связано с нарушениями центральных механизмов регуляции сосудистого тонуса, повышением функции коры надпочечников (избыточная продукция глюкокортикостероидов), вторичным альдостеронизмом, электролитными нарушениями (гипернатриемия, гипокалиемия) и хроническим пиелонефритом (Е. А. Васюкова и др.). При длительной избыточной продукции кортизола происходит увеличение содержания в крови ренина. Последний участвует в образовании ангиотензина I и способствует повышению артериального давления. Существенную роль в генезе артериальной гипертензии отводят также ги пер продукции кортикосте-рона, 11-дезоксикортизола и дезоксикортикостерона, которые наряду с кортизолом способствуют задержке натрия в организме и повышению содержания воды в стенках артериол с уменьшением их просвета. Артериальной гипертензии способствует и повышение сосудистого тонуса. Это происходит вследствие потери калия мышечными клетками, изменяющей сосудистую реактивность. Глюкокортикоиды потенцируют эффект катехоламинов на периферические сосуды. Считают, что в генезе артериальной гипертензии при болезни Иценко - Кушинга альдостерон имеет второстепенное значение. Вследствие избыточной продукции глюкокортикоидов происходят угнетение иммунобиологических процессов (подавление кортизолом выработки антител), снижение сопротивляемости организма инфекциям. Развитию инфекции способствует также и нарушение углеводного обмена. В патогенезе сахарного диабета при этом заболевании придают большое значение избыточной секреции кортизола, глюкагона, соматостатина на фоне относительного дефицита инсулина и инсулинорезистентности. Нарушение углеводного обмена при болезни Иценко - Кушинга возникает прежде всего вследствие избыточной продукции глюкокортикоидов, угнетающих утилизацию глюкозы на периферии и повышающих глюконеогенез. При этом гипергликемия возникает, несмотря на повышенное содержание инсулина в крови. Полагают, что снижение чувствительности к инсулину (инсулино-резистентность) обусловлено уменьшением к нему количества рецепторов.
Нарушения функции половых желез у женщин при болезни Иценко - Кушинга обусловлены снижением секреции гонадо-тропных гормонов (фолликулостимулирующего - ФСГ и лютеинизирующего - Л Г) и повышением секреции тестостерона надпочечниками. Развитие аменореи при болезни Иценко - Кушинга связывают также и с непосредственным влиянием андрогенов на слизистую оболочку матки. Полагают, что снижение содержания гонадотропных гормонов в крови происходит вследствие угнетения их секреции избыточной продукцией глюкокортикоидов и андрогенов. Гиперпродукция стероидов с андрогенными свойствами ведет к появлению акне, иногда к развитию гипертрихоза.
Понижение либидо и потенции у мужчин при болезни Иценко - Кушинга обусловлено снижением содержания тестостерона в сыворотке крови. Считают, что понижение секреции этого гормона происходит в результате непосредственного влияния на интерстициальные клетки (клетки Лейдига) кортизола, уменьшающего их ответную реакцию на стимуляцию ЛГ.

Общие сведения
Болезнь и синдром Иценко-Кушинга (кушингоид, гиперкортицизм) – это тяжелое состояние, для которого характерно нарушение регуляторных механизмов, контролирующих гипоталамо-гипофизарно-надпочечниковую систему. Впервые признаки этого заболевания описал в 1924 году невропатолог из СССР Николай Иценко. Он высказал предположение, что причиной болезни являются изменения гипоталамуса. Именно гипоталамус определяет взаимодействие нервной и эндокринной систем.
Американский нейрохирург Харвей Кушинг определил наличие связи этого заболевания с опухолью гипофиза. В настоящее время ученые доказали правоту обоих медиков. Они подтвердили, что болезнь Кушинга является следствием сбоев в функционировании гипоталамо-гипофизарной системы. Это заболевание является достаточно редким и чаще всего диагностируется у женщин в возрасте 25-40 лет. Представительниц прекрасного пола болеют этим недугом в пять раз чаще, чем мужчины.
Болезнь и синдром Кушинга не отличаются по своим клиническим проявлениям. Синдром Кушинга (или синдром гиперкортицизма) диагностируется при опухоли надпочечника либо эктопированной опухоли ряда органов, продуцирующих глюкокортикоиды. При этом синдроме на организм длительное время влияет чрезмерное количество гормонов коры надпочечников.
Патогенез
У людей с болезнью Иценко-Кушинга размеры гипофиза увеличены – развивается аденома или опухоль. Если болезнь развивается, со временем надпочечники также увеличиваются.
Чрезмерная выработка кортизола приводит к тем патологическим изменениям, которые характерны для этого заболевания. Если кортизола в организме продуцируется слишком много, это приводит к катаболическому влиянию на белковые структуры и матрицы тканей и структур. Речь идет о костной и мышечной ткани (оказывается влияние на миокард, а также гладкие мышцы), внутренние органы. Постепенно появляются выраженные атрофические и дистрофические изменения.
В таком состоянии в организме нарушен и углеводный обмен. Так как происходит стойкая стимуляция глюконеогенеза и гликогенолиза в печени и мышцах, развивается гипергликемия (стероидный диабет).
Гиперкортицизм приводит к изменениям жирового обмена. В одних местах тела происходит чрезмерное накопление жировых отложений, а в других – жировая клетчатка атрофируется. Объясняется этот тем, что разные жировые участки имеют разную чувствительность к глюкокортикоидам.
Еще одна важная составляющая патогенеза синдрома Кушинга – это электролитные расстройства (гипернатриемия, гипокалиемия). Их развитие связано с воздействием чрезмерного количества альдостерона на почки. Такие электролитные нарушения приводят к развитию артериальной гипертензии и кардиомиопатии, что, в свою очередь, ведет к сердечной недостаточности и аритмии.
Глюкокортикоиды негативно воздействуют на иммунный статус, что приводит к склонности к инфекциям.
Гиперкортицизм может развиваться и в процессе лечения разных заболеваний, когда человек принимает глюкокортикоиды – гормоны коры надпочечников — при условии передозировки.
Классификация
В процессе диагностики определяется эндогенный и экзогенный гиперкортицизм.
- Эндогенный синдром Кушинга– следствие слишком активной выработки надпочечниками глюкокортикоидов.
- Экзогенный синдром Кушинга – следствие приема глюкокортикостероидных лекарств в слишком больших дозах с целью заместительной терапии. Эта форма болезни может развиваться вне зависимости от формы лекарств: это могут быть как таблетки или растворы для инъекций, так и местные средства.
В свою очередь выделяются следующие формы эндогенного гиперкортицизма:
- АКТГ-независимый, то есть первичный. Его также подразделяют на несколько разных типов.
- АКТГ-зависимый, то есть вторичный. В таком случае чрезмерное количество АКТГ синтезирует гипофиз либо, в более редких случаях, опухоль, которая располагается вне гипофиза. Реже всего речь идет об эктопической секреции КРГ.
АКТГ-независимый гиперкортицизм связан с такими явлениями:
- Автономные опухоли надпочечников— это аденомы, как правило, одиночные, реже – множественные. Те опухоли, которые происходят из пучковой зоны, продуцируют только гормон кортизол. Другие типы опухолей – смешанные или опухоли из сетчатой зоны – кроме кортизола, синтезируют и андрогены. При избытке в организме кортизола вследствие ингибирования секреции КРГ и АКТГ атрофируются ткани коры надпочечников – как пораженной, так и здоровой железы . Иногда также появляются множественные узлы коры надпочечника.
- Макронодулярная гиперплазия надпочечников – эта форма связана с эктопическими рецепторами в коре надпочечников, которые реагируют на стимуляцию нетипичными раздражителями. Чаще всего это желудочный ингибиторный пептид, который выделяется после приема пищи в пищеварительном тракте. Но стимулирующие факторы могут быть и другими — вазопрессин, катехоламины, ТТГ, ЛГ, ХГЧ, ФСГ, большие концентрации эстрогенов, пролактина.
- Микронодулярная гиперплазия надпочечников – семейная форма и спорадическая форма, когда гиперплазию коры надпочечников провоцируют иммуноглобулины. Как и при других формах независимого гиперкортицизма может происходить атрофия ткани надпочечника между узелками.
Причины
Чаще всего кушингоидный синдром развивается при наличии базофильной или хромофобной аденомы гипофиза, которая выделяет адренокортикотропный гормон. Если развивается опухоль гипофиза, у больного появляется аденокарцинома или микроаденома.
В некоторых случаях развитие болезни Иценко-Кушинга связано с недавним инфекционным поражением ЦНС вследствие перенесенного энцефалита, арахноидита, ЧМТ, менингита, интоксикации.
Синдром Кушинга у женщин может быть связан с резкими гормональными скачками и перестройками. Иногда у женщин симптомы заболевания проявляются после беременности, родов, в период менструальной паузы.
Но в целом эксперты до сих пор ведут работу над тем, чтобы четко определить причины, вызывающие кушингоидный синдром.
Симптомы Иценко-Кушинга
И кортизол, и другие глюкокортикоиды являются в организме физиологическими регуляторами. Они снижают синтез белков и способствуют их распаду, увеличивают выработку глюкозы и стимулируют липолиз, оказывают влияние на иммунную систему.
Поэтому симптомы болезни Иценко-Кушинга связаны с чрезмерной продукций кортикостероидов, в частности ГКС. Происходит поражение большинства систем и органов, и при этом развивается характерный для болезни Иценко-Кушинга комплекс симптомов.
Определяются следующие характерные симптомы болезни Кушинга у человека:
- Диспластическое ожирение – этот признак появляется раньше всего и встречается наиболее часто. Жировые отложения под кожей перераспределяются так, что жир откладывается в плечах, над шейными позвонками, над ключицами, на животе. При этом конечности остаются сравнительно тонкими. Кушингоидное лицо округляется и приобретает багровый цвет (матронизм). Это – так называемый кушингоидный тип ожирения.
- Трофические изменения кожных покровов– кожа становится тонкой, очень сухой, имеет багрово-цианотичный оттенок. В тех местах, где откладывается чрезмерное количество жира, появляются растяжки фиолетового цвета. Появление стрий связано с тем, что кожа истончается и при этом активизируется катаболизм белков. Если человек получает незначительную травму, у него сразу появляются гематомы ввиду усиленной ломкости капилляров. В местах, где возникает сильное трение – на шее, локтях, подмышками – появляется гиперпигментация. У женщин часто появляются признаки гирсутизма – рост волос по мужскому признаку, а также гипертрихоз груди.
- Вторичный гипогонадизм – это ранний признак болезни. Симптомы синдрома Иценко-Кушинга проявляются нарушениями месячного цикла (развивается аменорея и опсоменорея). Эти симптомы у женщин могут в итоге привести к бесплодию. У мужчин ухудшается потенция, развивается гинекомастия. Если заболевание развивается в детстве, то у мальчиков в подростковом возрасте половой член и яички остаются недоразвитыми. У девочек же проявляется первичная аменорея и нормально не развиваются молочные железы. При этом в плазме крови больного понижается уровень гонадотропинов, эстрогенов, тестостерона.
- Миопатия– мышцы гипотрофируются, этот процесс затрагивает верхние и нижние конечности, переднюю брюшную стенку. Соответственно, ноги и руки становятся тонкими, а живот – увеличивается за счет отвисания и жировых отложений.
- Артериальная гипертензия– это проявление характерно для большинства таких больных. Вследствие регулярных проблем с артериальным давлением нарушается метаболизм миокарда, развивается сердечная недостаточность. В ходе электрокардиографии могут определяться признаки гипертрофии левого желудочка.
- Вторичный иммунодефицит – выражается в появлении акне и грибковых поражений на коже, а также поражений ногтей. У таких больных долго заживают раны, появляются трофические язвына голенях, развивается хронический пиелонефрит. Проявляются и многочисленные изменения вегетативной нервной системы, что приводит к развитию синдрома вегетативной дистонии с многочисленными и разнообразными проявлениями, в том числе и выраженными психозами.
- Нарушение обмена углеводов – нарушается толерантность к глюкозе, проявляется диабет второго типа с гиперинсулинемией, инсулинорезистентностью, отсутствием склонности к кетоацидозу и благоприятным течением.
- Изменения костей – если болезнь проявляется в детском возрасте, темпы роста малыша замедляются, либо он останавливается полностью. Задерживается и развитие скелета. Между реальным возрастом ребенка и возрастом его костей может отмечаться разница до 5 лет. Одним из самых тяжелых проявлений гиперкортицизма считается стероидный остеопороз, при котором происходит деминерализация костей и подавляется синтез белкового матрикса. В таком случае часто проявляются боли в позвоночнике, происходят переломы позвонков и ребер.
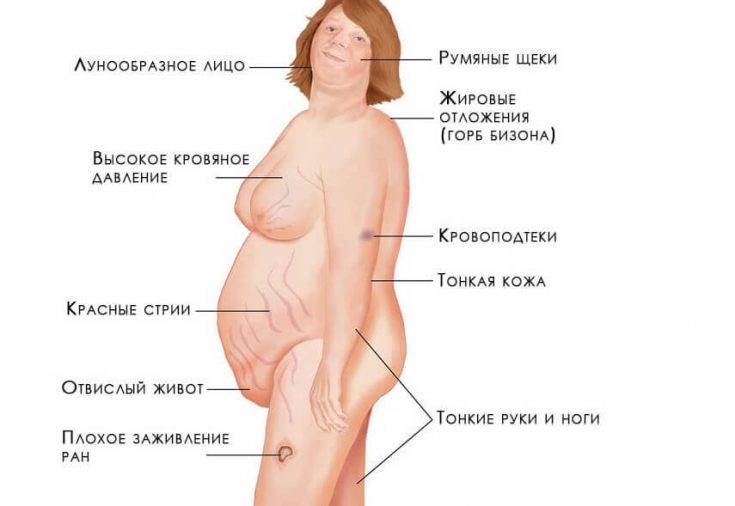
Симптомы синдрома Иценко-Кушинга
Итак, основные симптомы этого заболевания являются следующими:
- ожирение особого типа;
- истончение кожных покровов;
- слабость и атрофия мышц;
- гипертензия, проблемы с сердцем, отеки;
- нарушение месячного цикла, дисфункция половых желез;
- нервные расстройства;
- высокая частота инфекционных болезней;
- плохо заживающие раны;
- остеопороз, переломы.
Анализы и диагностика
Если человек отмечает у себя проявления части из описанных выше признаков, ему необходимо незамедлительно обращаться к эндокринологу.
Чтобы установить диагноз, врач изначально проводит осмотр, после чего назначает пациенту проведение необходимого комплекса исследований:
- Лабораторное исследование крови и мочи на содержание гормонов. Обязательно необходимо определить уровень кортикостероидов и АКТГ.
- Проводятся также гормональные пробы. Для этого изначально пациент сдает кровь для определения уровня гормонов, после чего принимает препарат (Синактен, Дексаметазони др.) и спустя определенное время снова сдает кровь.
- Биохимический анализ крови – позволяет определить наличие нарушений в организме, а также выявить сахарный диабет.
- Проводится рентген черепа и области турецкого седла, чтобы определить размеры гипофиза пациента.
- Компьютерная и магнитно-резонансная томография – проводят с целью подробного изучения особенностей гипофиза и структур мозга.
- Рентген костей скелета – проводят, чтобы определить наличие остеопороза и патологических переломов.
Лечение синдрома Иценко-Кушинга
После установления диагноза врач назначает комплексное лечение синдрома Кушинга. Лечение, в зависимости от индивидуальных особенностей течения заболевания, может быть следующим:
- Медикаментозное– назначают препараты, которые блокируют чрезмерную продукцию АКТГ или кортикостероидов.
- Лучевая терапия– ее проведение дает возможность снизить активность гипофиза.
- Хирургическое – врач принимает решение об удалении опухоли гипофиза. Проводят традиционную операцию либо используют криохирургию – разрушение опухоли влиянием низких температур (используют жидкий азот). Если болезнь развивается очень активно, проводят удаление одного или обоих надпочечников.
Как правило, в процессе терапии заболевания сочетается несколько разных методов.
Читайте также:


