Острый инфекционный эндокардит микропрепарат
Септический (бактериальный) эндокардит - особая форма сепсиса, для которой характерно септическое поражение клапанов сердца.
При септическом эндокардите выражена гиперергия, в связи с чем его можно рассматривать как бактериальную септицемию. Поскольку септический очаг находится на клапанах сердца, гиперергическому повреждению подвергается прежде всего сердечно-сосудистая система, что определяет своеобразие клинических и патологоанатомических проявлений этого заболевания.
↑ Этиология и патогенез
В настоящее время наиболее частыми возбудителями бактериального эндокардита стали белый и золотистый стафилококк, зеленящий стрептококк (преимущественно L-формы и мутанты), энтерококк. Возросло значение грамотрицательных бактерий - кишечной и синегнойной палочек, клебсиеллы, протея, а также патогенных грибов. Взгляды на патогенез бактериального эндокардита за последние 40 лет подверглись значительной эволюции. Еще в 1942 г. А. И. Абрикосов считал эндокардит (sepsis lenta) гиперергической формой сепсиса. Вскоре на смену этому взгляду пришел диаметрально противоположный: большинство исследователей стали рассматривать септический эндокардит как проявление гиперергии, как септицемию с септическим очагом на клапанах сердца. В настоящее время характер гиперергии расшифрован. Показано, что в ее основе лежат реакции гиперчувствительности, обусловленные воздействием циркулирующих в крови токсических иммунных комплексов, которые содержат антиген возбудителя. С циркулирующими иммунными комплексами связывают многие проявления септического эндокардита: генерализованные васкулиты, резкое повышение сосудистой проницаемости, тромбоэмболический синдром, клеточные реакции стромы и др.
↑ Классификация
Септический (бактериальный) эндокардит разделяют по характеру течения и наличию или отсутствию фонового заболевания.
Исходя из характера течения заболевания выделяют острый, подострый и затяжной (хронический) септический эндокардит. Продолжительность острого септического эндокардита составляет около 2 нед, подострого - до 3 мес, затяжного - многие месяцы и годы. В настоящее время преобладают подострые и затяжные формы, острые почти исчезли.
В зависимости от наличия или отсутствия фонового заболевания септический эндокардит (особенно подострый и затяжной) делят на два вида:
- развивающийся на измененных (порочных) клапанах - вторичный септический эндокардит;
- возникающий на интактных клапанах - первичный септический эндокардит, описанный в 1949 г. Б. А. Черногубовым (болезнь Черногубова).
Вторичный септический эндокардит, по данным вскрытий, наблюдается в 70-80% случаев и преимущественно на фоне ревматического порока сердца; редко он развивается на фоне атеросклеротического, сифилитического или врожденного (тетрада Фалло, сохранившийся артериальный проток и др.) порока. Первичный септический эндокардит отмечают в 20-30% случаев, причем в последнее десятилетие развитие его резко возросло.
↑ Патологическая анатомия
Достаточно характерна и проявляется преимущественно изменениями в сердце, сосудах, селезенке и почках, а также рядом так называемых периферических признаков. Эти изменения сочетаются с тромбоэмболиями, инфарктами и множественными геморрагиями.
Основные изменения касаются клапанов сердца. Преобладает изолированный эндокардит, который, по данным вскрытий, встречается в 60-75% случаев. В 50% случаев поражаются только аортальные клапаны, в 10-15% - митральный клапан, в 25-30% - аортальный и митральный клапаны, в 5% - другие клапаны. Следовательно, септический эндокардит очень часто (в 75-80%) развивается на аортальных клапанах. Как на склерозированных, так и на несклероэированных клапанах возникает полипозно-язвенный эндокардит. При этом обычно на склерозированных клапанах появляются обширные тромботические наложения в виде полипов, которые легко крошатся и рано пропитываются известью, что весьма характерно для этого заболевания. После удаления этих наложений обнаруживаются язвенные дефекты в склерозированных и деформированных створках клапанов, иногда поверхностные, иногда с нарушением целости клапана, образованием острых аневризм створок или массивным их разрушением. Тромботические наложения располагаются не только на створках, но и на пристеночном эндокарде, а при поражении аортальных клапанов распространяются на интиму аорты.
При микроскопическом исследовании удается установить, что процесс начинается с образования очагов некроза ткани клапана, вокруг которых наблюдается инфильтрация из лимфоидных клеток, гистиоцитов, многоядерных макрофагов, нейтрофилы отсутствуют или их очень мало. Среди клеток инфильтрата встречаются колонии бактерий. В участках некроза появляются массивные тромботические наложения, которые организуются. Разрастающаяся грануляционная ткань при созревании деформирует створки, что ведет к формированию порока сердца. Если эндокардит развился на порочных клапанах, то склероз их усиливается. В миокарде отмечается гипертрофия мышечных волокон, выраженность которой в стенках той или иной полости сердца зависит от характера порока. В межуточной ткани миокарда встречаются гистиолимфоцитарные инфильтраты и узелки, напоминающие ашофф-талалаееские гранулемы. В сосудах миокарда обнаруживлют плазматическое пропитывание и фибриноидный некроз стенок, эндо- и периваскулиты.
В сосудистой системе, особенно в микроциркуляторном русле, находят распространенные альтеративно-продуктивные изменения. Они представлены плазморрагией и фибриноидным некрозом стенок капилляров, артериол и вен, эндо- и периваскулитами. Воспалительные изменения, в стенках артерий мелкого и среднего калибра приводят к развитию аневризм, разрыв которых может оказаться смертельным (например, кровоизлияние в ткань головного мозга). Преобладают явления повышенной сосудистой проницаемости, с которыми в значительной мере связано развитие геморрагического синдрома. Появляются множественные петехиальные кровоизлияния на коже, в серозных и слизистых оболочках, а также в конъюнктиве глаз.
Селезенка в результате длительной гиперплазии пульпы, как правило, увеличена, с инфарктами различной давности. В почках развивается иммунокомплексный диффузный гломерулонефрит. Нередко наблюдаются инфаркты и рубцы после них. Во многих органах обнаруживают межуточные воспалительные процессы, васкулиты, кровоизлияния, инфаркты. В головном мозге, в частности, на почве сосудистых изменений (васкулиты, аневризмы) и тромбоэмболий возникают очаги размягчения и кровоизлияния. Среди так называемых периферических признаков септического эндокардита характерными считаются:
- петехиальные кровоизлияния в конъюнктиве глаз у внутреннего угла нижнего века (пятна Лукина-Либмана);
- узелковые утолщения на ладонных поверхностях кистей (узелки Ослера);
- утолщения ногтевых фаланг ("барабанные палочки");
- очаги некроза в подкожной жировой клетчатке;
- кровоизлияния в кожу и подкожную клетчатку (пятна Джейнуэя);
- желтуха.
В настоящее время из периферических признаков септического эндокардита постоянно встречаются лишь узелки Ослера.
Тромбоэмболические осложнения находят исключительно часто, так как источник тромбоэмболий - тромбоэндокардит - в подавляющем большинстве случаев локализуется в левом сердце. Тромбоэмболии нередко принимают распространенный характер и доминируют в клинической картине болезни. В этих случаях говорят о тромбоэмболическом синдроме. На почве эмболий могут развиваться инфаркты в легких, селезенке, почках, сетчатке глаза, некрозы кожи, гангрена конечностей, кишок, очаги размягчения в мозге. Несмотря на наличие в тромбоэмболах стрептококков, нагноение в тканях отсутствует, что свидетельствует о гиперергической реакции организма при септическом эндокардите.
↑ Патоморфоз
За последние десятилетия произошли значительные изменения в клинической и морфологической картине (патоморфоз) септического эндокардита. До применения антибиотиков септический эндокардит относился к числу крайне тяжелых болезней, неизбежно ведущих к смерти. Лечение массивными дозами антибиотиков приводит к ликвидации септического процесса на клапанах, ускоряет созревание грануляций в ткани створок клапанов и тем самым избавляет организм от септического очага, но способствует деформации клапанов, развитию или усилению предсуществовавшего порока сердца. Через несколько лет после начала лечения обычно появляются признаки сердечной декомпенсации, которые приводят к смерти. При вскрытии умерших от декомпенсации сердца после излечения от септического процесса находят чаще аортальный или аортально-митральный порок сердца с резко выраженной деформацией клапанов, перфорацией створок и заслонок и тяжелые дистрофические изменения миокарда. Патоморфоз септического эндокардита касается также его этиологии (преобладание стафилококка и грамотрицательных бактерий), структуры (учащение первичного септического эндокардита), клиники, морфологии, осложнений.
• Септический (бактериальный) эндокардит — особая форма сепсиса, для которой характерно наличие септического очага на клапанах сердца и гиперергии, поэтому ее рассматривают как бактериальную септицемию.
Этиология и патогенез.Наиболее частые возбудители — белый и золотистый стафилококк, зеленящий стрептококк (его L-формы и мутанты), энтерококки. В последние годы возросла этиологическая роль грамотрицательных бактерий — кишечной и синегнойной палочек, протея, клебсиеллы, а также патогенных грибов. В ответ на антигены всех перечисленных возбудителей образуются антитела, и в кровь больных поступают циркулирующие токсические иммунные комплексы. В связи с воздействием циркулирующих токсических иммунных комплексов развиваются реакции гиперчувствительности, которые и составляют сущность гиперергии при бактериальном эндокардите.
Классификация.Септический (бактериальный) эндокардит разделяют по характеру течения и по наличию (или отсутствию) фонового заболевания.
По характеру течения выделяют острый, подострый и затяжной (хронический) бактериальный эндокардит. Острый эндокардит в настоящее время практически не встречается, продолжительность его около 2 нед. Продолжительность подострого — около 3 мес и затяжного (хронического) — несколько месяцев, а иногда и несколько лет.
В зависимости от наличия или отсутствия фонового заболевания различают 2 вида септического эндокардита:
1) первичный септический эндокардит, или болезнь Черногубова. Эта форма сепсиса характеризуется тем, что развивается на
неизмененных клапанах. Она составляет 20—30 % случаев септического эндокардита и в последние годы эта цифра увеличивается;
2) вторичный септический (бактериальный) эндокардит. Эта форма сепсиса встречается гораздо чаще (70—80 % всех случаев септического эндокардита) и характеризуется тем, что развивается на фоне порока сердца чаще всего при ревматизме, реже при атеросклерозе, сифилисе и еще реже — на фоне врожденного порока сердца. Особое место занимает эндокардит, который развивается на протезированных клапанах.
Патологическая анатомия.Складывается из местных и общих изменений.
Местные изменения— это изменения в септическом очаге, т.е. на клапанах. Обычно поражены клапаны аорты, реже — левый предсердно-желудочковый (митральный) клапан или оба эти клапана вместе. Процесс на неизмененных и на склерозированных клапанах носит название полипозно-язвенного эндокардита. На клапанах появляются обширные изъязвления, иногда часть створки клапана отрывается или же возникают отверстия в створках (фенестры) в связи с перфорацией их; на язвах появляются крупные в виде полипов тромботические наложения, которые легко крошатся и пропитываются известью. В ряде случаев тромботические наложения располагаются не только на клапанах, но и на пристеночном эндокарде, а при поражении аортальных клапанов — распространяются на внутреннюю оболочку аорты.
При микроскопическом исследовании в створках клапанов выявляются обширные очаги некроза, вокруг которых наблюдается лимфогистиоцитарная инфильтрация, при этом среди клеток инфильтрата видны колонии бактерий. В участках некроза выявляются массивные старые организованные тромбы, иногда с отложениями кальция.
Описанные морфологические изменения характерны для первичного септического эндокардита. При вторичном септическом эндокардите отличие заключается лишь в том, что макро- и микроскопически выявляется, в дополнение к описанному, яркая морфология порока — склероз, гиалиноз, обызвествление и выраженная деформация створок клапана.
Общие измененияхарактеризуются поражением внутренних органов. Селезенка при септическом эндокардите увеличена, с резко напряженной капсулой. Пульпа ее малинового цвета, дает обильный соскоб. Гистологически выявляется выраженная гиперплазия лимфоидной ткани и полнокровие красной пульпы — септическая селезенка. Часто в ней обнаруживают инфаркты разной давности.
В связи с циркуляцией иммунных комплексов отмечается генерализованное поражение сосудов, в них развивается алътеративно-продуктивный заскулит, при этом воспалительные изменения отмечают прежде всего в сосудах микроциркуляторного русла в виде эндо- или периваскулита. В результате диффузного поражения возможно развитие аневризм в сосудах мелкого и среднего калибра, разрыв которых в жизненно важных органах (например, в головном мозге) может оказаться смертельным. В стенках сосудов нередко развивается фибриноидный некроз, что приводит к резкому повышению сосудистой проницаемости, развивается плазморрагия и появляются многочисленные диапедезные кровоизлияния. Множественные петехиальные кровоизлияния появляются на коже, слизистых и серозных оболочках, в конъюнктиве глаза развивается геморрагический синдром.
В почках при септическом эндокардите развивается иммунокомплексный диффузный гломерулонефрит, а также нередко возникают инфаркты и рубцы после них.
В связи с наличием массивных тромботических наложений на клапанах при септическом эндокардите неизбежно развиваются тромбоэмболические осложнения, а так как источником тромбоэмболии являются аортальный и/или митральный клапаны, то развиваются многочисленные инфаркты в органах большого круга кровообращения — в почках, селезенке, головном мозге, т.е. речь идет о тромбоэмболическом синдроме.
Циркулирующие иммунные комплексы нередко оседают на синовиальных оболочках, поэтому при септическом эндокардите развиваются артриты.
Очень характерны периферические признаки септического эндокардита. Среди них выделяют:
1) пятна Лукина—Либмана — петехиальные кровоизлияния в конъюнктиве глаз нижнего века у внутреннего угла;
2) узелки Ослера — узелковые утолщения на ладонных поверхностях кистей;
3) пальцы в виде барабанных палочек;
4) очаги некроза в подкожной клетчатке;
5) пятна Джейнуэя — кровоизлияния в кожу и подкожную клетчатку.
Патоморфоз. За последние десятилетия значительно изменились и клиническая, и морфологическая картины септического эндокардита. В частности, на фоне массивной антибактериальной терапии клиницисты успешно ликвидируют септический очаг на клапанах сердца, в связи с чем резко снизилась летальность. Практически исчезли острые формы течения бактериального эндокардита. Однако массивная противовоспалительная терапия усиливает и ускоряет развитие и созревание вегетации на створках и в створках клапанов. Это приводит к значительному склерозу и деформации створок клапанов. В результате у людей с первичным септическим эндокардитом после "успешного" лечения сепсиса происходит формирование порока сердца, а у лиц с уже имеющимся пороком последний после излечения сепсиса становится значительно тяжелее, более выраженным — усиливаются склероз, гиалиноз и резкая деформация клапанов. Все это в очень короткие сроки приводит к инвалидизации больных.
Патоморфоз бактериального эндокардита коснулся не только морфологии — изменилась этиология (раньше был только зеленящий стрептококк), клинические проявления и исходы заболевания.
Не нашли то, что искали? Воспользуйтесь поиском:
ВОСПАЛИТЕЛЬНЫЕ ЗАБОЛЕВАНИЯ СЕРДЦА
Стенка сердца состоит из трёх различных слоёв, это объясняет нередкое развитие изолированного воспаления одного из них — эндокардита, миокардита или перикардита. При определённых условиях возможно вовлечение в воспалительный процесс всех оболочек сердца (панкардит).
Эндокардит — воспаление внутренней оболочки сердца различной этиологии. Он занимает 4-е место среди болезней сердца после ишемических поражений миокарда, изменений, возникающих при гипертрофии и лёгочном сердце. Мужчины болеют в три раза чаще женщин. Выделяют следующие виды эндокардитов: инфекционный септический, неинфекционный тромбоэндокардит, ревматический эндокардит, париетальный фибропластический эозинофильный эндокардит Лёффлера.
Наиболее часто бывает эндокардит клапанов сердца, реже воспаление париетального эндокарда и эндокарда сухожильных хорд. Нередко сочетание воспаления этих отделов эндокарда.
Инфекционный септический эндокардит
Инфекционному септическому,или бактериальному эндокардитуморфологически соответствует язвенный или полипозно-язвенный эндокардит. Эта форма эндокардита протекает с выраженной гиперергической реакцией, до недавнего времени её рассматривали как форму сепсиса. Почти всегда причина септического эндокардита — бактериемия, особенно при септикопиемии. В 60–80% случаев заболевание вызывают стрептококки, энтерококк, в 30% — стафилококки, грамотрицательные бактерии, патогенные грибы, риккетсии. Однако примерно у 10–30% больных инфекционным эндокардитом возбудителей инфекции в крови не находят.
Локализация воспаления — клапаны сердца, значительно реже — париетальный эндокард. В 70% наблюдений инфекционному эндокардиту предшествуют другие заболевания (скарлатина, дифтерия, пневмония, ангина, брюшной и сыпной тиф, туберкулёз, сифилис и др.), а также болезни, вызывающие тяжёлые изменения клапанов сердца. В 6,5% случаев эндокардит возникает на фоне врождённых пороков сердца, в 10% —на клапанах, поражённых ревматизмом, в 6% — при пролапсе створок митрального клапана, в 5–9% — при гипертрофической обструктивной кардиомиопатии, в 2% случаев — после операций на сердце. Нередко этот эндокардит возникает у страдающих алкоголизмом и токсикоманией, у пациентов, получающих гемодиализ или иммуносупрессивную терапию.
Патогенез. В развитии острого инфекционного эндокардита ведущую роль играют иммунокомплексные механизмы. По характеру течения выделяют следующие формы инфекционного эндокардита: острый бактериальный эндокардит (длительность около 2 нед), подострый инфекционный эндокардит (до 6 нед, изредка до 3 мес), затяжной септический эндокардит (в течение многих месяцев и лет).
● Острый бактериальный эндокардит возникает обычно на интактных клапанах сердца при тяжёлых инфекциях и септикопиемии. В 80% случаев его вызывает золотистый стафилококк, в 20% другие возбудители — пневмококки, гонококки, патогенные грибы, риккетсии. На эндокарде клапанов возникают язвенные или язвенно-полипозные изменения, быстро формирующие порок сердца.
◊ Макроскопически в начале процесса по краям створок митрального, иногда аортального клапанов видны мелкие гранулярные образования величиной от нескольких миллиметров до сантиметра и более, жёлтого или тёмно-коричневого цвета. Под ними обнаруживают язвенные дефекты клапанов. При увеличении эти дефекты распространяются вглубь, могут переходить на сухожильные хорды и пристеночный эндокард. Часто изъязвление створок клапанов приводит к появлению их аневризмы, а в 50% летальных исходов — перфорации створок клапана. По краям язвенных дефектов возникают тромбы (полипозно-язвенный эндокардит). При острых эндокардитах, вызванных бактериями или риккетсиями (например, при Q-лихорадке) объём тромботических масс относительно невелик, а при грибковых эндокардитах полипозные разрастания могут быть большими и рыхлыми.
◊ Микроскопически на некротизированной поверхности клапана часто видны колонии бактерий и тромботические массы. Ткани клапана набухшие, пронизаны фибрином, нередко инфильтрированы нейтрофильными лейкоцитами (последние иногда отсутствуют). Изредка в инфильтрате находят гистиоциты и фибробласты. При затихании процесса обычно происходит организация тромботических масс, петрификация колоний бактерий, сморщивание и деформация створок клапана (рис. 10-15).
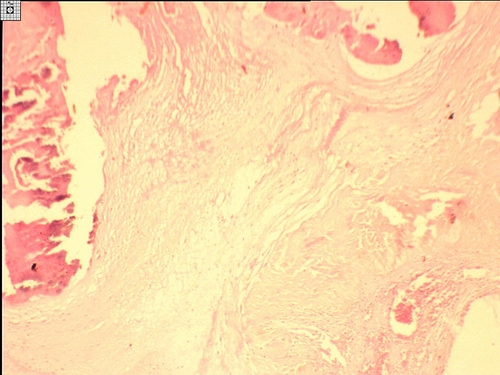
Рис. 10-15. Полипозно-язвенный эндокардит склерозированного клапана. Окраска гематоксилином и эозином (x40).
◊ Осложненияострого бактериального эндокардита: отрыв части клапана, сухожильных хорд, кусочков тромбов с развитием тромбоэмболического синдрома, в том числе инфаркта миокарда. При эмболии инфицированными тромботическими массами в миокарде могут возникать мелкие абсцессы. Возможно развитие диффузного пролиферативного гломерулонефрита и узелков Ослера в коже как проявление гиперчувствительности.
● Подострый инфекционный эндокардит диагностируют в 50% случаев септического эндокардита, в последние годы реже. Процесс возникает как на склерозированных, так и на неизменённых клапанах сердца. Воспаление чаще изолировано в аортальном, реже митральном клапане и приводит к развитию соответствующего порока сердца. Морфологическиэто обычно полипозно-язвенный эндокардит. Очаги некроза с мононуклеарными инфильтратами вокруг них находят также в пристеночном эндокарде и трабекулах.
● Затяжной септический эндокардит, или sepsis lenta составляет 45% всех инфекционных эндокардитов. В 50% случаев он связан с зеленящим стрептококком. Как правило, затяжной септический эндокардит возникает на клапанах, склерозированных и деформированных в результате атеросклероза или сифилиса, иногда при врождённых пороках клапанов (вторичный эндокардит). Однако в 18–25% заболевание возникает на неизменённых клапанах (первичный эндокардит, или болезнь Черногубова). В конце ХХ в. первичные эндокардиты стали более частыми, чем вторичные. Первичные эндокардиты наблюдают у более молодых людей, в то время как вторичный затяжной септический эндокардит чаще бывает у лиц старше 50 лет. Изолированное поражение клапанов диагностируют в 73% случаев. Из них в 53% поражён аортальный клапан, в 16% — митральный (обычно при сепсисе у наркоманов или как осложнение внутрисердечной катетеризации). Сочетанное поражение митрального и аортального клапанов отмечают в 27% случаев, трикуспидального — в 19%.
◊ Для затяжного септического эндокардита характерны язвенные дефекты створок клапанов, сухожильных хорд, иногда пристеночного эндокарда с массивными суховатыми крошащимися тромботическими наложениями. Вокруг очагов некроза лимфогистиоцитарные инфильтраты, иногда в тромботических наложениях видны гигантские клетки и колонии микроорганизмов, но в инфильтрате нет нейтрофилов. Затем под тромботическими наложениями возникает грануляционная ткань, она, созревая, сморщивает клапан. Деформацию клапана усиливает организация тромботических масс. Заболеванию свойственно хроническое рецидивирующее течение, поэтому в клапане одновременно можно видеть организованные и свежие тромбы, рубцующиеся и свежие участки некроза и изъязвлений. В клапанах, сухожильных хордах, париетальном эндокарде есть изменения, отражающие иммунное воспаление: очаги набухания и дезорганизации соединительной ткани, лимфомакрофагальная инфильтрация, иногда небольшие тромботические наложения на неизменённом эндокарде.
◊ Осложнения и причины смерти больных такие же, как при подостром инфекционным эндокардите. Обычно эти две формы эндокардита клинически рассматривают как одно заболевание.
Морфологическое проявление этого заболевания — бородавчатый или фибропластический эндокардит. Ревматический эндокардит, также как атипический небактериальный бородавчатый эндокардит Либмана–Сакса при системной красной волчанке и эндокардит при ревматоидном артрите — часть патогенеза соответствующих заболеваний и причина развития клапанных пороков (см. главу 16).
Париетальный фибропластический эозинофильный эндокардит Лёффлера
Другие названия заболевания — фибропластический париетальный эндокардит с эозинофилией, эндокардит Лёффлера.Этиология неизвестна. Заболевание было описано Лёффлером в 1936 г. как сочетание эндомиокардита, эозинофилии крови, эозинофильных васкулитов кожи и внутренних органов.
Патогенез эндокардита Лёффлера связывают с иммунными нарушениями.Характерно сочетание эозинофилии крови и поражения париетального эндокарда с последующим развитием его выраженного фиброза, утолщения, сужения камер сердца. Заболевание заканчивается сердечной недостаточностью. Правильнее говорить об эндомиокардите, так как почти всегда в процесс вовлечён миокард, особенно его субэндокардиальные отделы.
Морфогенезэндокардита Лёффлера состоит из острой стадии, тромботической и стадии фиброза.
● Острая (некротическая) стадия протекает 5–6 нед. Характерно воспаление париетального эндокарда с тромботическими наложениями в обоих желудочках, преимущественно в левом, особенно в области верхушки. Воспаление распространяется на субэндокардиальные отделы миокарда, где возникают очаги некроза. В инфильтрате много эозинофилов, лимфоцитов, плазматических клеток, присутствуют нейтрофильные лейкоциты. Кроме того, возможны эндартериит или панартериит коронарных артерий, а также сосудов кожи и внутренних органов.
● Тромботическая стадия. Полости сердца несколько сужены, возможна небольшая эксцентрическая гипертрофия миокарда. На париетальном эндокарде левого желудочка, особенно в области верхушки, и в правом желудочке по ходу приносящего тракта видны организующиеся тромбы. Микроскопическиобнаруживают фиброз эндокарда обоих желудочков. Между утолщённым эндокардом и миокардом — зона грануляций. Часть мышечных волокон гипертрофирована, часть — атрофирована. На месте некрозов возникает сетчатый или очаговый фиброз, особенно в субэндокардиальном и среднем слоях миокарда, а также периваскулярный склероз.
● Стадия фиброза. Камеры сердца сужены, париетальный эндокард обоих желудочков белесоватый, плотный, особенно по ходу приносящих трактов и в области верхушки сердца. Нередко отмечают выраженный фиброз папиллярных мышц и сухожильных хорд, особенно задней створки митрального клапана, в результате может возникнуть порок сердца. Возможно развитие порока аортального клапана. Микроскопически отмечают выраженное утолщение эндокарда за счёт склероза. Склероз в виде пальцевидных рубцов распространяется на субэндокардиальный и средний слои миокарда. Вокруг склерозированных участков — умеренная лимфогистиоцитарная инфильтрация с наличием отдельных эозинофилов. Сосуды склерозированы.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Это клинико-морфологическая форма сепсиса, при которой септический очаг локализуется на клапанах сердца. Наиболее частые возбудители - белый и золотистый стафилококк, зеленящий стрептококк, энтерококки и др. Выражены реакции гиперчувствительности, связанные с образованием циркулирующих токсических иммунных комплексов.
1. По характеру течения:
а) острый эндокардит - продолжительность около 2-х недель;
б) подострый эндокардит - продолжительность около 3-х месяцев;
в) хронический - продолжительность несколько месяцев (иногда несколько лет).
2. В зависимости от наличия или отсутствия фонового заболевания.
а) первичный септический эндокардит, или болезнь Черногубова: развивается на неизмененных клапанах. Составляет 20 % случаев.
б) вторичный септический эндокардит: развивается на фоне порока сердца (чаще ревматического, реже - атеросклеротического, сифилитического и врожденного). Особой формой является эндокардит на протезированных клапанах.
Патологическая анатомия
Местные изменения (септический очаг) представлены полипозно-язвенным эндокардитом; чаще поражаются клапаны аорты или аортальный и митральный клапаны одновременно; у наркоманов часто вовлекается трехстворчатый клапан. Макроскопически отмечаются обширные фокусы некроза и изъязвления, часто с отрывом створок и образованием отверстий (фенестр), массивные тромботические наложения в виде полипов в участках изъязвления. При вторичном эндокардите описанные выше изменения развиваются на измененном клапане (склероз, гиалиноз, обызвествление створок). Микроскопически в створке выявляются лимфо-макрофагальная инфильтрация, колонии микроорганизмов, массивное выпадение солей кальция в тромботические массы (характерно для подострого эндокардита). Септическая селезенка (увеличена в размерах с напряженной капсулой, дает обильный соскоб, часто в ней обнаруживают инфаркты) при подостром и хроническом эндокардите уплотняется вследствие склероза.
Изменения, связанные с циркулирующими иммунными комплексами:
а) генерализованный альтеративно-продуктивный васкулит (в сосудах микроциркуляции) с развитием множественных петехиальных кровоизлияний на коже, слизистых и серозных оболочках, конъюнктивите (кровоизлияния на конъюнктиве нижнего века, у внутреннего края - пятна Лукина-Лимбана - диагностический признак);
б) иммунокомплексный диффузный гломерулонефрит;
Тромбоэмболические осложнения связаны с массивными тромботическими наложениями на клапанах, проявляются развитием инфарктов и гангрены. Чаще инфаркты возникают в селезенке, почках, головном мозге. При множественных инфарктах говорят о тромбоэмболическом синдроме.
Хрониосепсис
а) длительное многолетнее течение;
б) снижение реактивности организма;
в) наличие длительно не заживающего септического очага (кариес, хронический тонзиллит, нагноившиеся раны);
г) хроническая интоксикация, приводящая к истощению (гнойно-резорбтивная лихорадка) и бурой атрофии органов (сердце, печени, скелетных мышц);
д) селезенка обычно маленькая, дряблая, на разрезе бурая вследствие гемосидероза;
е) возможно развитие амилоидоза (АА-амилоидоз).
Пупочный сепсис.
Пупочный сепсис, так называемый сепсис новорожденных по ВОЗ, единственный вид сепсиса, выделенный в самостоятельную нозологическую форму.
Возбудителями пупочного сепсиса до применения антибиотиков являлся стрептококк, реже стафилококк и кишечная палочка. В настоящее время стала преобладать грамотрицательная флора, грибы, вновь появились данные о значении стрептоккока группы В. Патогенез пупочного сепсиса изменился. Если ранее бактериальная флора попадала в пупочные сосуды при обработке культи пуповины и уходе за пупочной ранкой в детской комнате родильного дома, то в настоящее время источником заражения стали нестерильные условия введения преимущественно в пупочную вену лекарственных препаратов в родильной комнате, особенно часто проводимые недоношенным детям. Поэтому изменились сроки развития пупочного сепсиса. Если раньше от него погибали чаще на 3-й недели жизни, что говорило о заражении в детской комнате, то теперь дети стали чаще погибать на первой неделе жизни, что говорит о раннем их инфицировании в родильной комнате, где проводят инъекции и катетеризацию.
Входными воротами пупочного сепсиса раньше всегда была пупочная ямка, где при отторжении культи пуповины всегда имеется непосредственное соприкосновение эпителизированной грануляционной ткани с внешней средой. В настоящее время инфекция может быть непосредственно внесена в пупочные сосуды при инъекциях и катетеризации. Распространение инфекции осуществляется гематогенным путем, вероятно, vasa vasorum пупочных артерий, с образованием метастазов чаще всего в легких, при развитии флебита пупочной вены - по току крови с метастазами, в первую очередь в печени по ходу портального тракта из-за наличия анастомозов между ductus venosus (Arantii) и v.portaе.
До применения инфузионной терапии новорожденным и грудным детям септическим очагом чаще всего являлся артериит одной или обеих пупочных артерий, причем поражение сосудов обнаруживалось преимущественно под пупочной ямкой, реже в отдалении от нее. Пупочная вена после перевязки культи пуповины опорожняется и спадает благодаря отрицательному давлению и поэтому условия размножения в ней для микробов менее благоприятны. В настоящее время локализация септического очага изменилась в сторону преобладания флебита над артериитом из-за врачебных манипуляций на пупочной вене, причем катетеризация ее приводит, как правило, к тромбозу у конца стояния катетера, что соответствует отрезку пупочной вены на уровне ворот печени с развитием именно здесь тромбофлебита.
Чистый омфалит как септический очаг встречается, как и раньше, редко. Чаще имеет место его сочетание с флебитом или артериитом.
Пупочная рана гиперемирована, отечна, нередко с обильным гнойным экссудатом. Прямые и косвенные признаки поражения пупочных сосудов проявляются также в виде расширения венозной сети верхнего отдела брюшной стенки, отечности нижней части живота и надлобковой области, увеличения паховых лимфоузлов. Кожа приобретает землистый оттенок, а иногда развивается затяжная желтуха. Причиной смерти больных пупочным сепсисом чаще всего является интоксикация. При продуктивном тромбофлебите пупочной или воротной вен наблюдается более поздняя смерть (до 2-6 или более месяцев). Наиболее частыми проявлениями пупочного сепсиса являются изменения в легких в виде мелкоочаговой и интерстициональной пневмонии, абсцедирующей и сливной пневмонии, гнойного и фибринозного плевритов, пиопневмоторакса. Реже встречаются изменения желудочно-кишечного тракта и брюшной полости: язвенный колит, язвенный энтероколит, катаральный колит, катаральный энтерит, гнойный перитонит, фибринозный перитонит. При пупочном сепсисе вовлечение кишечника в патологический процесс возникает вследствие перехода воспаления с пораженных пупочных сосудов сначала на париетальную, а затем на висцеральную брюшину. Стафилококковый энтероколит у больных пупочным сепсисом является вторичным и развивается обычно в связи с дисбактериозом кишечника. Среди других проявлений пупочного сепсиса может наблюдаться изменение кожи, характеризующееся различными гнойничковыми поражениями; остеомиелит; перикардит; менингит; флегмона средостения; метастатические гнойники в печени, которые образовались при локализации первичного септического очага в пупочной вене; также метастатические гнойники в головном мозге, надпочечниках, почках.
Большую диагностическую ценность имеет обнаружение в интерстиции паренхиматозных органов - печени, почек, миокарда миелоидных инфильтратов, состоящих преимущественно из незрелых элементов миелоидного ряда. Миелоз пульпы селезенки, лимфатических узлов, вилочковой железы является свидетельством наиболее древнего неспецифического иммунного ответа организма на возбудитель. В паренхиматозных органах набюдаются значительные дистрофические изменения вплоть до мелких фокусов некроза или гибели отдельных клеток нефротелия, гепатоцитов, кардиомиоцитов. При исследовании микроциркуляторного русла в органах можно обнаружить васкулиты с микробными эмболами. В головном мозге - отек, набухание, дистрофические изменения нейронов.
Если у больного развертывается клиническая картина бактериального шока, в микроциркуляторном русле обнаруживаются стазы, сладжы и фибриновые тромбы. Васкулиты и ДВС-синдром, вызывающие повышение сосудистой проницаемости и коагулопатию потребления, считаются причиной геморрагий тканей и органов.
Септический шок.
Основными макроскопическими признаками септического шока являются изменения почек (ишемия коркового слоя и резкое полнокровие мозговых пирамид) и легких (увеличение в массе и объеме, полнокровие и отек). При гистологическом исследовании наблюдается неравномерность кровенаполнения тканей различных органов с малокровием в одних участках и переполнением кровью сосудов в других. В последнем случае часто отмечаются явления сладжа. Примерно в половине наблюдений септического шока развиваются нарушения гемокоагуляции в виде диссеминированного внутрисосудистого свертывания крови (ДВС), сменяемого гипокоагуляцией и фибринолизом. При этом в кровеносных сосудах различных органов выявляются фибриновые, эритроцитарные, лейкоцитарные и смешанные мелкие рассеянные тромбы. Однако при поздних вскрытиях может происходить посмертный лизис данных тромбов. Часто ДВС сопровождается мегакариоцитозом, хорошо обнаруживаемым в капиллярах легких.
Характерным для ДВС-синдрома является наличие мелких некрозов в тканях и органах (вследствие тромбоза) и язв в желудочно-кишечном тракте, а также различных по величине кровоизлияний и кровотечений в серозные полости, просвет полых органов. К наиболее тяжёлым проявлениям ДВС-синдрома относят некроз трабекулярного слоя и апоплексию надпочечников, кортикальный некроз почек, некроз аденогипофиза, эрозивно-язвенные поражения желудка, дистелектазы в легких.
ЗАДАНИЯ ДЛЯ САМОПОДГОТОВКИ И УИРС
Реферативные доклады по темам:
2. Струков А.И., Серов В.В. Патологическая анатомия. - М.: Медицина, 1995.
1. Ивановская Т.Е. Патологическая анатомия болезней плода и ребенка. - М.: Медицина, 1989.
2. Цинзерлинг А.В. Современные инфекции, патологическая анатомия и вопросы патогенеза. - Санкт-Петербург: СОТИС, 1993.
3. Тепляков В.Р., Шимкевич Л.Л. Морфологические изменения внутренних органов при экспериментальном стафилококковом сепсисе. // Архив патологии. - № 2. - 1987. - С. 32-32.
4. Смольянников А.В., Саркисов Д.С. Современное состояние проблемы патогенеза сепсиса. //Архив патологии. - № 3. - 1982. - С. 3-13.
5. Серов В.В., Буткевич О.М. и др. Клинико-морфологический анализ септического (инфекционного) эндокардита. //Архив патологии. - № 3. - 1982. - С. 27-34.
6. Ивановская Т.Е., Кипарисова Е.Л. Особенности совеременного сепсиса у детей. //Архив патологии. - № 3. - 1982. - С. 48-54.
7. Пермяков Н.К., Галанкина И.Е. и др. Бактериальный шок. //Архив патологии. - № 3. - 1982. - С. 19-27.
Читайте также:


