Патологоанатомическая диагностика инфекционных животных
Цель занятия: изучить основные правила отбора и пересылки патологического материала для лабораторного исследования, а также оформление сопроводительных документов.
Оборудование: секционный набор, спецодежда, металлические шпатели, консерванты [30%-й раствор химически чистого глицерина на стерильном физиологическом растворе: фосфатно-солевой буферный раствор (рН 7,6), 10%-й раствор формалина или 96%-й этиловый спирт], дезинфектанты (3. 5%-й раствор карболовой кислоты, хлорная известь или 10%-й раствор гидроксида натрия), термос со льдом, стерильные пробирки и флаконы с пробками, предметные стекла, спиртовка, стеклограф или водоустойчивый фломастер, пленка, пергаментная бумага, шпагат, пеналы, деревянный ящик, стеклянные банки, суртуч, парафин, пастеровские пипетки.
Отбор материала для прижизненной диагностики. В зависимости от вида инфекции у клинически больных животных берут соответствующий, специфический для данной болезни материал, соблюдая меры личной безопасности.
Секрет молочных желез служит объектом исследования при тех заболеваниях, при которых возбудитель активно выделяется с молоком (туберкулез, бруцеллез, сальмонеллез, мастит). У коров вымя обмывают теплой водой с мылом, соски обрабатывают 70%-м спиртом, первые струйки молока сдаивают, в стерильные сосуды набирают 15..20 мл секрета из первой и последней порций, полученных при выдаивании.
У овец и коз пробы получают путем пункции цистерны вымени. Поле операции готовят у основания соска, стерильной иглой, соединённой со шприцем, делают пункцию, набирают в шприц секрет и переносят его в стерильные пробирки с резиновыми пробками.
Моча чаще всего служит объектом исследования при подозрении на лептоспироз. У коров и свиноматок мочу можно брать непосредственно из мочевого пузыря с помощью катетера или собирать, при естественном мочеиспускании в чистые пробирки, банки. Легче всего мочу получать после утреннего подъема животных, и у свиней — в любое время дня после 1. 2-часового лежания.
Кал берут из прямой кишки в стерильную посуду, которую накрывают плотной крышкой. При обнаружении на стенке прямой кишки слизи, утолщений или других патологических изменений дополнительно делают соскобы; их помещают в отдельную посуду.
Выделения из верхних дыхательных путей и ротовой полости собирают в посуду при естественном истечении или поступают так: крылья носа и переднюю часть носовых ходов обмывают водой, после чего выделения собирают стерильными тампонами из глубоких частей носа. Тампоны помешают в стерильные пробирки, содержащие по 0,5 мл стерильного физиологического раствора.
Содержимое синовиальных бурс и абсцессов берут следующим образом. Шерсть выстригают, кожный покров обрабатывают 70%-м спиртом и смазывают настойкой йода. Затем стерильным шприцем с иглой большого диаметра делают пункцию и переносят пунктат в стерильную пробирку с резиновой пробкой.
Материал из язв и ран получают методом соскоба на границе пораженной и здоровой тканей.
Волосы и участки кожи исследуют при кожных заболеваниях. При этом волосы выщипывают, а соскобы с кожи делают скальпелем на границе пораженной и здоровой тканей.
Кровь для серологических исследований берут в разгар заболевания, а в некоторых случаях повторно через 10. 20 дней по 10 мл от двух-трех больных животных в разные пробирки.
Отбор материала для посмертной диагностики. Патологический материал необходимо взять как можно раньше: не позднее 12 ч после гибели животного зимой и 6 ч — в теплое время года, законсервировать или отправить в свежем виде. Аутолизированный патматериал для выделения возбудителя непригоден.
Для бактериологического исследования в лабораторию отправляют кусочки кожи, слизистых оболочек, паренхиматозных органов, трубчатую кость, спинной и головной мозг, лимфатические узлы, пробы жидкости из грудной и брюшной полостей, отрезок кишечника, изолированный лигатурами, плод, плодные оболочки и т. д. Пробы из каждого органа помещают в отдельную посуду и маркируют. В каждом случае необходимо брать тот материал, в котором можно обнаружить характерные для данной болезни изменения.
Для вирусологического исследования материалом могут служить; кровь или ее сыворотка, смывы из носоглотки и другие жидкости организма, стенки и содержимое афт, папулы (узелки), везикулы (серозные пузырьки), пустулы (гнойные пузырьки), кусочки головного мозга, печени, легких, селезенки или кусочки других органов и тканей, в которых вирус предполагаемого заболевания содержится в наибольшем количестве.
Для гистологического исследования патматериал берут только от свежих трупов. В лабораторию отправляют кусочки площадью 3. 4 см 2 , толщиной не более 1 см, при этом следят, чтобы в них вошли пораженные и граничащие с ними неизмененные участки ткани.
Поверхность органа или ткани трупа на участке, из которого предполагают брать пробу, очищают от загрязнений, обеззараживают спиртом, 3%-м раствором фенола или прижигают нагретой металлической пластинкой (шпателем). Материал берут стерильными инструментами и помещают в стерильную посуду (пенициллиновые флаконы, пробирки и другие стеклянные сосуды с резиновыми пробками). Жидкий патматериал (кровь, слизь, мочу, желчь и т.д.) можно набирать в одноразовые шприцы или пастеровские пипетки, которые затем с обоих концов запаивают. Кроме того, различные выделения можно посылать в виде мазков или мазков-отпечатков, которые фиксируют на воздухе, заворачивают каждый в отдельности в пергаментную бумагу и маркируют.
Трупы мелких животных, части трупов крупных животных и отдельные органы в свежем виде направляют для исследования в лабораторию только нарочным. Посылаемый материал тщательно упаковывают в плотный деревянный или металлический ящик, чтобы предупредить рассеивание возбудителя по пути следования.
Консервирование патологического материала. Полученные пробы отправляют в лабораторию в свежем виде; если невозможно отправить в течение ближайших 24. 30 ч, то их фиксируют в консерванте.
Патматериал для гистологического исследования консервируют 10%-м водным раствором формалина или 96%-м этиловым спиртом. Объем консерванта должен в 10 раз превышать объем взятого материала.
Материал, предназначенный для бактериологического исследования, фиксируют 30%-м химически чистым глицерином (лучше на физиологическом растворе) или вазелиновым маслом. Соотношение патматериала и консерванта 1:4 или 1:5. Трубчатую кость и кишечник обычно консервируют поваренной солью.
Для вирусологического исследования материал консервируют 30. 50%-м глицерином на стерильном физиологическом растворе. Наилучший и простой метод сохранения биологических свойств вирусов в патматериале — охлаждение. Надежно закрытые флаконы заворачивают в вату или упаковочную бумагу и плотно укладывают в термос, заполненный на 1/3 снегом или льдом. При этом в термосе в течение 12. 24ч удерживается температура 2…6°С, при которой вирусы сохраняются практически без изменений.
Оформление документов на отправляемый материал. На взятый цитологический материал ветеринарный врач составляет сопроводительный документ (форма 3). В документе необходимо указать также эпизоотическую ситуацию хозяйства, лечили животное или нет; если лечили, то какими препаратами, как законсервирован материал; число отправленных упаковок с пробами.
При этом направляется для__________________________________
патологический материал (перечислить какой) __________________
(вид и возраст животного) (название хозяйства, фермы)
Дата заболевания животного _________________________________
Данные патологоанатомического вскрытия _____________________
Дата отправления материала_________________________________
[youtube.player]ДИАГНОСТИКА ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
Методы диагностики. Чтобы распознать инфекционную болезнь и выявить больных животных, проводят клинический осмотр, аллергические, серологические, микроскопические, бактериологические исследования, биологическую пробу и патологоанатомпческие вскрытия.
Клиническому осмотру подвергают все поголовье животных в хозяйстве, где появилось заболевание. Животных с явно выраженными ь неясными клиническими признаками выделяют для уточнения диагноза.
Аллергические исследования заключаются в введении в организм животного (на конъюнктиву глаза, подкожно или внутрикожно) специфических препаратов, вызывающих у больного животного характерную реакцию. Имеются препараты для выявления лошадей, больных сапом (маллеин), животных, больных туберкулезом (туберкулин), бруцеллезом (бруцеллизат) и другие. Эти препараты называются аллергенами. При введении двух-трех капель маллеина в глаз больной сапом лошади у нее через несколько часов начинается слезотечение из этого глаза, с выделением гноя. У здоровой лошади такой реакции не наблюдается.
Серологическим исследованием называется исследование сыворотки крови животных, позволяющее выявить зараженных животных. В ветеринарной практике широко применяют исследование сыворотки крови по реакции агглютинации (РА) и реакции связывания комплемента (РСК).
Микроскопическому исследованию подвергают мазки крови или отпечатки из органов животных. При этом удается увидеть возбудителей болезни под микроскопом. Бактериологическим исследованием выделяют из органов павшего животного культуру возбудителя болезни посевами зараженного материала на специальные питательные среды. Биологическая проба позволяет воспроизвести заболевание у здоровых животных заражением их материалом, взятым от больного животного, или культурой возбудителя.
Патологоанатомическое вскрытие трупа животного нередко помогает подтвердить прижизненный диагноз. Иногда кусочки органов посылают в лабораторию для гистологического исследования, т. е. исследования под микроскопом ткани, ее характера и строения.
Взятие и пересылка материала для исследования на инфекционные болезни. Взятие патологического материала. Патологический материал берут в стерильную посуду стерильным инструментом, строго соблюдая меры личной предосторожности. Место на трупе или органе, от которых необходимо взять материал на исследование, прижигают горячей металлической пластиной (шпателем).
Жидкий материал - кровь, желчь, мочу, эксудат, слизь, гной и пр. - насасывают в тоЕпше стеклянные пастеровские пипетки, которые запаивают с обоих концов. Его можно также взять стерильным шприцем с иглой в стерильный флакон или стерильную пробирку с плотной резиновой или корковой пробкой, залив ее сверху расплавленным парафином пли воском. Тот же материал, но для микроскопического исследования наносят тонким слоем на чистое предметное, предварительно обезжиренное и профламбированное на огне стекло, которое затем подсушивают на воздухе; стекла связывают попарно мазками внутрь, вложив между ними перекладины из спичек. Вместо предметного можно использовать кусочек оконного стекла, чисто вымыв его в теплом 2-3%-ном растворе питьевой соды и обезжирив в спирте с эфиром или в бензине. Такое стекло высушивают на воздухе и обжигают пламенем спиртовки, после чего на него наносят тонким слоем подлежащий исследованию материал,
Гной из глубоких полостей берут стерильным ватным тампоном на кусочке тонкой проволоки или на небольшой деревянной палочке, вделанной в ватную пробку стерильной пробирки. ,
Гной из невскрывшихся глубоких абсцессов берут проколом стенки абсцесса тонкой, длинной иглой, в стерильный 5-20-граммовый шприц. Затем гной сливают через эту же иглу в стерильную пробирку (или флакон), плотно закрыв ее стерильной ватной или корковой пробкой и залив сверху расплавленным парафином или воском. Место прокола предварительно выстригают и дезинфицируют, после взятия гноя .смазывают настойкой йода.
Кал берут из прямой кишки в небольшом количестве в стерильные пробирки или в такие же стеклянные баночки, плотно закрывающиеся пробками.
Мочу у большинства животных берут через катетер в стерильные флакончики емкостью 100-200 мл. Ее можно взять и без катетера, массажируя рукой мочевой пузырь через прямую кишку и вызывая этим мочеиспускание.
Для исследования на бешенство берут аммоновы рога, а на болезнь Ауески - продолговатый мозг. Их кладут в стерильные баночки и консервируют: для бактериологического исследования - 33%-ным водным раствором глицерина, для гистологического исследования - 10%-ным водным раствором формалина.
Если невозможно вскрыть черепную коробку с соблюдением всех мер предосторожности, в лабораторию посылают голову, целиком отделив ее от трупа. Отпрепарированную голову необходимо завернуть в марлю, пропитанную дезинфицирующим раствором, а затем в пергамент или клеенку, запаковать в плотный ящик и срочно отправить с нарочным в ветеринарную лабораторию. Руки необходимо защитить резиновыми перчатками или брезентовыми (кожаными) рукавицами и после этой работы вымыть и тщательно продезинфицировать, помня, что в слюне бешеных животных содержится вирус.
Внутренние органы - сердце, легкие, печень, селезенку, почки, лимфатические узлы, желудок, а также пораженные мышцы и др. ткани - для бактериологического и гистологического исследования берут маленькими кусочками в местах с наиболее типическим поражением на границе со здоровой тканью в стерильные баночки с плотно притертыми пробками. Части пораженного желудка, кишечника или кусочки некротизированных тканей вначале обмывают водой, затем просушивают ватными тампонами и также помещают в стерильные баночки.
Материал, взятый для бактериологического исследования в зимнее время, не консервируют, в теплое же время года заливают 33%-ным водным раствором глицерина; для гистологического исследования - 10%-ным водным раствором формалина.
Материал не следует консервировать при быстрой доставке его в лабораторию. Банки с материалом герметически закупоривают пробками, закрепляя их тонкой проволокой или шпагатом, а затем заливают сургучом или замазывают смесью воска с парафином.
Трубчатые кости отделяют от трупа, стремясь не повредить их концы, освобождают от мышц и сухожилий, заворачивают в марлю, смоченную раствором сулемы или фенола, и упаковывают в плотный ящик.
Ухо (для исследования па сибирскую язву) берут с той стороны, на которой лежал труп. Предварительно ухо перевязывают у основания в двух местах шпагатом и отрезают между перевязками. Участок кожи на трупе, где отрезано ухо, прижигают каленым железом. Отделенное ухо сначала заворачивают в марлю, смоченную раствором сулемы или фенола, а затем в пергаментную бумагу, после чего упаковывают в плотный ящик. Для проведения бактериологического исследования на сибирскую язву вместо уха можно послать кровь, взятую из него толстой иглой. Можно сделать небольшой, но глубокий надрез кожи, взять кровь и нанести ее толстыми мазками на несколько предметных стекол. Мазки высушивают на открытом воздухе и, не фиксируя их пламенем спиртовки, складывают на перекладинки спичек, затем заворачивают в пергамент и упаковывают в плотный ящик или коробку, в которой и отправляют с нарочным в лабораторию. Место надреза (или укола иглой) прижигают раскаленным железом.
Трупы поросят, ягнят, птиц, телят и жеребят, а также плоды абортировавших животных отправляют в лабораторию в целом виде в тех случаях, когда на месте невозможно стерильно взять материал.
Трупы и плоды животных предварительно обтирают и завертывают в мешковину, смоченную раствором фенола или креолина, а затем упаковывают в металлический или плотный деревянный ящик со стружками и опилками.
Пчелиный сот с погибшим расплодом заворачивают в пергамент или вощеную бумагу и плотно укладывают в деревянный * ящик на планки (чтобы сот не соприкасался с дном и крышкой ящика). Погибших пчел и маток пересылают в стеклянных, плотно закрывающихся баночках, наполненных медом.
Патологический материал пересылают в лабораторию с нарочным. Плотный материал (например, трубчатую кость) можно послать почтой, обеспечив надежную упаковку, исключающую возможность рассеивания инфекции. Верх посылки обозначают надписью. При подозрении на особо опасные инфекции (сибирская язва, сап, эмфизематозный карбункул, туляремия, бруцеллез, чума свиней и птиц, инфекционная анемия, инфекционный энцефаломиелит и бешенство) материал, взятый в стеклянную посуду, помещают в металлическую коробку, которую запаивают, пломбируют или опечатывают и упаковывают в деревянный ящик.
При отправке нарочным следует герметически упакованную посуду с патологическим материалом опечатать, завернуть в вату и уложить в деревянный ящик.
В лабораторию отправляют вместе с посылкой сопроводительный документ (направление), в котором указывают: 1) адрес лаборатории; 2) какой материал направляют для исследования и в чем он законсервирован; 3) от какого животного и кому оно принадлежит; 4) клинические признаки у больного животного; 5) основные патологоанатомические изменения, обнаруженные при вскрытии трупов на месте; 6) имеются ли еще в хозяйстве больные животные со сходными признаками (сколько); 7) предполагаемые причины падежа; 8) на какие заболевания необходимо произвести исследование. Сопроводительное письмо подписывает ветеринарный работник, направляющий материал. В письме указывают дату взятия и отправления материала.
Взятие крови для серологического исследования. Кровь животных берут стерильными иглами у лошадей, крупного рогатого скота, верблюдов и у других крупных животных, а также у овец, коз из яремной вены, у свиней - из копчика хвоста или из ушной вены. На месте взятия пробы шерсть выстригают и кожу протирают дезинфицирующим раствором или денатурированным спиртом. При взятии крови следят, чтобы капли ее не попали на землю; для этого на муфту иглы надевают небольшую резиновую трубку, конец которой опускают в пробирку. С этой же целью используют специальный прибор, в который с одного конца вставляют иглу, а с противоположной стороны - пробирку. Струю крови нужно направлять по стенке пробирки, чтобы избежать распада эритроцитов (гемолиза). Гемолизированная кровь для исследования непригодна.
Кровь, взятую зимой, сразу же ставят в теплое место для свертывания кровяного сгустка и отстаивания сыворотки. Кровь доставляют в лабораторию не позднее чем на 2-3-й день после ее взятия. Сохранять ее следует в темном и прохладном месте. В жаркую погоду при невозможности своевременной отправки крови для исследования ее необходимо консервировать 0,5%-ным раствором карболовой кристаллической кислоты на физиологическом (0,85?о-ном) растворе поваренной соли. С этой целью отстоявшуюся сыворотку крови пипеткой отсасывают и переносят в чистые пробирки, оставив в первоначальной пробирке кровяной сгусток. К 9 мл сыворотки крови добавляют 1 мл 5%-ного раствора карболовой кристаллической кислоты, пробирку тщательно встряхивают, плотно закрыв ватной пробкой. При малом количестве исследуемой сыворотки к 1 мл ее добавляют 0,1 мл указанного раствора карболовой кислоты. Консервированная сыворотка может сохраняться длительное время.
Пробирки с кровью упаковывают в вертикальном положении и отправляют в лабораторию с нарочным, предохраняя от замораживания и встряхивания. Гемолизированная, проросшая и покрытая сверху пленкой плесени кровь, а также помутневшая сыворотка давно взятой крови для серологического исследования непригодны.
На каждой пробирке с кровью ставят номер или кличку животного. Бумажную этикетку надписывают простым карандашом и прикрепляют ее резиновым колечком, плотно надетым на пробирку. Пробы с кровью направляют в сопровождении списка, составленного в 2 экземплярах. Одни из них с обозначением полученных результатов лаборатория возвращает лицу, направившему кровь на исследование.
[youtube.player]Радюк Екатерина Васильевна – врач-лаборант ИВЦ МВА
Инфекционные заболевания весьма часто встречаются в ветеринарной практике. Для владельца животного важно вовремя обратить внимание на симптомы недомогания питомца. Для большинства инфекционных заболеваний эти симптомы неспецифичны: угнетение, отказ от корма, повышенная температура тела, рвота, понос; при некоторых заболеваниях встречается хромота и опухание суставов; возможно изменение цвета мочи.
Для ветеринарного врача, к которому приводят заболевшее животное, важно составить список дифференциальных диагнозов и исключить (или подтвердить) их специальными методами диагностики. Однако стоит помнить, что выбор диагностического метода будет зависеть от вида возбудителя, его локализации и стадии заболевания. Методика, применимая для диагностики одной инфекции, совершенно неприемлема для диагностики другой.
В данной статье представлен обзор основных методов диагностики инфекционных заболеваний, которыми располагает современная ветеринарная медицина.
Возбудители многих заболеваний, как правило, достаточно требовательны к питательным средам и достаточно сложны для культивирования invitro. Не для всех возбудителей определены условия культивирования. В некоторых случаях используют синтетические или полусинтетические среды – однако при этом рост возбудителей очень медленный (до нескольких месяцев) и всегда присутствует значительный риск грибковой или бактериальной контаминации, несмотря строгое соблюдение асептики. Кроме того, проведение работ по культивированию возможно только в специализированных микробиологических лабораториях. Поэтому в ветеринарии данный метод не нашел широкого применения при диагностике инфекционных заболеваний; работы, связанные с культивированием возбудителей, проводятся, как правило, только в специальных исследовательских институтах с целью их более детального изучения и разработки диагностических тест-систем.
2. Световая микроскопия
1) Микроскопия фиксированных окрашенных препаратов
Является наиболее доступным и потому распространенным методом диагностики инфекционных (особенно трансмиссивных) заболеваний в ветеринарной медицине. Основан на выявлении возбудителя в клиническом материале по характерной морфологии. Однако, несмотря на свою простоту и доступность, у этого метода есть свои недостатки.
Во-первых, у метода световой микроскопии достаточно ограниченная чувствительность. При незначительном количестве возбудителей в материале результат микроскопии может быть отрицательным.
Во-вторых, необходимо тщательное приготовление и окраска мазков для минимизации возможных артефактов.
В-третьих, лаборанту или врачу, интерпретирующему мазок, требуется достаточный опыт и хорошее знание морфологии как клеток тканей, так и возбудителей и умение отличать последних от возможных рефракционных артефактов или преципитатов красителя. И, в-четвертых, точное определение вида возбудителя при использовании только световой микроскопии возможно далеко не всегда. Поэтому световую микроскопию стараются дополнять другими методами диагностики, основанными на обнаружении специфических антител либо генетического материала возбудителя.
2)Темнопольная микроскопия
Вид оптической микроскопии, в которой контраст изображения увеличивают за счет регистрации только света, рассеянного изучаемым образцом. Как правило, используется для обнаружения спирохет - боррелий и лептоспир. Из-за необходимости наличия специального оборудования в рутинной ветеринарной практике применяется редко. Кроме того, с помощью темнопольной микроскопии невозможно определить видовую принадлежность возбудителя и его патогенность.
3. Полимеразная цепная реакция (ПЦР)
Полимеразная цепная реакция (ПЦР) – это метод ферментативного получения ампликонов (большого количества копий) исследуемых фрагментов ДНК путем повторных циклов репликации и денатурации (разделения цепи ДНК на отдельные нити); при этом происходит копирование только исследуемого участка ДНК (при условии его присутствия в данном образце), поскольку только этот участок соответствует заданным условиям.
Метод ПЦР идеально подходит для обнаружения микроорганизмов, трудно визуализирующихся, медленно растущих или сложных в культивировании. ПЦР является наиболее предпочтительным методом для диагностики заболевания в острый период. Основным лимитирующим фактором при использовании ПЦР является содержание в исследуемой пробе достаточного количества материала (нуклеиновой кислоты возбудителя). Для многих возбудителей известно, что их количество в крови меняется с течением времени; таким образом, в какой-то момент времени ПЦР может показать ложноотрицательный результат у инфицированного пациента. Таким образом, для врача крайне важно знать тропность возбудителя к тканям организма и отправлять на исследование тот материал, в котором вероятность обнаружения возбудителя наиболее высока (например, мочу – при диагностике лептоспироза, плаценту или пунктат семенников при подозрении на бруцеллез, синовиальную жидкость - при исследовании на боррелиоз).
4. Серологические методы диагностики
Данные методы основаны на выявлении у животных специфических антител. Заражение инфекционным агентом, если оно происходит впервые, в течение недели вызывает у животного умеренный рост иммуноглобулинов класса М (IgM) и постепенное увеличение иммуноглобулинов класса G (IgG), которое достигает пика через 14 дней. Определение уровня антител у животных с остро начинающимся заболеванием (таким как бабезиоз) дает мало полезной диагностической информации. Для диагностики хронических заболеваний (например, моноцитарного эрлихиоза) измерение уровня антител будет более полезным.
Продукция антител у каждого животного может сильно варьироваться; этот процесс зависит от возраста, иммунного статуса и генетической принадлежности. Лучший способ оценки степени сероконверсии заключается в исследовании парных сывороток, взятых с интервалом в 2-3 недели. Растущий титр антител указывают на недавнюю и, следовательно, клинически значимую инфекцию, особенно если это подтверждается соответствующими клиническими признаками. Альтернативным методом определения недавней инфекции является измерение уровня IgM, однако в ветеринарной практике данный метод практически не используется.
1) Твердофазный иммуноферментный анализ (ИФА, ELISA)
Принцип метода заключается в том, один их специфических реагентов (антиген) иммобилизуют на твердой фазе. Затем последовательно добавляют другие специфические реагенты, проводя после инкубации каждого из них промывку с целью удаления несвязавшихся компонентов. Один из специфических реагентов, так называемый конъюгат, содержит ферментную метку. Для визуализации результата в конце реакции добавляют хромогеновый субстрат. Через определенный промежуток времени реакцию останавливают и проводят считывание на спектрофотометре.
Для определения титра антител в сыворотке готовят несколько последовательных разведений; титр антител определяется как обратный последнему видимому разведению (к примеру, если последнее разведение было 1:2000, то титр антител составит 2000). Метод твердофазного ИФА является наиболее предпочтительным для определения наличия антител к возбудителям, антигены которых легкодоступны (т.е. это либо легко культивируемые микроорганизмы, либо те, для которых получены рекомбинантные антигены). Кроме того, он может использоваться и для выявления антигенов возбудителя – например при диагностике инвазии Dirofilariaimmitisили вируса лейкемии кошек.
Для использования полноценного твердофазного иммуноферментного анализа необходимо наличие специального лабораторного оборудования. Однако существует экспресс-модификация ИФА (SNAP, IDEXX Laboratories), где антиген/антитела иммобилизированы не на плашке, а на мембранном фильтре. Эти тесты широко используются в клиниках для диагностики трансмиссивных заболеваний (лейшманиоза, дирофиляриоза, анаплазмоза, эрлихиоза и боррелиоза). Однако они не дают возможность зафиксировать рост или снижение титра антител, а также определить их принадлежность к M или G классу.
2) Метод флюоресцирующих антител (МФА, IFA)
В случае, когда культивирование микроорганизма сопряжено с техническими сложностями либо небезопасно, применяют метод иммунофлюоресценции. При этом может быть обнаружен как сам организм в зараженных клетках и тканях пациента (прямой МФА) либо наличие в сыворотке специфичных антител (непрямой МФА). В непрямом МФА зараженные клетки (как правило, культурального происхождения) зафиксированы на предметных стеклах либо планшетках. Сама процедура исследования схожа с таковой в ИФА. Однако в конъюгате вместо фермента здесь используется специальный краситель, дающий при определенной длине волны флюоресцентное свечение, которое можно видеть в специальный микроскоп. Количество антител также определяется по последнему разведению, давшему положительный результат.
Прямой МФА считается менее чувствительным; используется в тех случаях, когда число зараженных клеток невелико (например, для выявления в мазках крови морул Anaplasmaphagocytophilum).
3) Иммуноблот (вестерн-блот)
Таким образом, в статье были рассмотрены основные методы, применяемые сегодня для диагностики инфекционных заболеваний животных. Особое внимание хотелось бы уделить тому, что не существует какого-либо универсального метода для диагностики того или иного заболевания. Поэтому от врача при постановке диагноза требуется комплексный подход; необходимо учитывать анамнез, длительность заболевания, клинические признаки и данные общих лабораторных исследований.
Кроме того, необходимо умение правильно интерпретировать результаты – ведь даже обнаружение антител (особенно класса G) к тому или иному возбудителю не говорит о том, что именно этот этиологический агент является причиной нынешнего состояния животного. Только грамотное применение и интерпретация специальных методов исследования (не только при диагностике трансмиссивных заболеваний) в сочетании с клинической картиной дает возможность правильно поставить диагноз и назначить адекватное лечение.
[youtube.player]Микроскопия (световая, люминесцентная)
Микроскопия (люминесцентная, световая, электронная)
Выделение вируса биопроба
Гематологический
Примечание. Для каждой болезни существует перечень показателей, по которым диагноз считают установленным.
Благодаря правильному и своевременному диагнозу удается обеспечить эффективность оздоровительных мероприятий, т. е. быстро купировать возникший эпизоотический очаг и предупредить дальнейшее распространение болезни.
Эпизоотологический метод. Представляет собой систему изучения проявлений эпизоотического процесса. Для характеристики последнего необходимо собрать точную информацию о восприимчивых видах, источнике и резервуаре возбудителя болезни, механизме его передачи, воротах инфекции, интенсивности проявления эпизоотического процесса, сезонности, предрасполагающих факторах, заболеваемости, смертности, летальности. Кроме того, особое внимание обращают на факторы, определяющие пути дальнейшего распространения заболевания — выполнение противоэпизоотических мероприятий и условия внешней среды.
Чтобы охарактеризовать эпизоотическое состояние хозяйства, сопоставляют и оценивают обобщенные эпизоотологические показатели, получаемые путем статистической обработки данных первичного учета заболеваний и профилактических мероприятий.
Клинический метод. При клиническом исследовании животных, подозреваемых в заболевании инфекционной болезнью, необходимо всегда строго соблюдать правила работы, предусмотренные соответствующей инструкцией.
Клиническое исследование рекомендуют начинать с измерения температуры тела животного. Далее осматривают животное в нефиксированном состоянии: обращают внимание на положение тела реакцию на различные раздражители, прием корма и воды, характер фекалий, особенности дефекации и мочеиспускания. Затем приступают к исследованию отдельных систем и органов по схеме, общепринятой в клинической диагностике болезней.
Клинические признаки инфекционной болезни зависят от многих факторов: вида и локализации возбудителя, течения, формы проявления и стадии болезни, резистентности организма и других причин. Во всех случаях клинические признаки одной и той же инфекционной болезни у животных даже одного вида сильно варьируют.
Патоморфологический метод. Включает в себя патологоанатомический и гистологический методы исследований. Патологоанатомический метод считают важным, но не всегда окончательным методом диагностики. Например, если при вскрытии трупа животного (птицы) отмечают характерные изменения — туберкулы, то сразу же диагностируют туберкулез, при обнаружении в селезенке свиньи краевых геморрагических инфарктов — чуму, кровоизлияний на границе мышечного и железистого желудка у кур — болезнь Ньюкасла и т. д.
Порядок патологоанатомического исследования: оценивают состояние трупа, кожи и слизистых оболочек, затем исследуют лимфатическую систему, серозные покровы, мышцы и суставы, органы дыхания, сердце и кровеносные сосуды, печень, селезенку, почки, глотку, пищевод, желудок, тонкий кишечник, толстый кишечник, мочевой пузырь, органы воспроизводства, головной и спинной мозг.
Однако во многих случаях наряду с патологоанатомическим применяют и метод лабораторных исследований (гистологических, бактериологических и др.). С помощью гистологического метода устанавливают точный диагноз при таких болезнях, как - бешенство (тельца Бабеша—Негри), ринопневмония (внутриядерные включения типа Коудри), оспа (тельца-включения).
Бактериологический метод. Это ценный метод диагностики инфекционных болезней. Для бактериологического исследования от больных или павших животных необходимо правильно взять патологический материал и грамотно оформить сопроводительный документ. Поступивший биоматериал обрабатывают в зависимости от предполагаемой болезни, делают мазки-отпечатки, красят их соответствующими методами, выделяют чистую культуру посевом на питательные (элективные) среды, заражают чувствительных лабораторных животных биоматериалом или выделенной чистой культурой (табл.1).
1. Бактериологический метод диагностики некоторых инфекционных болезней
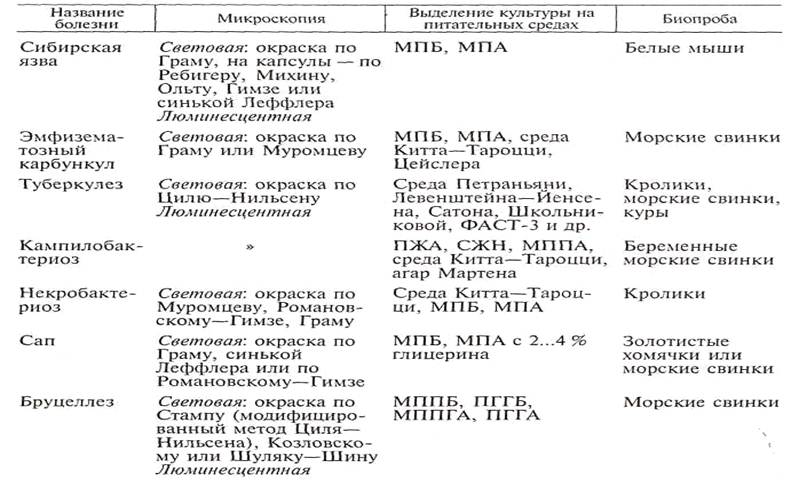
На основании обнаружения патогенных микроорганизмов в поступившем материале устанавливают этиологический диагноз.
Вирусологический метод. Для вирусологического исследования в лабораторию направляют патологический материал от больных животных, взятый в период проявления у них клинических признаков (температурная реакция, угнетение, воспалительные процессы в верхних дыхательных путях, сопровождающиеся серозными или слизистыми истечениями из носовой полости, диарея, образование везикул, афт, иногда аборты), или вынужденно убитых (павших) животных, взятый не позднее чем через 2 ч после их гибели. Вирусологический метод диагностики включает в себя: обнаружение возбудителя в патологическом материале различными методами (электронная, люминесцентная или световая микроскопия, заражение культуры клеток, лабораторных животных и т. д.), выделение и идентификацию вируса в различных серологических реакциях, биопробу.
Гематологический метод. В лабораторию для гематологического исследования отправляют кровь, которую берут с соблюдением правил асептики из яремной вены в пробирки с антикоагулянтом— 10 %-м раствором трилона Б, гепарина, цитрата натрия из расчета 0,02 мл раствора на 1 мл крови.
Гематологический метод используют как вспомогательный, а при некоторых инфекционных болезнях (лейкоз крупного рогатого скота, инфекционная анемия лошадей) — в качестве основного метода диагностики. При лейкозе крупного рогатого скота диагноз основан на обнаружении в периферической крови повышения содержания лейкоцитов основного лимфоидного ряда в 1-10-3 мл крови, а при инфекционной анемии лошадей — на основании снижения содержания эритроцитов в 1 • 103 мл крови, гемоглобина и замедленной скорости оседания эритроцитов (СОЭ).
Иммунологический метод. Включает в себя серологическую диагностику — в лаборатории исследуют сыворотки крови для обнаружения антител и аллергическую пробу, с помощью которой в хозяйствах выявляют животных, больных туберкулезом, паратуберкулезом, бруцеллезом, сапом, реже — сибирской язвой, листериозом, туляремией.
[youtube.player]Читайте также:


