Перелом костей у недоношенных
У недоношенных детей после рождения скорость минерализации костей скелета замедлена по сравнению с таковой во внутриутробном периоде, подобно тому как замедляется во внеутробном периоде скорость роста. Наиболее тяжелое осложнение указанной патологии — переломы костей. Чаще всего отмечаются переломы ребер, но переломы длинных трубчатых костей встречаются редко.
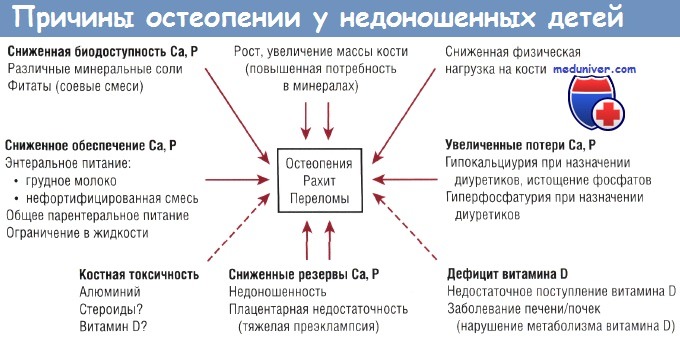
Остеопения/рахит отмечается практически у каждого недоношенного ребенка, родившегося с массой тела менее 1500 г. Наиболее тяжелые по состоянию недоношенные дети имеют наиболее выраженную остеопению. Таким образом, частота возникновения рахита (иногда переломов костей) в целом обратно пропорциональна массе тела при рождении. Если тщательно проанализировать результаты рентгенографии, то частота переломов у недоношенных детей колеблется от 20 до 32%. У детей, имеющих массу тела при рождении менее 1000 г, она возрастает до 50-60%.
Описания гистологических изменений при данной патологии немногочисленны. Считается, что ее этиология предполагает участие многих факторов. Как уже было указано ранее, наиболее значимым фактором являются ограниченные запасы кальция (и фосфора) в костной ткани при рождении, а также сниженная скорость минерализации кости по сравнению с внутриутробным периодом.
Остеопения отмечается даже в тех случаях, когда недоношенные дети в качестве питания получают специально разработанные для младенцев с ОНМТ смеси с высоким содержанием минералов или фортификаторы грудного молока.
В опубликованных в последнее время обзорах есть доказательства роли сниженной нагрузки на кость в возникновении остеопении недоношенных. У данной категории младенцев нагрузка на кость ограничена выполнением пассивных или активных мышечных движений. Увеличение нагрузки на кость (например, в виде пассивных движений с вовлечением в работу суставов) способствует формированию костной ткани, в то время как снижение нагрузки (уменьшение физической активности) ведет к резорбции кости.
Две линии доказательств указывают на важность нагрузки на кость у недоношенных детей. Во-первых, было выявлено повышение уровня биохимических маркеров резорбции кости у недоношенных детей (гидроксипролина, телопептида коллагена типа 1, щелочной фосфатазы). Во-вторых, исследования показали, что внедрение программ, стимулирующих пассивную физическую нагрузку у недоношенных детей, улучшает параметры минерализации костной ткани. Удивительно, но программы пассивных упражнений показали свою эффективность, даже если применяли кратковременные упражнения (5-10 мин/сут).
Поскольку опора на ноги в этом возрасте не столь значима, те очевидные симптомы рахита, которые проявляются искривлением нижних конечностей у детей старшего возраста, не имеют клинического значения.
В большинстве случаев остеопению диагностируют при проведении рутинной рентгенографии, когда выявляют выраженную гипо-минерализацию или признаки произошедших ранее переломов ребер. В случае более тяжелых форм заболевания на стандартных рентгенограммах костей запястья и коленей могут быть видны классические признаки рахита, но обычно они не заметны до двухмесячного возраста ребенка.
Следует указать, что стандартная рентгенография не способна выявить сниженную минерализацию костной ткани до того момента, пока не произойдет потеря 30-40% минерального состава костной ткани. Для проведения в исследовательских целях диагностики костных изменений у недоношенных детей более подходящими считают технологии, обладающие специфической чувствительностью, такие как одиночная фотонная абсорбциометрия, двойная энергетическая рентген-абсорбциометрия, количественная компьютерная томография и трансмиссионная ультразвуковая диагностика.
Для диагностики остеопении недоношенных применяют ряд биохимических маркеров сыворотки крови. Они включают кальций, фосфор, щелочную фосфатазу, паратиреоидный гормон, 25(OH)D, l,25(OH)2D и остеокальцин. Исследуя мочу, можно оценить фракционную экскрецию кальция и тубулярную реабсорбцию фосфата, а также отношение кальций/креатинин. Низкую концентрацию фосфора в сыворотке (менее 45 мг/л) можно считать наилучшим индикатором дефицита минералов у данной категории детей.
Согласно рекомендациям Комитета по питанию Американской академии педиатрии (American Academy of Pediatrics Committee on Nutrition) и некоторых других организаций, в США и Канаде младенцам с ОНМТ, имеющим остеопению, не рекомендуют назначение суточной дозы витамина D более 200-400 ME.
Высокие концентрации l,25(OH)2D и нормальные уровни 25(OH)D практически у всех детей, имеющих указанную патологию, подтверждают правильность упомянутых рекомендаций; детям с ОНМТ не следует назначать в качестве питания продукты, содержащие неадекватное количество кальция и фосфора, например нефортифицированное грудное молоко. Увеличение суточной дозы витамина D до 960 ME и выше не подтвердило эффективности. Потребности в витамине D при парентеральном его введении еще менее ясны.
Впрочем, при использовании современных мультивитаминных препаратов для парентерального введения сложно превысить суточную дозу витамина D 400 ME, не вызывая одновременно передозировки других витаминов-компонентов комплексного препарата. Тем не менее недоношенные дети, длительно получающие полное парентеральное питание, имеют адекватный статус по витамину D даже при получении его в дозе 30-35 МЕ/кг/сут.
Несмотря на то что получены доказательства пользы физической нагрузки (при выполнении пассивных мышечных движений), наиболее важным компонентом профилактики и лечения остается адекватное обеспечение ребенка кальцием и фосфором, без которого любые физические нагрузки на кость будут неэффективными. Вполне логично, что при расчете необходимой дозы минералов преследуют цель достижения скорости минерализации кости, характерной для таковой у плода.
Для этого ребенку необходимо получать энтеральным путем кальций в дозе примерно 200 мг/кг/сут и фосфор в дозе 90 мг/кг/сут, принимая во внимание, что усваивается только 65% кальция (в лучшем случае) и 80% фосфора.
Как уже было сказано, профилактика и/или лечение остеопении у детей с ОНМТ, получающих полное парентеральное питание, служит основанием для более пристального внимания к введению некоторых внутривенных растворов. Концентрации кальция и фосфора в них не позволяют достигнуть внутриутробной скорости минерализации кости.
Однако используемые для парентерального питания препараты все же позволяют предупредить переломы костей и развитие рахита. Применение внутривенных препаратов, содержащих 15 ммоль (60 мг/дл) кальция и 15 ммоль (46 мг/дл) фосфора, может способствовать достижению желаемых показателей минерального гомеостаза (как биохимических маркеров, так и уровня кальциотропных гормонов).
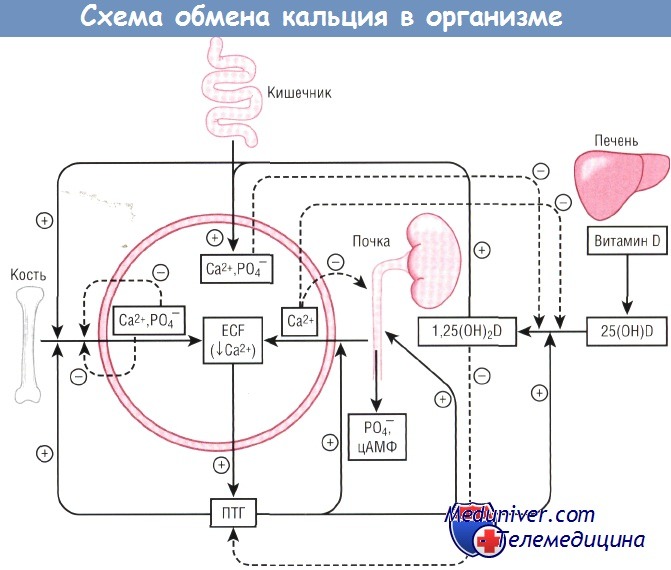
Схема гомеостаза кальция, демонстрирующая взаимодействия между кальцием, кальциотропными гормонами и системой органов.
1,25(OH)2D—1,25-дигидроксивитамин D;
25(OH)D—25-гидроксивитамин D;
ECF — эргокальциферол;
ПТГ — паратиреоидный гормон;
цАМФ — циклический аденозинмонофосфат.
В США встречаются случаи рахита у детей ранней возрастной группы, связанные с неадекватным поступлением в организм витамина D и дефицитом солнечного света. Обычно причиной служит выраженный гиповитаминоз D.
Большинство указанных случаев заболевания относились к детям, находящимся исключительно на грудном вскармливании без дополнительного введения витамина D. Следует отметить, что содержание витамина D в грудном молоке минимально. Анализируя случаи рахита у детей, можно отметить, что у этих младенцев часто наблюдалась повышенная пигментация кожи, а также они редко находились под воздействием солнечного света.
Вместе с тем на многих территориях США в зимние месяцы воздействие солнечного света не может считаться достаточно эффективным для синтеза витамина D в коже. Рекомендации по профилактике гиповитаминоза D заключаются в обеспечении всех детей, находящихся на грудном вскармливании, витамином D в дозе 200-400 МЕ/сут до тех пор, пока они не смогут получать адекватное количество витамина D из витамин D-фортифицированных смесей или другой пищи.
Аннотация научной статьи по клинической медицине, автор научной работы — Нароган Марина Викторовна, Рюмина Ирина Ивановна, Степанов А.В.
Обзор посвящен современным возможностям диагностики, лечения и профилактики остеопении ( метаболической болезни костей ) недоношенных детей. Рассматриваются причины, патогенез и клиническая картина данного заболевания. Обращается внимание на развитие электролитных расстройств ( гипофосфатемии , гиперкальциемии) на начальном этапе деминерализации костей, которые в выраженных случаях могут иметь тяжелые последствия для ребенка. В обзоре представлены существующие методы диагностики, подходы к лечению и профилактике. Обсуждаются результаты последних исследований, спорные и нерешенные вопросы. Проблема остеопении недоношенных детей в настоящее время требует пристального внимания и решения многих вопросов, начиная с разработки эффективных критериев диагностики и заканчивая организационными мероприятиями, в том числе регистрацией необходимых лекарственных средств в России.
Похожие темы научных работ по клинической медицине , автор научной работы — Нароган Марина Викторовна, Рюмина Ирина Ивановна, Степанов А.В.
Osteopenia (metabolic bone disease) in preterm infants: possibilities of diagnostics, treatment and prevention
The review is devoted to modern possibilities of diagnosis, treatment and prevention of osteopenia ( metabolic bone disease ) in preterm infants . the reasons, pathogenesis and clinical symptoms of the disease are considered. Attention is paid to the development of electrolyte disorders ( hypophosphatemia , hypercalcemia), at the initial stage of demineralization of the bones, which in severe cases can have serious consequences for the child. This review summarizes the existing diagnostic methods, approaches to treatment and prevention. The results of recent research, the controversial and unresolved issues are discussed. The problem of osteopenia in preterm infants currently requires attention and decision of many problems, starting with the development of effective diagnostic criteria, and ending organizational arrangements, including the registration of essential medicines in Russia.
Остеопения (метаболическая болезнь костей) у недоношенных: возможности диагностики, лечения и профилактики
М.В. Нароган, И.И. Рюмина, А.В. Степанов
Обзор посвящен современным возможностям диагностики, лечения и профилактики остеопении (метаболической болезни костей) недоношенных детей. Рассматриваются причины, патогенез и клиническая картина данного заболевания. Обращается внимание на развитие электролитных расстройств (гипофосфатемии, гиперкальциемии) на начальном этапе деминерализации костей, которые в выраженных случаях могут иметь тяжелые последствия для ребенка. В обзоре представлены
существующие методы диагностики, подходы к лечению и профилактике. Обсуждаются результаты последних исследований, спорные и нерешенные вопросы. Проблема остеопении недоношенных детей в настоящее время требует пристального внимания и решения многих вопросов, начиная с разработки эффективных критериев диагностики и заканчивая организационными мероприятиями, в том числе регистрацией необходимых лекарственных средств в России.
Osteopenia (metabolic bone disease) in preterm infants: possibilities of diagnostics, treatment and prevention
M V. Naroaan I.I. Rvumina V'L Kulakov Obstetrics, Gynec°l°gy and ftsrina^gy Reseai-ch
3 ' ' ' J ' Center of Ministry of Healthcare of the Russian Federation, Moscow
The review is devoted to modern possibilities of diagnosis, treatment and prevention of osteopenia (metabolic bone disease) in preterm infants. the reasons, pathogenesis and clinical symptoms of the disease are considered. Attention is paid to the development of electrolyte disorders (hypophosphatemia, hypercalcemia), at the initial stage of demineralization of the bones, which in severe cases can have serious consequences for the
child. This review summarizes the existing diagnostic methods, approaches to treatment and prevention. The results of recent research, the controversial and unresolved issues are discussed. The problem of osteopenia in preterm infants currently requires attention and decision of many problems, starting with the development of effective diagnostic criteria, and ending organizational arrangements, including the registration of essential medicines in Russia.
osteopenia of prematurity, metabolic bone disease, preterm infants, hypophospha-temia, vitamin D
Выхаживание и ранняя реабилитация детей, родившихся недоношенными, оценка и прогнозирование психомоторного и физического развития актуальны на протяжении нескольких десятилетий, однако современное поколение неонатологов сталкивается с новыми проблемами, появление которых связано как с повышением выживаемости глубоко недоношенных детей, так и с появлением новых достижений в изучении особенностей физиологии плода и новорожденного. Одна из таких проблем, о существовании которой мы узнаем все больше и которой придается все большее значение в развитии ребенка, - это остеопения.
Остеопения недоношенных (Р74.8) - метаболическое заболевание, обусловленное дефицитом кальция, фосфора и витамина D и проявляемое снижением минерализа-
Статистических данных по частоте остеопении не существует, в связи с отсутствием единых критериев установления диагноза. Теоретически все недоношенные дети, рожденные с массой тела Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
В формировании кости участвуют прежде всего такие микроэлементы, как кальций и фосфор, которые встраиваются в органический матрикс - остеоид, секретируемый остеобластами, ремоделирование кости обеспечивается остеокластами. Около 99% кальция и 80% фосфора находятся в костях в форме кристаллического гидроксиапати-та, в котором молярное соотношение Са2+:Р составляет 5:3. Многие биологически активные вещества являются регуляторами обмена кальция и фосфора: 1,25(ОН)2-витамин D, паратгормон, кальцитонин, паратиреоидный гормон, связанный пептид, гормон роста, инсулиноподобные факторы роста, тиреоидные гормоны, эстрогены, андрогены, корти-костероиды, витамины А и С, цитокины и др. [1, 6, 8].
1,25(ОН)2-витамин D - физиологически активная форма витамина D, которая в действительности является гормоном, действующим на уровне рецепторов и генетического аппарата клетки. Как показано в настоящее время, эффекты витамина D для здоровья более многогранны, так как он влияет не только на строение костного скелета, но и на работу иммунной системы и дифференциров-ку клеток [9, 10]. Поступивший в желудочно-кишечный тракт или синтезированный в коже витамин D по цирку-ляторному руслу переносится в печень, где превращается в транспортную форму 25ОН-витамин D. Исследование сывороточной концентрации этой формы используется для оценки достаточности поступления витамина D в организм. Далее 25ОН-витамин D в почках конвертируется в 1,25(ОН)2-витамин D, действие которого заключается в стимуляции всасывания кальция и фосфора в кишечнике, реабсорбции их в почках, минерализации кости, стимуляции функции остеобластов [6, 8]. Гидроксилиро-вание витамина D уже сформировано на 24-й неделе ге-стации [1].
Физиологическая особенность внутриутробного роста плода - высокая скорость накопления кальция и фосфора в III триместре беременности, которая не встречается больше никогда на протяжении развития человека. В III триместре плод накапливает около 80% кальция и фосфора. Согласно некоторым исследованиям, кальций в III триместре накапливается со скоростью 90-150 мг/кг/сут с максимальным поступлением (150 мг/кг/сут) в период 36-38 нед беременности [6, 11, 12], по другим данным, -со скоростью 100-130 мг/кг/сут с максимальным накоплением между 32-й и 36-й неделей 13. Таким образом, чем меньше срок гестации, на котором произошли роды, тем выше риск и степень последующего развития
дефицита кальция и фосфора, так как обеспечить высокую скорость поступления кальция и фосфора, соответственно внутриутробной, в неонатальном периоде у недоношенных детей практически невозможно. С первых дней жизни у недоношенных детей начинаются процессы деминерализации костей, которые продолжаются, по меньшей мере, в течение первых 2 мес жизни. Этот процесс усиливается известным физиологическим явлением деминерализации костей, которое развивается с началом постнатальной жизни и протекает в течение первых нескольких месяцев жизни у доношенных детей. У недоношенных детей минерализация костей к постконцептуальному возрасту 38-40 нед остается сниженной [1, 16, 17].
Недостаточное поступление прежде всего кальция и фосфора после рождения ребенка имеет наибольшее негативное влияние на минерализацию и рост костей, в меньшей степени в патогенезе участвует дефицит витамина D [1, 3, 6, 18]. Таким образом, практика вскармливания недоношенных детей имеет очень большое влияние на кальциево-фосфорный обмен и процессы формирования скелета. Достаточное поступление этих микроэлементов с питанием может предотвратить дальнейшее прогресси-рование остеопении, а нерациональное питание приводит к тяжелым осложнениям, таким, как переломы костей.
Задержка энтерального питания и пролонгированное парентеральное питание неблагоприятно влияют на минерализацию костей. Это связано с тем, что адекватные для ребенка дозы Са2+ и Р не всегда можно ввести внутривенно, в том числе из-за имеющегося порога преципитации для этих веществ. Кроме того, растворы парентерального питания содержат алюминий. В исследовании A.B. Sedman и соавт. (1985) показано, что содержание алюминия в костях у детей, получавших парентеральное питание более 3 нед в 10 раз выше, чем в группе контроля [19]. Повышение концентрации алюминия оказывает неблагоприятное влияние на формирование костей и когнитивное развитие [3, 20].
Вскармливание необогащенным грудным молоком недоношенных детей с массой тела менее 1800 г ведет к недостаточному поступлению большинства необходимых веществ, при этом дефицит поступления кальция и фосфора составляет более 60%, а витамина D - более 97-99% от физиологической потребности недоношенного ребенка (рис. 1).
Неадекватное поступление нутриентов, в том числе кальция, фосфора и витамина D, возникает и при искусственном вскармливании недоношенных детей, если используется непредназначенное для них питание, в том числе смеси, содержащие гидролизованный белок, разработанные для доношенных детей (см. табл.1).
Для формирования костей необходима адекватная механическая стимуляция, которая обеспечивается двигательной активностью. Недостаточная двигательная активность у тяжелобольных детей на фоне длительной седации, неврологических расстройств вносит свой вклад в нарушение роста костей. Результаты ряда исследований показали благоприятный эффект кратковременных (5-10 мин в день) пассивных физических упражнений на развитие
НЕОНАТОЛОГИЯ: новости, мнения, обучение №3 2014

Определение не включает повреждение при амниоцентезе, внутриутробной трансфузии, заборе крови из кожи головы или проведении реанимационных мероприятий.
Частота и смертность
Частота родовых травм — 2-7 случаев на 1000 живорожденных младенцев. К родовой травме предрасполагают длительные роды, крупный плод, клинически узкий таз, дистония, преждевременные роды, тазовое предлежание. Родовые травмы составляют 2-3% причин смерти новорожденных. Технологический прогресс, позволяющий акушеру-гинекологу выявить факторы риска родовой травмы при УЗИ и фетальном мониторинге до влагалищного родоразрешения, частично объясняет такой низкий показатель. Даже самостоятельно разрешающиеся повреждения вызывают значительное беспокойство у родителей. Родители нуждаются в поддержке и подробном информировании.
Различные типы родовых травм
- Повреждения черепа
- Внутрижелудочковое кровоизлияние
- Повреждения спинного мозга
- Повреждения периферических нервов
- Повреждения внутренних органов
- Переломы
- Гипоксически-ишемические повреждения
Повреждения черепа
Родовая опухоль — диффузное подкожное экстрапериостальное скопление жидкости с плохо ограниченными краями — распространяется вдоль линии швов черепа и средней линии. Возникает из-за давления предлежащей части на раскрывающуюся шейку. Родовая опухоль обычно не вызывает осложнений и рассасывается в течение первых нескольких суток после родов.
Покраснение, экхимозы, царапины и некроз подкожной жировой клетчатки головы и лица возникают после инструментальных родов. У недоношенных младенцев часто встречают экхимозы (подкожное скопление крови из-за разрыва мелких кровеносных сосудов). Некроз подкожной жировой клетчатки после родов обычно не виден, до его обнаружения проходит несколько недель. Типичные признаки — плотная неровная подкожная бляшка пурпурного цвета. Обычно лечение не требуется; иногда появляется гиперкальциемия, требующая коррекции.
Часто возникают субконъюнктивальные и ретинальные кровоизлияния и петехии на лице и шее, как результат внезапного повышения внутригрудного давления при прохождении грудной клетки по родовым путям. Лечения не требуется, необходимо успокоить родителей.
Переломы черепа возникают в результате давления щипцов или костей таза матери. Чаще это линейные переломы, не требующие лечения. Вдавленные переломы обычно наблюдают при родах с применением акушерских щипцов. Перелом затылочной кости несет значительную опасность смертельного кровотечения из-за разрыва сосудистых синусов. Он образуется при родах в тазовом предлежании.
Внутричерелное-внутрижелудочковое кровоизлияние
Внутричерепное кровоизлияние результат травмы или асфиксии и редко — первичного геморрагического диатеза. Предрасполагающие факторы — клиническое несоответствие головки плода и таза, роды в тазовом предлежании, стремительные роды или роды с механическим пособием. Массивные субдуральные кровоизлияния редки, их чаще отмечают у доношенных новорожденных. Внутричерепное кровоизлияние иногда связано с дефицитом витамина К у новорожденного, изоиммунной тромбоцитопенией и синдромом диссеминированного внутрисосудистого свертывания.
Внутрижелудочковое кровоизлияние (ВЖК) у недоношенных может возникать без какой-либо травмы. Чем меньше масса тела при рождении, тем чаще ВЖК, и его определяют у 2/3 недоношенных с массой при рождении менее 750 г. Эта патология редко проявляется при рождении, симптомы возникают в первые сутки в 50% случаев. Кровотечение возникает в субэпендимальном зародышевом матриксе. К возникновению ВЖК у недоношенных предрасполагает незрелость кровеносных сосудов в этой перивентрикулярной области, содержащей большое количество кровеносных сосудов в сочетании с плохим кровоснабжением.
Наиболее частые симптомы — уменьшение или отсутствие рефлекса Моро, слабый мышечный тонус, вялость, апноэ и бледность. У недоношенных младенцев с ВЖК на 2-3-и сутки жизни возникает внезапное ухудшение состояния. Тяжелое ВЖК приводит к значительному ухудшению неврологического статуса, легкие формы часто протекают бессимптомно.
Диагноз устанавливают на основе анамнеза и клинических признаков. Стандартный метод исследования для подтверждения диагноза — УЗИ черепа. У крупных доношенных детей с субдуральным кровоизлиянием симптомы могут отсутствовать до месячного возраста. У доношенных новорожденных с подозрением на внутричерепное кровоизлияние необходимо провести магнитно-резонансную томографию (МРТ) или компьютерную томографию (КТ) головного мозга, так как внутрипаренхиматозное кровоизлияние или инфаркт при УЗИ черепа не выявляют.
Частоту травматических внутричерепных кровоизлияний можно уменьшить профилактикой возникновения клинически узкого таза и хирургическим родоразрешением. Частоту ВЖК у недоношенных можно снизить антенатальным применением стероидов и тщательным контролем вентиляции. Витамин К необходимо давать всем младенцам для предотвращения кровотечения из-за его дефицита.
У новорожденных с массивным кровоизлиянием быстро наступает ухудшение состояния, и они часто умирают. У большинства новорожденных с небольшими ВЖК постгеморрагическая гидроцефалия не развивается. При прогрессирующей гидроцефалии необходимо вентрикуло-перитонеальное шунтирование.
Позвоночник и спинной мозг
Повреждения спинного мозга у новорожденных во время родов возникают при переразгибании (вытягивании) или ротировании позвоночника. Вытягивание более значительно при родах в тазовом предлежании и оно вызывает повреждение нижних шейных и верхних грудных позвонков. Значительное вращение или скручивание при родах в теменном предлежании плода вызывает повреждение IV шейного позвонка.
Основные нейропатологические изменения — острые повреждения, например кровоизлияния, отек и редко переломы и смещения позвонков. Геморрагические осложнения сочетаются с разрывами спинного мозга различной степени, нарушением его целостности или полным поперечным разрывом спинного мозга.
Ниже уровня повреждения утрачены рефлексы, потеряна чувствительность и полностью отсутствуют самостоятельные движения. При тяжелом повреждении существует риск быстрой смерти от угнетения дыхания, шока и гипотермии. В других случаях клиническое течение длительное с постепенным развитием симптомов. Тяжелую дыхательную недостаточность устраняют искусственной вентиляцией легких, и в дальнейшем это становится этической дилеммой. Апноэ в первый день и слабое восстановление двигательной активности в течение 3 мес — плохие прогностические признаки.
Профилактика — самый важный аспект перинатального наблюдения, ведение родов должно быть адекватным. В редких случаях травма происходит внутриутробно.
Диагноз подтверждают при КТ или МРТ-миелографии. Дифференциальную диагностику проводят с врожденной амиотонией и миелодисплазией со скрытым расщеплением позвоночника (spina bifida).
Повреждение периферических нервов
В большинстве случаев это паралич Эрба.
При параличе Эрба-Дюшенна поражение ограничено 5 и 6 шейными нервами. У младенцев невозможно отведение руки, поворот руки кнаружи и супинация предплечья. Типично положение приведения и внутреннего поворота руки с пронацией предплечья (поза официанта). Рефлекс Моро и бицепс-рефлекс обычно отсутствуют, а хватательный рефлекс сохранен. Односторонний паралич диафрагмального нерва наблюдают у 5% пациентов с параличом Эрба.
Паралич Клюмпке — редкая форма паралича плечевого сплетения вследствие повреждения 7-8 шейных и 1 грудного спинномозгового нерва. В результате появляется слабость мышц кисти, отсутствие хватательного рефлекса. При повреждении 1 грудного спинномозгового нерва возникает синдром Горнера (односторонний птоз и миоз).
Прогноз зависит от степени повреждения умеренное повреждение или полный разрыв. Поражение дельтовидной мышцы — наиболее серьезная проблема, приводящая к опущению плеча. В целом при параличе верхнего отдела руки прогноз лучше, чем при поражении дистального ее отдела.
Лечение — частичная иммобилизация и придание соответствующего положения конечности для профилактики контрактур. При параличе верхнего отдела руки ее отводят на 90° с наружным поворотом плеча и полной супинацией предплечья и ладонью, направленной к лицу. Иммобилизацию проводят с перерывами в течение дня и между кормлениями. При параличе предплечья или кисти запястье шинируют в нейтральном положении, в кулак кладут подушечку. При сохранении паралича более 3-6 мес пациента должен осмотреть нейрохирург.
Цианоз и нерегулярное затрудненное дыхание у новорожденного подозрительны на паралич диафрагмального нерва (3, 4 и 5 шейных нервов). Часто такие повреждения сочетаются с параличом плечевого сплетения. Диагноз устанавливают при флюороскопии или УЗИ. Специальное лечение отсутствует. Оптимизируют подачу кислорода и кормление. Рекомендуют уход за пораженной стороной (шинирование пораженной диафрагмы). Обычно через 3 мес наступает самостоятельное выздоровление.
Паралич лицевого нерва обычно имеет периферическое происхождение. Он часто возникает в результате давления на лицевой нерв внутриутробно, при потугах во время родов, при родах с помощью акушерских щипцов или редко вторично из-за агенезии ядер. Периферический паралич вялый и часто вовлекает всю половину лица, включая лоб. При крике ребенка двигается только непораженная половина лица и, следовательно, рот растянут в эту сторону. На пораженной стороне лоб гладкий и глаз открыт. При центральном параличе лицевого нерва лоб остается нетронутым.
При периферическом параличе у большинства младенцев выздоровление наступает в течение нескольких недель. Важен адекватный уход за глазом. При отсутствии улучшения в течение 2 нед необходима консультация детского невролога или нейрохирурга. При стойком параличе показана пластика нерва.
Дифференциальный диагноз проводят с агенезией ядер, врожденным отсутствием лицевых мышц, односторонним отсутствием круговой мышцы глаза и внутричерепным кровоизлиянием.
Внутренние органы
Печень — единственный внутренний орган, кроме головного мозга, ранимый при родах. Предрасполагающие факторы крупный плод, внутриутробная асфиксия, нарушения свертывания крови, крайняя степень недоношенности, тазовое предлежание и гепатомегалия. Чаще наблюдают субкапсулярную гематому. Симптомы шока отсрочены. Разрывы возникают реже. Залог спасения жизни — раннее выявление при УЗИ и немедленное поддерживающее лечение.
Разрывы селезенки редко возникают изолированно, чаще в сочетании с разрывами печени.
В некоторых случаях возникают кровоизлияния в надпочечники, особенно при родах в тазовом предлежании, однако причина их не установлена. Предрасполагающие факторы — травма, стресс, гипоксия или тяжелый сепсис; 90% кровоизлияний односторонние. Симптомы кровоизлияния — тяжелый шок и цианоз, однако не все кровоизлияния в надпочечники смертельны.
Переломы
Переломы чаще всего возникают вследствие родов в тазовом предлежании плода и/ или дистонии плечиков у крупных плодов.
Во время родов у новорожденных чаще ломается ключица, и иногда такой перелом непредсказуем и неизбежно осложняет нормальные роды. У младенца определяют псевдопаралич, перелом подтверждают при рентгеновском исследовании. Прогноз отличный, ключица срастается через 10 сут. Движения руки можно ограничить путем прикрепления рукава к рубашке.
Ранний симптом перелома — утрата самопроизвольных движений конечности, отсутствие рефлекса Моро; сопутствует поражение нерва. Во время родов акушер может услышать или почувствовать хруст, характерный для перелома. Диагноз подтверждают рентгенографией конечностей.
Перелом диафиза плечевой кости обычно лечат шинированием и фиксированием руки к грудной клетке. Кость срастается в течение 2 нед. При переломе бедренной кости хорошие результаты получают при подвешивании-тракции обеих нижних конечностей, даже при одностороннем переломе. Заживление обычно сопровождается образованием избыточной костной мозоли. Переломы у недоношенных младенцев иногда связаны с остеопенией. Рекомендована консультация ортопеда.
Вывихи и отделения эпифиза
Эти повреждения — редкая родовая травма. Во время извлечения плода при родах в тазовом предлежании может произойти отделение верхнего эпифиза бедренной кости. Наблюдают припухлость пораженной ноги, ограничение активных движений и болезненность пассивных движений. Прогноз обычно хороший.
Гипоксия-ишемия
Итоксическая ишемическая энцефалопатия — важная причина стойкого повреждения центральной нервной системы, которое может закончиться смертью новорожденного или проявиться позже церебральным параличом. В общей сложности 15-20% новорожденных с гипоксической ишемической энцефалопатией умирают в неонатальный период, стойкие аномалии нервной системы развиваются у 25-30% выживших. Профилактику и лечение проводят в соответствии с этиологией заболевания. Инвалидность и смертность уменьшают проведением адекватной вентиляции, оксигенации и коррекции сопутствующей полиорганной дисфункции. Для асфиксии плода характерны: рН крови плода менее 7, 5-минутная оценка по шкале Апгар — 0-3 и клинические проявления полиорганной дисфункции.
Читайте также:


