Преимущества метода пцр как метода диагностики инфекционных заболевании
Преимуществами полимеразной цепной реакции являются:
-
Прямое определение наличия возбудителя.
Полимеразная цепная реакция рассчитана на выявление нуклеиновых кислот возбудителя. Этим она выгодно отличается от других традиционных методов диагностики, которые обеспечивают обнаружение косвенных признаков инфекции (антител, белковых маркеров, являющихся продуктами жизнедеятельности инфекционных агентов), дающих опосредованное свидетельство о наличии заболевания.
Высокая чувствительность метода.
Полимеразная цепная реакция обладает высокой чувствительностью, дающей возможность обнаружить единичные бактериальные клетки или вирусные частицы в тех случаях, когда другими методами (иммунологическим, бактериологическим, микроскопическим) это сделать невозможно. С помощью ПЦР-диагностики можно определить инфекционный агент непосредственно в биологическом материале с исключительно высокой чувствительностью - порядка 1,0-0,5 микроорганизмов или вирусных частиц при высокой специфичности, обеспечиваемой последовательностью нуклеотидов синтезируемого фрагмента ДНК (чувствительность иммунологических и микроскопических тестов 1О 3 -10 5 клеток).
Универсальность процедуры выявления различных возбудителей. Материалом для исследования служит ДНК, РНК возбудителя. Полимеразная цепная реакция основана на обнаружении фрагмента ДНК, РНК, являющегося специфичным для конкретного организма. Сходство химического состава нуклеиновых кислот позволяет применять унифицированные методы лабораторных исследований. Это дает возможность диагностировать несколько возбудителей из одной биопробы.
Высокая скорость реакции.
Для ПЦР-диагностики не требуется выделение и выращивание культуры возбудителей, что занимает много времени. Унифицированный метод обработки материала и идентификации продуктов реакции, автоматизация процесса амплификации дают возможность провести полный анализ за 5 часов.
Особенно эффективна полимеразная цепная реакция для диагностики трудно культивируемых, некультивируемых и персистирующих форм микроорганизмов, с которыми приходится сталкиваться при латентных и хронических инфекциях, поскольку этот метод позволяет избежать сложностей выращивания таких микроорганизмов в лабораторных условиях. Применение полимеразной цепной реакции также эффективно в отношении возбудителей с высокой антигенной активностью и внутриклеточных паразитов, способных длительно персистировать в организме хозяина.
Внедрение в практику полимеразной цепной реакции существенно расширило возможности современной микробиологии, так как использование культуральных методов является проблематичным, что связано с недостаточной диагностической ценностью и сложностью анализа, основанного на заключении исследователя.
Рационально и эффективно применение полимеразной цепной реакции для обнаружения микроорганизмов, труднокультивируемых в лабораторных условиях, а также атипичных форм бактерий. К ним относятся внутренние паразиты и микроорганизмы, способные длительно персистировать в организме хозяина без клинических симптомов. Особое место в этом ряду занимает Mycobacterium tuberculosis и вирусные агенты.
Наиболее эффективна и обоснованна ПЦР-диагностика при урогенитальных инфекциях: трихомониазе, хламидиозе, уреа-, микоплазмозе, гонорее, герпесе, гарднереллезе.
В пульмонологии данный метод используется для дифференциации вирусных и бактериальных пневмоний, туберкулеза; в гастроэнтерологии - для выявления хеликобактериоза; в клинике инфекционных болезней - для диагностики вирусных гепатитов В, С, D; в гематологии - с целью обнаружения цитомегаловирусной инфекции, вируса Эпштейна - Барр.
Особое практическое значение имеет полимеразная цепная реакция при определении устойчивости микрофлоры к антибиотикам тетрациклину и эритромицину, что обоснованно в тех случаях, когда другие методы недостаточно эффективны или приемлемы (например, рост Мсb. Тbс). Исследование чувствительности к противотуберкулезным препаратам занимает 1-2 месяца; в процессе культурального выделения происходит искажение результата из-за снижения активности лекарственных препаратов.
Но применение полимеразной цепной реакции этим не ограничивается, она широко используется не только для диагностики и идентификации, но и для субвидового типирования и анализа генетического родства выделенных штаммов микроорганизмов, особенно при эпидемиологических исследованиях.
По сравнению с традиционными фенотипическими методами (био-, фаго-, серотипированием) генотипирование на основе полимеразной цепной реакции отличается универсальностью, более глубоким уровнем дифференциации, возможностью использовать качественный подход к оценке идентичности штамма.
Таким образом, ПЦР-диагностика является наиболее современным незаменимым методом молекулярно-генетического анализа, имеющим перспективу широкого внедрения в медицинскую науку и практику.
=================
Вы читаете тему:
Полимеразная цепная реакция. Сущность метода, его преимущества и возможности.
1. Сущность ПЦР и циклы синтеза ДНК.
2. Преимущества и сферы применения полимеразной цепной реакции.
ПЦР - это метод ДНК-диагностики, который позволяетвыделить в клиническом материале ничтожно малые количества определенного генетического материала, размножить и идентифицировать его.
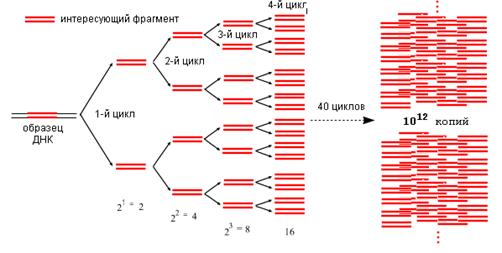
Рис. Схема ПЦР
Изящность, простота исполнения в лабораторных условиях, непревзойденные показатели чувствительности и специфичности полимеразной цепной реакции принесли новому методу небывалую популярность. За короткое время ПЦР-анализ распространился по всему миру, быстро выйдя из лабораторий научных институтов в сферу практического использования. Метод нашёл применение в археологии, в практике судебной медицины, в области медицинской генетики, прежде всего, для оценки предрасположенности человека к некоторым онкологическим и генетическим заболеваниям. Но особенно широко ПЦР-анализ стал использоваться для диагностики различных инфекционных заболеваний, в частности, заболеваний, передающихся половым путём (ЗППП), диагностики вирусных гепатитов и ВИЧ-инфекции, туберкулёза, клещевого энцефалита, острых респираторных и кишечных инфекций и множества других. На сегодняшний день практически нет инфекционного агента, которого нельзя было бы выявить с помощью метода ПЦР. Для диагностики некоторых урогенитальных инфекций, например, Mycoplasmagenitalium – возбудителя воспалительных заболеваний мочеполового тракта, ПЦР как метод молекулярной диагностики, стал "золотым стандартом", проверенным временем и тщательно апробированным клиниче
Достоинства ПЦР как метода молекулярной диагностики.
Метод ПЦР, в отличие от других, традиционно используемых для диагностики инфекционных заболеваний (иммуноферментный анализ (ИФА), бактериологический посев, микроскопия и др.), характеризуется целым рядом достоинств, которые позволили вывести лабораторную диагностику на качественно новый уровень.
Возможность одновременного выявления нескольких микроорганизмов в одной биологической пробе, в отличие от бактериологических методов, где для разных возбудителей используются разные способы культивирования.
2. Высокая cпецифичность
Высокая специфичность метода ПЦР обусловлена тем, что в исследуемом материале выявляется уникальный, характерный только для данного микро-(макро)-организма участок его генетического материала. Согласно имеющимся данным, специфичность ПЦР-анализа для хламидийных, микоплазменных, уреаплазменных и большинства других бактериальных инфекций достигает 95-99 %.
4. Универсальность процедуры выявления различных возбудителей
Материалом для исследования методом ПЦР служит ДНК или РНК возбудителя. Сходство химического состава нуклеиновых кислот всех микро-(макро)-организмов позволяет применять унифицированные методы проведения лабораторных исследований, а также использовать для диагностики различный биологический материал: соскобы эпителиальных клеток урогенитального тракта, цельную кровь, плазму, сыворотку, мочу, сперму, секрет простаты, фекалии, плевральную и спинномозговую жидкости, мокроту, слюну, биоптаты различных органов и др. Материалом для исследования методом ПЦР могут служить вода, почва, продукты питания.
Для проведения ПЦР-анализа не требуется выделение и выращивание культуры возбудителя, что занимает большое количество времени как, например, при бактериологическом посеве, также нет необходимости сохранять возбудителя в живом состоянии. Особенно эффективен метод ПЦР для диагностики трудно культивируемых, некультивируемых и скрыто существующих форм микроорганизмов, с которыми часто приходится сталкиваться при диагностике скрытых или хронических инфекций.
6. Возможность одновременной диагностики многих возбудителей (анаэробов и аэробов; вирусов, бактерий и грибов).
7. Для некоторых микроорганизмов ПЦР является практически единственным методом диагностики (например, для Mycoplasma genitalium).
Как это используется?
[youtube.player]О методе ПЦР-диагностики
1. Прямое определение наличия возбудителей.
Метод полимеразной цепной реакции рассчитан на выявление нуклеиновых кислот возбудителя. Этим он выгодно отличается от многих традиционных методов диагностики, которые обеспечивают обнаружение косвенных признаков инфекции (антител либо белков-маркеров, являющихся продуктами жизнедеятельности инфекционных агентов), дающее лишь опосредованное свидетельство наличия заболевания.
2. Высокая специфичность
Высокая специфичность метода ПЦР обусловлена тем, что в исследуемом материале выявляется уникальный, характерный только для данного возбудителя фрагмент ДНК. Специфичность задается нуклеотидной последовательностью праймеров, что исключает возможность получения ложных результатов в отличие от метода иммуноферментного анализа, где нередки ошибки в связи с перекрестно-реагирующими антигенами. ПЦР аналогична росту бактерий на искусственных питательных средах (процессу биологической амплификации), при которой одна микробная клетка, образуя видимую колонию, амплифицируется в 10 5 -10 6 раз, давая возможность определить свойства бактерии, манипулируя уже с целой колонией. Как и питательные среды, которые могут быть селективными, поддерживающими рост только одного микроорганизма, или обогатительными, дающими возможность размножаться широкому кругу микроорганизмов, так и праймеры, определяющие специфичность ПЦР, могут быть строго видоспецифичными или с их помощью можно выявить целые рода или семейства микроорганизмов.

3. Высокая чувствительность.
Метод ПЦР обладает высокой чувствительностью, дающей возможность обнаружить единичные бактериальные клетки или вирусные частицы. Но это преимущество ПЦР уместно рассматривать при сравнении с другими молекулярно-генетическими или иммунологическими методами диагностики. Использование ПЦР позволяет определять инфекционный агент непосредственно в биологическом материале с исключительно высокой чувствительностью - порядка 1-10 микроорганизмов или вирусных частиц при высокой специфичности, обеспечиваемой последовательностью нуклеотидов синтезируемого фрагмента ДНК. Исходный материал для ПЦР может быть получен из плевральной жидкости, мокроты, спинномозговой жидкости, периферической крови, а также из биопсийного материала и парафинированных тканей, т.е. из любой ткани или жидкости, которые могут быть обеззаражены фенолом или нагреванием, а также храниться неограниченно долго, что не влияет на результаты исследования .
Однако высочайшая чувствительность ПЦР обычно достигается при работе с чистой культурой микроорганизма или, что еще лучше, с очищенной нуклеиновой кислотой. Эта чувствительность автоматически не трансформируется в чувствительность метода при работе с клиническим материалом. На успех определения при работе с этим материалам влияют такие факторы, как методика приготовления образца, возможное присутствие ингибитора фермента, осуществляющего амплификацию, объем образца при низких концентрациях тестируемых молекул.


4. Универсальность процедуры выявления различных возбудителей
Материалом для исследования методом ПЦР служит ДНК/РНК возбудителя. Метод основан на выявлении фрагмента ДНК или РНК, являющегося специфичным для конкретного организма. Сходство химического состава всех нуклеиновых кислот позволяет применять унифицированные методы проведения лабораторных исследований. Это дает возможность диагностировать несколько возбудителей из одной биопробы.


5. Высокая скорость получения результата анализа
Для проведения ПЦР-анализа не требуется выделение и выращивание культуры возбудителя, занимающее большое количество времени. Унифицированный метод обработки материала и детекции продуктов реакции, автоматизация процесса амплификации дают возможность провести полный анализ за 4-4,5 часа. Этим он выгодно отличается от других лабораторных методов, которые дают замедленные результаты.


6. Возможность диагностики не только острых, но и латентных инфекций
Метод ПЦР особенно эффективен при выявлении трудно культивируемых, некультивируемых, требующих сложной питательной среды и персистирующих форм микроорганизмов, с которыми часто приходится сталкиваться при латентных и хронических инфекциях, поскольку этот метод позволяет избежать сложностей, связанных с выращиванием таких микроорганизмов в лабораторных условиях.
Диагностические возможности ПЦР не ограничены способностью микроорганизма расти на искусственных средах или в культуре клеток. Поэтому основное преимущество ПЦР перед культуральными методами состоит не в высокой чувствительности ПЦР-метода (поскольку их чувствительность сопоставима), а в способности идентифицировать, определять свойства и работать с большим разнообразием микроорганизмов, которые не удается по тем или иным причинам размножать в лабораторных условиях.
Применение ПЦР-диагностики также очень эффективно в отношении возбудителей с высокой антигенной изменчивостью и внутриклеточных паразитов. Следует отметить, что методом ПЦР возможно выявление возбудителей не только в клиническом материале, полученном от больного, но и в материале, получаемом из объектов внешней среды (вода, почва и т.д.).
Дополнительные возможности повышения специфичности и чувствительности ПЦР-амплификации дает так называемая "nested-PCR" . Если первичная ПЦР недостаточно чувствительна или среди продуктов реакции наблюдается накопление неспецифических фрагментов, происхождение которых трудно объяснить, проводят еще одну серию амплификаций с использованием другого набора олигонуклеотидных праймеров. То есть сначала для амплификации используют внешние праймеры, а затем - внутренние (nested) праймеры. В качестве матрицы используется первичный продукт ПЦР, а внутренние олигонуклеотидные праймеры имеют гомологии с участками ДНК внутри первичного амплифицированного фрагмента (рис.5). Такая процедура позволяет получить большое количество искомых фрагментов ДНК, немного короче, чем исходный фрагмент.
↓ Реамплификация (первый цикл) ↓
↓ Реамплификация (второй цикл) ↓
Для повышения чувствительности и специфичности реакции в последние годы широко используется такой простой прием как "горячий старт" . Он обеспечивается методикой приготовления реакционной смеси, состоящей из двух слоев (верхнего и нижнего), разделенных прослойкой из парафина. Нижний слой содержит праймеры, верхний - фермент Taq-полимеразу и ДНК-мишень. Смешение слоев и превращение их в реакционную смесь происходит только при расплавлении парафина на стадии денатурации, что исключает неспецифический отжиг праймеров. Дальнейшее технологическое совершенствование диагностических тест-систем на основе ПЦР в настоящее время ведется по трем основным направлениям:
1. Создание методических приемов, предохраняющих от возможности получения ложноположительных результатов.
2. Использование внутреннего контроля, наличие которого гарантирует отсутствие ложноотрицательных результатов. Матрицей для внутреннего контроля является фрагмент ДНК, содержащий места отжига используемых праймеров, но находящихся друг от друга на расстоянии, меньшем по сравнению с тестируемым фрагментом. Образующийся на такой матрице ампликон будет меньше по размеру, чем искомый. Отсутствие синтеза контрольного ампликона указывает на наличие в исследуемом образце ингибитора ПЦР.
3. Превращение этой реакции в количественный тест. Это достигается благодаря титрованию продукта амплификации с использованием внутреннего стандарта, что позволяет перевести значение титров в абсолютное количество бактериальных клеток или вирусных частиц.

480057 Казахстан, г. Алматы,
ул. Айманова, 193, офис 61,
Последние изменения : Thursday September 14, 2006 .
[youtube.player] 







ПЦР, КАК ЭКСПРЕСС МЕТОД ДИАГНОСТИКИ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ
Некультивируемость микроорганизмов - главная причина, по которой культуральный метод все более и более теряет свои позиции по мере появления альтернативных подходов. При этом под некультивируемостью мы понимаем, как невозможность на современном уровне развития микробиологии подобрать условия культивирования для большинства микроорганизмов, существующих в природе (по некоторым данным эта цифра может достигать 99%), так и невозможность высеять хорошо культивируемый микроорганизм из какой-либо биологической среды, содержащей ингибиторы его размножения. Кроме того, целый ряд клинически важных бактериальных возбудителей животных может плохо культивироваться из-за широкого применения в современной ветеринарной лечебной практике антибиотиков широкого спектра действия. Помимо этого, для многих возбудителей культуральный метод представляет собой трудоемкую, длительную и дорогостоящую процедуру. В то же время традиционные серологические тесты: РСК, РДП, РГА, а порой и наиболее перспективные методы диагностики - иммуноферментный анализ (ИФА) и иммунноблотинг (ИБ), оказываются фактически неэффективными или принципиально неприемлемыми для выявления инфекционных возбудителей по причине, главным образом, их низкой чувствительности.
Принцип ПЦР был описан в 1986 г. К. Мullis, получившим за это Нобелевскую премию в 1993 г. В основе этого метода лежит многократное копирование с помощью фермента ДНК-полимеразы определенного фрагмента ДНК, который является маркерным для данного вида. Механизм копирования таков, что комплементарное достраивание нитей может начаться не в любой точке последовательности ДНК, а только в определенных стартовых блоках — коротких двунитевых участках. Для создания стартовых блоков в заданных участках ДНК используют затравки, представляющие собой специально синтезированные in vitro олигонуклеотиды длиной около 20 нуклеотидов, называемые праймерами (рис.1).
Рис.1.Праймеры-основа специфичности ПЦР.
Праймеры комплементарны последовательностям ДНК на левой и правой границах специфического фрагмента и ориентированы таким образом, что синтез ДНК, осуществляемый ДНК-полимеразой, протекает только между ними. В результате происходит экспоненциальное увеличение количества копий специфического фрагмента по формуле 2n , где п — число циклов амплификации (рис. 2).
Рис.2. Экспоненциальная ампфликация
Поскольку праймеры входят в состав амплифицируемого фрагмента, его размер определяется числом олигонуклеотидных пар между 5'-концами праймеров. Обычно размер фрагмента составляет несколько сотен нуклеотидных пар. Построение новых ДНК нитей из дезоксирибонуклеотидтрифосфатов осуществляет фермент термостабильная ДНК-полимераза, называемая Таq-полимеразой. Процесс амплификации заключается в повторении циклов амплификации, состоящих из денатурации ДНК (1 мин), отжига праймеров (1—2 мин) и построения фрагмента (1—2 мин). В результате 30—35 циклов амплификации синтезируется 10 8 копий фрагмента, что делает возможным визуальный учет результатов после электрофореза в агарозном или акриламидном геле. Использование термостабильной ДНК-полимеразы позволило автоматизировать процесс амплификации с помощью специального прибора, называемого термоциклером (рис.3).
Этот прибор автоматически осуществляет смену температур согласно заданной программе и числу циклов амплификации. Таким образом, ПЦР аналогична росту бактерий на искусственных питательных средах — процессу биологической амплификации, при которой одна микробная клетка, образуя видимую колонию, амплифицируется в 10 5 —10 6 раз, давая возможность определить свойства бактерии, манипулируя уже с целой колонией. Как и питательные среды, которые могут быть селективными, поддерживающими рост только одного микроорганизма, или обогатительными, дающими возможность размножаться широкому кругу микробов, так и праймеры, определяющие специфичность ПЦР, могут быть строго видоспецифичными или с их помощью можно выявить целые роды или семейства микроорганизмов. Но в то же время ПЦР имеет принципиальное преимущество перед культуральными методами. Диагностические потенции ПЦР не ограничены способностью микроба расти на искусственных средах или в культуре клеток. Поэтому основное преимущество ПЦР перед культуральными методами состоит не в высокой чувствительности ПЦР-метода (так как чувствительность этих методов сопоставима), а в способности идентифицировать и определять свойства тех микроорганизмов, которых не удается по тем или иным причинам размножать в лабораторных условиях. Здесь уместно отметить, что идентификационные тест-системы, основанные на ПЦР, разрабатываются для микроорганизмов с известными к данному моменту последовательностями ДНК в интересующих генах. Наивысшая чувствительность ПЦР обычно достигается при работе с чистой культурой микроба или, что еще лучше, с очищенной нуклеиновой кислотой. Эта чувствительность автоматически не трансформируется в чувствительность метода при работе с клиническим материалом. На успех определения при работе с этим материалом влияют такие факторы, как методика приготовления образца, возможное присутствие ингибитора фермента, осуществляющего амплификацию, объем образца при низких концентрациях тестируемых молекул. Наибольшее внимание среди этих методов привлекает полимеразная цепная реакция (ПЦР) в основе которой лежит многократное повторение циклов удвоения (амплификация) специфического участка нуклеотидной последовательности. Главное достоинство метода - очень высокая чувствительность: в результате амплификации концентрация специфической олигонуклеотидной последовательности в реакционной пробе возрастает в десятки миллионов раз. За последние 10 лет достигнут значительный прогресс в изучении молекулярной основы наследственных болезней и в их диагностике с помощью молекулярного анализа ДНК. В первую очередь это относится к болезням, которые вызваны мутацией в одном гене (моногенным). Каждый год увеличивается список наследственных болезней, которые могут быть выявлены методами анализа последовательности нуклеиновых оснований хромосомной ДНК. Появилась возможность с помощью исследования образцов ДНК поставить диагноз наследственного заболевания еще до появления клинических симптомов или в пренатальный период. Это позволяет выявить носителей мутантного гена при аутосомнорецессивных болезнях, а также распознать фенотипически сходные, но генетически различные заболевания. В настоящее время расширяется сфера применения этих методов. Помимо диагностики болезней с установленным типом наследования, они начинают использоваться для изучения и мультифакториальных заболеваний (коронарная болезнь сердца, сахарный диабет, опухоли и др.), а также для идентификации личности, установления отцовства и др.
Схема 1. Схема ПЦР-анализа
Особую диагностическую ценность ДНК-анализ приобретает при тех наследственных болезнях, при которых неизвестен биохимический дефект, лежащий в их основе, и которые поэтому не могут быть выявлены традиционными методами лабораторной диагностики. Кроме того, этот метод практически незаменим в тех случаях, когда патологический ген оказывает свое действие только в тканях, которые недоступны для исследования (мозг, печень). Ключом к расширению клинического применения достижений современной молекулярной генетики являются не только разработка методов рекомбинантной ДНК, но и значительное упрощение технологии проведения ДНК-анализа, повышение чувствительности, быстроты и надежности методов с их последующей автоматизацией. Остановимся теперь более подробно на основных этапах технологии анализа. Получение и хранение ДНК. Геномную ДНК выделяют с помощью многоступенчатых методов из тканей, содержащих ядерные клетки, в том числе из лимфоцитов периферической крови, лимфобластоидных клеточных линий, а также из амниоцитов и ворсин хориона плода, полученных путем биопсии. Кровь для исследования берут в количестве около 10 мл с антикоагулянтом: цитратом, глюкозоцитратным раствором (глюгициром) или ЭДТА. В большинстве лабораторий ДНК выделяют из взятых образцов в тот же день, но их можно и хранить при температуре —20°С. Первым этапом анализа ДНК является ее экстракция из тканей по стандартному методу. Клетки крови (или ворсин хориона) гемолизируют, обрабатывают протеиназой в течение ночи для расщепления белков, экстрагируют сопутствующие вещества фенолом и хлороформом и осаждают нуклеиновые кислоты этанолом. Методы экстракции ДНК постоянно совершенствуются, разрабатываются различные модификации, направленные на ускорение и повышение эффективности методов, а также использование менее вредных для исследователя реактивов. Количество и чистота препарата ДНК оцениваются спектрофотометрически. Экстрагированная ДНК стабильна и может храниться неопределенно долгое время. Это имеет большое значение, так как образцы от людей с генетическими заболеваниями могут быть собраны и сохранены для будущих сопоставлений при обследовании других членов семьи, а также для проведения повторных исследований после получения ДНК- проб нового поколения. Обычно образцы ДНК дублируются и хранятся раздельно в двух морозильниках. Хранение ДНК обеспечивает возможность ДНК-диагностики в семьях, в которых пожилые или страдавшие наследственными заболеваниями родственники умерли до того, как стало возможным предсказательное тестирование. В случаях, когда пораженные родственники уже умерли и ДНК лейкоцитов недоступна для анализа, оказалось возможным использовать замороженную ткань мозга, взятую на аутопсии. Для радиоизотопного анализа по Саузерну обычно требуется 5—10 мкг геномной ДНК, что составляет около 2-10 –18 мол. Такое количество ДНК присутствует приблизительно в 10 6 ядерных клеток, которые могут быть выделены менее чем из 1 мл крови, а в случае пренатальной диагностики — из биоптата ворсин хориона или из амниоцитов. Еще меньшее, крайне незначительное количество ДНК необходимо в тех случаях, когда анализу предшествует амплификация (умножение) участка ДНК-мишени с помощью недавно разработанного метода, использующего повторные циклы полимеразной цепной реакции (ПЦР).
В настоящее время используется несколько способов подготовки образца для проведения ПЦР. Процедура подготовки пробы включает лизис микроба и экстракцию нуклеиновой кислоты. С целью разрушения микробной клетки используют простое кипячение, замораживание—оттаивание в присутствии лизоцима, а также специальные лизирующие буферы, содержащие детергенты и протеиназу. Выбор метода, как правило, диктуется природой микроба, а точнее природой его клеточной стенки. Для экстракции ДНК используют два основных метода. Во-первых, классическую процедуру фенольно-хлороформной экстракции. При этом достигается хорошая очистка ДНК и в первую очередь от ингибиторов Таq-полимеразы, но неизбежны большие потери нуклеиновой кислоты, особенно заметные при работе с образцами небольшого объема с низкой концентрацией инфекционного агента. Другой способ, применяемый для очистки нуклеиновой кислоты, основан на использовании нуклеосорбентов. Подготовка материала с применением нуклеосорбента занимает меньше времени и более проста в исполнении, хотя не всегда может гарантировать удаление возможных ингибиторов. Зная возможности и преимущества этого метода, сформулируем те направления исследований в инфекционной патологии, в решении которых ПЦР начинает играть ведущую роль: — диагностика хронических инфекционных состояний, обусловленных персистенцией бактерий или вирусов, — наиболее очевидная область применения ПЦР в диагностических целях; — ПЦР — незаменимый инструмент при идентификации и молекулярно- генетических исследованиях практически всех внутриклеточных и мембранных паразитов, таких как вирусы, риккетсии, хламидии, микоплазмы; — ПЦР является наиболее эффективным способом выявления и изучения возбудителей сапронозов, которые, находясь во внешней среде в "некультивируемом" состоянии, способны там сохраняться, переживая неблагоприятные внешние условия в межэпидемические периоды; — ПЦР позволяет проводить определение антибиотикорезистентности у мед- ленно растущих и труднокультивируемых бактерий; — технология ПЦР коренным образом изменила способы маркирования штаммов для целей эпидемиологического анализа, тем самым расширив его возможности. Теперь обратимся к конкретным примерам, которые показывают, как технология ПЦР позволяет решать перечисленные выше задачи. На настоящий момент преимущество ПЦР-анализа перед "золотым стандартом" (так красиво называют культуральный метод выявления бактерий и вирусов) состоит в следующем: 1) более высокая частота обнаружения микроба, превышающая культуральный метод на 6— 7%. Эти различия объясняются возможной гибелью микроба при хранении и транспортировке, тогда как ПЦР способна обнаруживать и нежизнеспособные формы микроорганизма; 2) время, необходимое для обнаружения микроба культуральным методом, составляет около 4-6 сут., тогда как при использовании ПЦР через 4—5 ч; 3) использование технологии ПЦР позволяет проводить определение инфекционного агента в образцах, взятых неинвазивным путем. Одной из наиболее интересных сфер приложения ПЦР в эпидемиологии является использование этой технологии для мониторинга объектов внешней среды. Помимо решения чисто прикладных задач (усовершенствование методик обнаружения возбудителей в пробах воды, почвы и т. д.) в этой области, ПЦР является важным инструментом для получения фундаментальной информации о способах поддержания жизнеспособности микроорганизмов вне связи с организмом животного или человека. За последние 5—7 лет накоплен достаточно обширный материал, свидетельствующий о способности многих видов патогенных бактерий переходить в так называемое некультивируемое состояние. Формирование некультивируемых форм бактерий сопровождается глубокими перестройками метаболизма и изменением морфологии бактериальной клетки. В результате клетки бактерий, сохраняя жизнеспособность, перестают делиться и, будучи перенесены на плотную питательную среду, не формируют колоний. Однако переход в некультивируемое состояние не является необратимым, и под воздействием изменяющихся условий внешней среды некультивируемые клетки бактерий могут восстанавливать способность к пролиферации.46 Очевидно, что некультивируемые формы бактерий нельзя выявить традиционными микробиологическими приемами, включающими посевы из исследуемых образцов на плотные питательные среды. Микроскопия с использованием витальных красителей в данном случае может служить лишь инструментом изучения формирования некультивируемых форм в лабораторном эксперименте. Показано, что переходить в некультивируемое состояние могут возбудители многих заболеваний человека. Переход в некультивируемое состояние представляет собой способ поддержания жизнеспособности в неоптимальных для активного роста условиях. Эта способность обнаруживается в первую очередь у патогенных бактерий—сапрофитов. Диагностика заболеваний, вызванных многими из подобных инфекционных агентов, успешно обеспечивается традиционными методами. Однако единственным в настоящее время методическим подходом, способным доказать присутствие в образце некультивируемых форм возбудителя, является ПЦР. При использовании такого подхода продемонстрировано, что эндемичность ряда природных очагов объясняется способностью возбудителей сапронозов сохраняться в объектах внешней среды в некультивируемом состоянии. Это положение, по нашему мнению, чрезвычайно важно для всей системы эпизоотоологического надзора, так как дает возможность, используя технологию ПЦР, выявлять потенциально опасные штаммы возбудителей сапронозов раньше, чем они попали в человеческую популяцию и вызвали эпидемиологическое осложнение. Большое значение приобретает метод ПЦР при контроле продуктов питания. Таким образом, технология ПЦР является мощным инструментом, обеспечивающим возможность фундаментального изучения хронических инфекционных процессов и экологии возбудителей инфекционных заболеваний.
[youtube.player]Читайте также:


