Ревматическая полимиалгия национальные рекомендации
Клиническая картина РПМ состоит из комбинации признаков поражения опорно-двигательного аппарата и изменений лабораторных показателей воспаления, которые наблюдаются у всех пациентов, а также общих (конституциональных) нарушений, возникающих часто, но не постоянно [6]. Клинические особенности РПМ отображены в следующих положениях.
• Основными клиническими симптомами являются боль и скованность в плечевом и тазовом поясе, шее, которые в большинстве случаев носят симметричный характер.
• Симптомы в большей степени выражены в утреннее время.
• Общеконституционные симптомы – слабость, вялость, общее недомогание, депрессия, потеря веса, субфебрильная температура тела.
• Характерны артралгии и артриты суставов кистей, теносиновиты кисти.
• Несмотря на наличие миалгий, отсутствует мышечная слабость, боль не уменьшает силу в конечностях, не отмечаются мышечные атрофии/гипотрофии.
• Определяется болезненность мышц при пальпации от слабой до умеренной.
• Уменьшение диапазона движений в суставах, возможно, из-за боли.
• Могут присоединяться симптомы гигантоклеточного артериита (болезни Хортона). Единого мнения по вопросу взаимосвязи РПМ и болезни Хортона нет. Она может быть начальным симптомом, возникать одновременно и появляться позже. Приблизительно у 15% пациентов с РПМ развивается гигантоклеточный артериит, и 40-50% больных с гигантоклеточным артериитом имеют РПМ [3].
• Лабораторные характеристики и особенности РПМ сгруппированы ниже.
• Существенное повышение СОЭ >50 мм/ч и уровня С-реактивного белка (СРБ). СРБ при этом – более чувствительный показатель, чем СОЭ.
• Анемия – нормохромная, нормоцитарная (анемия хронического заболевания).
• Миозит-специфические ферменты: нормальные значения креатинфосфокиназы, миоглобина, альдолазы.
• Ревматоидный фактор негативный (следует помнить о возможности позитивного ревматоидного фактора у 5% лиц без признаков ревматического заболевания), антитела к циклическому цитруллинированному пептиду – негативные.
• Антинуклеарные антитела – негативные.
• Наблюдается значительное повышение уровня интерлейкина-6, что коррелирует с выраженностью воспаления.
• Может отмечаться незначительное повышение уровня печеночных ферментов (АлАТ, АсАТ, ГГТП).
С помощью инструментальных методов исследования установлено, что клиническая симптоматика РПМ обусловлена главным образом воспалительными изменениями суставов и околосуставных тканей. Магнитно-резонансная томография, ультразвуковое исследование (УЗИ) и позитронно-эмиссионная томография позволяют выявить у больных РПМ признаки бурсита в области плечевых и тазобедренных суставов, а также шейного отдела позвоночника [7, 8]. Наиболее характерными являются поддельтовидный бурсит, теносиновит бицепса, трохантерный (вертлужный) бурсит, выпот в плечевом и/или тазобедренном суставах. Описан также синовит плечевых и тазобедренных суставов. При гистологическом исследовании синовиальной оболочки у больных РПМ наблюдается слабо выраженная воспалительная инфильтрация с преобладанием макрофагов и CD4 Т-клеток [10].
На сегодняшний день не существует единственного клинического, лабораторного или инструментального признака, наличие которого позволяло бы подтвердить диагноз РПМ. Диагностика проводится на основании совокупности проявлений болезни. Наиболее типичные из них используются в качестве диагностических критериев, предложенных Европейской группой по изучению РПМ [8]. Они включают обязательные необходимые критерии, к которым относят возраст ≥50 лет, двустороннюю боль в плечах (появившуюся менее 12 нед назад), повышение СОЭ/уровня CРБ. Критерии следует применять лишь в тех случаях, когда диагноз другого заболевания не представляется более обоснованным [4]. Для верификации диагноза и решения вопроса о назначении глюкокортикоидов (ГК) у таких пациентов могут быть использованы два набора критериев.
При отсутствии данных УЗИ диагноз может быть подтвержден на основании 4 признаков: утренней скованности более 45 мин, боли или ограничения подвижности в тазобедренном суставе, отсутствия ревматоидного фактора и АЦЦП, отсутствия поражения других суставов. Максимально возможная сумма баллов по данным 4 критериям составляет 6. Для подтверждения диагноза РПМ достаточно 4 баллов.
Второй набор классификационных критериев используется при наличии результатов УЗИ и, помимо указанных основных 4 параметров, включает 2 дополнительных. Каждый дополнительный критерий представляет собой набор сонографических признаков. Первый из них предусматривает наличие как минимум поддельтовидного бурсита и/или теносиновита бицепса и/или синовита плечевого сустава (заднего или аксиллярного отдела), а также синовита тазобедренного сустава и/или трохантерного бурсита. Второй определяется как наличие двустороннего поддельтовидного бурсита, теносиновита бицепса или синовита плечевых суставов. Каждый из дополнительных критериев оценивается в 1 балл. Поэтому при использовании второго набора классификационных критериев максимально возможная сумма баллов составляет 8, и в этом случае для подтверждения диагноза РПМ необходимо набрать 5 баллов (табл.).

На сегодняшний день существует множество расхождений в подходах к лечению РПМ, которые включают вопросы дозирования ГК и целесообразности использования базисных болезнь-модифицирующих антиревматических препаратов [5].
К сожалению, у большинства пациентов (29-45%), страдающих РПМ, не удается достичь адекватного ответа на терапию ГК в течение первых 3-4 недель. При этом приблизительно у 50% больных наблюдаются различные побочные эффекты на фоне лечения этой группой препаратов. Целью Американской коллегии ревматологов (ACR) и Европейской антиревматической лиги (EULAR) являлось обеспечение клиницистов кратким, четко изложенным современным руководством, которое поможет стандартизировать подходы к лечению и улучшить прогнозы для пациентов с данным заболеванием [9]. Как обычно, при создании подобных рекомендаций эксперты ACR и EULAR руководствовались доказательной методологией с использованием классов рекомендаций и уровней доказательств [2]. Алгоритм лечения РПМ, основанный на рекомендациях (EULAR/ACR 2015), представлен на рисунке.

Экспертами тщательно проработана и обобщена вся база исследований по РПМ, а после детальной оценки и обсуждения изложена в окончательном варианте данных рекомендаций [9].
1. На старте терапии больных РПМ настоятельно рекомендуется использовать ГК вместо нестероидных противовоспалительных препаратов (НПВП), за исключением возможного кратковременного применения НПВП и/или анальгетиков в случаях, когда болевой синдром ассоциирован с другой патологией (к примеру, сопутствующим остеоартритом).
2. Настоятельно рекомендуется использовать минимально эффективную индивидуальную длительность ГК-терапии у больных РПМ.
3. Условно рекомендуется применять минимально эффективную дозу ГК в диапазоне 12,5-25 мг преднизолона (или эквивалента) как стартового лечения РПМ. Вопрос о назначении более высокой стартовой дозы ГК в границах этого диапазона может рассматриваться у пациентов с высоким риском развития рецидива и низким риском возникновения побочных эффектов; в то же время у пациентов с сопутствующими заболеваниями (например, сахарным диабетом, остеопорозом, глаукомой и др.) и другими факторами риска для ГК-ассоциированных побочных эффектов может быть предпочтительным назначение более низких доз ГК. Условно отрицается использование начальных доз ≤7,5 мг/сут и высказаны настоятельные возражения против применения начальных доз >30 мг/сут.
4. Настоятельно рекомендуется индивидуализация графиков постепенной отмены ГК, основанных на регулярном мониторинге состояния пациента, активности заболевания, лабораторных маркеров и негативных событий. Предложены следующие принципы снижения доз:
a) стартовое снижение: рекомендуется медленно уменьшать дозу ГК до 10 мг/сут в пересчете на преднизолон на протяжении 4-8 нед;
b) терапия рецидивов: рекомендуется увеличить дозу перорального преднизолона до уровня, предшествовавшего рецидиву, и в последующем уменьшать ее постепенно (в течение 4-8 нед) до дозы, во время приема которой случился рецидив;
c) снижение дозы в период ремиссии: после достижения ремиссии необходимо уменьшать дозу перорального преднизолона на 1 мг каждые 4 нед (либо на 1,25 мг, используя, к примеру, схему 10/7,5 мг через день и т.д.) на протяжении того времени, пока сохраняется ремиссия.
5. Условно рекомендуется рассмотреть возможность внутримышечного введения метилпреднизолона как альтернативы применению пероральных ГК. Выбор между пероральным и внутримышечным введением остается на усмотрение врача. Рекомендации не могут четко указать фенотип пациента, который бы нуждался во внутримышечном введении ГК. Предложен следующий график отмены внутримышечного метилпреднизолона:
• метилпреднизолон (депо-форма) внутримышечно 120 мг каждые 3 нед до 9-й недели;
• на 12-й неделе – 100 мг, с последующими 3-месячными интервалами;
• далее доза снижается на 20 мг каждые 12 нед до 48-й недели;
• после этого доза снижается на 20 мг каждые 16 нед до полного прекращения.
6. Условно рекомендуется использовать одноразовый, а не раздельный прием ежедневных доз ГК для лечения РПМ. Разделять дозу препарата на несколько приемов следует в случае выраженного интенсивного болевого синдрома в ночное время суток.
7. Условно рекомендуется учесть возможность раннего назначения метотрексата в дополнение к ГК, в частности у пациентов с высоким риском развития рецидива и/или длительной терапии, а также в случаях имеющихся факторов риска, сопутствующих заболеваний и/или приема сопутствующих препаратов, когда высока вероятность возникновения осложнений ГК-терапии или побочных эффектов ГК. В клинических испытаниях метотрексат применялся перорально в дозах 7,5-10 мг/нед.
8. Настоятельно не рекомендуется использовать ингибиторы фактора некроза опухолей для лечения РПМ в связи с отсутствием доказательной базы. В настоящее время продолжается только одно рандомизированное клиническое исследование с тоцилизумабом (clinicaltrials.gov NCT01396317), а также в другом исследовании сравниваются секукинумаб, канакинумаб и ГК (clinicaltrials.gov NCT01364389).
9. Условно рекомендуется рассмотреть вопрос о создании индивидуальной программы упражнений для пациентов с РПМ, направленных на поддержку мышечной массы и функции, а также снижение риска падений.
10. Применение растительных препаратов в терапии РПМ не рекомендуется.
Особенно категорически авторы документа выступают против использования китайских травяных препаратов Yanghe и капсул Biqi у пациентов с РПМ. Данное заявление связано в первую очередь с тем, что вышеуказанные средства не одобрены Управлением по контролю качества пищевых продуктов и лекарственных препаратов США (FDA), а также Европейским агентством лекарственных средств (EMA).
Настоящие рекомендации [9] Американской коллегии ревматологов и Европейской антиревматической лиги предназначены прежде всего для врачей-клиницистов, и предполагается, что они окажут им определенную помощь в ведении пациентов с РПМ.
1. Бунчук Н.В. Ревматические заболевания пожилых. – М.: МЕДпресс-информ, 2010. – 272 с.
2. Ватутин Н.Т., Смирнова А.С., Тарадин Г.Г., ЭльХатиб М.А. Обзор рекомендаций по лечению ревматической полимиалгии (EULAR/ACR 2015). Архивъ внутренней медицины. 2016; 1: 3-5.
3. Глазунов А.В., Жиляев Е.В., Толдиева Ф.А. Ревматическая полимиалгия и височный артериит. Клиническая геронтология. 2006; 6: 34-46.
4. Олюнин Ю.А. Ревматическая полимиалгия. Consilium medicum. 2013; 15(9): 53-57.
5. Сатыбалдыев А.М. Лечение ревматической полимиалгии. Современная ревматология. 2013; 1: 66-72.
6. Щедрина И.С., Троицкая М.П., Овчаренко С.И. Ревматическая полимиалгия: сложности диагностики. Лечащий врач. 2011; 4: 33-36.
7. Blockmans D., de Ceuninck L., Vanderschueren S. et al. Repetitive 18-fluorodeoxyglucose positron emission tomography in isolated polymyalgia rheumatica: a prospective study in 35 patients. Rheumatology (Oxford) 2007; 46 (4): 672–677.
8. Dasgupta B., Cimmino M., Maradit-Kremers H. et al. 2012 provisional classification criteria for polymyalgia rheumatica: a European League Against Rheumatism/American College of Rheumatology collaborative initiative. Ann Rheum Dis. 2012; 71(4): 484-492.
9. Dejaco C., Singh Y., Perel P. et al. 2015 Recommendations for the management of polymyalgia rheumatica: a European League Against Rheumatism. American College of Rheumatology collaborative initiative Ann Rheum Dis. 2015; 74: 1799–1807.
10. Meliconi R., Pulsatelli L., Uguccioni M. et al. Leukocyte infiltration in synovial tissue from the shoulder of patients with polymyalgia rheumatica. Quantitative analysis and influence of corticosteroid treatment. Arthritis Rheum. 1996; 39 (7): 1199-1207.
11. Spiera R., Westhovens R. Provisional diagnostic criteria for polymyalgia rheumatica: moving beyond clinical intuition? Ann Rheum. Dis. 2012; 71 (4): 475-476.
![]()
Ревматическая полимиалгия (РПМ) является воспалительным ревматологическим синдромом, который проявляется в виде боли и утренней ригидности, поражающей шею, плечевой пояс и/ или тазовый пояс у лиц старше 50 лет. Также может отмечаться вовлечение периферической мышечно-скелетной системы. РПМ возникает при отдельном заболевании или ассоциируется с гигантоклеточным артритом.
Точная причина возникновения РПМ неизвестна. Сообщалось о конфликтных наблюдениях относительно сезонных изменений заболеваемости РПМ. Данные наблюдения предполагают действие возбудителей инфекции, например, аденовируса, РСВ, I тип вируса парагриппа, парвовирус В19, Mycoplasma pneumoniae и Chlamydia pneumoniae.
Хотя исследования связи могут предлагать рассматривать возбудителей болезни в качестве возможно этиологии, ни в одном исследовании данный факт не был установлен. Предположение о роли генетических факторов было сделано на основании различий в этническом происхождении и случаях в семейной истории. Существует связь между РПМ и аллелями HLA-DRB1*04 и -DRB1*01, а также с генетическими полиморфизмами для ICAM-1, факторами некроза опухоли-альфа, а также антагонистами рецепторов интерлейкина (IL)-1.
Данные факторы могут влиять на предрасположенность к РПМ. Предполагается потенциальное действие гормонов на основании наблюдений пониженной функции надпочечников у пациентов, не получавших лечение. Отмечался нормальный уровень кортизола и низкий уровень дегидроандростерона.
Патогенез РПМ остается неуточненным. Учитывая связь РПМ с гигантоклеточным артритом (ГКА), предположили действие механизмов, подобных тем, которые вызывают ГКА. Хотя васкулит присутствует при ГКА, васкулит с поражением сосудов шеи, плечевого пояса и тазового пояса не был выявлен. Повышенный уровень интерлейкина (IL)-6 в сыворотке и в пробах биопсии височной артерии отмечался у пациентов с ОПМ и ГКА, что предполагает воспалительное действие IL-6.
Кроме того, существует предположение, что полиформизмы провоцирующего фактора IL-6 влияют на клиническое выражение РПМ и ГКА. Результаты исследования предполагают, что пациенты с РПМ и ГКА имеют схожие профили мРНК цитокинов, полученных из макрофагов in situ. Выявили, что IL-2 и интерферон (IFN)-гамма вырабатываются Т-лимфоцитами в васкулитных очагах. Тем не менее, при РПМ не отмечалось экспрессии IFN-гамма, предполагающей действие IFN-гамма в прогрессировании васкулита.
Снижение уровня иммунодепрессивных Трегулирующих лимфоцитов и повышение уровня провоспалительных клеток Т-хелпера 17 отмечалось в исследовании у пациентов с РПМ по сравнению с контролем по возрастным группам, что предполагает дисбаланс при иммунологической регуляции.
У пациентов с впервые диагностированной РПМ отмечалось сниженное количество В-клеток и перераспределение субпопуляций по сравнению с контролем, что позволяет предположить, что В-клетки выполняют регулирующую функцию в патогенезе РПМ.
Значимое снижение уровня глутамата и простгландина Е2, с сохраненным значением мышечного лактата и тока крови при эффективном лечении кортикостероидами в одном исследовании с участием пациентов с РПМ указывает на то, что ишемия ткани может не быть основной причиной мышечных симптомов РПМ.
Диагноз главным образом основывается на анамнезе.
Пациенты, как правило, женщины в возрасте старше 50 лет, жалуются на внезапное появление болей и ригидности в области шеи, плечевого и/или тазового пояса, которые ухудшаются по утрам. Ригидность может быть настолько тяжелой, что может быть проблематично встать с кровати. Ригидность улучшается до различной степени в течение дня. Могут проявляться конституционные симптомы, например, субфебрильная лихорадка, потеря веса, астения, слабость, анорексия, ночная потливость и депрессия. Пациент может сообщать об асимметричной боли в суставах, симптомах запястного синдрома и отекании кистей и ступней. Кроме того важно проверить анамнез на наличие симптомов, указывающих на гигантоклеточный артрит (ГКА), например, односторонней височной или затылочной боли, хронического вывиха нижней челюсти, болезненности кожи головы или визуальных симптомов
Быстрый ответ на лечение кортикостероидами в течение 24-72 часов лечения (некоторыми критериями установлен период 4-7 дней) может эффективно поддержать диагноз РПМ и его дифференциацию от воспалительных расстройств.
Полный ответ на лечение низкими дозами кортикостероидов не исключает диагноз.
У пациентов может отмечаться ограниченный диапазон движений плечами и бедрами изза боли или ригидности. У пациента могут возникать проблемы при вставании со стула или стола для осмотров. Данные симптомы могут возникнуть из-за болей в плечевых и бедренных мышцах, плече-лопаточного периартрита, вертлужного бурсита бедер, и иногда олигоартрита периферических суставов. Иногда отмечается отечность пальцев и дорсальной поверхности запястий и ступней в результате теносиновита.
Соответствующие негативные находки в отношении других систем органов, включая отсутствие язв во рту, сыпи, сердечно-легочные патологии, абдоминальные патологии и очаговые неврологические находки. Пациенты должны пройти оценку на истончение височных и затылочных артерий, узлов и чувствительность, а также чувствительность кожи головы для оценки ГКА.
Повышенные значения СОЭ и/или СРБ поддерживают диагноз в анамнезе и данных осмотра. Нормальные значения в анамнезе и данные, полученные при осмотре, не исключают диагноз, так как при РПМ редко отмечаются нормальные значения маркеров системного воспаления. Определение уровня интерлейкина-6 в сыворотке клинически доступно. Хотя повышенное значение может быть чувствительным маркером для определения активности заболевания РПМ и поддерживать диагноз, оно не является достаточно специфическим для применения в качестве диагностического теста. Гипотироидизм может периодически сопутствовать артралгиям и ригидности, исследования функции щитовидной железы необходимо включить в диагностическое исследование при подозрении на РПМ. Так как при некоторых миелопролиферативных заболеваниях могут проявляться симптомы, подобные РПМ,а именно, утомляемость, боль в костях, повышенные значения СОЭ, полный клинический анализ крови и электрофорез белков также рекомендуется, как часть оценки РПМ. В случаях преобладания боли в области плечей необходимо рассмотреть миозит в качестве дифференциального диагноза и проверить уровень креатинфосфокиназы (КФК).
Ультразвук и МРТ могут быть эффективны в дифференциации бурсита, синовита или теносиновита в области плечей и бедер. Данные тесты могут быть эффективны при постановке диагноза РПМ с меньшим количеством признаков и симптомов. Симметричный бурсит или теносиновит в области плечей и бедер при отсутствии синовита скорее указывает на РПМ. Присутствие симметричного артрита плеча и/или бедра при отсутствии бурсита или теносиновита скорее указывает на системный артрит, например на ревматоидный артрит; УЗИ и МРТ могут помочь отличить данные характеристики.
Один системный поиск в литературе в отношении применения визуализации при РПМ показал, что теносиновит длинной головки сухожилия бицепса, двухсторонний плече-лопаточный периартрит и вертлужный бурсит характерны для пациентов с РПМ. МРТ и УЗИ были эффективны в определении этих данных. Кроме того МРТ часто применяется для выявления межостистого бурсита. Эти данные являются значимыми, так как коррелируют с определением симптомов РПМ в области плечей и бедер.
Повышенное поглощение фтордеоксиглюкозы F-18 в процессе ПЭТ-сканирования может эффективным при определении воспаления в суставах, синовиальной сумке и теносиновиальных тканях в области плечей и больших сосудов. Хотя данная информация может быть полезной при диагностике РПМ, остается неясным, может ли подобное сканирование предупредить о рецидивах.
Цель лечения — достичь состояния без воспаления и симптомов. В идеале пациент должен вернуться к исходному уровню функционирования с нормальной СОЭ и/или СРБ.
Основа терапии — кортикостероиды в низких дозах; эффект обычно наступает в течение 24-72 часов. Доза кортикостероидов повышается до полного исчезновения симптомов и нормализации СОЭ и СРБ. При неудаче лечения необходимо провести переоценку диагноза или признать наличие резистентности к лечению.
Рекомендуется минимально эффективная доза кортикостероидов (то есть, 12,5-25 мг/сут преднизолона или его эквивалента), при этом дозы ≤7,5 мг/сут или >30 мг/сут не рекомендуются. В целом постепенное снижение дозы должно быть индивидуальным у каждого пациента. Однако после разрешения симптомов и нормализации воспалительных маркеров рекомендуется постепенное снижение дозы преднизолона (или его эквивалента) до 10 мг/сут за 4-8 недель. Затем рекомендуется постепенно снижать дозу преднизолона (или его эквивалента) на 1 мг/в месяц.
При рецидивах доза увеличивается до той, которая применялась до рецидива, с последующим постепенным снижением дозы до той, при которой случился рецидив, за 4-8 недель.
У пациентов с плохой приверженностью можно использовать внутримышечное введение метилпреднизолона, хотя это не стандартная терапия. Если лечение преднизолоном или его эквивалентом в дозах, превышающих физиологические (>5 — 7,5 мг/сут), длится дольше 1 месяца, рекомендуется назначать профилактику кортикостероидиндуцированного остеопороза (добавки кальция, витамина D и бисфосфонатов). Чтобы минимизировать риск желудочно-кишечного кровотечения, следует избегать сочетанного применения НПВП.
Симптомы отмены включают артралгии, недомогание и усталость, что можно спутать с рецидивом симптомов РПМ. Для предотвращения рецидивов и обострений симптомов часто требуется постепенное снижение дозы кортикостероидов в течение 2-3 лет.
НПВП не рекомендуются для лечения РПМ. Их можно назначить на короткое время для купирования боли, связанной с другими заболеваниями (например, синдром отмены кортикостероидов). Для предотвращения развития язвенной болезни с риском кровотечения из ЖКТ при хроническом применении НПВП необходимо назначить ингибитор протонной помпы (например, омепразол).
Метотрексат следует назначить рано во время лечения (назначается индивидуально). В частности, его следует назначить лицам с высоким риском рецидива или длительной терапией, пациентам с рецидивом в анамнезе, пациентам, у которых не удалось достичь адекватного ответа на терапию кортикостероидами или тем, у кого возник рецидив во время постепенного снижения дозы, а также пациентам, у которых длительное применение кортикостероидов связано с серьезными неблагоприятными последствиями (т.е., остеопорозом, глаукомой, катарактой, сахарным диабетом).
Фолиевая кислота применяется параллельно для снижения риска метотрексат-связанных побочных эффектов. Применять метотрексат рекомендуется по назначению специалистов-практиков, которые либо имеют опыт его применения, либо проконсультировавшись с такими опытными практиками.
Перед началом лечения рекомендуется выполнить рентген ОГК для оценки любого фонового интерстициального заболевания легких. Если выявлено фоновое интерстициальное заболевание легких, метотрексат обычно не назначается. Любое другое серьезное заболевание легких может быть относительным противопоказанием для назначения метотрексата. Если метотрексат применяется в качестве препарата, смягчающего действие кортикостероидов, его прием следует продолжать до тех пор, пока можно будет снизить дозу кортикостероидов без рецидива симптомов РПМ. Не существует окончательных руководств по снижению дозы метотрексата. Однако после того, как доза кортикостероидов была успешно снижена, разумно будет отменить метотрексат, постепенно снижая дозу в течение приблизительно 3 месяцев.
Перед назначением метотрексата рекомендуется определить исходный уровень ОАК, функциональные печеночные пробы (ФПП) и провести серологическое исследование на гепатит B и C. Относительными противопоказаниями к назначению метотрексата являются значительные отклонения печеночных проб, гематологические отклонения, гепатит B или C в анамнезе, активное употребления алкоголя или злокачественное новообразование в анамнезе.
ОАК, креатинин и ФПП необходимо контролировать один раз в месяц при каждом повышении дозы. После того, как будет установлена стабильная доза, которая принимается в течение 6 месяцев без каких-либо побочных эффектов, эти уровни можно будет контролировать каждые 3 месяца.
Около 30-50% пациентов страдает от рецидива, который не связан с дозой кортикостероидов или скоростью снижения дозы, рецидив обычно наступает в течение 2 лет после постановки диагноза. В таких случаях доза кортикостероидов увеличивается до такой, которая позволит контролировать симптомы и нормализовать СОЭ и СРБ. Как только симптомы удастся взять под контроль, можно возобновить постепенное снижение дозы.
Хотя не существует точного определения рецидива РПМ, дельфийский консенсусный подход коллегии ревматологов выделяет следующие полезные параметры для определения ремиссии и рецидива РПМ: утренняя скованность; боль в шее, лопатках, плечах и тазовом поясе; боль в плече при активных и пассивных движениях; ограничение поднятия плеча; синовит тазобедренного сустава; СОЭ и СРБ; а также лечебная доза кортикостероидов.
Для контроля симптомов и нормализации СОЭ и СРБ доза кортикостероидов может быть увеличена до двух приемов в день. Как только это удастся, дозу можно постепенно снижать.
Сообщалось о нескольких случаях эффективности ингибитора ИЛ-6 тоцилизумаба и ряде случаев эффективности лефлуномида для лечения рецидива/рефрактерного РПМ; однако не существует контролированных исследований для подтверждения этих ограниченных наблюдений.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Ключевые слова: ревматическая полимиалгия, классификационные критерии, глюкокортикоиды, острофазовые показатели крови.
Для цитирования: Башкова И.Б., Бусалаева Е.И. Ревматическая полимиалгия: редко диагностируемое, но нередко встречающееся заболевание. РМЖ. Медицинское обозрение. 2017;1:48-52.
Rheumatic polymyalgy: frequent disease, which is rarely diagnosed
Bashkova I.B.1, Busalaeva E.I. 1,2
1 Chuvash State University named after I.N. Ulyanov, Cheboksary
2 Institute for Advanced Training of Doctors, Cheboksary
Rheumatic polymyalgia (RPM) is an inflammatory disease of the musculoskeletal system with typical manifestations, the most noticeable of which is a combination of pains in proximal muscle groups with a high acute phase inflammatory response, high efficacy of small doses of prednisolone, and which develops exclusively in people over 50 years old. The modern classification criteria are designed to facilitate the timely diagnosis, though careful collection of anamnesis and examination of the patient are of a great importance too. Differential diagnostics of RPM is given. Despite the classic debut and the further course of the disease, timely diagnosis is significantly delayed, which is due to low awareness of doctors about this pathology. A clinical case in a patient aged over 50 years is presented. The patient had a bilateral pain in the shoulder area and an increase in the acute phase blood values, the morning stiffness for more than 45 minutes, bilateral synovitis of the shoulder joints, no increase in the level of rheumatoid factor and anti-bodies to the cyclic citrullinated peptide, which allowed diagnosing RPM. A good effect of using prednisolone was an additional sign. Inadequate knowledge of physicians regarding the possible development of RPM in elderly patients, became the reason for a late verification of the diagnosis. After the appointment of glucocorticoids, the patient returned to the initial body weight within a month. The subfebrility and arthritis of peripheral joints was fully relieved, the volume of active movements in the joints was restored.
Key words: rheumatic polymyalgia, classification criteria, glucocorticoids, acute phase blood values.
For citation: Bashkova I.B., Busalaeva E.I. Rheumatic polymyalgy: frequent disease, which is rarely diagnosed // RMJ. MEDICAL REVIEW. 2017. № 1. P. 48–52.
Статья посвящена проблеме ревматической полимиалгии. Приводится дифференциальная диагностика ревматической полимиалгии. Описан клинический случай данного заболевания.

Пациентка М., 71 год, самостоятельно обратилась на прием к ревматологу с жалобами на сильные боли, охватывающие область шеи и верхнего плечевого пояса. Боли носили двусторонний, постоянный характер, усиливались при движении, в т. ч. и ночью, при каждом изменении положения тела, кратковременное облегчение состояния приносил прием простых анальгетиков или НПВП. Также беспокоила скованность, наиболее выраженная утром после пробуждения (сохранялась более 1 ч) или любого длительного периода неподвижности. Болевой синдром сопровождался ограничением активных движений в суставах, пациентка нуждалась в посторонней помощи при выполнении элементарных бытовых и гигиенических действий. Еще одной жалобой было онемение пальцев кистей и трудности при сжатии кистей в кулак. Из конституциональных проявлений обращали на себя внимание повышение температуры тела до 37,5° С (на протяжении последних 4–5 нед.) и похудание на 5 кг за 4 мес.
С 2010 г. наблюдалась у терапевта по поводу двустороннего коксартроза, проводились краткосрочные курсы приема симптоматических препаратов медленного действия (хондроитина сульфат) и нестероидных противовоспалительных препаратов (НПВП). Прогрессирующий характер поражения тазобедренных суставов и стойко сохраняющийся болевой синдром стали причиной последовательного проведения тотального эндопротезирования обоих суставов (2013, 2014 г.). В амбулаторных условиях дальнейшее лечение остеоартроза не проводилось.
Резкое ухудшение состояния – с июня 2017 г., когда впервые отметила появлений болей в суставах и мышцах верхнего плечевого пояса и области шеи. В течение нескольких недель интенсивность суставно-мышечных болей нарастала, присоединились ночные боли, затруднения при самообслуживании, стала отмечать ежедневное повышение температуры тела до субфебрильных цифр. Появление онемения пальцев обеих кистей, парастезий (усиливались по ночам) послужило поводом к обращению к неврологу. При обследовании выявлен синдром запястного канала (туннельная нейропатия срединного нерва), носивший двусторонний характер. В июле 2017 г. в условиях травматологического отделения одного из городских стационаров были выполнены пластика карпальной связки левой кисти и невролиз срединного нерва слева. Значимого улучшения самочувствия пациентки в послеоперационном периоде не последовало, было предложено выполнение аналогичного оперативного вмешательства на другой кисти, от проведения которого она отказалась. Следует обратить внимание, что в условиях стационара не было обращено должного внимания на резкое повышение острофазовых показателей крови (СОЭ по методу Вестергрена – 78 мм/ч, СРБ – 53 мг/л).
Интенсивный суставно-мышечный синдром с конституциональными проявлениями, сохранение высокого лабораторного воспалительного ответа, отсутствие эффекта от приема НПВП послужили поводом к обращению пациентки к ревматологу в сентябре 2017 г. При объективном осмотре: состояние средней степени тяжести, выражение лица страдальческое. Нуждается в посторонней помощи при раздевании. Диффузный отек кистей, кисти с трудом сжимаются в кулак. Выявлено ограничение активных движений в обоих плечевых суставах, при заведении рук за спину и за голову, болезненность при пальпации в области бугорков головок плечевых костей, лучезапястных суставов. Узелки Гебердена и Бушара в области межфаланговых суставов кистей. Послеоперационные рубцы по передненаружной поверхности обоих бедер. По внутренним органам и системам – без особенностей.
По результатам дообследования: ревматоидный фактор (РФ) – 1,0 Ед/л, антитела к циклическому цитруллинированному пептиду (АЦЦП) – менее 7 Ед/мл (при верхней границе – до 17). Тиреотропный гормон – 4,02 мМЕ/л (при верхней границе – до 3,4) в отсутствие изменения сывороточного уровня тиреоидных гормонов. В протеинограмме отмечалось повышение содержания альфа-2-глобулинов в отсутствие изменения уровня общего белка. Уровни КФК, ЛДГ, трансаминаз, щелочной фосфатазы, кальция оставались в пределах референсных значений. Антинуклеарные антитела не обнаружены.
При проведении УЗИ плечевых суставов выявлены двусторонний синовит плечевых суставов, бурсит сумки подлопаточной мышцы, более выраженный справа.
Таким образом, у пациентки в возрасте старше 50 лет с двусторонними болями в области плечевого пояса и повышением острофазовых показателей крови (обязательные критерии) определялись дополнительные критерии: утренняя скованность более 45 мин (2 балла), отсутствие повышения в сыворотке крови РФ и АЦЦП (2 балла), двусторонний синовит плечевых суставов по результатам УЗИ (1 балл), что позволило расценить это состояние как РПМ.
Дополнительным признаком стал также хороший эффект от приема преднизолона в дозе 15 мг/сут, отмеченный через 3 сут от начала приема ГК.
Недостаточная осведомленность врачей в отношении возможного развития у пожилых пациентов РПМ послужила поводом для поздней верификации диагноза (спустя 4 мес. от дебюта заболевания) и необоснованного проведения хирургического вмешательства. Необходимо также отметить, что диффузный умеренно выраженный отек правой кисти со сгибательной контрактурой пальцев, вероятно, за счет ладонного фасциита и парастезии пальцев полностью купировались на фоне лечения ГК. Спустя 1 мес. от начала терапии ГК наблюдалось снижение уровней СОЭ до 35 мм/ч (по методу Вестергрена) и СРБ до 12 мг/л. Пациентка в течение 1 мес. вернулась к исходной массе тела. Полностью купированы субфебрилитет и артрит периферических суставов, восстановился объем активных движений в суставах, в посторонней помощи не нуждается.
В таблице 2 представлены основные заболевания, которые включаются в круг дифференциально-диагностического поиска при установлении диагноза РПМ, и их отличительные особенности, позволяющие исключить данные состояния. 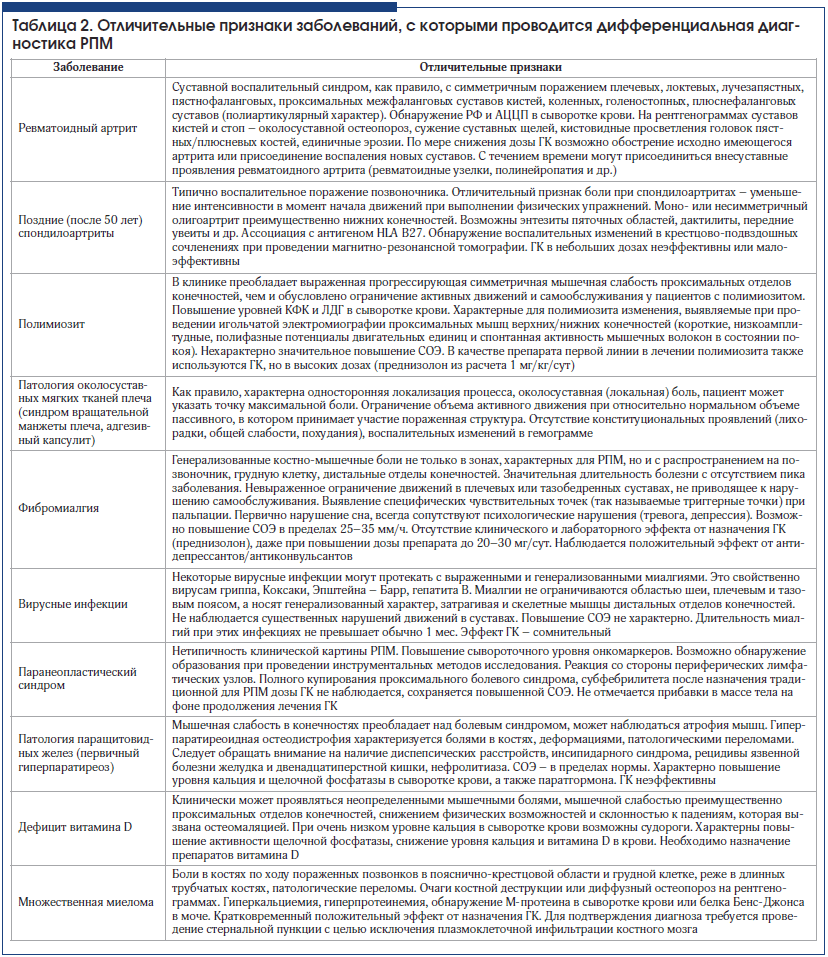
Только для зарегистрированных пользователей
Читайте также:


