Ревматоидный артрит инфаркт миокарда
При обнаружении у больного РА митрального стеноза всегда необходимо исключать его ревматическую этиологию, так как сочетание РА с предшествующим ревматическим пороком признается многими авторами. Патогмоничным признаком ревматоидного артрита являются рев
Ревматоидный артрит (РА) — хроническое системное воспалительное заболевание соединительной ткани с прогрессирующим поражением преимущественно периферических (синовиальных) суставов по типу симметричного эрозивно-деструктивного полиартрита с частыми внесуставными проявлениями, среди которых поражение сердца, по данным вскрытия, отмечается в 50-60% случаев [1, 4, 7]. Изменения в сердце при РА в недавнем прошлом выделяли в суставно-сердечную форму заболевания. При поражении суставов, когда заметно снижается физическая активность, сердечная патология часто маскируется, что требует от врача более внимательного и тщательного обследования больного. При этом клинические изменения со стороны сердца, как правило, минимальные и редко выходят на первый план в общей картине основной болезни. Системные проявления РА, в том числе и поражение сердца, определяют прогноз в целом, поэтому важно их раннее распознавание и целенаправленное лечение.
 |
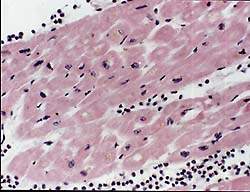
| Рисунок 1. Интерстициальный миокардит, умеренный васкулит. Окр. гематоксилином и эозином. Х 150 |
Частота поражения миокарда при РА в форме миокардита не выяснена. Это обусловлено, с одной стороны, трудностью диагностики миокардита у лиц с ограниченной двигательной активностью, с другой — отставанием клинических проявлений от морфологических изменений сердца [6, 7]. Патология миокарда носит полиморфный характер в связи с наличием различной давности сосудистых поражений [7]. В одних сосудах имеется васкулит, в других — гиалиноз, в третьих — склероз. Характер васкулита может быть пролиферативным и редко пролиферативно-деструктивным. В воспалительном инфильтрате преобладают лимфогистиоцитарные элементы как в периваскулярном пространстве (рис. 1), так и в стенке сосудов. Следует отметить, что при активации основного процесса наблюдается сочетание старых и свежих сосудистых изменений. Наряду с этим встречается очаговый, или диффузный, интерстициальный миокардит, заканчивающийся развитием мелкоочагового кардиосклероза. У больных ревматоидным артритом нередко развивается бурая атрофия миокарда с накоплением липофусцина в кардиомиоцитах (рис. 2). Эти изменения могут являться причиной стенокардии. Патогмоничным признаком ревматоидного артрита являются ревматоидные узелки в миокарде, перикарде и эндокарде в основании митрального и аортального клапанов, в области фиброзного кольца. В исходе узелка развивается склероз, вызывающий формирование недостаточности клапанов. Миокардит проявляется и диагностируется, как правило, на высоте активности основного ревматоидного процесса, то есть при очередном выраженном обострении суставного синдрома.
 |
| Рисунок 2. Интерстициальный миокардит. Отложения липофусцина в перинуклеарных пространствах. Окр. гематоксилином и эозином. Х 400 |
Ведущей жалобой при миокардите в дебюте поражения сердца являются неприятные ощущения в области сердца (кардиалгии), невыраженные, длительные, разлитые и без четкой локализации, как правило, без иррадиации и не купирующиеся нитратами. К основным жалобам относятся сердцебиение, перебои и реже одышка при физической нагрузке. Быструю утомляемость, повышенную потливость и субфебрилитет врачи обычно связывают с очередным обострением РА, а не с кардиальной патологией [3].
При аускультации физикальные данные выявляют тахикардию и ослабление I тона с систолическим шумом, нередко удается выслушать III тон. Как правило, миокардит при РА не склонен к прогрессированию, признаки сердечной недостаточности отсутствуют [4].
При обычном ЭКГ-исследовании могут отмечаться снижение зубцов Т, опущение интервалов ST, небольшие нарушения внутрижелудочковой проводимости. Эти изменения неспецифичны и могут сопровождать различные заболевания. Более характерное для миокардитов замедление атриовентрикулярной проводимости бывает редко.
В литературе описано значительное число наблюдений, когда нарушение ритма сердца служит единственным патологическим симптомом поражения коронарных артерий. Нарушение ритма и проводимости при активном РА существенно чаще определяется при суточном мониторировании ЭКГ и чреспищеводном электрофизиологическом исследовании, чем при обычной ЭКГ. Так,
И. Б. Виноградова [2] при исследовании больных РА с использованием вышеуказанной методики выявила нарушение ритма и проводимости у 60% больных, в том числе предсердную (18%) и желудочковую (10%) экстрасистолию, пароксизмальную тахикардию (4%), мерцательную аритмию (6%), проходящую блокаду правой ножки пучка Гиса (20%) и атриовентрикулярную блокаду II степени (2%). Также было высказано предположение, что депрессия ST, выявляемая при чреспищеводном электрофизиологическом исследовании, является косвенным признаком изменения коронарной микроциркуляции вследствие ревматоидного васкулита. Поэтому у данных больных отмечены высокие уровни циркулирующих иммунных комплексов, ревматоидного фактора, антител к кардиолипину Ig M. Важно отметить, что в этой же группе больных имелись другие признаки васкулита: дигитальный артериит, сетчатое ливедо, синдром Рейно и ревматоидные узелки. Следовательно, если рутинные клинические методы исследования не выявляют достаточно убедительных признаков ревматоидного миокардита, то современные электрофизиологические исследования обнаруживают факты нарушений функции сердца, что указывает на связь этих изменений с активностью ревматоидного процесса. Подтверждением этому может служить положительная динамика изменений под влиянием адекватного лечения основного заболевания, обычно отмечаемая при регрессе суставного синдрома.
Дифференциальная диагностика миокардита и миокардиодистрофии, нередко проводящаяся у больных РА, длительно получающих массивную лекарственную терапию, затруднена, т. к. клинические проявления в том и другом случае близки [5, 6]. Наличие миокардита подтвердит положительная динамика его проявлений под влиянием правильно подобранного и назначаемого в адекватных дозах противоревматического лечения.
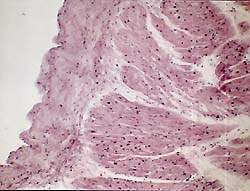 |
| Рисунок 3. Утолщение перикарда. Склероз. Окр. гематоксилином и эозином. Х 150 |
Перикардит является наиболее характерным поражением сердца при РА [1]. Патологоанатомически он выявляется в подавляющем большинстве случаев в виде фиброзного, реже геморрагического перикардита; нередко обнаружение характерных ревматических гранулем. Отличительной особенностью перикардита при ревматоидном артрите является участие в воспалении крупных базофильных гистиоцитов под зоной фибринозных наложений. Глубже формируется грануляционная ткань, содержащая лимфоциты и плазматические клетки, с утолщением перикарда и формированием грубого склероза (рис. 3).
Больной может предъявлять жалобы на боли в области сердца разной интенсивности и длительности. Частота клинической диагностики перикардита различна (20-40%) и зависит в основном от тщательности клинического изучения больного и уровня компетентности клинициста. В большинстве случаев анатомически определяются спайки в полости перикарда и утолщение последнего за счет склеротического процессса, нередко рецидивирующего. Выпот обычно небольшой, без признаков тампонады. Подтверждается, как правило, данными рентгенологического исследования, указывающими на нечеткость и неровность контуров сердца. Шумы трения перикарда непостоянны, выслушиваются далеко не у всех больных, хотя в некоторых случаях остаются длительно в виде перикардиальных щелчков в различные фазы сердечного цикла, что фиксируется качественным ФКГ-исследованием. ЭКГ-изменения у большинства больных неспецифичны для перикардита. Но в случае появления даже умеренного экссудата можно наблюдать снижение вольтажа QRS с положительной динамикой при уменьшении выпота. Перикардиты при РА склонны к рецидивированию. В части случаев перикардиты сопровождаются появлением конкордантных отрицательных зубцов Т на многих ЭКГ-отведениях, что может приводить к постановке ошибочного диагноза инфаркта миокарда. Большое значение в обнаружении РА-перикардитов имеет эхокардиография, позволяющая выявлять изменения перикарда (его уплотнение, утолщение, наличие жидкости) и динамику этих изменений при повторных исследованиях. Во многих случаях ЭХО-изменения перикардита являются неожиданной находкой как для больного, так и для лечащего врача [8].
Эндокардит при РА отмечается значительно реже, чем перикардит. Патологоанатомические данные свидетельствуют о нередком вовлечении в процесс эндокарда, в том числе клапанного, в виде неспецифических воспалительных изменений в створках и клапанном кольце, а также специфических гранулем. У большинства больных вальвулит протекает благоприятно, не приводит к значительной деформации створок и не имеет ярких клинических проявлений. Однако у некоторых больных течение вальвулита может осложняться деформацией створок и сопровождаться выраженной недостаточностью пораженного клапана, чаще митрального, что диктует необходимость хирургической коррекции порока. Обычно эндокардит сочетается с миокардитом и перикардитом. В литературе обсуждается возможность образования стенозов митрального и аортального клапанов, но единого мнения по этому вопросу нет [6]. При обнаружении у больного РА митрального стеноза всегда необходимо исключать ревматическую этиологию его, т. к. сочетание РА с предшествующим ревматическим пороком признается многими авторами [4].
С целью изучения характера клапанной патологии сердца при РА проанализированы результаты лечения 297 больных с достоверным РА по критериям АРА. Анализ показал, что чаще всего — в 61,6% случаев — имеет место митральная регургитация. При этом у 17,2% больных она была умеренной или выраженной. У 152 (51,2%) больных полипроекционное ЭХО-КГ-исследование структурных изменений створок клапанов не выявило. Более детальный анализ позволил выделить в отдельную группу 14 больных, которые имели в анамнезе ревматизм и ревматический порок сердца. РА эти больные заболели за 1–24 года до исследования (в среднем через 8,9 года). 7 человек из них имели характерные признаки ревматического митрального стеноза (у 3 — выраженного) в сочетании с митральной регургитацией разной выраженности и признаки аортального порока, который у 1 больной был диагностирован как сочетанный. У 2 больных митральный порок был в виде умеренной митральной недостаточности и комбинировался с недостаточностью аортального клапана. У 3 больных выявлены признаки ревматической недостаточности митрального клапана. У 2 больных отмечался выраженный сочетанный аортальный порок в комбинации с относительной недостаточностью митрального клапана.
Таким образом, наши данные подтверждают возможность заболевания РА лиц, ранее болевших ревматизмом и имеющих ревматические пороки сердца.
В отдельную группу были выделены 38 больных (средний возраст 58,7 года, давность РА 12,8 года) с наличием структурных изменений клапанного аппарата сердца в виде тотального краевого утолщения створок или отдельных очагов утолщения, нередко достигающих больших величин (13х6 мм), признаков кальциноза и ограничения подвижности створок. Створки митрального кольца оказались измененными у 19, аортального — у 33, трикуспидального — у 1 больной, причем у 16 пациентов были сочетанные изменения митрального и аортального клапанов, у 1 — митрального и трикуспидального. У 17 из 19 больных структурные изменения митральных створок сопровождались митральной регургитацией.
У 17 из 33 больных с изменениями аортальных створок диагностировалась аортальная регургитация, при этом у 12 она была умеренной или выраженной. У 16 больных, в том числе у 2 с признаками кальциноза, имел место склероз аортальных створок без нарушения функции клапана, что нашло свое подтверждение и неизмененным трансаортальным кровотоком. У 1 больной со значительным утолщением створок и умеренной аортальной регургитацией имелось ограничение открытия их (1-2 см) и повышение трансаортального градиента давления, т. е. признаки аортального стеноза. И еще у 1 больной 33-летнего возраста был диагностирован врожденный двухстворчатый аортальный клапан с признаками умеренной аортальной регургитации. Выраженная трикуспидальная регургитация была диагностирована у 3 больных с очаговым утолщением трикуспидальных створок, причем у 1 из них было диагностировано легочное сердце как осложнение ревматоидного поражения легких.
Возникает вопрос: все ли обнаруженные изменения у этой группы, состоящей из 33 больных, являются следствием РА? Анализ наших данных показал, что большинство больных этой группы были в возрасте 51–74 лет. У 19 из них диагностировалась артериальная гипертензия, имелись признаки ишемической болезни сердца, 4 больных перенесли инфаркт миокарда, 1 — острое нарушение мозгового кровообращения. Результаты исследования показали, что у лиц с высокими цифрами артериального давления изменения клапанного аппарата были более выраженными, и только у них диагностировался кальциноз митрального клапана и/или аортального клапана, признаки аортальной регургитации, гипертрофия стенки левого желудочка и межжелудочковой перегородки, а также утолщение стенок аорты с признаками дилятации и диастолическая дисфункция левого желудочка. Выявленные ЭХО-КГ-изменения в этой группе больных не отличаются от таковых при атеросклеротическом кардиосклерозе, атеросклерозе аорты и являются классическими. Поэтому в этой группе больных не представляется возможным исключить атеросклеротический генез пороков сердца. Вместе с тем вполне вероятно, что собственно ревматоидное поражение клапанов может служить тем благоприятным фоном, на котором в дальнейшем развиваются выраженные структурные изменения створок, патология которых доминирует как в клинической, так и в ЭХО-КГ-картине атеросклеротического поражения клапанов сердца. В каждом случае вопрос о генезе порока при РА требует учета всех имеющихся клинических данных.
1. Балабанова Р. М. Ревматоидный артрит. В кн.: Ревматические болезни (руководство по внутренним болезням)/ Под ред. В. А. Насоновой и Н. В. Бунчука. — М.: Медицина, 1997. С. 257-295.
2. Виноградова И. Б. Нарушение сердечного ритма и проводимости у больных ревматоидным артритом// Автореф. дис. . канд. мед. наук. М., 1998. С. 21.
3. Елисеев О. М. Амилоидоз сердца// Тер. арх. 1980. № 12. С. 116-121.
4. Котельникова Г. П. Поражение сердца при ревматоидном артрите// В сб.: Ревматоидный артрит. — М.: Медицина, 1983. С. 89-90.
5. Котельникова Г. П., Лукина Г. В., Муравьев Ю. В. Кардиальная патология при вторичном амилоидозе у больных ревматическими заболеваниями// Клин. ревматол. 1993. № 2. С. 5-8.
6. Немчинов Е. Н., Каневская М. З., Чичасова Н. В. и др. Пороки сердца у больных ревматоидным артритом (результаты многолетнего проспективного клинико-эхокардиографического исследования)// Тер. арх. 1994. № 5. С. 33-37.
7. Раденска-Лоповок С. Г. Морфологические методы исследования и диагностики в ревматологии В кн.: Ревматические болезни (руководство по внутренним болезням) под ред. В. А. Насоновой и Н. В. Бунчука. М.: Медицина, 1997. С. 80-94.
8. Цурко В.В. Асептический некроз головок бедренных костей при ревматоидном артрите и системной красной волчанке. Клинико-инструментальная диагностика и исходы: Автореф. дис. . д-ра мед. наук. М., 1997. С. 50
ОСТРЫЙ ИНФАРКТ МИОКАРДА ПРИ РЕВМАТОИДНОМ АРТРИТЕ
И.Б.Виноградова, М.И.Удовика, О.М.Едигарова, Л.Ф.Федякина.
ТРИБУНА ПРАКТИЧЕСКОГО ВРАЧА
УДК 616. 72-002. 77-616.005.8
ОСТРЫЙ инфаркт миокарда ПРИ РЕВМАТОИДНОМ АРТРИТЕ
И .Б.Виноградова, М.И. Удовика,
О.М. Едигарова, Л. Ф. Федякина.
Ульяновская областная клиническая больница № 1 — гл. врач Раков П.П.,
Ревматоидный артрит (РА) — хроническое системное воспалительное заболевание соединительной ткани, при котором в патологический процесс помимо суставов, вовлекаются и другие органы, в том числе и сердце [4].
Поражение сердца при РА включает перикардит, миокардит, эндокардит, поражение проводящих путей, коронарный артериит, гранулематозный аортит [1]. Коронарные артерии вовлекаются в воспалительный процесс у больных РА с генерализованным ревматоидным васкулитом. Коронариит, как и другие проявления ревматоидного кардита, в основном описывается патологоанатомами и наблюдается в среднем у 20% больных РА [2]. По литературным данным встречаются 2 формы острого коронарного артериита: с воспалительно-клеточной инфильтрацией и с гранулематозным поражением стенки венечных артерий. Исходом ревматоидного коронариита может быть склерозирование коронарных артерий, сужение их просвета и как следствие — развитие инфаркта миокарда (ИМ) [1, 3].
Приводим описание случая мелкоочагового передне-перегородочно — верхушечного ИМ, развившегося у больной РА вследствие коронариита на фоне генерализованного ревматоидного васкулита.
Больная Ж., 44 лет, находилась на лечении в ревматологическом отделении УОКБ №1 с 14.10.98г. Диагноз: Ревматоидный артрит, серопозитивный полиартрит с системными проявлениями: генерализованная амиотрофия, ревматоидные узелки, анемия, поражение сердца (коронариит с исходом в мелкоочаговый передне-перегородочно-верхушечный инфаркт
Адрес для переписки:
г. Ульяновск, пл. III Интернационала, Областная больница
миокарда от 27.10.98г., фиброз митрального и аортального клапанов без признаков стено-зирования), медленно прогрессирующее течение, акт. III, ст. IV, НФС II. Артериальная гипертония I ст. по ВОЗ, Н-1.
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Больна с 1987г., в дебюте заболевания -поражение коленных суставов, в последующие годы в процесс были вовлечены мелкие суставы кистей и стоп, плечевые, лучезапястные, голеностопные. В 1987г. был проведен курс кризо-терапии и преднизолона в суточной дозе 15мг с последующей полной отменой. В 1996г. в условиях ревматологического отделения УОКБ № 1 г.Ульяновска в связи с высокой клинико -иммунологической активностью (ЦИК 158ед., РФ 1:640) проводилась пульс-терапия солю-медролом в суммарной дозе 1500мг, синхронизированная с сеансами плазмафереза. При обследовании сердечно-сосудистой системы с применением холтеровского мониторирования ЭКГ и чреспищеводного ЭФИ (ЧПЭФИ) у больной выявлялись признаки поражения миокарда и, возможно, коронарных артерий в виде частой политопной желудочковой экстрасистолии и появления депрессии сегмента 8Т в первых 2 постстимуляционных комплексах во время проведения ЧПЭФИ [5)]. В дальнейшем в качестве базисного препарата использовался метотрексат в дозе 7,5мг в неделю, который через 6 месяцев был отменен из-за отсутствия препарата. Особенностью данного случая является наследственная агрегация по ревматическим заболеваниям (у родной сестры — СКВ).
При поступлении: общее состояние удовлетворительное, пониженного питания, астенического телосложения, лимфоузлы не увеличены. Ревматоидные узелки в.области разгиба-тельных поверхностей локтевых суставов. В легких везикулярное дыхание, хрипов нет. Тоны сердца ритмичные, тахисистолия с ЧСС ЮОуд/
НАУЧНО-ПРАКТИЧЕСКАЯ РЕВМАТОЛОГИЯ № 1, 2000
мин; у верхушки непродолжительный систолический шум; АД 150/90мм рт.ст. Живот мягкий, безболезненный при пальпации; печень и селезенка не увеличены. Артриты плечевых, локтевых, лучезапястных, пястно-фаланговых суставов кистей, синовииты коленных суставов; сгибательные контрактуры локтевых суставов; ульнарная девиация кистей III степени; генерализованная амиотрофия; ограничение отведения и ротации в плечевых и т/б суставах.
ОАК: гемоглобин — 95г/л, эр — Зх10|2/л, цп —
0,9, тромб. — 210хЮ9/л, лейкоциты — 5,7×109/лп -1%, с — 71%, э — 3%, л — 19%, м — 6%, СОЭ — б9мм/ч.
Протромбиновый индекс — 85%, креатинин -77мкмоль/л, мочевина — 10ммоль/л, билирубин общ. — 4,8мкмоль/л, холестерин — 4,35ммоль/л, сахар крови -6,06ммоль/л.
ACT — 254ед/л, АЛТ — 359ед/л, КФК — 25ед/л, ЛДГ — 359ед/л (после ангинозного приступа).
Общий белок — 88г/л, альбумины — 40%, глобуллины — а1 — 3%, а2 -10%, b-9%, g-38%.
РФ — 1:320, СРБ — 1+, ЦИК 118ед. (норма до ЗОед.), серомукоид -52ед. АТ к кардиолипину ++.
ЭКГ при поступлении: регулярный синусовый ритм, срединное положение электрической оси сердца .
Больная получала нндометацин в суточной дозе 150мг, дезинтоксикационную терапию, магнитолечение на локтевые и лучезапястные суставы.
На 13-е сутки со дня поступления в стационар, вне связи с проведением сеанса магнито-терапии, у больной внезапно впервые в жизни появились интенсивные жгучие загрудинные боли с иррадиацией в левую руку и под лопатку, АД 130/90мм рт.ст. При регистрации ЭКГ на фоне ангинозного приступа выявлены очаговые изменения в миокарде нижней стенки левого желудочка (отрицательные Т во II, III, AVF отведениях при высоком Т в V2), что позволило предположить заинтересованность заднебазальных отделов, которая с учетом дальнейшей ЭКГ-динамики была расценена как реци-прокная. При последующем ЭКГ-наблюдении появилась закономерная, однако замедленная, динамика мелкоочагового инфаркта миокарда передне-перегородочной области с захватом верхушки. Клинически в этот период у больной рецидивировали ежедневные ангинозные приступы в покое на фоне проводимой терапии нитратами, бета-блокаторами и гепарином. При ЭХО-кардиографии у больной были обнару-
жены морфологические изменения на створках аортального и митрального клапанов в виде фиброза, а также очаги фиброза в хордах и головках папиллярных мышц (которые регистрировались и при обследовании в 1996 году); сократительная функция миокарда ЛЖ сохранена: нарушения локальной сократимости не выявлены. При динамическом ЭХО-КГ наблюдении на восьмой день инфаркта миокарда появилось умеренное расширение полости ЛЖ, снизилась сократительная способность миокарда (фракция выброса — 30,2%), зарегистрирован участок дискинеза базального и среднего, передне-перегородочного и переднего сегментов с систолическим истончением этой зоны, что соответствовало локализации очаговых изменений на ЭКГ.
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Жалобы больной, данные ЭХО-КГ, коррелирующие с динамикой ЭКГ, позволили диагностировать острый мелкоочаговый передне-перегородочно-верхушечный инфаркт миокарда. Отсутствие достаточного эффекта от комбинированной коронароактивной терапии в адекватных дозах, выявление высокой иммунологической активности (РФ 1:320, ЦИК 118ед., АТ к кардиолипину ++) и наличие клиники позволили предположить васкулитную (корона-риит) этиологию ИМ и явились показанием к назначению ГКС и цитотоксической терапии (соответственно — преднизолон per os в суточной дозе 20мг и циклофосфан первоначально в дозе 400мг в/в, затем 200мг в неделю в/м).
На фоне коррекции терапии уменьшилась частота ангинозных приступов, снизилась лабораторная активность. На серии последующих ЭКГ отмечено ускорение формирования рубцовых изменений. При динамическом ЭХО-КГ исследовании на 15-й день ИМ отмечалась положительная динамика в виде уменьшения полости ЛЖ (КДР с 59мм до 50мм), улучшение сократительной способности миокарда (фракция выброса возросла до 43,6%); исчезли участки дискинеза, определилась умеренная гипокинезия базального и среднего переднего, переднеперегородочного, с присоединением задне-перегородочного сегментов, появилось систолическое утолщение в указанной зоне.
Таким образом, высокая активность заболевания у больной РА с генерализованным васкулитом привела к поражению коронарных артерий и развитию острого инфаркта миокарда. Подтверждением коронариита служит появление быстрой положительной динамики на
ФУНКЦИОНАЛЬНЫЕ НАГРУЗОЧНЫЕ ПРОБЫ ПРИ РЕВМАТОИДНОМ АРТРИТЕ Н.С.Крыжановская.
фоне глюкокортикоидами и циклофосфаном в дополнение коронароактивной терапии.
1. Немчинов Е.Н., Крель A.A. Ревматоидное поражение сердца. Тер. архив., 1986, 12, 126-132.
2. Копьева Т.Н. Патология ревматоидного артрита. М., 1980, 110-118.
3. Струков А.Н., Бегларян А.Г. Патологическая анатомия и патогенез коллагеновых болезней. М., 1963, 195-199.
4. Насонова В.А., Бунчук Н.В. Ревматические болезни. М., 1997, 257.
5. Виноградова И.Б. Нарушения сердечного ритма и проводимости у больных ревматоидным артритом: Дис… к.м.н. -М., 1998.
ФУНКЦИОНАЛЬНЫЕ НАГРУЗОЧНЫЕ ПРОБЫ ПРИ РЕВМАТОИДНОМ АРТРИТЕ
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Институт ревматологии (дир. — академик РАМН В.А.Насонова) РАМН, Москва
При многих ревматических заболеваниях имеются проблемы со стороны сердечно-сосудистой системы, включающие поражения, вызванные собственно ревматическим процессом, обусловленные васкулитом, а порой вызванные некоторыми лекарственными препаратами, используемыми для коррекции основной патологии. Большинство ревматологических больных имеет поражение опорно-двигательного аппарата различной степени тяжести, сопровождаемое функциональной недостаточностью. Этот факт делает необходимым оценку состояния сердечно-сосудистой системы и определение индивидуальной толерантности к физической нагрузке с целью объективной и адекватной оценки лечебных и реабилитационных мероприятий, а также для решения экспертных вопросов о трудоспособности пациентов. Для достижения этих целей необходимо использовать пробы с физическими нагрузками под контролем ЭКГ, являющиеся наиболее фундаментальными в плане практической значимости, изученности и широты применения.
Еще в 1929 году Мастер и Оппенгеймер предложили ставшую классической двухступенчатую пробу для диагностики ИБС. С тех пор было разработано и предложено множество методов с использованием дозированной нагрузки, применяющихся с самыми разнообразными целями, но физиологическое обоснование их
Адрес для переписки:
115522, Москва, Каширское шоссе, 34-а Институт ревматологии РАМН
применения едино: физическая нагрузка является идеальным и самым естественным видом провокации, позволяющим оценить полноценность физиологических компенсаторно-приспособительных механизмов организма, а при наличии явной или скрытой патологии — степень функциональной неполноценности кардиореспиратор-ной системы. [1]
Вне зависимости от цели применения функциональные нагрузочные пробы всегда имеют два критерия надёжности исследования: возможность стандартизировать методику и хорошую воспроизводимость, что позволяет корректно сопоставлять полученные результаты.
Американской коллегией по кардиологии и Американской ассоциацией сердца были предложены семь основных направлений использования нагрузочных проб:
1. Массовые (эпидемиологические) обследования различных контингентов населения с целью раннего выявления сердечно-сосудистой патологии;
2. Дифференциальная диагностика ИБС и отдельных её форм;
3. Выявление и идентификация нарушения ритма сердца;
4. Выявление лиц с гипертензивной реакцией на нагрузку;
5. Определение индивидуальной толерантности к физической нагрузке;
6. Оценка эффективности лечебных и реабилитационных мероприятий по результатам динамического наблюдения больных;
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
7. Экспертиза трудоспособности.
Инфаркт
Нет комментариев
Ученые обнаружили, что наличие ревматоидного артрита у больных, формально не относящихся к группе риска по инфаркту миокарда, тем не менее, связано с заметным увеличением опасности развития этого тяжелейшего кардиологического заболевания.
Больных ревматоидным артритом, которые не курят и не страдают сахарным диабетом, обычно не принято относить к группе высокого риска развития инфаркта миокарда.
Однако ученые из Мексики сообщают, что наличие ревматоидного артрита значительно повышает риск внезапного инфаркта даже при отсутствии традиционных факторов риска.
У 55% больных имелась дислипидемия, у 32% – артериальная гипертензия, 14% участников исследования были курильщиками, а 10% страдали сахарным диабетом 2-го типа.
Обследование всех больных с помощью метода однофотонной эмиссионной компьютерной томографии выявило наличие ишемии миокарда или инфаркта у 24% участников.
При этом не было обнаружено прямой корреляции между наличием ишемии и/или инфаркта миокарда и степенью тяжести ревматоидного артрита, а также наличием биомаркеров воспаления.
Авторы исследования утверждают, что полученные ими результаты свидетельствуют о том, что у четверти больных ревматоидным артритом риск развития внезапного инфаркта миокарда повышен почти в 2 раза. При этом у них могут полностью отсутствовать какие-либо симптомы заболеваний сердца.
Для начала немного печальной статистики… В многочисленных исследованиях показано, что у больных ревматоидным артритом риск сердечно-сосудистых заболеваний в 2-5 раз выше, чем в общей популяции. Это приводит к уменьшению продолжительности жизни данной категории пациентов в среднем на 5-10 лет. У больных ревматоидным артритом в 2 раза чаще, чем у больных без него, развивается инфаркт миокарда и внезапная сердечная (коронарная) смерть. Установлено, что уже за 2 года ДО установления диагноза ревматоидного артрита эти пациенты в 3 раза чаще госпитализируются по поводу острого коронарного синдрома. При проведении коронароангиографии у больных ревматоидным артритом с бОльшей частотой выявляется обширное атеросклеротическое поражение коронарных артерий.
К “болезнь-обусловленным” факторам ускоренного развития атеросклероза при ревматоидном артрите относятся следующие:
- длительность заболевания;
- тяжесть заболевания (наличие внесуставных проявлений, поражение большого количества суставов, высокая активность воспалительного процесса, дефицит массы тела);
- тромбоцитоз (повышение количества тромбоцитов);
- положительный ревматоидный фактор (РФ) и/или антитела циклическому цитруллинированному пептиду (АЦЦП).
В патологический процесс при ревматоидном артрите могут вовлекаться ВСЕ структуры сердца. Характерным признаком ревматоидного артрита являются ревматоидные узелки в миокарде, перикарде и эндокарде в основании митрального и аортального клапанов. В исходе узелка развивается склероз, вызывающий формирование недостаточности клапанов.
Перикардит, то есть воспаление наружной оболочки сердца (перикарда) — это наиболее частое проявление поражения сердца при ревматоидном артрите.
Вовлечение в патологический процесс эндокарда и формирование порока сердца у больных ревматоидным артритом развивается в результате неспецифического воспалительного процесса, васкулита или гранулематоза в створках клапанов, чаще митрального и аортального. В большинстве случаев эндокардит протекает благоприятно, однако, у некоторых пациентов могут возникать клапанные пороки (чаще митральная недостаточность), требующие хирургической коррекции.
Ревматоидный миокардит (поражение сердечной мышцы), по данным вскрытий, выявляется с частотой до 30% случаев, но в реальной клинической практике распознаётся значительно реже. Это связано с тем, что миокардит при ревматоидном артрите часто не имеет специфических клинических проявлений и протекает довольно мягко. Обычно миокардит сочетается с эндокардитом. Одной из причин поражения миокарда при ревматоидном артрите может быть амилоидоз — тяжёлое осложнение ревматоидного артрита.
Клинически у пациентов с сопутствующей сердечно-сосудистой патологией чаще наблюдаются эпизоды безболевой ишемии миокарда. Приступ стенокардии у таких пациентов чаще протекает в виде слабости, одышки, боли в шее, плече.
Сердечно-сосудистые заболевания являются одной из наиболее распространенных сопутствующих заболеваний, связанных с ревматоидным артритом (РА). Распространенность ряда сердечно-сосудистых заболеваний увеличивается у пациентов с РА. Включая инфаркт миокарда (сердечный приступ), инсульт, застойную сердечную недостаточность, ишемическую болезнь сердца и сосудистые заболевания. В этой статье рассмотрим сердечно-сосудистые заболевания и ревматоидный артрит. Причины аутоиммунных заболеваний.
У пациентов с РА повышенный риск смерти по сравнению с общей популяцией от различных сердечно-сосудистых событий. Большое исследование, проведенное в Рочестере, штат Миннесота, по изучению результатов в отношении здоровья у мужчин и женщин с РА в течение 40 лет, показало, что эта группа в 1,27 раза чаще умирает от сердечно-сосудистых заболеваний, чем их не — РА — аналогов (P
Сердечно-сосудистый риск у женщин с РА.
Результаты исследования здоровья медсестер, исследование, в котором приняли участие более 100 000 участников. Показали, что женщины, с ревматоидным артритом в течение 10 лет, в 3 раза превышали риск сердечного приступа по сравнению с женщинами без РА. В целом, женщины с РА более чем в два раза чаще, чем их коллеги из других стран имели сердечный приступ. Кроме того, группа РА была в 1,5 раза больше шансов иметь инсульт. Диагностика ревматологии.
Если у вас РА, ряд факторов может увеличить риск развития заболеваний. К ним относятся гипертония, диабет, высокий уровень холестерина, курение и ожирение. Кроме того, воспаление, связанное с РА, как представляется, увеличивает риск развития сердечно-сосудистых заболеваний. Вы можете снизить риск, не куря, контролируя свое артериальное давление и уровень холестерина, сохраняя уровень сахара в крови в безопасном диапазоне и сохраняя свой вес.
Упражнения, диета и медицина помогут вам достичь всех этих целей. Если ваше кровяное давление или холестерин высоки, существует множество лекарств, которые могут помочь вам снизить любой из этих сердечно-сосудистых факторов риска. Поговорите со своим врачом о ваших вариантах лечения этих состояний здоровья. Ранние признаки РА.
Когда дело доходит до воспаления, связанного с ревматоидным артритом и его вклада в риск сердечно-сосудистых заболеваний, хорошей новостью является то, что вы можете снизить этот фактор риска. Контролируя воспаление РА с помощью надлежащего лечения, вы можете значительно снизить риск. В одном исследовании, в котором пациенты РА получали модифицирующее заболевание антиреватическое лекарственное средство метотрексат, риск смерти был снижен на 70%. Упражнения на растяжку мышц и суставов.
Читайте также:


