Серрация маркенсенс инфекция человека

Особую значимость среди бактериальных инфекций имеют нозокомиальные заболевания [1]. С каждым годом число возбудителей внутрибольничных инфекций (ВБИ) увеличивается в основном за счет условно-патогенных микроорганизмов. Ведущую роль играют стафилококки (до 60% всех случаев ВБИ), представители грамотрицательной микрофлоры, аскомицеты рода Candida [2, 3]. Главной особенностью возбудителей внутрибольничных инфекций является их выраженная вирулентность и устойчивость к антибактериальным препаратам и дезинфектантам [4, 5]. В последние годы наряду с вышеперечисленными возбудителями ВБИ все чаще выделяются представители рода Serratia [6, 7].
Серрации – условно-патогенные микробы, вызывающие у человека гнойно-воспалительные заболевания различной локализации. Наиболее изученным видом является Serratia marcescens. В настоящее время бактерии рода Serratia marcesens описаны как возбудители диарейных заболеваний у человека, инфекций мочевыводящих путей, менингита, артрита, сепсиса [8]. Постоянный мониторинг изменяющихся биологических свойств выделенных клинических изолятов является одним из важнейших этапов эпидемиологической работы, в связи с чем актуально исследование постоянно меняющихся свойств бактерий этой группы.
Целью данного исследования было изучение патогенных свойств клинических штаммов бактерий рода Serratia.
Материал и методы исследования. В работе использовано 58 клинических штаммов, отнесенных на основании биологических свойств к роду Serratia. Штаммы Serratia были выделены из различного патологического материала: из испражнений (15 штаммов) от пациентов с кишечными инфекциями, мочи (20 штаммов) от больных с уретритами и гнойного (раневого) отделяемого (23 штамма) от пациентов с абсцессами и флегмонами мягких тканей.
Способность к адгезии у бактерий изучали с помощью формалинизированных эритроцитов человека. Определяли основные показатели адгезии. Вычислили индекс адгезивности микроорганизмов. По данному показателю все бактерии разделили на 4 группы: 1 – неадгезивные (индекс адгезивности 4,0).
Адсорбцию бактериями красителя конго красного выявляли на 1,5%-ном мясопептонном агаре с добавлением 0,02% казаминовых кислот и 0,01% конго красного.
Способность к гемагглютинации у бактерий определяли в реакции гемагглютинации с 3%-ной взвесью свежих эритроцитов человека и барана, которую проводили на панелях из органического стекла.
Для выявления D-маннозорезистентной гемагглютинации во взвесь эритроцитов добавляли 1,5% D-маннозы [9].
Антилизоцимную активность изучали по методике О.В. Бухарина. Исследования антилизоцимной активности проводили в диапазоне концентраций от 1 до 6 мкг/мл. В качестве тест-культуры использовался штамм Micrococcus luteus var. Lysodeikticus № 2665. Гемолитическую способность бактерий определяли на мясопептонном агаре с 3–5% отмытых в растворе Хенкса эритроцитов кролика. Для выявления тиолзависимых гемолизинов использовался мясопептонный агар с 0,002% L-цистеина.
Статистическую обработку проводили стандартными методами.
Результаты исследования и их обсуждение
Исследование адгезивных свойств бактерий рода Serratia выявило, что адгезивные штаммы с индексом адгезивности выше 2,5 составили 70,6% (41 штамм) из общего количества изученных штаммов, из которых 13 штаммов серраций (86,7%) были выделены из испражнений, 18 штаммов серраций (78,3%) были выделены из гнойного отделяемого, 10 штаммов серраций (50%) были выделены из мочи.
Все адгезивные штаммы разделили на две группы: высокоадгезивные и со средней степенью адгезивности. К штаммам, обладающим высоким индексом адгезивности (более 4), отнесли 3 штамма серраций (20%), выделенных из испражнений, 5 штаммов серраций (21,7%), выделенных из гнойного отделяемого, все адгезивные штаммы (10 бактериальных культур), выделенные из мочи.
Сренеадгезивными оказались 23 штамма (39,7%). Индекс адгезивности у них составил от 2,5 до 4. Среди выделенных из испражнений штаммов со средним показателем ИАМ было 10 штаммов (66,7%), а выделенные из гнойного отделяемого составили 13 штаммов (56,5%). Все остальные штаммы были отнесены к низкоадгезивным с индексом адгезивности микроорганизмов от 1,76 до 2,5. 40 штаммов (68,9%) из всех изученных клинических культур серраций обладали способностью адсорбировать конго красный. Из выделенных из испражнений такой способностью обладало 14 штаммов (93,3%), 10 культур серраций, выделенных из мочи (50%), а среди выделенных из гнойного отделяемого это свойство было выявлено у 16 штаммов (69,6%) (табл. 1).
Адгезивная активность штаммов рода Serratia
Serratia Marcescens является грамотрицательной палочкой, оппортунистическим патогеном, принадлежащим к семейству Enterobacteriaceae. Эта бактерия была ранее известна под именем Bacillus prodigiosus, но позже он был переименован в Serratia Marcescens.
Вид Marcescens является наиболее важным из рода Serratia, потому что он был связан с большим разнообразием оппортунистических инфекций у людей. Когда-то этот микроорганизм использовался в качестве безвредного маркера загрязнения окружающей среды, но сегодня он считается инвазивным микроорганизмом..
Известно, что в последние десятилетия хаос в больничной среде, особенно в палатах интенсивной терапии и контрольно-пропускных пунктах. Он был изолирован от мокроты и посевов крови у пациентов, получающих химиотерапию. Также в образцах мочи и CSF.
Таким образом, он был возбудителем пневмонии, сепсиса, инфекций мочевыводящих путей, детского менингита и других. Некоторые вспышки были вызваны загрязнением растворов, предметов и инструментов для использования в больницах..
Тем не менее, вне внутрибольничной среды также может вызвать инфекцию. Было видно, что 8% случаев язвенного кератита вызваны Serratia Marcescens. Кроме того, это было связано с ухудшением качества некоторых продуктов, богатых крахмалом..
- 1 Характеристики
- 1.1 Общая характеристика и условия роста
- 1.2 Биохимические характеристики
- 1.3 Факторы вирулентности
- 1.4 Устойчивость к противомикробным препаратам
- 2 Таксономия
- 3 Морфология
- 4 Патологии и симптомы
- 5 Диагноз
- 6 Лечение
- 7 ссылок
черты
Serratia Marcescens Это факультативная аэробная палочка, подвижная, как и большинство энтеробактерий. Это вездесущий обитатель почвы, воды и поверхности растений. Поэтому обычно его можно найти во влажных средах, таких как ванные комнаты, водостоки, раковины, раковины и т. Д..
Он способен существовать в неблагоприятных условиях. Например, он может расти при температуре от 3,5 до 40 ° С. Кроме того, он может выживать в хлоргексидиновом мыльном растворе до концентрации 20 мг / мл..
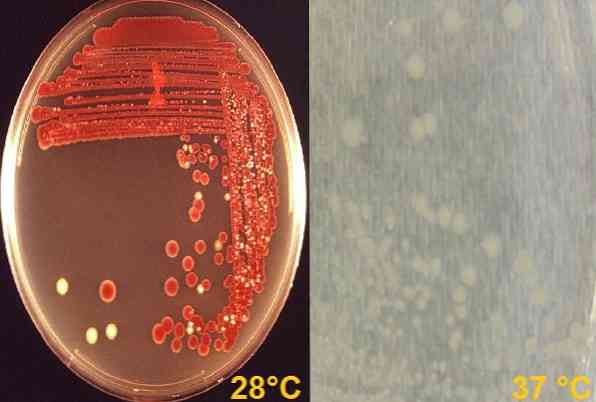
В лаборатории это может расти при комнатной температуре (28 ° C), где у некоторых разновидностей развивается характерный пигмент кирпично-красных разновидностей, названных продигиозином. Но он также растет при 37 ° C, где его колонии имеют кремово-белый цвет, то есть при этой температуре он не образует пигмент.
Это представляет физиологическое фенотипическое изменение, стимулируемое температурой. Эта характеристика уникальна для этой бактерии, поскольку ни один другой вид семейства не способен это сделать..
Производство пигмента, несомненно, является очень полезным инструментом для постановки диагноза..
Что касается диапазона pH, который может поддерживать, это колеблется от 5 до 9.
Биохимически говоря Serratia Marcescens соответствует основным характеристикам, которые описывают полное семейство Enterobacteriaceae, то есть он ферментирует глюкозу, восстанавливает нитраты до нитритов и является отрицательной оксидазой.
Теперь у него есть другие биохимические характеристики, которые описаны ниже:
S. marcescens положительные тесты: Voges-Proskauer, цитрат, подвижность, лизин декарбоксилаза, орнитин и O-нитрофенил-β-D-галактопиранозид (ONPG) и каталаза.
В такой же степени это отрицательно сказывается на: производстве сероводорода (H2S), индол, фенилаланин-деаминаза, мочевина и аргинин.
Столкновение с метиловым красным тестом может быть переменным (положительным или отрицательным).
Наконец, перед поллиглигером происходит щелочная / кислотная реакция, то есть ферментируется глюкоза с образованием газа, но не лактоза..
Род Serratia выделяется в этом семействе, потому что он имеет 3 важных гидролитических фермента: липазу, желатиназу и внеклеточную ДНКазу. Эти ферменты способствуют инвазивной способности этого микроорганизма.
Он также содержит 3 хитиназы и белок, связывающий хитин. Эти свойства важны при деградации хитина в окружающей среде..
Кроме того, киназы предоставляют собственность S. marcescens противогрибкового действия на грибы Zygomycetes, клеточная стенка которых состоит в основном из хитина.
С другой стороны, S. marcescens Он способен формировать биопленки. Это представляет значительный фактор вирулентности, поскольку в этом состоянии бактерия более устойчива к действию антибиотиков..
Недавно было обнаружено, что некоторые штаммы S. marcescens они представляют систему секреции типа VI (T6SS), которая служит для секреции белков. Однако его роль в вирулентности еще не определена.
Штаммы S. marcescens продуценты хромосомных бета-лактамаз AmpC.
Это дает им внутреннюю устойчивость к ампициллину, амоксициллину, цефокситину и цефалотину, поэтому единственным вариантом среди бета-лактамов для лечения штаммов, продуцирующих ESBL, являются карбапенемы и пиперациллин тазобактам..
Кроме того, он обладает способностью приобретать механизмы устойчивости к другим обычно используемым антибиотикам, в том числе аминогликозидам..
Штаммы S. marcescens производители кпк-2 и бла тэм-1. В этом случае карбапенемы уже не эффективны.
Первый штамм КПК за пределами больницы был изолирован в Бразилии, он был устойчив к азтреонаму, цефепиму, цефотаксиму, имипенему, меропенему, гентамицину, ципрофлоксацину и цефазидиму и был чувствителен только к амикацину, тигециклину и гатифлоксацину.
таксономия
морфология
Это длинные бациллы, которые, в отличие от окраски по Граму, окрашены в красный цвет, то есть они являются грамотрицательными. Не образует спор. У них есть чрескожные жгутики и липополисахарид в клеточной стенке.
Патологии и симптомы
Среди патологий, которые могут вызвать Serratia Marcescens У ослабленных больных имеются: инфекция мочевыводящих путей, инфекция ран, артрит, конъюнктивит, эндофтальмит, кератоконъюнктивит и язвенный кератит..
Кроме того, это может вызвать более серьезные патологии, такие как: сепсис, менингит, пневмония, остеомиелит и эндокардит.
Ворот к этим патологиям обычно представлен загрязненными растворами, венозными катетерами с образованием биопленки или другими загрязненными инструментами..
В случае офтальмологических патологий это главным образом вызвано использованием контактных линз, заселенных этой или другой бактерией. В этом смысле язвенный кератит является наиболее серьезным офтальмологическим осложнением, которое возникает у тех, кто носит контактные линзы. Характеризуется потерей эпителия и стромальной инфильтрацией, что может привести к потере зрения.
Другим менее агрессивным офтальмологическим проявлением является синдром CLARE (острый красный глаз, вызванный контактными линзами). Этот синдром проявляется острой болью, фотофобией, слезотечением и покраснением конъюнктивы без повреждения эпителия.
диагностика
Они растут в простых средах, таких как питательный агар и инфузия сердца, на обогащенных средах, таких как кровяной агар и шоколад.
В этих средах колонии имеют тенденцию становиться кремово-белыми, если они инкубируются при температуре 37 ° C, в то время как при комнатной температуре колонии могут иметь красно-оранжевый пигмент..
Они также растут на селективной среде и дифференциальном агаре Макконки. В этом случае колонии становятся бледно-розовыми или бесцветными при 37 ° С, а при 28 ° С они увеличивают оттенок своего цвета.
Агар Müeller Hinton используется для выполнения антибиограммы.
лечение
Из-за естественной устойчивости этой бактерии к пенициллинам и цефалоспоринам первого поколения следует использовать другие антибиотики, если они чувствительны к антибиограмме и механизмы резистентности, такие как продуцирование бета-лактамаз расширенного спектра, среди других, отсутствуют..
Среди антибиотиков, которые могут быть проверены для определения их восприимчивости:
- Фторхинолоны (ципрофлоксацин или лебофлоксацин),
- Карбапенемы (эртапенем, имипенем и меропенем),
- Цефалоспорины третьего поколения (цефотаксим, цефтриаксон или цефадроксил),
- Цефалоспорин четвертого поколения (цефепим),
- Аминогликозиды (амикацин, гентамицин и тобрамицин),
- Хлорамфеникол особенно полезен в случаях инфекций, в которых участвует образование биопленок.
Нозокомиальные (внутрибольничные) инфекции отличаются от внебольничных как спектром возбудителей, так и их устойчивостью к противомикробным средствам. К ним относят инфекции, развившиеся через 48 часов и более после поступления в стационар (если больной не находился в инкубационном периоде), и возникшие в течение 72 часов после выписки из стационара. К нозокомиальным относят и инфекции, возникшие в закрытых медицинских учреждениях, а также возникшие в связи с лечением больного на дому.
Анаэробные возбудители
Анаэробные возбудители в большинстве своем являются представителями нормальной флоры человека, вызывая патологические процессы при снижении иммунной реактивности (анаэробная ангина) и/или барьерных функций (пупочная ранка, повреждение слизистых, операции, занос в легкое при аспирации или бронхоскопии), чаще всего как сопутствующая другим возбудителям нозокомиальная инфекция. Анаэробные посевы оправданы у истощенных детей с пролежнями, нейтропенией, при абдоминальной патологии, низкой гигиене рта, обширной травме и т.д.
Бактероиды. Bacteroides — грам-отрицательиые факультативно анаэробные неспорообразующие палочки. Prevotella melaninogenicus и P. oralis (ранее относившиеся к бактероидам) обитают в ротовой полости, представители группы В. fragilis — в толстом кишечнике, являясь основой его бактериальной популяции (10 10 особей в 1 г кала); они также обитают во влагалище. Вызванные этими возбудителями процессы практически всегда полимикробны. При инфекции легких они сочетаются с гемолитическим стрептококком группы А, стафилококком, реже — с гемофильной палочкой типа b. Инкубационный период 1-5 дней, больной не заразен.
Лекарственная чувствительность бактероидов практически 100%-ная к клиндамиципу, а также к метронидазолу, хлорамфениколу, карбапенемам, фторхинолонам. Превотеллы ротовой полости обычно чувствительны к амино- и уреидопенициллинам, но с учетом возможности выработки лактамаз препаратами выбора являются ингибитор-защищенные пенициллины и цсфалоспорины.
Клинические проявления. Обитая в десневых карманах и зубных бляшках, превотеллы могут вызывать их инфекцию, а также хронические синусит, средний отит, перитонзиллярный абсцесс, а при заносе или аспирации — абсцесс и гангрену легкого. Анаэробы кишечника выявляются при перитоните, абсцессах брюшной полости и органов малого таза, при перианальных и вагинальных воспалительных процессах. Инфекции пупочной ранки и кожи (под датчиками) нередки у новорожденных. В качестве возбудителей бактериемии анаэробы составляют не более 5%, но их всегда следует иметь в виду при гематогенных абсцессах.
Терапия. Препарат выбора — клиндамицин, эффективны ингибитор-защищенные амино- и уреидопенициллины, цефоперазон/сульбактам. В терапию вероятно анаэробных процессов (в т.ч. бактериемии) часто эмпирически включают метроиидазол.
Clostridium difficile. С. difficile — спорообразующий облигатный грам-положительная анаэроб, выделяющий токсины А и В. Обитает в почве и часто колонизирует кишечник, особенно у детей 1-го года жизни. Основной фактор риска — нарушение нормальной микрофлоры кишечника при массивной антибактеральной терапии (особенно, но не исключительно пенициллинами, цефалоспоринами, клиндамицином), что создает условия для размножения возбудителя и продукции им токсинов. Играет роль и госпитализация при наличиии в отделении носителя клостридий. Инкубационный период не известен.
Лекарственная чувствительность к метронидазолу и ванкомицину.
Клинические проявления. Псевдомембранозный колит — обычно развивается в стационаре на фоне антибиотика, но иногда — через несколько недель после выписки.
Диагностические тесты. Высев возбудителя диагностического значения не имеет. Поскольку клинические проявления связаны с воздействием токсинов, их выявление в кале (есть ИФА- системы) — основной метод. К сожалению, у здоровых носителей клостридий в возрасте до 1 года также можно выявить токсины, так что важно исключить другие инфекции. Характерные изменения выявляются при эндоскопии.
Лечение. Внутрь или в/в метронидазол (30 мг/кг/сут на 4 приема — макс. 2 г/сут), при неэффективности — внутрь ванкомицин (40 мг/кг/сут на 4 приема, макс. 500 мг/сут).
Пептострептококки. Peptostreptococcus spp. — наиболее важная в клиническом отношении группа анаэробных кокков ротовой полости, желудочно-кишечного тракта, влагалища. Часто высевается из анаэробных абсцессов, обычно вместе с бактероидами.
Лекарственная чувствительность к природным и полусиптетическим пенициллинам, цефалоспоринам, карбапенемам, клиндамицину, хлорамфениколу, на 80-90% — к фторхинолонам.
Клинические проявления. Специфическую роль пептострептококков, выявляемых обычно вместе с другими анаэробами, установить трудно.
Терапия. Выбор препаратов для лечения инфекции бактероидами бывает обычно эффективным и в отношении пептострептококков.
Enterobacteriaceae spp.
Эта группа микроорганизмов обитает в кишечнике человека, представляя серьезную опасность для новорожденных с еще не установившейся флорой кишечника. У старших детей и взрослых эти возбудители вызывают инфекции мочевых путей, являясь, в то же время, важнейшей причиной нозокомиальных инфекций.
Представители этой группы при нозокомиальной инфекции обычно полирезистентны, часто за счет выработки бета-лактамаз расширенного спектра (БЛРС). Поэтому основная тактика при их выявлении — базировать выбор препаратов на данных о чувствительности выделенных штаммов.
Кишечная палочка. Esherichia coli является основным возбудителем инфекций мочевых путей (см. Главу 4), у новорожденных является важной причиной менингита и септицемии (особенно штаммы, содержащие К-1 полисахарид), а у старших детей нередко вызывает нозокомиальные инфекции. Вызывающие энтерит кишечные палочки — см. Главу 3.
Лекарственная чувствительность к ампициллину снижается, особенно при ИМП, но чувствительность к аминогликозидам обычно сохраняется. БЛРС-отрицательными штаммы чувствительны к цефалоспоринам 2-4 поколения, ингибитор-защищенным пенициллинам, фторхинолонам.
Клинические проявления: менингит и септицемия новорожденных, инфекция мочевых путей у старших детей, внутрибольничная (нозокомиальная) пневмония.
Терапия. При септицимии новорожденных эмпирически используют ампициллин + гентамицин. При нозокомиальных инфекциях, вызванных БЛРС-отрицательными штаммами, используют цефалоспорины и амоксицшлин/клавуланат, в т.ч. с аминогликозидами. Для БЛРС-положительных штаммов рекомендуется использовать карбапенемы, фторхинолоны, цефоперазон/сульбактам, также с аминогликозидами.
Клебсиеллы. Klebsiella pneumoniae — представитель многочисленного вида Klebsiella, патогенна для человека также К. oxitoca. Эти грам-отрицательные возбудители продуцируют эндотоксин, вызывающий ДВС-синдром и другие признаки септического процесса. Заражение возможно через загрязненные предметы: мы наблюдали случаи клебсиеллезной пневмонии у детей, помещенных в палату, где незадолго до этого был аналогичный больной.
Лекарственная чувствительность практически 100% штаммов чувствительны к карбапенемам, 70% — к амикацину, цефоперазопу/сулъбактаму и фторхинолонам. Нозокомиальные штаммы в России высоко резистентны к пенициллинам (86-100% устойчивых штаммов), в т.ч. ингибитор-защищенным (42-85%), цефалоспоринам 3-4 поколений 57-76%), что указывает на широкое распространение (81%) штаммов с БЛРС в отделениях интенсивной терапии, где проводилось исследование. В целом, доля штаммов с БЛPC превышала 60%, причем в стационарах, где эта инфекция наблюдалась часто, отмечалась более высокая частота продукции этой лактамазы. К ко-тримоксазолу устойчивы 62% штаммов, к гентамицину — 75%.
Клинические проявления: лобарная пневмония у госпитализированных (редко вне больницы у истощенных больных, при ИДС), раневая инфекция, ИМП, ИЖП.
Терапия. Эмпирически для БЛРС-отрицательных штаммов: цефалоспорины 3-4 поколения, ингибитор-защищенные пенициллины, в т. ч. с аминогликозидами, фторхинолоны. Для БЛРС-положительных штаммов: карбапенемы, фторхинолоны, цефоперазон/сульбактам, в т.ч. с аминогликозидами (лучше — с амикацином).
Провиденция. Providencia spp. распространены в окружающей среде, колонизируют желудочно-кишечный тракт. Внутрибольничную (нозокомиальную) инфекцию человека чаще вызывает P. stuartii.
Лекарственная чувствительность природная — к пенициллинам, цефалоспоринам 2-3 поколения, карбапеиемам, фторхинолонам и аминогликозидам, ко-тримоксазолу. В связи с учащающейся резистентностью важно проведение антибиоти-кограммы.
Клинические проявления: нозокомиальная инфекция мочевого тракта, реже пневмония, септицемия.
Терапия. Эмпирически используют цефалоспорины 3 поколения, карбапенемы, в т.ч. в комбинации с аминогликозидами.
Протей. Proteus vulgaris (индол-отрицательный) и Proteus mirabilis (индол-положительный) — грам-отрицательные обитатели кишечника человека, вызывающие инфекции мочевых путей (благодаря наличию фимбрий и жгутика, а также способности разлагать мочевину) и 10-15% нозокомиальных инфекций. Протей, как и другие возбудители этой группы, вызывает вспышки в отделениях для новорожденных детей, часто с развитием менингита.
Лекарственная чувствительность природная бета-лактамная — выражена в большей степени в отношении уреидопенициллинов и цефалоспоринов 2-4 поколений, но нозокомиальные штаммы протея теряют чувствительность к бета-лактамам, а также к аминогликозидам; это в большей степени относится к штаммам P. vulgaris.
Клинические проявления: ИМП, пневмония, раневая инфекция, хроническая некротическая инфекция среднего уха.
Терапия. Эмпирическая для БЛРС-отрицательных штаммов: цефалоспорины 3-4 поколения, ингибитор-защищенные пенициллины, фторхинолоны, в т.ч. в комбинации с аминогликозидами. Для БЛРС-положительных штаммов: карбапенемы, фторхинолоны, цефоперазон/сульбактам, в т.ч. с аминогликозидами.
Серрация. Serratia marcescens колонизирует кишечник и вызывает нозокомиальные инфекции, в основном, в отделениях интенсивной терапии.
Лекарственная чувствительность. Показано, что применение цефалоспоринов 3-4 поколения ведет к отбору устойчивых штаммов серраций, так что подбор препаратов должен основываться на данных антибиотикограммы.
Клинические проявления: нозокомиальная пневмония, ИМП, бактериемия.
Терапия. Эмпирически используют защищенные пенициллины широкого спектра, цефепим, карбапенемы, в т.ч. в комбинации с аминогликозидами.
Цитробактер. Citrobacter divcrsus и ряд других представителей вида обитает в кишечнике и могут колонизировать мочевые пути, респираторный тракт, раны. Вырабатывает эндотоксин, сходный с таковым клебсиелл.
Лекарственная чувствительность , как и других эитеробактерий во многом определяется наличием лактамаз.
Клинические проявления: септицемия и менингит новорожденных, нозокомиальная пневмония, инфекция мочевых путей, бактериемия.
Терапия. Эмпирически используют карбапенемы, цефепим.
Энтеробактер. Enterobacter — грам-отрицательный обитатель кишечника, на 50% (по ДНК) родственный клебсиеллам. Продуцирует эндотоксин (липополисахарид), вызывающий ДВС-синдром, лейкоцитоз или лейкопению, падение АД и другие септические проявления.
Лекарственная чувствительность. Нозокомиальные штаммы часто БЛРС+.
Клинические проявления: бактериемия, пневмония, инфекция ожогов.
Терапия. Эмпирически: защищенные уреидопенициллины, меропенем, цефепим.
Неферментирующие микроорганизмы
В эту группу входят возбудители нозокомиальных инфекций, не ферментирующие, в отличие от большинства других возбудителей, глюкозу.
Alcaligenes spp. Широко распространенные во внешней среде грам-отрицательные бактерии, некоторые из них — A. fecalis, A. xyloxidans (также известный как Achromobacter xyloxidans) колонизируют кишечник человека. Источником может быть загрязнение растворов, больничного оборудования, вентиляционных систем. Особо восприимчивы истощенные больные, в т.ч. на иммуносупрессии, инфицированные ВИЧ лица.
Лекарственная чувствительность к цефалоспоринам 3 поколения, уреидопени-инллинам, карбапенемам, но быстро вырабатывается устойчивость. Чувствительность к иминогликозидам и фторхинолонам непостоянна.
Клинические проявления: бактериемия, пневмония, послеоперационная инфекция рай, нервной системы.
Терапия. Меропенем, цефалоспорины 3-4 поколения, в т.ч. с аминогликозидами.
Acinetobacter spp. A. baumannii, A. cacoaceticus и ряд других представителей вида — грам-отрицательные каталозо-положительные коккобациллы, не ферментирующие лактозу, родственные Neisseria и Moraxella, распространены в воде и почве, они колонизируют кожу (25% взрослых), респираторный тракт (5%), мочевые пути. Частота колонизации возрастает у грахеостомированных и больных на ИВЛ; среди заболевших до половины дети с онкологической патологией, почти все — с центральным венозным катетером. Обнаруживается в местах высокой влажности — вентиляционных системах, увлажнителях, ингаляторах. Внебольничная инфекция крайне редка.
Лекарственная чувствительность больничных штаммов набольшая к амикацину п чмитнему, в последние 2 десятилетия она снижается из-за выработки лактамаз, в т.ч. металлл-бета-лактамазы (МБЛ). Нарастает устойчивость и к аминогликозидам (в России — 68-89%), цефалоспоринам 3-4 поколений (64-98%) и фторхинолонам (62-74%).
Клинические проявления: ИВЛ-ассоциированная пневмония, бактериемия, менингит, ИМИ, абдоминальный сепсис, инфекция мягких тканей.
Терапия. Ими не нем, меропенем, цефоперазон/сульбактам, в т.ч. с аминогликозидами.
Лекарственная чувствительность изначальная к аминопенициллинам, цефалоспоринам 3 поколения, карбапенемам, хлорамфениколу, тобрамицину, ко-тримоксазолу, фторхинолонам, однако у большинства штаммов, выделенных у больных муковисцидозом, наблюдается множественная лекарственная устойчивость.
Клинические проявления. У иммунокомпетентных лиц возбудитель вызывает но-юкомиальные ИМП, пневмонии, сепсис, протекающие без особой тяжести. У больных муковисцидозом и хронической гранулематозной болезнью развиваются тяжелые пневмонии, при инфицировании пересаженного легкого летальность достигает 80%.
Терапия. Эмпирически: тобрамицин или ципрофлоксацин + цефтазидим или защищенный уреидопенициллин. Альтернативы: карбапенем, хлорамфеникол.
Псевдомонады. Pseudomonas aeruginosa (из-за выработки синего пигмента известен как сине-гнойная палочка) — широко распространенный микроорганизм, обитающий в сырых местах — сливах раковины, ванн, душевых поддонов, увлажнителях, аэрозольных аппаратах. Колонизация наблюдается часто, выделение их из клинических проб в отсутствие проявлений диагностического значения пе имеет. Заболевание развивается, в основном, у лиц с нарушенными барьерами (трахеостомия, ИВЛ, муковисцидоз, нейтропения, ожоги), а также при манипуляциях (катетеризация, пункции и т.д.).
Клинические проявления практически неотличимы от вызванных энтеробакте-риями, при плеврите, ожоговом нагноении; характерен синеватый вид гноя.
Терапия. Эмпирически: карбапенемы, цефепим, цефтазидим, ципрофлоксацин, в т.ч. с аминогликозидами.
Stenotrophomonas. S. maltophilia — грам-отрицательиая аэробная палочка, широко распространенная во внешней среде, нередко выделяется из кала. Инфицирует больных на иммуносу-прессии, длительно получающих антибиотики, имеющих внутривенные катетеры.
Лекарственная чувствительность к ко-тримоксазолу. Металло-бета-лактамазы (МБЛ) делают его устойчивым ко всем (3-лактамам, в т.ч. карбапенемам.
Клинические проявления: септицемия, раневая инфекция, пневмония, ИМИ.
Терапия. Ко-тримоксазол в комбинации с защищенными пенициллинами и фторхинолоном. Используют и доксициклин или ципрофлоксацин + тикарциллин/клавуланат.
Стафилококки
Нозокомиальная стафилококковая инфекция распространена повсеместно, ее вызывает, в основном, S. aureus: коагулазо-отрицательный (белый, КоаНС) стафилококк представляет собой серьезную угрозу для новорожденных детей.
Лекарственная чувствительность. Среди больничных штаммов S. aureus в России 50% (0-87%) составляют метициллинорезистентные (МРЗС), но чувствительные на 100% к ванкомицииу, линезолиду, мупироцин, а также (на 97-99%) к фузидиевой кислоте и ко-тримоксазолу. 46-75% стафилококков были устойчивы к остальным препаратам. В США в ОРИТ доля МРЗС в 2003 г. достигла 60%. Среди КоаНС встречаются как чувствительные к метициллииу штаммы (МЧЭС), так и резистентные (МРЭС).
Клинические проявления. Внутрибольничная (нозокомиальная) инфекция, вызванная стафилококком как МЧЗС, так и МРЗС) проявляется в форме бактериемии, сепсиса, остеомиелита, артрита, эндокардита (особенно частого при длительной катетеризации магистральной вены), в виде органного поражения (чаще всего пневмонии), а также как раневая инфекция и инфекция мягких тканей.
Терапия. Практически все случаи нозокомиальной стафилококковой инфекции следует расценивать как МРЗС и эмпирически использовать ванкомицин (в т.ч. в комбинации с аминогликозидами или рифампицином). Препарат резерва — линезолид. Местные процессы, вызванные МРЗС, поддаются лечению мупироцином.
При лечении инфекции, вызванной КоаНС, используют те же правила, что и в отношении золотистого стафилококка соответствующей чувствительности; но и в этом случае эмпирически оправдано применение ванкомицина.
Профилактика. Для борьбы с носительством стафилококков персоналом применяется обработка входа в нос мупироцином (Бактробан) в течение 5 дней.
Энтерококки
Enterococcus spp. — ранее относимые к стрептококкам группы D — каталазо-отрицательные, обитающие в кишечнике, нередко также в уретре, влагалище, реже во рту. Близок к ним S. bovis, обитающий в кишечнике и вызывающий бактериемию и эндокардит у лиц с патологией толстого кишечника. Обладая умеренной патогенностью, энтерококки рассматриваются как оппортунистические возбудители внутрибольничных инфекций, особенно у лиц, получающих много антибиотиков. Ко-патогенами чаще всего становятся грам-отрицательные бактерии.
Лекарственная чувствительность к линезолиду (100%), ванкомицину (98% — только Е. fecium). К ампициллину чувствителен Е. fecalis, но не Е. fecium (97% и 8% соответственно). Оба штамма устойчивы к тетрациклинам (Е. fecalis 69%, Е. fecium 53%), хлорамфениколу (45% и 58%), ципрофлоксацину (70% и 100%), гентамицину (41% и 82%), стретомицину (34% и 74%). Энтерококки изначально устойчивы к бета-лактамам (кроме ампициллина), клиндамицину, ко-тримоксазолу. В целом, частота выявления устойчивых штаммов Е. fecalis намного ниже, чем Е. fecium.
В США в 2003 г. доля устойчивых к ванкомицину энтерококков (ВРЭ) в ОРИТ составила 28%5; для лечения вызванных ими инфекций у взрослых там лицензированы квинупристин-дальфопристин, даптомицин. Доля МРЗС и ВРЭ в педиатрических ОРИТ США намного ниже чем во взрослых ( Клинические проявления. Помимо бактериемии, энтерококки вызывают инфекцию мочевых путей, эндокардит, внутриабдоминальную инфекцию. Часто осложняет использование эндопротезов, шунтов и в/в катетеров.
Диагностические тесты. Достоверным является высев из стерильных в норме жидкостей. Обнаружение возбудителей в крови в 85-90% указывает на инфекцию.
Терапия. Стандартом лечения энтерококковой инфекции является ампициллин, амоксищиишн или ванкомицин в комбинации с аминогликозидом; с учетом высокой устойчивости к гентамицину в России, следует использовать другой препарат этой группы. При выделении резистентных к ванкомицину штаммов используют линезолид, доксициклин, хлорамфеникол (не у новорожденных!), даптомицин; терапия эндокардита требует 4-6 недель, другие инфекции лечат более короткими курсами.
Читайте также:


