Синдрома кушинга ревматоидный артрит

Общие сведения
Болезнь и синдром Иценко-Кушинга (кушингоид, гиперкортицизм) – это тяжелое состояние, для которого характерно нарушение регуляторных механизмов, контролирующих гипоталамо-гипофизарно-надпочечниковую систему. Впервые признаки этого заболевания описал в 1924 году невропатолог из СССР Николай Иценко. Он высказал предположение, что причиной болезни являются изменения гипоталамуса. Именно гипоталамус определяет взаимодействие нервной и эндокринной систем.
Американский нейрохирург Харвей Кушинг определил наличие связи этого заболевания с опухолью гипофиза. В настоящее время ученые доказали правоту обоих медиков. Они подтвердили, что болезнь Кушинга является следствием сбоев в функционировании гипоталамо-гипофизарной системы. Это заболевание является достаточно редким и чаще всего диагностируется у женщин в возрасте 25-40 лет. Представительниц прекрасного пола болеют этим недугом в пять раз чаще, чем мужчины.
Болезнь и синдром Кушинга не отличаются по своим клиническим проявлениям. Синдром Кушинга (или синдром гиперкортицизма) диагностируется при опухоли надпочечника либо эктопированной опухоли ряда органов, продуцирующих глюкокортикоиды. При этом синдроме на организм длительное время влияет чрезмерное количество гормонов коры надпочечников.
Патогенез
У людей с болезнью Иценко-Кушинга размеры гипофиза увеличены – развивается аденома или опухоль. Если болезнь развивается, со временем надпочечники также увеличиваются.
Чрезмерная выработка кортизола приводит к тем патологическим изменениям, которые характерны для этого заболевания. Если кортизола в организме продуцируется слишком много, это приводит к катаболическому влиянию на белковые структуры и матрицы тканей и структур. Речь идет о костной и мышечной ткани (оказывается влияние на миокард, а также гладкие мышцы), внутренние органы. Постепенно появляются выраженные атрофические и дистрофические изменения.
В таком состоянии в организме нарушен и углеводный обмен. Так как происходит стойкая стимуляция глюконеогенеза и гликогенолиза в печени и мышцах, развивается гипергликемия (стероидный диабет).
Гиперкортицизм приводит к изменениям жирового обмена. В одних местах тела происходит чрезмерное накопление жировых отложений, а в других – жировая клетчатка атрофируется. Объясняется этот тем, что разные жировые участки имеют разную чувствительность к глюкокортикоидам.
Еще одна важная составляющая патогенеза синдрома Кушинга – это электролитные расстройства (гипернатриемия, гипокалиемия). Их развитие связано с воздействием чрезмерного количества альдостерона на почки. Такие электролитные нарушения приводят к развитию артериальной гипертензии и кардиомиопатии, что, в свою очередь, ведет к сердечной недостаточности и аритмии.
Глюкокортикоиды негативно воздействуют на иммунный статус, что приводит к склонности к инфекциям.
Гиперкортицизм может развиваться и в процессе лечения разных заболеваний, когда человек принимает глюкокортикоиды – гормоны коры надпочечников — при условии передозировки.
Классификация
В процессе диагностики определяется эндогенный и экзогенный гиперкортицизм.
- Эндогенный синдром Кушинга– следствие слишком активной выработки надпочечниками глюкокортикоидов.
- Экзогенный синдром Кушинга – следствие приема глюкокортикостероидных лекарств в слишком больших дозах с целью заместительной терапии. Эта форма болезни может развиваться вне зависимости от формы лекарств: это могут быть как таблетки или растворы для инъекций, так и местные средства.
В свою очередь выделяются следующие формы эндогенного гиперкортицизма:
- АКТГ-независимый, то есть первичный. Его также подразделяют на несколько разных типов.
- АКТГ-зависимый, то есть вторичный. В таком случае чрезмерное количество АКТГ синтезирует гипофиз либо, в более редких случаях, опухоль, которая располагается вне гипофиза. Реже всего речь идет об эктопической секреции КРГ.
АКТГ-независимый гиперкортицизм связан с такими явлениями:
- Автономные опухоли надпочечников— это аденомы, как правило, одиночные, реже – множественные. Те опухоли, которые происходят из пучковой зоны, продуцируют только гормон кортизол. Другие типы опухолей – смешанные или опухоли из сетчатой зоны – кроме кортизола, синтезируют и андрогены. При избытке в организме кортизола вследствие ингибирования секреции КРГ и АКТГ атрофируются ткани коры надпочечников – как пораженной, так и здоровой железы . Иногда также появляются множественные узлы коры надпочечника.
- Макронодулярная гиперплазия надпочечников – эта форма связана с эктопическими рецепторами в коре надпочечников, которые реагируют на стимуляцию нетипичными раздражителями. Чаще всего это желудочный ингибиторный пептид, который выделяется после приема пищи в пищеварительном тракте. Но стимулирующие факторы могут быть и другими — вазопрессин, катехоламины, ТТГ, ЛГ, ХГЧ, ФСГ, большие концентрации эстрогенов, пролактина.
- Микронодулярная гиперплазия надпочечников – семейная форма и спорадическая форма, когда гиперплазию коры надпочечников провоцируют иммуноглобулины. Как и при других формах независимого гиперкортицизма может происходить атрофия ткани надпочечника между узелками.
Причины
Чаще всего кушингоидный синдром развивается при наличии базофильной или хромофобной аденомы гипофиза, которая выделяет адренокортикотропный гормон. Если развивается опухоль гипофиза, у больного появляется аденокарцинома или микроаденома.
В некоторых случаях развитие болезни Иценко-Кушинга связано с недавним инфекционным поражением ЦНС вследствие перенесенного энцефалита, арахноидита, ЧМТ, менингита, интоксикации.
Синдром Кушинга у женщин может быть связан с резкими гормональными скачками и перестройками. Иногда у женщин симптомы заболевания проявляются после беременности, родов, в период менструальной паузы.
Но в целом эксперты до сих пор ведут работу над тем, чтобы четко определить причины, вызывающие кушингоидный синдром.
Симптомы Иценко-Кушинга
И кортизол, и другие глюкокортикоиды являются в организме физиологическими регуляторами. Они снижают синтез белков и способствуют их распаду, увеличивают выработку глюкозы и стимулируют липолиз, оказывают влияние на иммунную систему.
Поэтому симптомы болезни Иценко-Кушинга связаны с чрезмерной продукций кортикостероидов, в частности ГКС. Происходит поражение большинства систем и органов, и при этом развивается характерный для болезни Иценко-Кушинга комплекс симптомов.
Определяются следующие характерные симптомы болезни Кушинга у человека:
- Диспластическое ожирение – этот признак появляется раньше всего и встречается наиболее часто. Жировые отложения под кожей перераспределяются так, что жир откладывается в плечах, над шейными позвонками, над ключицами, на животе. При этом конечности остаются сравнительно тонкими. Кушингоидное лицо округляется и приобретает багровый цвет (матронизм). Это – так называемый кушингоидный тип ожирения.
- Трофические изменения кожных покровов– кожа становится тонкой, очень сухой, имеет багрово-цианотичный оттенок. В тех местах, где откладывается чрезмерное количество жира, появляются растяжки фиолетового цвета. Появление стрий связано с тем, что кожа истончается и при этом активизируется катаболизм белков. Если человек получает незначительную травму, у него сразу появляются гематомы ввиду усиленной ломкости капилляров. В местах, где возникает сильное трение – на шее, локтях, подмышками – появляется гиперпигментация. У женщин часто появляются признаки гирсутизма – рост волос по мужскому признаку, а также гипертрихоз груди.
- Вторичный гипогонадизм – это ранний признак болезни. Симптомы синдрома Иценко-Кушинга проявляются нарушениями месячного цикла (развивается аменорея и опсоменорея). Эти симптомы у женщин могут в итоге привести к бесплодию. У мужчин ухудшается потенция, развивается гинекомастия. Если заболевание развивается в детстве, то у мальчиков в подростковом возрасте половой член и яички остаются недоразвитыми. У девочек же проявляется первичная аменорея и нормально не развиваются молочные железы. При этом в плазме крови больного понижается уровень гонадотропинов, эстрогенов, тестостерона.
- Миопатия– мышцы гипотрофируются, этот процесс затрагивает верхние и нижние конечности, переднюю брюшную стенку. Соответственно, ноги и руки становятся тонкими, а живот – увеличивается за счет отвисания и жировых отложений.
- Артериальная гипертензия– это проявление характерно для большинства таких больных. Вследствие регулярных проблем с артериальным давлением нарушается метаболизм миокарда, развивается сердечная недостаточность. В ходе электрокардиографии могут определяться признаки гипертрофии левого желудочка.
- Вторичный иммунодефицит – выражается в появлении акне и грибковых поражений на коже, а также поражений ногтей. У таких больных долго заживают раны, появляются трофические язвына голенях, развивается хронический пиелонефрит. Проявляются и многочисленные изменения вегетативной нервной системы, что приводит к развитию синдрома вегетативной дистонии с многочисленными и разнообразными проявлениями, в том числе и выраженными психозами.
- Нарушение обмена углеводов – нарушается толерантность к глюкозе, проявляется диабет второго типа с гиперинсулинемией, инсулинорезистентностью, отсутствием склонности к кетоацидозу и благоприятным течением.
- Изменения костей – если болезнь проявляется в детском возрасте, темпы роста малыша замедляются, либо он останавливается полностью. Задерживается и развитие скелета. Между реальным возрастом ребенка и возрастом его костей может отмечаться разница до 5 лет. Одним из самых тяжелых проявлений гиперкортицизма считается стероидный остеопороз, при котором происходит деминерализация костей и подавляется синтез белкового матрикса. В таком случае часто проявляются боли в позвоночнике, происходят переломы позвонков и ребер.
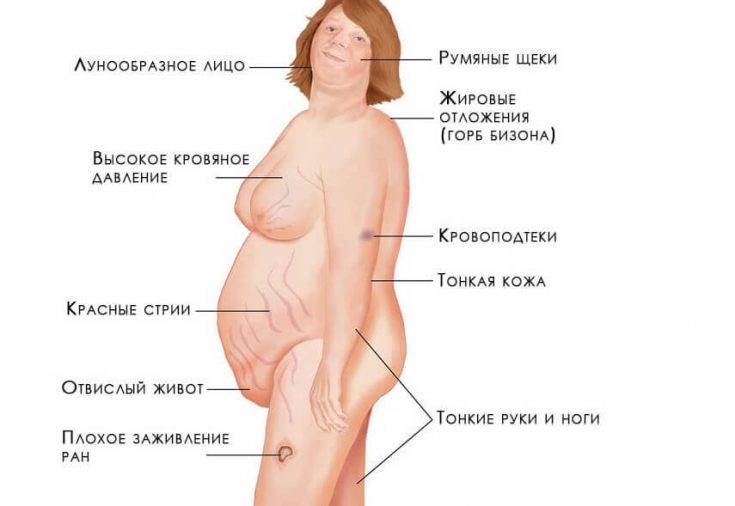
Симптомы синдрома Иценко-Кушинга
Итак, основные симптомы этого заболевания являются следующими:
- ожирение особого типа;
- истончение кожных покровов;
- слабость и атрофия мышц;
- гипертензия, проблемы с сердцем, отеки;
- нарушение месячного цикла, дисфункция половых желез;
- нервные расстройства;
- высокая частота инфекционных болезней;
- плохо заживающие раны;
- остеопороз, переломы.
Анализы и диагностика
Если человек отмечает у себя проявления части из описанных выше признаков, ему необходимо незамедлительно обращаться к эндокринологу.
Чтобы установить диагноз, врач изначально проводит осмотр, после чего назначает пациенту проведение необходимого комплекса исследований:
- Лабораторное исследование крови и мочи на содержание гормонов. Обязательно необходимо определить уровень кортикостероидов и АКТГ.
- Проводятся также гормональные пробы. Для этого изначально пациент сдает кровь для определения уровня гормонов, после чего принимает препарат (Синактен, Дексаметазони др.) и спустя определенное время снова сдает кровь.
- Биохимический анализ крови – позволяет определить наличие нарушений в организме, а также выявить сахарный диабет.
- Проводится рентген черепа и области турецкого седла, чтобы определить размеры гипофиза пациента.
- Компьютерная и магнитно-резонансная томография – проводят с целью подробного изучения особенностей гипофиза и структур мозга.
- Рентген костей скелета – проводят, чтобы определить наличие остеопороза и патологических переломов.
Лечение синдрома Иценко-Кушинга
После установления диагноза врач назначает комплексное лечение синдрома Кушинга. Лечение, в зависимости от индивидуальных особенностей течения заболевания, может быть следующим:
- Медикаментозное– назначают препараты, которые блокируют чрезмерную продукцию АКТГ или кортикостероидов.
- Лучевая терапия– ее проведение дает возможность снизить активность гипофиза.
- Хирургическое – врач принимает решение об удалении опухоли гипофиза. Проводят традиционную операцию либо используют криохирургию – разрушение опухоли влиянием низких температур (используют жидкий азот). Если болезнь развивается очень активно, проводят удаление одного или обоих надпочечников.
Как правило, в процессе терапии заболевания сочетается несколько разных методов.
В каких случаях врач общей практики должен заподозрить синдром Кушинга? Как подтвердить диагноз? Нужно ли отменять короткие курсы экзогенных кортикостероидов постепенно? Рисунок 1. Плетора и лунообразность лица, присущие синдрому К
Ярко выраженный СК не представляет особых диагностических трудностей, но заболевание с умеренными проявлениями может вызвать у врача общей практики ряд проблем. Диагноз ставится клинически, а подтверждается данными лабораторных исследований.
Большинство случаев СК имеет ятрогенное происхождение и обусловлено длительным приемом преднизолона, дексаметазона или других кортикостероидов. К развитию клинических проявлений заболевания приводит ежедневное применение кортикостероидов в дозах, превышающих эквивалент 7,5 мг преднизолона.
Детям для развития кушингоидных черт достаточно меньших доз.
Хотя СК встречается относительно редко, любой врач общей практики сталкивается с его ятрогенными случаями, вызванными длительным приемом кортикостероидов по поводу таких распространенных заболеваний, как, например, ревматоидный артрит.
БК — наиболее распространенная причина неятрогенного СК (70%); оставшиеся 30% приходятся на случаи эктопической секреции АКТГ и надпочечниковое происхождение болезни (АКТГ-независимый СК).
Клиническая картина. Симптомы СК (см. табл. 1) могут, в зависимости от причины, развиваться остро или исподволь в течение нескольких лет.
Как правило, симптомы неспецифичны и включают сонливость, депрессию, увеличение веса, жажду, полиурию, слабость, легкость появления синяков и гирсутизм [1].
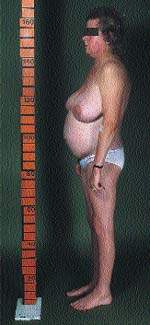 |
| Рисунок 2. Типичная конституция пациента с СК. Обратите внимание на центральное ожирение и относительно тонкие руки и ноги, что вызвано проксимальной миопатией |
Еще одним клиническим признаком СК служат истончение кожи и ломкость капилляров, приводящие к легкому и часто спонтанному образованию синяков. Таким больным присущи кожные инфекции, например отрубевидный лишай, молочница и онихомикоз, причем кожные повреждения заживают с трудом. Почти всегда можно обнаружить абдоминальные стрии, развивающиеся вторично за счет центрального ожирения (рис. 3).
Больные могут страдать от гирсутизма вследствие избыточного образования надпочечниковых андрогенов под воздействием повышенного АКТГ.
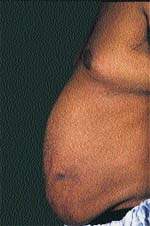 |
| Рисунок 3. Стрии живота у мужчины с СК |
Метаболические изменения, вызываемые повышенным уровнем кортизола, приводят к развитию сахарного диабета, гипертензии и дислипидемии. С длительным повышением циркулирующего в крови кортизола связано также уменьшение минеральной плотности костей и остеопороз.
Применение стероидных ингаляторов (например, беклометазона в дозе 200 мкг каждые 6 часов в течение более чем трех месяцев) и других местных стероидных препаратов может приводить к значительному системному всасыванию и развитию клинических проявлений СК с подавлением гипоталамо-гипофизарно-адреналовой оси.
Если пациент не принимает подобных лекарств, первым шагом будет подтверждение избытка кортизола путем определения свободного кортизола мочи (СКМ) в двух суточных пробах [3].
Следующая задача — показать, что эндогенная секреция кортизола не подавлена экзогенными глюкокортикоидами. Для этого проводится ночная дексаметазоновая проба (ДП): в 11 часов вечера пациент принимает 1 мг дексаметазона, а на следующее утро между 8 и 9 часами берется проба крови на кортизол. СК предполагается в том случае, если уровень кортизола не упал ниже 50 нмоль/л. Однако вследствие низкой специфичности теста могут быть ложноположительные результаты.
Направление к специалисту. При подозрении на СК необходимо сразу же направить пациента к эндокринологу. После направления, как правило, дважды проводится определение СКМ и выполняется более специфическое исследование — проба с дексаметазоном в низкой дозе (ДПНД) [4]. Пациент принимает по 0,5 мг дексаметазона восемь раз каждые 6 часов. Отсутствие падения кортизола ниже 50 нмоль/л в 9 часов утра по окончании ДПНД указывает на СК.
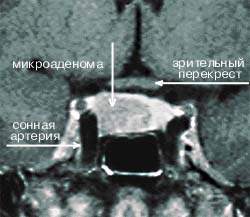 |
| Рисунок 4. МР-томограмма гипофиза, на которой видна правосторонняя микроаденома, секретирующая АКТГ (гипофиз-зависимая болезнь Кушинга) |
Определение СКМ дает нормальные результаты практически постоянно, если у пациента циклический СК (то есть активность заболевания нарастает и падает в течение недель или месяцев), поэтому данное исследование считается низкочувствительным. Более важная проба — ДПНД, и при обнаружении отклонений от нормы пациента следует направить на дальнейшее обследование.
Амбулаторные исследования включают изучение суточного ритма кортизола (рис. 5), дексаметазоновую пробу с высокой дозой [5] (ДПВД, рис. 6) и определение кортикотропин-рилизинг гормона (КРГ). Подтверждение гипофиз-зависимого заболевания основывается на заборе крови из нижнего каменистого синуса для определения в ней уровня АКТГ и последующего введения КРГ [6, 7]. Как правило, требуется визуализация: компьютерное сканирование надпочечников, чтобы дифференцировать надпочечниковое и АКТГ-зависимое состояние; МР-томография гипофиза (рис. 4); компьютерное сканирование грудной клетки и брюшной полости при подозрении на эктопическую секрецию АКТГ.
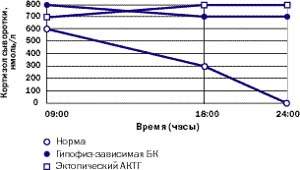 |
| Рисунок 5. Так выглядит типичный суточный ритм кортизола у здорового человека, пациента с БК и пациента с эктопическим СК |
Лечение СК зависит от причины заболевания. Методом выбора при БК служит селективная транссфеноидальная микроаденомэктомия: излечения удается добиться в 80% случаев (эффективным лечение считается тогда, когда наличие кортизола через 24-48 часов после операции не обнаруживается) [8].
При успешном исходе операции по поводу БК пациенту понадобится заместительный курс гидрокортизона, пока не восстановится его собственная гипоталамо-гипофизарно-надпочечниковая (ГГН) функция. Как правило, достаточно 20 мг гидрокортизона утром и 10 мг — в 6 часов вечера.
В случае обнаружения аденомы надпочечников показана односторонняя адреналэктомия. Железа с другой стороны оказывается атрофичной (по принципу обратной связи) в результате длительного подавления секрецией АКТГ, поэтому пациенту также понадобится заместительная терапия гидрокортизоном вплоть до восстановления ГГН.
Эктопические АКТГ-секретирующие опухоли (например, карциноиды бронхов или тимуса) требуют удаления. После операции вновь проводится гидрокортизоновое прикрытие. Процесс включения ГГН может занять несколько месяцев. При отсутствии эффекта от операции проводят облучение гипофиза из внешнего источника (4500 Гр в 25 сериях).
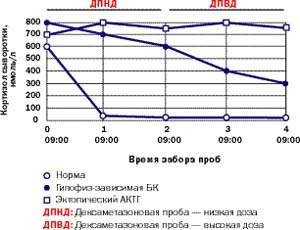 |
| Рисунок 6. Типичные реакции кортизола на дексаметазоновую супрессию низкими (0,5 мг каждые 6 часов в течение 48 часов) и высокими дозами (2 мг каждые 6 часов в течение 48 часов) у здорового человека, пациента с БК и пациента с эктопическим СК |
Если есть противопоказания к проведению оперативного вмешательства, связанные непосредственно с СК, снизить уровень кортизола можно кетоконазолом (начиная с 200 мг). Дозы препаратов подбирают индивидуально, ориентируясь на средний уровень кортизола 200-300 нмоль/л.
После медикаментозного лечения пациент может успешно перенести операцию. При отказе от операции остается возможность длительного лечения кетоконазолом, проводящимся под наблюдением госпитального эндокринолога.
Двусторонняя адреналэктомия проводится только в самых тяжелых случаях, когда безуспешно испробованы все остальные методы. Она неизбежно приводит к необходимости пожизненной заместительной терапии кортикостероидами и минералокортикоидами.
Ведение больных с СК. Самая распространенная причина СК — ятрогенная, особенно если доза принимаемых внутрь стероидов превышает эквивалент 7,5 мг преднизолона у взрослых.
Для профилактики остеопороза пациентам, принимающим стероиды более шести месяцев, назначают бисфосфонаты.
Решение о снижении дозы стероида следует принимать, проконсультировавшись с соответствующим специалистом. Экзогенные стероиды, назначаемые коротким курсом (менее 6 недель), редко вызывают клинически значимую надпочечниковую супрессию, поэтому их можно резко отменять.
При подозрении на неятрогенный СК измерение СКМ и ночная ДП могут помочь в подтверждении этого диагноза (vide supra). Но пациента, у которого обнаружены клинические признаки неятрогенного СК (см. табл.), рекомендуется обязательно направить к эндокринологу.
Она была срочно направлена к эндокринологу по месту жительства. При обследовании выявлена повышенная суточная экскреция с мочой свободного кортизола и потеря суточного кортизольного ритма. Дексаметазоновая проба не выявила супрессии ни при низкой, ни при высокой дозе дексаметазона; реакция кортизола на экзогенный КРГ оказалась плоской.
МРТ-скан гипофиза был нормальным, а при компьютерном сканировании брюшной полости обнаружены утолщенные гиперплазированные надпочечники, характерные для АКТГ-зависимости. Пигментация ладонных складок также подтверждала повышение продукции АКТГ.
Был поставлен клинический и биохимический диагноз эктопического АКТГ-синдрома, и больную отправили в соответствующий центр. Компьютерное сканирование грудной клетки выявило опухоль размером 1 см в верхушке правого легкого, которая была удалена под прикрытием гидрокортизона.
После четырехмесячного курса преднизолона (5 мг на ночь и 2,5 мг днем) наблюдалось восстановление ее ГГН-оси, и стероиды постепенно отменили. Тело приобрело нормальные формы в течение 6 месяцев, восстановилась супрессорная активность дексаметазона.
Синдром Иценко-Кушинга назван по имени двух ученых — советского невропатолога Николая Иценко и американского нейрохирурга Харвея Кушинга. Иценко первым, в 1924 году описал серьезное заболевание, связав его с нарушениями работы гипоталамуса. Кушинг спустя определенное время описал симптомы заболевания, связанного с образованием в гипофизе опухоли. На самом деле и Иценко, и Кушинг не ошиблись, поэтому в настоящее время синдром носит двойное название (в зарубежных медицинских источниках — просто синдром Кушинга), по имени двух ученых. Заболевание действительно возникает вследствие нарушений нормальной функции гипоталамуса и гипофиза.
Суть синдрома — избыточный уровень гормона кортизола. Эндокринная система человека состоит из желез, производящих гормоны, регулирующие массу внутренних процессов. К этим железам относятся: надпочечники, гипофиз, щитовидная железа, паращитовидная и поджелудочная железы, а также яичники у женщин и яички у мужчин.
Кортизол вырабатывается надпочечниками и очень важен для организма. Например, помогает регулировать артериальное давление и стабилизирует работу сердечно-сосудистой системы. Он также помогает организму реагировать на стресс и регулирует то, как человек конвертирует белки, углеводы и жиры из ежедневного рациона в полезную для тела энергию. Однако, когда уровень кортизола слишком высок, развивается синдром Иценко-Кушинга.
Причины синдрома Иценко-Кушинга. Экзогенный и эндогенный синдром Кушинга
Экзогенный синдром Кушинга
Причин может быть несколько. Если виноваты внешние факторы, такой синдром Кушинга называется экзогенным. Например, в результате длительного употребления кортикостероидов, в том числе препарата Преднизолон, развивается этот вид синдрома. Кортикостероиды — популярные препараты для лечения ревматоидного артрита, волчанки и астмы. Также они необходимы для предотвращения отторжения пересаженных органов. Поскольку дозы, необходимые для лечения, зачастую выше, чем способно покрыть вырабатываемое организмом количество кортизола, возникают последствия: боли в суставах, бурсит, боли в спине.
Ингаляционные препараты для лечения астмы или стероидные кремы, использующиеся для лечения кожных заболеваний, например, экземы, реже вызывают побочные эффекты.
Эндогенный синдром Кушинга
Если причины синдрома Кушинга связаны с нарушениями в организме, такое заболевания называют эндогенным. Появляется оно в результате избыточной активности надпочечников, которые стимулируются гипофизом и гипоталамусом, в результате этого кортизола вырабатывается больше, чем необходимо. В этих случаях синдром Кушинга связывают с:
1. Опухолью гипофиза (аденомой).
Нераковая опухоль гипофиза заставляет железу выделять большое количество АКТГ. Эта форма синдрома называется АКТГ-синдром. Чаще встречается у женщин и является наиболее распространенной формой проявления эндогенного синдрома Иценко-Кушинга.
2. Внематочной АКТГ-секретирующей опухолью.
Изредка, когда опухоль появляется в органе, не секретирующем АКТГ, например, на тимусе, щитовидной, поджелудочной железе или легких, кортизол так же вырабатывается с избытком.
3. Основным заболеванием надпочечников.
В этом случае перепроизводство кортизола не связано от стимуляции АКТГ и вызвано лишь нарушениями в самих надпочечниках. Самой распространенной причиной такого состояния является аденома надпочечника или раковая опухоль коры надпочечника.
4. Наследственной формой заболевания.
В редких случаях у людей появляется тенденция к развитию опухолей на железах внутренней секреции, и передается такая особенность по наследству.
Симптомы синдрома Иценко-Кушинга
Симптомы заболевания могут изменяться в зависимости от формы и степени тяжести.
- ожирение;
- изменение состояния кожи;
- увеличение жировой прослойки в области верхней части спины, между плечами;
- легко появляются синяки, тонкая кожа;
- розовые или пурпурные растяжки (стрии) на коже живота, бедер, груди и рук;
- медленное заживление порезов, укусов насекомых и длительное течение инфекций;
- акне;
- слабость мышц;
- нарушение толерантности к глюкозе, приводящее к диабету;
- головные боли;
- когнитивные нарушения;
- высокое кровяное давление;
- потеря костной ткани, приводящая к переломам.
У мужчин снижается либидо, угнетается репродуктивная функция.
Лечение синдрома Иценко-Кушинга
Лечение синдрома Кушинга направлено на снижение высокого уровня кортизола. Среди эффективных методов лечения можно выделить следующие:
1. Ограничение количества кортикостероидов.
Уменьшение дозировки препарата (если отказаться полностью от него нельзя) помогает держать симптомы заболевания под контролем.
2. Хирургическое лечение.
Если причиной заболевания является опухоль, рекомендуется полное ее удаление. Опухоли гипофиза нередко удаляются через нос. Если опухоль присутствует в надпочечниках, легких или поджелудочной железе, хирург может удалить ее с помощью стандартной процедуры или минимально инвазивным путем. После операции пациенту показан прием препаратов кортизола, чтобы избежать резкого скачка и сбоев гормональной системы. После восстановления функции надпочечников выработка кортизола восстанавливается, и необходимость употребления препаратов исчезает. В некоторых случаях синдрома Кушинга больной нуждается в пожизненной заместительной гормональной терапии.
3. Радиационная терапия.
При невозможности полного удаления опухоли применяют радиационную терапию. Продолжительность такого курса лечения в среднем составляет 6 недель. Другой вариант — использование гамма-ножа — когда к опухоли точечно поставляются малые дозы радиации, не повреждая соседние ткани.
4. Лекарственные препараты.
Как правило, применяются до операции у пациентов с тяжелой формой заболевания. Среди используемых препаратов такие: Низорал, Митотан, Метирапон, Мифепристон. Последний показан больным с диабетом 2 типа или непереносимостью глюкозы.
Если ни один из этих вариантов лечения не является эффективным, врач может рекомендовать хирургическое удаление надпочечников (двустороннюю адреналэктомию). Эта процедура избавляет от избыточного производства кортизола.
Синдром Нельсона: симптомы и лечение
Синдром Нельсона — это расстройство, характеризующееся увеличением гипофиза и развитием инвазивных опухолей крупных размеров (аденом). Наблюдается примерно у 15—25% больных, перенесших удаление надпочечников в результате синдрома Кушинга.
Симптомы
Основные симптомы синдрома Нельсона это:
- гиперпигментация кожных покровов;
- головные боли;
- ухудшение зрения;
- прекращение менструаций;
- аномально высокие уровни АКТГ и бета-меланоцитстимулирующего гормона в крови.
Из-за наличия опухоли гипофиз становится аномально большим, вызывая мигрени и проблемы со зрением.
Лечение
- Радиационная терапия (общая или точечная).
- Микрохирургическое удаление опухолей. Проводится в области кости в основании черепа.
Простой способ продлить жизнь, который многие игнорируют
Крепкие кости: что нужно включить в рацион, а про какие продукты лучше забыть?
При каких смертельно опасных болезнях может быть частая зевота?
Как должны проходить встречи с друзьями во время пандемии коронавируса?
Коронавирус станет более заразным из-за новой мутации?
Современная ультразвуковая диагностика и сервисное обеспечение УЗИ аппаратов
Акне: причины и методы лечения
Как повысить давление без лекарств

6 достоинств, которые считаются недостатками

Бандажи и ортезы: их ассортимент и предназначение
Читайте также:


