Синякова л а инфекция мочевыводящих путей
Полный текст:
Инфекции нижних мочевых путей представляют в настоящее время актуальную клиническую и социальную проблему в связи с высокой распространенностью, необходимостью междисциплинарного подхода к диагностике и лечению, выраженностью сочетания нарушений мочеиспускания с диспареунией, что приводит к отказу от половой жизни, нарушениям детородной функции. Своевременная и адекватная диагностика нарушений мочеиспускания у женщин с выявлением факторов риска, сопутствующих заболеваний, возбудителей позволяют подобрать рациональную, в первую очередь необходимую антибактериальную терапию, способствующую не только избавлению пациентки от симптомов заболевания, но и препятствующую переходу заболевания в хроническую форму.
Синякова Любовь Александровна – доктор медицинских наук, профессор кафедры урологии и хирургической андрологии
125993, г. Москва, ул. Баррикадная, д. 2/1, стр. 1
Косова Инга Владимировна – кандидат медицинских наук, ассистент кафедры урологии и хирургической андрологии
125993, г. Москва, ул. Баррикадная, д. 2/1, стр. 1
Незовибатько Яков Игоревич – аспирант кафедры урологии и хирургической андрологии
125993, г. Москва, ул. Баррикадная, д. 2/1, стр. 1
1. Нарушения биотопа влагалища в разные периоды жизни женщины: связь с дизурическими расстройствами. Взгляд гинеколога и уролога на причины и принципы лечения генитоуринарных расстройств. В.Е. Балан, Л.А. Синякова, О.В. Богдашевская; под редакцией В.Е. Радзинского. М.: Редакция журнала Status Praesens, 2018. С. 3.
2. Flores-Mireles A.L., WalkerJ.N., Caparon M. et al. Urinary tract infections: Epidemiology, mechanisms of infection and treatment options. Nat. Rev. Microbiol. 2015;13(5):269-284. [PMID:25853778].
4. Gupta K. et al. 2011. Clinical Infectious Diseases. 2011 March; 52(5):103-120.
7. Coussens L.M., Werb Z. Inflammation and cancer. Nature. 2002;420(6917):860–867.
8. Hussain S.P., Harris C.C. Inflammation and cancer: an ancient link with novel potentials. International Journal of Cancer. 2007; 121(11):2373–2380.
9. Schetter A.J., Heegaard N.H.H., Harris C.C. Inflammation and cancer: interweaving microRNA, free radical, cytokine and p53 pathways. Carcinogenesis. 2010;31(1):37-49.bgp272.
10. Kawanishi S., Hiraku Y. Oxidative and nitrative DNA damage as biomarker for carcinogenesis with special reference to inflammation. Antioxidants and Redox Signaling. 2006; 8(5- 6):1047–1058.
11. Murata M., Thanan R., Ma N., Kawanishi S. Role of nitrative and oxidative DNA damage in inflammation-related carcinogenesis. Journal of Biomedicine and Biotechnology. 2012;2012:11 pages.623019.
12. Kawanishi S., Ohnishi S., Ma N., Hiraku Y., Oikawa S., and Murata M. Nitrative and oxidative DNA damage in infection-related carcinogenesis in relation to cancer stem cells. Genes Environ. 2016;38:1–12.
13. Ohnishi S., Ma N., Thanan R., Pinlaor S., Hammam O., Murata M., Kawanishi S. DNA Damage in Inflammation-Related Carcinogenesis and Cancer Stem Cells. Oxid Med Cell Longev. 2013; 2013:387014.
14. IARC. Chronic infectionsin. In: Stewart B.W., Kleihues P., editors. World Cancer Report. Lyon, France: IARC Press; 2008:128–135.
15. Лоран О.Б., Синякова Л.А., Гундорова Л.В., Косов В.А., Косова И.В., Колбасов Д.Н, Погодина И.Е. Морфологические особенности рака мочевого пузыря у больных с хронической герпесвирусной инфекцией. Лечащий врач. 2017;9:13-18.
16. Косова И.В., Лоран О.Б., Синякова Л.А., Гундорова Л.В., Косов В.А., Погодина И.Е., Колбасов Д.Н. Сочетанная вирусная инфекция при раке мочевого пузыря. Consilium Medicum. 2018; 20(7):30-36.
17. Marchese A., Gualco L., Debbia E.A., et al. In vitro activity of fosfomycin against gram-negative urinary pathogens and the biological cost of fosfomycin resistance. Int J Antimicrob Agents. 2003;22:53–59.
18. Schito G.C. Attività in vitro di fosfomicina nei confronti di patogeni urinari Gram negativi di recente isolamento. Presented at the 21st Congresso Nazionale della Società Italiana di Chemioterapia, Florence, 1–5 December 2001.
19. Ungheri D., Albini E., Belluco G. In vitro susceptibility of quinolone resistant clinical isolates of E. coli to fosfomycin trometamol. J Chemother. 2002;14:132–135.
20. Babb J.R. et al. Effect of a single dose of fosfomycin trometamol on the resident skin flora. In: Neu H.C., Williams J.D., editors. New Trends in Urinary Tract Infections. Basel: Karger. 1988:284–291.
21. Reeves D.S. et al. Effect of fosfomycin trometamol on the faecal flora of eight healthy volunteers. In: Neu H.C., Williams J.D., editors. New Trends in Urinary Tract Infections. Basel: Karger, 1988:292–298.
22. Bonfiglio G., Mattina R., Lanzafame A., et al. Fosfomycin tromethamine in uncomplicated urinary tract infections: a clinical study. Chemotherapy. 2005;51:162–166.
23. Elhanan G., Tabenkin H., Yahalom R., Raz R. Singledose fosfomycin trometamol versus 5-day cephalexin regimen for treatment of uncomplicated lower urinary tract infections in women. Antimicrob Agents Chemother. 1994; 38:2612–2614.
24. Hooton T.M. Prevention of recurrent urogenital tract infections in adult women (introduction). In: Naber K.G., Schaeffer A.J., Heyns C.F., et al., editors. Urogenital infections. European Association of Urology – International Consultation on Urological Diseases. Arnhem, The Netherlands. 2010:236–239.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Инфекции мочевых путей относятся к наиболее распространенным инфекционным заболеваниям как в амбулаторной, так и в госпитальной практике. По характеру течения инфекции мочевых путей подразделяются на неосложненные и осложненные. Неосложненные инфекции мочевых путей возникают у больных при отсутствии каких–либо нарушений оттока мочи из почек или мочевого пузыря, без структурных изменений в почках или мочевых путях и без серьезных сопутствующих заболеваний. Осложненные возникают у больных с различными обструктивными уропатиями, на фоне инструментальных методов лечения и обследования, у больных с серьезными сопутствующими заболеваниями (сахарный диабет, нейтропения) [1].
К неосложненным инфекциям мочевыводящих путей у взрослых относятся острый цистит, острый пиелонефрит. В течение года у 25–35% женщин в возрасте 20–40 лет имеет место, по крайней мере, один эпизод инфекции мочевых путей [2]. Заболеваемость острым циститом составляет 0,5–0,7 эпизода заболевания на 1 женщину в год [3]. В России, по расчетным данным, имеет место 26–36 млн. случаев острого цистита в год [4]. В США острый цистит ежегодно является причиной 7 млн. обращений к врачу и более 1 млн. госпитализаций [5]. Заболеваемость острым циститом у взрослых мужчин крайне низка и составляет 6–8 эпизодов в год на 10000 мужчин в возрасте 21–50 лет [6]. Однако после 50 лет заболеваемость значительно повышается, достигая к 70–75 годам такого же уровня, что и у женщин. Инфекции мочевыводящих путей являются одной из главных причин временной нетрудоспособности. Например, клинические симптомы острого цистита обычно сохраняются на протяжении 6,1 дней, снижая активность больного в течение 2–3 дней [7]. Ежегодно в США только на лечение неосложненных инфекций мочевыводящих путей у молодых женщин затрачивается около 1 млрд долл., а прямые затраты на один эпизод цистита составляют около 40–80 долл. [3,5].
Более 95% неосложненных инфекций мочевых путей (НИМП) вызываются одним микроорганизмом. Наиболее частым возбудителем в настоящее время остается Escherichia coli – 80%, вторым по частоте выделения является Staphylococcus saprophyticus – 10–15%, который несколько чаще выделяется у молодых женщин [8,9]. Значительно реже НИМП вызывают Klebsiella spp. или Proteus mirabilis. В 1–2% случаев возбудителями являются такие грамположительные микроорганизмы, как стрептококки группы B и D [6,10]. Возбудителями циститов могут быть микобактерии туберкулеза и редко – бледная трепонема. Однако в 0,4–30% случаев в моче больных не выявляется какая–либо патогенная микрофлора [11]. У больных сахарным диабетом Klebsiella spp. стрептококки группы B и D, Enterococcus spp. выявляются с такой же частотой как и E. coli [8].
Первичный неосложненный острый цистит – инфекция слизистой мочевого пузыря, при которой отдают предпочтение коротким, 3–дневным курсам антибактериальной терапии [9,12]. Короткие курсы имеют ряд преимуществ: высокая клиническая и микробиологическая эффективность, снижение селекции резистентных штаммов, низкая частота нежелательных реакций, высокая комплаентность лечения, низкая стоимость. Терапия острых циститов является эмпирической.
Критерии выбора антибактериального препарата при остром цистите [9]:
– спектр антимикробной активности в отношении возбудителей острого цистита;
– фармакокинетика антибактериального препарата, позволяющая обеспечить высокие концентрации в моче при приеме препарата 1–2 раза в день;
– высокий профиль безопасности антибактериального препарата;
– приемлемая стоимость.
Согласно рекомендациям Европейской и Американской Ассоциаций урологов по лечению инфекций мочевых путей к препаратам стандартной эмпирической антибактериальной терапии здоровых взрослых небеременных женщин с острым циститом относятся триметоприм–сульфаметоксазол или триметоприм при отсутствии резистентности более 10–20% в данном регионе, при наличии резистентности препаратами выбора являются пероральные фторхинолоны – в течение 3 дней. В качестве альтернативных препаратов используются нитрофурантоин – в течение 7 дней, фосфомицин–трометамол однократно 3 г и b–лактамные антибиотики в течение 5 дней [13–16]. У детей применяются ингибитор–защищенные пенициллины и пероральные цефалоспорины I–III поколения. У беременных – цефалоспорины I–III поколения, фосфомицин–трометамол (однократно).
Основные режимы антибактериальной терапии неосложненных инфекций нижних мочевых путей в России представлены в таблице 1 [17].
Все указанные препараты в амбулаторных условиях назначают внутрь. Препаратами выбора считают фторхинолоны (ципрофлоксацин, офлоксацин, норфлоксацин, левофлоксацин, ломефлоксацин), которые обладают очень высокой активностью в отношении E. coli и других грамотрицательнызх возбудителей уроинфекций. Основные характеристики биологического действия препаратов класса хинолонов представлены в таблице 2 [18].
Норфлоксацин (Нолицин) – относится к группе фторхинолонов II поколения. Это пероральный монофторированный антибиотик, обладающий широким спектром действия. Активен в отношении грамотрицательных микроорганизмов (E. coli, Salmonella spp., Shigella spp., Proteus spp., Morganella morganii, Klebsiella spp., Enterobacter spp., Citrobacter spp., Haemophilus influenzae), а также в отношении некоторых грамположительных бактерий, в частности, Staphylococcus spp. Нолицин активен в отношении микроорганизмов, продуцирующих b–лактамазы. К препарату нечувствительны анаэробные бактерии, малочувствительны энтерококки. Норфлоксацин выводится до 80% принятой дозы почками (за счет канальцевой секреции) [19]. Норфлоксацин является единственным фторхинолоном, который применяется в основном для лечения инфекций мочевыводящих путей и кишечных инфекций (все остальные фторхинолоны являются системными). Нолицин – наименее фототоксичный фторхинолон [20].
Как показано на рисунке 1, по данным многоцентрового исследования структуры и резистентности к антибиотикам возбудителей инфекций мочевыводящих путей, к норфлоксацину чувствительно наибольшее количество штаммов возбудителей инфекций мочевыводящих путей [21].
В настоящее время достаточно хорошо установлена клиническая и бактериологическая эффективность применения норфлоксацина при неосложненных инфекциях мочевыводящих путей. Показано, что при 3–дневном режиме лечения элиминация бактерий и клинический эффект отмечались на 5–9–е сутки после лечения у 83–98% [22]. В сравнительных исследованиях не было выявлено преимуществ ципрофлоксацина по сравнению с Нолицином в лечении больных острым циститом: клиническая эффективность составила 91,2% и 93,8%, бактериологическая 91,2% и 91,9% соответственно, разница статистически достоверна [23].
Средняя разовая доза, которая применяется в лечении острого цистита, составляет 400 мг х 2 раза в сутки, максимальная – 1,6 г. Некоторые авторы указывают на возможность применения норфлоксацина однократно в дозе 800 мг. Данные основывались на двойном слепом рандомизированном исследовании, при этом эффективность как клиническая, так и бактериологическая была практически одинакова у больных, которые применяли норфлоксацин по 400 мг х 2 раза в сутки, и у больных при однократном приеме Нолицина по 800 мг в сутки (100% и 95,3%, 95,5% и 92%).
Побочные действия зарегистрированы со стороны желудочно–кишечного тракта (тошнота, анорексия, диарея, повышение печеночных проб), ЦНС (головная боль, сонливость), опорно–двигательного аппарата (тендинит, разрыв сухожилий), лабораторных показателей (снижение гематокрита, эозинофилия). Препарат противопоказан при беременности, кормлении грудью.
Было изучено влияние норфлоксацина, триметоприма и нитрофурантоина на кишечную флору. Установлено, что Нолицин и триметоприм подавляют рост грамотрицательной флоры кишечника, на рост энтерококка данные антибактериальные препараты не влияют, нитрофурантоин на рост кишечной флоры не влияет [26]. В исследованиях Menday установлено, что после назначения норфлоксацина по 400 мг х 2 раза в день в течение 3 дней кандидозный вагинит развивается только у 4,3% женщин [27].
Альтернативой фторхинолонам является амоксициллин–клавуланат, который также применяется в течение 5 дней. Препарат обладает широким спектром активности, включая продуцирующие b–лактамазу штаммы E. coli, Haemophilus influenzae, Moraxella catarrhalis, Klebsialla spp. Bacteroides spp. Staphylococcus aureus, Staphylococcus epidermidis, за исключением метициллин–резистентных штаммов [15,28].
Фосфомицин является препаратом второго выбора. К недостаткам можно отнести высокий процент развития диареи после приема препарата.
Нефторированные хинолоны – налидиксовая, пипемидиевая кислота, оксолиновая кислота утратили свое лидирующее значение в связи с высокой резистентностью и рекомендуются только при легких формах инфекции мочевых путей. По фармакокинетическим параметрам, спектру действия они уступают фторхинолонам (данные представлены в таблице 3).
Бактериальные инфекции мочевых путей являются наиболее частыми воспалительными заболеваниями наряду с заболеваниями дыхательных путей. В последние годы возможности лечения данных инфекций значительно расширились благодаря появлению новых высокоэффективных антибактериальных препаратов. Однако результаты лечения воспалительных заболеваний мочевых путей нередко остаются неудовлетворительными – замедленное выздоровление, рецидивы, суперинфекции. Учитывая возрастающий уровень резистентности возбудителей уроинфекций к основным группам препаратов, используемых для лечения острого цистита, необходимо избегать назначения системных фторхинолонов; применять короткие курсы антибактериальной терапии при отсутствии факторов риска. При наличии факторов риска и отсутствии эффекта от проводимой терапии в течение 7 дней необходимо провести обследование: исключить аномалии развития дистального отдела уретры, наличие инфекций, передающихся половым путем, сопутствующих гинекологических заболеваний.
Особенности психо-эмоционального статуса больных с воспалительными заболеваниями органов моче- половой системы.
Кузьменко А.В., Проценко А.А., Варганов С.А., Гяургиев Т.А., Строева Д.Е.
Воронежская Государственная Медицинская Академия им Н.Н. Бурденко
Введение.
Инфекции мочевых путей (ИМП) – наиболее распространенные заболевания в амбулаторной и госпитальной практике[Лоран О.Б., СиняковаЛ.А., 2008,Кузьменко А.В., Курносова Н.В.,2011].Они поражают свыше 13% взрослого населения ежегодно и встречаются более чем у 50 %в течение жизни [Rané А., DasguptaR, 2013г].В США ежегодно на ИМП приходится более 7млн. визитов к врачу, 2 млн. из которых связанны с циститом, и свыше 100000 госпитализаций, преимущественно по поводу пиелонефрита [EAU, 2008г].Почти у половины пациенток после первого эпизода цистита в течение года развивается рецидив; у трети молодых женщин рецидив развивается в течение 6 месяцев; у 50 % больных инфекция рецидивирует чаще 3 раз в год [Синякова Л.А.,2013]. Острый пиелонефрит составляет 14% всех болезней почек, у 36% из них развиваются гнойно-деструктивные формы [Мирошников В.М., 2006г].При генерализации инфекции и развитии уросепсиса летальность достигает 80% [Аляев Ю.Г. и соавт., 2007].
Кроме медицинской составляющей, крайне важна социальная значимость этойпроблемы. В связи с неожиданным началом, острым течением, ярко выраженной симптоматикой, данная группа заболеваний представляет для больных серьезные неудобства, что приводит к резкому снижению физической и психической активности, ограничению свободы передвижений[Кузьменко А.В., Курносова Н.В.,2011].Охватывая в большинстве своем работоспособное население, ИМП может приводить к утрате трудоспособности и развитию неврозоподобного состояния, лишаябольных полноценного ночного сна и привычного образа жизни [Неймарк А.И., Неймарк Б.А., Кондратьева Ю.С,2010]. Таким образом, высокая медико- социальная значимость этой проблемы обуславливает необходимость совершенствования диагностики и методов лечения инфекции мочевых путей, в частности хронического цистита.
Материалы и методы.
С целью оценки психоэмоционального состояния больных, был проведен анализ показателей тяжести тревожно-депрессивных расстройств, качества жизни пациенток на 1-е, 3-5-е и 10-е сутки госпитализации. Было проведено обследование с помощью батареи психометрических и психологических методик: шкалы Гамильтона для оценки депрессии (HDRS), тревоги (HARS); шкалы оценки качества жизни Sf-36. Всем пациентам проводилась антибактериальная терапия препаратом левофлоксацинпо 500мг perosлибо парентерально один раз в день в течение 10 суток.
Результаты и их обсуждение.
Больные с острым серозным необструктивным пиелонефритомпредъявляли жалобы на недомогание, слабость, потрясающие ознобы со значительным повышением температуры до 39.5 °С, обильное потоотделение,головную боль,тахикардию, миалгию, тошноту, сухость во рту, из местных симптомов отмечали постоянную боль в пояснице различной интенсивности без иррадиации. Некоторые обращали внимание на помутнение мочи и ее необычный запах.Все женщины с хроническим рецидивирующим бактериальным циститом в стадии обострения предъявляли жалобы на частое мочеиспускание с резями, императивные позывы, ноктурию. 18 пациенток (30%) отмечали боли в проекции мочевого пузыря. По данным дневников мочеиспускания за первые сутки его ведения частота микций составила от 10 до 13 раз (средний показатель 11,5±1,5), количество императивных позывов от 3 до 6 (средний показатель 4,5 ±1,5), ноктурия от 0 до 4 раз за ночь.
При оценке психо-эмоционального статуса у всех пациентов отмечалось пониженное настроение, бессонница, тревога, за своё состояние,невозможность получить удовольствие от простых вещей.
На 1-е сутки в общем анализе крови: эритроциты крови от 3.61х 10*12/л до 4.01х 10*12/л (средний показатель 3,92±0,1на 10*12/л); уровень гемоглобина находился в пределах от 94 г/л до 110г/л (средний показатель 101.6 ±7г/л); гематокрит от 36.2% до 40,9%(средний показатель 38.47 ±2,35 %); лейкоциты крови от 9,0х 10*9/л до 14,3х 10*9/л (средний показатель 12,4±0,95х 10*9/л); В общем анализе мочи количество лейкоцитов составило от50 до 300 (средний показатель 172,3 ±20г/л), количество эритроцитов от 0 до 10 в п\зр (средний показатель 7±3), плотность от 1010 до 1020 (средний показатель 1013 ±2), прозрачность мочи от слабо-мутной до мутной. В бактериальном посеве мочи в 38(63,3%) случаях возбудителем являлась E.Coli, St. Saprophiticus- в 10(16,6 %) случаях, Еnterococcusspp- в 8(13.3%)случаях, Klеbsiellaspp-в 2 (3,3%) случаях и Enterococcusfaecalis– в 2 (3,3%)случаях. Все возбудители быличувствительны к левофлоксацину, фурадонину, меропенему, цефотаксиму.
В биохимическом анализе крови пациентов с острым серозным необструктивным пиелонефритомуровень мочевинысоставил 8.4мМ/л(±0.1); креатинин крови 110мкМ/л(±0.3).При инструментальном обследовании в 1-е сутки по данным УЗИ почек ихконтур ровный, экскурсия почек сохранена, паренхима диффузно неоднородна, визуалируются пирамидки с гиперэхогенным ободком,ЧЛС без деформации. На экскреторной урографии уданной группыпрослеживались рентгенологические признаки необструктивного пиелонефрита.
При УЗИ верхних и нижних мочевых путей больных с хроническим рецидивирующим бактериальным циститом в стадии обострениязначимой патологии не обнаружено. По данным цистоскопического исследования у 100% пациенток слизистая мочевого пузыря отечная, гиперемирована, сосудистый рисунок усилен, устья мочеточников расположены типично, очаговых образований в просвете не обнаружено.
По шкале Гамильтона для оценки депрессии у всех пациентов на 1-есутки наиболее выраженными симптомами были: депрессивное настроение, суточные колебания состояния и их выраженность, чувство вины, ранняя и поздняя бессонница, ипохондрия. Средний балл по шкале Гамильтона составил 15, что соответствует средней степени выраженности депрессивной симптоматики. Депрессия легкой степени наблюдалась у 6(10%)пациентов, средней степени тяжести – у 26 (43,3%)человек, тяжелая депрессия - у 12 (36,7%) больных, очень тяжелая - у 6 (10%) пациентов (рис.1).

Рис1. Оценка уровня депрессии у больных с ИМПна 1-е сутки лечения.
По шкале Гамильтона для оценки тревоги у обследуемых больных наиболее выражены симптомы тревожного настроения, депрессивного настроения, мочеполовые симптомы, напряжение, инсомния. При поступлении тревогу испытывали 50(83.3%), пациентов, отсутствие тревоги отмечалось у 10(16.7%)опрошенных (Рис.2).
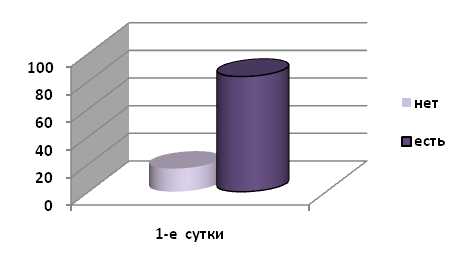
Рис.2 Оценка уровня тревоги у больных с ИМПна 1-е сутки лечения.
На 3-5 сутки у пациентов с диагнозом острый серозный необструктивный пиелонефрит жалобы на боли в поясничной области сохранялись в21(35%)случае, температура тела снизилась до 37-38 С в28(46.65%)случаях, ознобы отсутствовали у 16(26.65%).
В общем анализе крови: эритроциты крови от 3,9 х 10*12/л до 4,2 х 10*12/л (средний показатель 4,1 ±0,01х 10*12/л; р 0,05); лейкоциты крови от 8,03 х10*9/л до 11,3х 10*9/л (средний показатель 9,2 ±1,01 х 10*9/л; p 0,05), прозрачность мочи от слабо-мутной до мутной. По данным бактериологических посевов, эрадикация возбудителя на 3-5-е сутки отмечена в 56 случаях (93,3%).Данные УЗИ почек остались без изменений у всех наблюдаемых пациентов (100%).
На 10-е сутки у больных с острым серозным необструктивным пиелонефритомтемпература тела нормализовалась, отсутствовали боли и ознобы. У пациенток с хроническим рецидивирующим циситомчастота мочеиспускания снизилась в 100% случаев и составила от 5 до 6 раз в сутки (средний показатель 5 ±2,7; р 0,05); лейкоциты крови от 6,0 х 10*9/л до 8.2 х 10*9/л (средний показатель 7,1±1,04 х 10*9/л; р 0,05), прозрачность мочи от слабо-мутной до мутной. Эрадикация возбудителя отмечена в 100% наблюдений.
По данным УЗИ толщина паренхимы у пациентов с пиелонефритом уменьшиласьу 2 (3.3%) обследованных, вернулась в пределы нормы- у 28 (46.65%)пациентов.
При цистоскопии у всей группы больных с хроническим циститом слизистая мочевого пузыря обычной окраски, сосудистый рисунок выражен удовлетворительно, устья мочеточников расположены типично, очаговых образований в просвете не обнаружено.
Депрессия отсутствовала в 16 (26,7%) случаях, легкая степень депрессии отмечалась у 24 (40%) пациенток, а средней степени тяжести депрессия – у 20 (33,3%).Тяжелая депрессия и очень тяжелая отсутствовала (0%) (рис.3).

Рис.3Оценка уровня депрессии у больных с ИМП на 10-е сутки лечения.
Тревога была купирована у 50(83,3%) пациенток, при ее сохранении у 10(16,6%) пациентов(рис.4).

Рис.4 Сравнительная оценка уровня тревоги у больных с ИМПна 1-е и10-е сутки лечения.
Выводы:
1.При оценке психоэмоционального статуса у пациентовс ИМП были выявлены выраженные тревожно-депрессивные расстройства, о чем свидетельствует наличие депрессии различной степени тяжести в 100% и тревоги в 83,3% наблюдений согласно данным шкалл Гамильтона для оценки депрессии (HDRS) и тревоги (HARS).
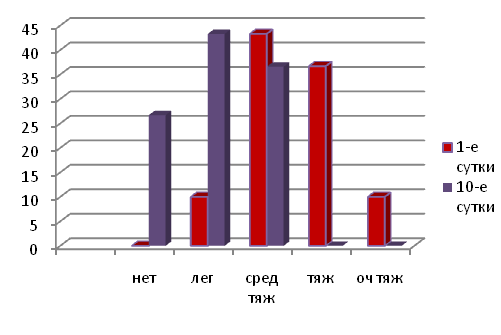
Рис.5 Сравнительная оценка уровня депрессии у больных с хроническим циститом в фазе обострения на 1-е и 10-е сутки лечения.
5.Таким образом, купирование воспалительной реакции у пациенток с хроническим циститом в стадии обострения на фоне проведенной терапии позволило улучшить их психоэмоциональное состояние, а так же повысить качество жизни данной группы больных.
1.Лоран О.Б. Воспалительные заболевания органов мочевой системы. Актуальные вопросы : учеб.пособие для врачей / О.Б. Лоран, Л.А. Синякова. – Москва, МИА, 2008.– 88 С.
Синякова Л.А. Рецидивирующие инфекции нижних мочевых путей: сложности упрощенной диагностики / Л.А. Синякова // Урология сегодня. –2013. – №1. –С. 18.
3. Эффективность применения фосфомицинатриметамола в лечении больных хроническим рецидивирующим циститом / О.Б. Лоран [и др.]// Эффективная фармакотерапия в урологии.– 2008. –№ 4. –C. 15.
4.Перепанова Т.С. Возможности фитотерапии при рецидивирующей инфекции мочевых путей / Т.С.Перепанова // Эффективная фармакотерапия в урологии. –2010.– № 1. –С. 21.
5.Применение гиалуроновой кислоты в лечении хронического цистита/ П.В. Глыбочко[ и др.]//Эффективная фармакотерапия в урологии.– 2011.– №5. –C. 12.
6. Циститы / Г.Н. Скрябин [и др.]. –Санкт- Петербург, 2006. – 54с.
Дата добавления: 2018-02-15 ; просмотров: 166 ;
Любовь Александровна Синякова
Д.м.н., профессор кафедры урологии и хирургической андрологии ГБОУ ДПО РМАПО, врач-уролог высшей квалификационной категории
УС: Какими данными должны пользоваться урологи, сталкиваясь с инфекциями мочевыводящих путей (ИМП)?
Данные региональных и зарубежных исследований подтверждают нарастающую резиситентность E. coli и других грам- отрицательных уропатогенов к ампициллину триметоприму, фторхинолонам и цефалоспо- ринам, что должно быть учтено при лечении неосложненных ИМП.
Национальные рекомендации Антимикробная терапия и профилактика инфекций почек, мочевыводящих путей и мужских половых органов, переизданные в 2014 году, будут ежегодно пересматриваться. И в 2015 году мы планируем переиздать рекомендации с учетом новых данных по резистентности возбудителей, в том числе о распространенности продуцентов бета-лактамаз расширенного спектра.
УС: Есть ли какая-та интрига или особые ожидания в отношении обновленных рекомендаций?
ЛС: Никакой интриги не существует, экстраординарных данных нет. Единственное, что могу сказать, - нарастает резистентность к фторхинолонам, поэтому мы подтвердим, что применение этих препаратов должно быть ограничено, особенно у женщин с острыми циститами. Будет также подчеркнуто, что для больных рецидивирующими циститами, чтобы не усугублять проблему с резистентностью, необходимо делать выбор с учётом выделенного возбудителя; так же должно быть ограничено использование препаратов, способствующих распространению резистентных штаммов, в первую очередь - цефалоспоринов третьей генерации.
УС: Как часто урологи не знают, с каким возбудителем связано заболевание, насколько актуальна эта проблема для отечественных клиницистов?
ЛС: Такая проблема существует не только в России. У больных рецидивирующими инфекциями возбудители выделяются примерно в 50 % случаев, что вовсе не означает отсутствие инфекции. Во-первых, возбудитель может не расти на обычных питательных средах. Во-вторых, под маской циститов могут протекать абсолютно другие заболевания.
Хочу обратить внимание, что только в половине случаев при наличии одних и тех же симптомов, в т. ч. учащенного болезненного мочеиспускания, действительно выявляется цистит - у остальных же пациентов эти жалобы могут быть связаны с наличием других заболеваний, например, гиперактивного мочевого пузыря или интерстициального цистита.
Симптоматика, схожая с циститом, может быть связана с воспалительными гинекологическими заболеваниями, дисбиозом влагалища, ИППП, в том числе вирусными.
Так же необходимо помнить, что рецидивирующие ИМП предполагают наличие двух обострений в течение 6 мес или трех в течение года. Если у женщины больше обострений, это означает, что есть иная проблема, решить которую с помощью антибактериальной терапии невозможно.
В таком случае пациентка нуждается в тщательном обследовании для выявления истинной причины - стоит обратить внимание на гормональный фон и необходимость проведения заместительной терапии, количество остаточной мочи, вероятность наличия пролапса и так далее.
Я считаю, что проблема рецидивирующих циститов - это не столько вопрос выбора препарата, сколько адекватной диагностики.
ИМП у беременных: выбор эмпирической терапии в каждом триместре
В 2014 году опубликованы данные ретроспективного исследования по бактериальному профилю и противомикробной терапии среди беременных женщин (Unlu B.S., et al., Ginecol Pol.) В исследование было включено более 700 пациенток, которым в каждом из триместров потребовалась госпитализация в связи с ИМП.
E. coli оказалась наиболее распространенной бактерией, выделенной всего в 82,2 % случаев госпитализации. Следующим по распространенности оказались Klebsiella spp., выделенные в 11,2 % случаев. При анализе по подгруппам E. coli оказалась возбудителем ИМП в 86 %, 82,2 % и 79,5 % случаев госпитализации в каждом из триместров соответственно. Для Klebsiella spp. распространенность по триместрам составила 9 %, 11,6 % и 12,2 % соответственно.
Enterococcus spp. были изолированы как третий микробный агент, выделяемый в каждом триместре - всего в 5,7 % случаев госпитализации.
Основные возбудители ИМП оказались чувствительными к фосфомицину трометамолу: активность препарата в отношении E. coli составила 98-99 %, в отношении Klebsiella spp. 88-89 %. Наиболее эффективным антибактериальным препаратом в отношении Enterococcus spp. оказался нитрофурантоин - чувствительность патогена в каждом триместре составила 93-100 %.
УС: Позволяет ли хорошая диагностика излечить рецидивирующие циститы?
ЛС: Нет, и это вторая сторона вопроса: задача уролога при рецидивирующих ИМП - увеличить безрецидивный период. Чаще всего мы назначаем антибиотики, что способствует росту резистентности возбудителей, провоцирует дисбактериоз и дисбиоз влагалища. Поэтому стоит вопрос о том, чтобы во время одного из эпизодов цистита применять не антибиотики, а препараты с другими механизмами действия. Но такая тактика справедлива только при рецидивирующей инфекции, при остром же цистите нам необходимо избавить пациентку от симптомов болезни, устранив возбудителя - т. е. никаких других вариантов, кроме адекватной антибактериальной терапии, применяться не должно.
УС: Какие препараты могут быть альтернативой антибиотикам во время одного из эпизодов рецидивирующего цистита?
ЛС: В 2010 году проведено исследование по изучению эффективности ципрофлоксацина в сравнении с нестероидным противовоспалительным препаратом - ибупрофеном. Оказалось, что на четвертый и седьмой день у женщин с обострением рецидивирующего цистита клиническая эффективность была аналогичной или даже несколько выше при применении нестероидного противовоспалительного препарата, то же было и на седьмой день. Поэтому во время одного из обострений мы можем использовать и этот препарат.
Международное сообщество считает, что мы имеем право начать лечение одного из обострений рецидивирующего цистита растительным препаратом Канефрон. Если в течение двух дней выраженность симптомов не уменьшается, то необходимо обсуждать вопрос о применении антибактериальной терапии.
УС: С какими биологическими особенностями возбудителя связана сложность лечения рецидивирующих ИМП?
ЛС: Уропатогенные штаммы E. coli очень часто образуют сообщество - биоплёнки, биофильмы. Ранее считалось, что биоплёнки формируются только на инородных телах - камнях в мочевых путях, катетерах, дренажах и т. д. Теперь мы знаем, что эти ассоциации могут формироваться и на слизистых мочевых путей, особенно на фоне урогенитальных инфекций, когда нарушен защитный слой мочевого пузыря.
Часто мы не имеем эффекта от антибактериальной терапии именно из-за биопленок. Дело в том, что часть препаратов, применяемых для лечения рецидивирующих ИМП, действует только на планктонные формы бактерий, не проникая внутрь биоплёнок.
Это способствует рецидиву инфекций, так как периодически возбудитель выходит из этих сообществ, вызывая очередное обострение. Учитывая эти биологические особенности, предпочтение следует отдавать препаратам, обладающим проникающими способностями внутрь биоплёнок.
В настоящее время у нас есть информация о двух группах препаратов, способных воздействовать на возбудителя в сообществе, - это фторхинолоны и фосфомицина трометамол. Однако, как было отмечено выше, из-за высокой резистентности E. coli к фторхинолонам мы вынуждены ограничить их применение.
УС: Каковы первичные причины рецидивов?
УС: Какие приемы профилактики рецидивирующих инфекций рекомендованы научным сообществом и наиболее целесообразны?
ЛС: В составе комплексной терапии возможно применение эстрогенов, которые у определенной группы пациенток, в постменопаузе или при приеме гормональных контрацептивов, создают благоприятный фон для более эффективных методов лечения.
Возможно применение препаратов клюквы.
В отношении этого подхода проведено достаточно много исследований и имеется адекватная доказательная база. Однако эффективны препараты, содержащие необходимое количество активного вещества - проантоцианидина А (ПАЦ). Согласно рекомендациям EAU, для повседневной практики достаточно принимать препарат, содержащий 36 мг ПАЦ. Поэтому для комплексного лечения и профилактики ИМП можно принимать препарат Монурель (Замбон), в отношении которого доказано достоверное снижение адгезии возбудителей ИМП к эпителию мочевых путей.
Наибольшую доказательную базу имеют иммунологически активные препараты, в отечественной практике - Уро-Ваксом. Он повышает защитные свойства слизистых оболочек мочевых путей и хорошо переносится, примерно у половины пациентов снижает лейкоцитурию и бактериурию, являясь препаратом выбора для профилактики рецидивирующих циститов.
Другой подход, активно позиционируемый в Европе - это использование длительной низкодозной антибактериальной терапии, в отношении которой нет консенсуса. Длительное применение низкодозной антибактериальной терапии приводит к росту резистентности возбудителей, аллергическим реакциям, дисбактериозу и дисбиозу влагалища, и, что самое главное, после окончания указанной терапии примерно у половины больных в течение 3-4 мес возникают рецидивы заболевания.
УС: Каковы возможности применения фосфомицина трометамола как препарата с наибольшей активностью по отношению к E. coli?
ЛС: Использование фосфомицина трометамола, как и других препаратов при рецидивирующих инфекциях, рекомендовано полными курсовыми дозами - одна упаковка препарата (3 г) один раз в десять дней на протяжении трех месяцев. Эта рекомендация должна быть выполнена, если установлен диагноз рецидивирующий цистит, обострение; исключены ИППП и вирусные инфекции, как причина развития уретрита. После завершения трехмесячного курса мы должны начать противорецидивное лечение, в том числе патогенетическое лечение - внутрипузырные инстилляции для восстановления гликозаминогликанового слоя мочевого пузыря.
УС: Есть ли какие-то разногласия в отношении фосфомицина трометамола?
ЛС: Нет, по этому вопросу консенсус достигнут - доказательная база достаточная и рекомендация абсолютно обоснованна.
В 2014 году опубликован ряд работ, в которых подтверждена высокая эффективность фосфомицина в отношении наиболее распространенных уропатогенов и продуцентов бета-лактамаз расширенного спектра.
УС: Обострение рецидивирующего цистита наиболее вероятно при беременности. Какими должны быть действия врача?
ЛС: Действительно, каждая 10-я беременная страдает той или иной ИМП, в 20-40 % случаев развивается острый пиелонефрит во втором и третьем триместре. Эта проблема наиболее распространена среди женщин, столкнувшихся с ИМП до беременности и должным образом не подготовленных к ней.
При появлении клинических признаков ИМП у беременной женщины требуется антибактериальная терапия, так как нарушения уродинамики опасны не только для здоровья, но и для жизни матери и будущего ребёнка.
Перечисленные препараты безопасны, разрешены и могут применяться по показаниям, начиная со второго триместра беременности.
УС: Каковы ваши ожидания в наступающем году?
ЛС: У нас запланировано и проводится ряд научных работ и исследований, результаты которых, в том числе по проблеме лечения ИМП, подготовлены к публикации. Надеюсь, что благодаря активной научной и просветительской работе, со временем часть проблем, связанных с диагностикой и лечением ИМП, будет решена.
Подготовила Алла Солодова
Читайте также:


