Снижение риска инфекционных осложнений
Инфекции, ассоциированные с оказанием медицинской помощи (ИАМП или ВБИ) (Healthcare associated infections – HAIS), — это инфекции, приобретённые пациентами в процессе лечения и ухода.
ИАМП главным образом вызываются микроорганизмами, резистентными к часто используемым противомикробным препаратам и характеризуются множественной лекарственной устойчивостью. Хотя из-за трудности сбора достоверные данные неизвестны. По оценкам экспертов сотни миллионов пациентов страдают от ИАМП, которые являются причиной значительной смертности и финансовых потерь.
Из 100 госпитализированных пациентов в развитых странах у 7, а в развивающихся у 15 возникнет хотя бы одна ИАМП. Уровень ИАМП существенно выше (в 2-3 раза) в странах с низким и средним уровнями доходов, чем в странах с высоким доходом, особенно у пациентов, госпитализированных в отделения реанимации и интенсивной терапии (ОРИТ) и отделения новорожденных.
Инфекционное поражение области хирургического вмешательства (ИОХВ, SSI – Surgical site infection) по данным ВОЗ, наиболее частый вид внутрибольничной инфекции (ВБИ) в странах со средним уровнем дохода. ИОХВ затрагивает до 1/3 больных, перенесших хирургические вмешательства. Средний показатель ИОХВ составляет 11,8 на 100 операций (диапазон от 1,2 до 23,6).
Частота ИОХВ гораздо ниже в странах с высоким доходом, но продолжает занимать второе место в структуре ВБИ в Европе и США, а в некоторых странах Европы это наиболее частый тип ВБИ. Самые высокие показатели осложнений наблюдаются в хирургии толстой кишки – 9,5%, при аортокоронарном шунтировании (АКШ) – 3,5%, кесаревом сечении – 2,9%, холецистэктомии – 1,4%, эндопротезировании тазобедренного сустава – 1,0%, полипэктомии – 0,8%, протезировании коленного сустава – 0,75%.
ИОХВ как потенциальные осложнения ассоциируются с любыми типами и классами хирургических вмешательств. Хотя ИОХВ относятся к наиболее предотвратимым формам ВБИ, они по-прежнему представляют проблему с точки зрения осложнений для пациентов, смертности и дополнительных расходов.
ИОХВ относятся к наиболее частым изучаемым формам ВБИ в госпиталях стран с низким и средним достатком. Существует мнение, что частота ИОХВ может отражать низкий уровень качества медицинской помощи.
По данным SS EJ Magill et al. (2014) в период с 2006 по 2008 гг. ИОХВ занимали второе место (всего 157 тыс. случаев) в структуре ВБИ. Результаты исследования Y. Mu et al. (2011) показали, что в 2006-2008 гг. на 749659 хирургических вмешательств приходилось 16147 (1,9%) случаев ИОХВ. Наиболее часто встречались инфекции, вызванные стафилококком (30,4%), ванкомицин-резистентным стафилококком (11,7%), синегнойной палочкой (9,4%).
По данным 3654 больниц в США (страна с высоким доходом) за 2014 г. было зарегистрировано 201916 случаев ИОХВ на 2417933 хирургических вмешательства. За 2008-2014 гг. было отмечено сокращение числа ИОХВ на 17% при выполнении 10 основных хирургических вмешательств, в частности при трансабдоминальной гастрэктомии на 17% и при операциях на толстой кишке на 2%.
Определение уровня экономических затрат в 2005 г. на ИОХВ было проведено с использованием данных 1054 больниц из 37 государств. Продление сроков госпитализации в среднем составило 9,7 дня, при этом увеличение расходов на 1 случай составило 20842 доллара. Суммарно госпитализация по причине ИОХВ составила 406730 дней, а дополнительные расходы – более 900 млн. долларов. ИОХВ являются статьей расходов на ВБИ, на которые затрачивается 3,510 млрд. долларов. Стоимость лечения одного пациента колебалась от 1087 до 29443 долларов.
В 2011-2012 гг. в странах Европы ИОХВ являлись наиболее частой причиной ВБИ. В последнее время отмечено уменьшение осложнений ИОХВ при кесаревом сечении, эндопротезировании тазобедренного сустава и полипэктомии. При инфекционных осложнениях средний показатель пребывания больного увеличивается на 6,5 дня, стоимость лечения – в 3 раза.
По результатам 13-летнего мультицентрового исследования в Швейцарии (19982010 гг.) показатель ИОХВ после колоэктомии составил 18,2%, аппендэктомии – 6,4%, холецистэктомии – 2,3%, грыжесечения – 1,7%, артропластики бедра – 1,6% и артропластики коленного сустава – 1,3%.
В Англии хирургические инфекции чаще возникали при оперативном лечении заболеваний тонкой кишки – 8,3%, толстой кишки – 4,9%, желчных путей, печени, поджелудочной железы – 4,9%, при холецистэктомии – 4,6%. Минимальные показатели наблюдались при эндопротезировании коленного сустава – 0,4%. В среднем продолжительность стационарного лечения увеличилась на 10 дней (от 7 до 13 дней).
В Японии при возникновении ИОХВ продолжительность госпитализации увеличивается на 20,7 дня, а стоимость лечения – на 8791 доллар. При этом в абдоминальной хирургии сроки лечения увеличиваются на 17,6 дня, расходы – на 6624 доллара, а в кардиохирургии на 48,9 дня и 28534 доллара соответственно. Чаще ИОХВ встречаются в хирургии ободочной и прямой кишок – 15% и 17,8% соответственно.
К потенциальным факторам развития ИОХВ, которые могут вызвать раневую инфекцию, относятся факторы, связанные с пациентом (эндогенные) и технологией/вмешательствами (технологические/процедурные) (экзогенные). Некоторые переменные являются немодифицируемыми, такие как возраст и пол. Контролирование других способствует уменьшению вероятности инфицирования — это питание больного, отказ от употребления табака, рациональное применение антибиотиков, правильная интраоперационная техника. Целесообразность оценки факторов риска остается спорной, ввиду очень малого количества исследований, основанных на оценке риска развития инфекционных осложнений.
Анализ результатов 57 исследований, проведенных в странах как с высоким, так и низким и средним доходами, позволил выделить следующие факторы, связанные с повышенным риском ИОХВ, это высокий индекс массы тела, высокая оценка по национальной системе наблюдения нозокомиальной инфекции (NNIS – National Nosocomial Infections Sutveillance), класс раны, сахарный диабет и продолжительность операции, оценка состояния больного > 3 ст. по ASA, пребывание больного в стационаре до операции (минимум 2 дня). Другие авторы также к факторам риска относят отсутствие или проведение антибиотикопрофилактики менее чем за 1 час до операции, тип операций (загрязненные или грязные).
В больницах с большим и средним коечным фондом, при проведении операций хирургами высокой квалификации наблюдаются более низкие показатели ИОХВ.
Основными признаками ИОХВ являются:
- гнойное отделяемое из раны или выделения из ран при непосредственном осмотре;
- покраснение, увеличение размеров покраснения (эритемы), болезненные, распространенные эритемы, свидетельствующие о целлюлите;
- гнойное отделяемое из дренажа из-под фасции;
- гнойное отделяемое из дренажа, помещенного через рану в орган /пространство;
- высев микроорганизмов, выделенных из отделяемого или тканей органа/пространства;
- рана спонтанно расходится (открывается);
- боль;
- лихорадка (t >39 C);
- локальный отек;
- абсцесс или другие доказательства инфекции при прямом исследовании.
На сегодня существует более 40 методик определения хирургических инфекций (SSI). Только 4 из них являются стандартными – CDC (Centers fo Disese Control and Prevention); SESG (Surgical Infection Study Group); NPS (National Prevalence Survey); PHLS (Public Health Laboratory Service).
Введение различных способов контроля хирургических инфекций, позволяет добиться их снижения. Так, в Англии за 5 лет наблюдений ИОХВ при ортопедических операциях снизились на 64 – 69%, во Франции за 8 лет наблюдений совокупно при различных операциях – на 30%, в Германии за 4 года наблюдения – на 25%, в Нидерландах за 5 лет – на 57%, в Швейцарии за 13 лет наблюдении – на 3 – 22%, в США за 5 лет – на 35%.
При анализе результатов наблюдения и контроля различными методами установлено, что золотым стандартом является проспективное прямое наблюдение, хотя этот метод занимает много времени, является трудоемким и дорогостоящим. Так, при использовании CDC-рекомендации как косвенного метода наблюдения чувствительность составляет 84-89%, специфичность – 99,8%. При этом проводят анализ данных записей в историях болезни и результатов микробиологических исследований, учитывают случаи повторной госпитализация и/или повторной операции, а также другую информацию (оперативные отчеты, заказ противомикробных препаратов и пр.).
Это касается различных подходов к сбору данных и классификации осложнений. Некоторыми авторами предлагается сократить сроки наблюдения до 90 дней, а не в течение года. Это направлено на упрощение наблюдения после выписки и сокращение числа случаев задержки обратной связи, хотя данное мнение не является общепринятым. Некоторые авторы утверждают, что частота ИОХВ в стационарах является более показательным индикатором, принимая во внимание различные сроки пребывания больных в стационаре, а также различные методы наблюдения после выписки.
Предлагается подсчет стандартизованных коэффициентов инфекции, представляющих собой соотношение между наблюдаемыми и ожидаемыми частотами осложнений. При этом значение коэффициента >1 означает, что произошло больше случаев ИОХВ, чем ожидалось, а


Каковы шансы пациента благополучно перенести хирургическую операцию? Ответ на этот вопрос крайне важен для всех участников предстоящего оперативного вмешательства - больного, хирурга и анестезиолога. Степень риска хирургического вмешательства в значительной степени определяет согласие пациента на операцию. Хирургу эти сведения необходимы для выбора объема и характера вмешательства. Анестезиолог, таким образом, прогнозирует возможность осложнений, определяет объем и выбирает адекватный метод обезболивания. Оценка операционного риска является обязательным элементом лечебно-диагностического процесса, настораживая анестезиолога и хирурга, и должна быть зарегистрирована в истории болезни.
Любое, даже небольшое, хирургическое вмешательство таит в себе определенные опасности, которые необходимо предвидеть и попытаться предотвратить. О возможности развития интра- и послеоперационных осложнений нужно думать еще до начала операции, тогда же начинают принимать необходимые профилактические меры.
Цель предоперационной подготовки – максимально возможное снижение риска хирургической операции, предотвращение послеоперационных осложнений и уменьшение психологического стресса у пациента.
Прогнозирование риска хирургического вмешательства
На определении физического состояния пациента основана классификация Американской Ассоциации Анестезиологов (ASA) широко используемая в мировой клинической практике.
Классификация физического состояния пациента по ASA:
I класс ∙ нормальный здоровый субъект;
II класс ∙ пациент с легкими системными расстройствами;
III класс ∙ пациент со значительными системными расстройствами,
ограничивающими активность, но не приводящими к
IV класс ∙ пациент с выраженным инвалидизирующим заболеванием,
которое представляет угрозу жизни;
V класс ∙ умирающий больной, который может погибнуть в течение
ближайших суток даже без хирургического вмешательства.
_______________________________________________________________
добавляемым к соответствующему классу.
Риск экстренной операции намного выше, чем плановой. Это связано с тем, что состояние пациента при подготовке к плановой операции можно улучшить с помощью коррекции метаболических и электролитных сдвигов, устранения анемии и гипоксии, адекватного питания. Вместе с тем в острых ситуациях опасность промедления с хирургическим лечением нередко перевешивает преимущества предоперационной подготовки.
А. Малые операции (вскрытие поверхностных гнойников,
аппендэктомия, грыжесечение, перевязка и удаление
Б. Операции средней тяжести на полостных органах (холецистэктомия,
вскрытие абсцесса брюшной полости).
В. Обширные хирургические вмешательства (резекция желудка и
Г. Радикальные операции на пищеводе и расширенные операции с
удалением нескольких органов брюшной полости.
Для уточнения состояния пациента и прогноза операции используют различные интегральные шкалы. На практике наиболее доступна упрощенная система оценки тяжести состояния и прогноза - SAPS (Simplified Acute Physiology Score) (табл. 3. 1-3. 3) . Сумма баллов по 14 основным клинико-лабораторным параметрам, ранжированным от 0 до 4 баллов, отражает общее состояние пациента и позволяет прогнозировать летальность.
Сумма баллов шкалы Глазго составляет 3-15. Конечную оценку получают путем сложения баллов по каждой из трех групп признаков; в каждой группе учитывают лучшую из выявленных реакций.
Профилактика осложнений
Возможности хирургии в лечении огромного числа заболеваний постоянно возрастают. Неизбежным спутником высокой хирургической активности являются различные послеоперационные осложнения. Возникающие осложнения значительно ухудшают результаты хирургического лечения, увеличивают летальность, приводят к существенному увеличению сроков госпитализации пациентов и общих затрат на лечение. В предоперационном периоде хирург и анестезиолог, иногда, несмотря на довольно жесткий цейтнот, обязаны детально ознакомиться с состоянием больного и провести его подготовку, направленную если не на полную нормализацию всех функций, то хотя бы на устранениё наиболее опасных нарушений деятельности жизненно важных органов и систем.
Всесторонняя подготовка пациента к хирургической операции включает физиологическую и психологическую поддержку и предусматривает развитие доверия, которое необходимо для оптимальных взаимоотношений между врачом и пациентом. Психологическая подготовка должна проходить одновременно с физиологической поддержкой, направленной на коррекцию имеющихся у пациента нарушений гомеостаза. Особые трудности возникают при подготовке к экстренной операции. Хотя и в этой ситуации необходимо стремиться к максимально возможной коррекции физиологических параметров и обсудить с пациентом пользу и риск предстоящей операции, возможности альтернативных методов лечения и прогнозируемый риск хирургического вмешательства. Кроме юридической обязанности хирурга предоставить эту информацию, процесс информированного согласия пациента на операцию позволяет уменьшить беспокойство пациента и получить его доверие.
При подготовке больных к операции, хирург и анестезиолог могут столкнуться главным образом с тремя видами расстройств — хроническими сопутствующими заболеваниями, нарушениями, связанными с основной хирургической патологией, и их сочетанием.
Сердечно-сосудистые осложнения
Сердечно-сосудистые заболевания – главная причина периоперационных осложнений и летальности. Риск периоперационного инфаркта миокарда или смерти, вызванной сердечно-сосудистыми осложнениями, у больных, которым предстоит экстракардиальная операция, значительно увеличивается при наличии факторов, приведенных в табл. 3. 4. Особенно высок риск послеоперационных осложнений в первые месяцы после перенесенного инфаркта миокарда. Сочетание любых трех из первых шести перечисленных факторов свидетельствует о 50% вероятности периоперационного инфаркта миокарда, отека легких, желудочковой тахикардии или смерти больного. Наличие одного из трех последних факторов увеличивает риск этих осложнений только на 1%, тогда как любое сочетание двух из трех последних признаков повышает риск до 5-15%.
Степень риска развития послеоперационных осложнений может быть определена по сумме баллов (табл. 3. 5). Риск таких угрожающих жизни осложнений, как периоперационный инфаркт миокарда, отек легких и желудочковая тахикардия, становится высоким у пациентов с третьей степенью риска, а у больных при четвертой степени риска оперативное вмешательство возможно лишь по жизненным показаниям. Особенно высок риск анестезии и операции у больных со свежим инфарктом миокарда. Лишь по прошествии не менее полугода этот риск снижается (табл. 3. 6). Риск развития угрожающих жизни послеоперационных кардиальных осложнений может быть оценен также по виду хирургического вмешательства (табл. 3. 7).
Плановые хирургические вмешательства не следует проводить в первые 6 месяцев после перенесенного инфаркта миокарда. Больным с ИБС необходима адекватная премедикация, предотвращающая активацию симпатоадреналовой системы и повышение потребности миокарда в О2 (бензодиазепины, центральные a-адреностимуляторы). ЭКГ – мониторинг у этой категории больных обязателен. Признаки ишемии миокарда – отрицательный зубец Т или высокий остроконечный зубец Т. Прогрессирующая ишемия – косонисходящая и горизонтальная депрессия сегмента ST. Подъём сегмента ST над изолинией – спазм коронарных артерий (стенокардия) или инфаркт миокарда.
Инвазивный мониторинг гемодинамики во время хирургического вмешательства и в течение 48 часов после операции показан при тяжёлой ИБС (фракция выброса 75












Снижение риска инфекционных осложнений при искусственном прерывании беременности и возможности последующей реабилитации
Цель исследования. Определить возможность применения антисептических средств (флуомизина) для снижения частоты постабортных осложнений и последующей реабилитации, а также доказать необходимость назначения содержащего лактобактерии и эстриол препарата (гинофлора Э) для восстановления нормального биоценоза влагалища в послеабортном периоде.
Материал и методы. В исследование были включены 100 женщин, средний возраст которых составил 28,9±0,4 года, обратившихся по поводу искусственного прерывания беременности (ИПБ) в сроки от 5 до 9 нед беременности. На I этапе исследования после углубленного изучения биоценоза влагалища 31 пациентке с установленными диагнозами бактериальный вагиноз и неспецифический вульвовагинит проводили санацию влагалища препаратом флуомизин в течение 6 дней до ИПБ. На II этапе в течение 6 дней после ИПБ (независимо от применяемой технологии) с целью восстановления нормального биоценоза влагалища женщинам, у которых на этапе подготовки к ИПБ использовали флуомизин, назначали гинофлор Э.
Всем беременным проводили стандартное клинико-лабораторное обследование, включавшее микроскопическое исследование вагинального отделяемого и дополнительное исследование биоценоза влагалища методом ПЦР в реальном времени
Результаты исследования. Представлены результаты лечения бактериальных вагинальных инфекций неспецифической этиологии с использованием двухэтапной схемы терапии в пред- и послеоперационном ведении пациенток при искусственном прерывании беременности. Установлена эффективность препарата широкого спектра действия флуомизина (деквалиния хлорид) для лечения вульвовагинальных инфекций неспецифической этиологии. Доказана необходимость применения содержащего лактобактерии и эстриол препарата (гинофлор Э) для восстановления нормального биоценоза влагалища в послеабортном периоде.
Аборты являются самой распространенной гинекологической операцией. По оценкам ВОЗ приблизительно 25% всех беременностей в мире заканчивается искусственным абортом, что
составляет приблизительно 50 миллионов каждый год [3, 6]. Значительный вклад в эту статистику вносит Россия, занимая второе место после Китая по абсолютному числу абортов. При этом число абортов в России по сравнению со странами Восточной Европы и СНГ больше в 1,5–2,5 раза, а Западной Европы – в 3–15 раз. Существующая статистика не отражает достоверного состояния вопроса ни относительно общего числа абортов, ни числа осложнений после него. Вместе с тем данные отдельных научных исследований свидетельствуют о высоком уровне этих
осложнений [4, 7, 8].
Наиболее общей причиной обращения женщин репродуктивного возраста к гинекологу являются влагалищные инфекции. Бактериальный вагиноз, вульвовагинальный кандидоз и трихомониаз считаются в мире наиболее распространенными неспецифическими воспалительными и дисбиотическими процессами нижнего отдела генитального тракта [7, 10, 11]. Оценить частоту встречаемости бактериального вагиноза достаточно сложно, но большинство исследователей сходятся во мнении, что 10–41% женщин в течение репродуктивного возраста хотя бы раз сталкивались с этой проблемой [5, 8, 10]. Хотя определены антибактериальные схемы лечения, которые обычно высокоэффективны в эрадикации патогенных микроорганизмов, продолжительная эффективность лечения ставится под сомнение в связи с высоким риском хронизации и/или рецидивирования процесса. Это означает, что не во всех случаях лечение оказывается эффективным.
Есть данные о том, что применение метронидазола изменяет влагалищную микрофлору. Препарат оказывает бактерицидное действие не только по отношению к патологической микрофлоре, но и по отношению к Lactobacillus spp. in vitro. V. Redondo-Lo’pez и соавт. (1990) установили [12], что влагалищная флора женщин, леченных метронидазолом, обеднена лактобациллами; более чем у 50% женщин возникали рецидивирующие кандидозы. В других исследованиях уровень реинфекции достигал 14–39% случаев через мес после лечения метронидазолом и еще в 30% случаев – через 3 мес после лечения.
Вместе с тем в нескольких обзорах представлен опыт использования препаратов, содержащих живые лактобациллы, для лечения урогенитальных инфекций. Показано, что экзогенно введенные лактобациллы способны снижать уровень реинфекции у женщин с кандидозом, бактериальным вагинозом и рецидивирующим вагинитом [6, 11]. В открытом неконтролируемом исследовании H. Lauritzen и соавт. (1984) показали, что восстановительное лечение препаратом гинофлор значительно улучшает степень чистоты влагалища и степень пролиферации влагалищного эпителия [9].
Учитывая научные и клинические данные последних лет, свидетельствующие о том, что для полноценного устойчивого функционирования влагалищного биотопа необходим целый комплекс условий, включая, прежде всего, присутствие лактобактерий, нам представлялось важным изучить возможность применения препаратов флуомизин и гинофлор Э в программе реабилитации женщин при искусственном прерывании беременности Цель исследования: оценить эффективность и приемлемость применения препаратов флуомизин и гинофлор Э в программе профилактики воспалительных осложнений и реабилитации женщин после аборта.
Материал и методы исследования
В исследование были включены 100 женщин, средний возраст которых составил 28,9±0,4 года, обратившихся по поводу искусственного прерывания беременности (ИПБ) в сроки от 5 до 9 нед беременности Когорта исследуемых была представлена рожавшими женщинами (49,0%) и первобеременными (37,0%). Предшествовавшие настоящей беременности аборты имели 44,0% женщин, в том числе самопроизвольные аборты и неразвивающуюся беременность – 7,0% пациенток. В целом возрастная структура включенных в исследование женщин отражала статистику абортов
в России. В социальной структуре беременных преобладали служащие (80,0%), каждая десятая пациентка была домохозяйкой, студентки составили 8,0% и рабочие – 2,0%.
Критериями возможности прерывания беременности было отсутствие воспалительных заболеваний гениталий, в т.ч. кольпита, БВ у обследованных женщин.
Исследование состояло из двух этапов, На I этапе проводили углубленное исследование биоценоза влагалища. По результатам исследования 31 пациентке с установленными диагнозами бактериальный вагиноз и неспецифический вульвовагинит проводили санацию влагалища препаратом флуомизин, который содержит деквалиния хлорид (соединение четвертичного аммония с широким спектром антимикробной активности против грамположительных и грамотрицательных бактерий, грибов и простейших), в течение 6 дней до ИПБ.
На 2-ом этапе в течение 6 дней после ИПБ (независимо от применяемой технологии ИПБ) с целью восстановления нормального биоценоза влагалища женщинам, у которых на этапе подготовки к ИПБ использовали флуомизин, назначали гинофлор Э, содержащий не менее 100 млн жизнеспособных ацидофильных лактобактерий (L. acidophilus) и 0,03 мг эстриола, а также вспомогательные компоненты. Для этого пациентки, получавшие флуомизин, были разделены на две группы: в I группе (n=16) пациенткам была назначена терапия гинофлором Э (по 1 влагалищной табл. на ночь в течение 6 дней); пациенткам II группы (n=15) терапия не проводилась. Остальные 69 женщин составили контрольную группу.
Статистическую обработку данных проводили с помощью свободно распространяемого программного продукта WINPEPI версии 9.7 и Statistica 7.0 for Windows. Оценку достоверности результатов проводили с применением критерия Стьюдента (t), непараметрического критерия Фишера.
Результаты исследования и обсуждение
Анализ состояния здоровья обследуемых женщин показал, что более половины из них имели гинекологические заболевания в анамнезе: доброкачественные заболевания шейки матки (28,0%), воспалительные заболевания гениталий (14,0%) и ИППП (17,0%). Жалобы на бели предъявляли 17,0% беременных, неприятный запах – 30,0%, дискомфорт во влагалище – 20,0% пациенток.
Результаты микроскопического исследования влагалищного отделяемого в зависимости от числа лейкоцитов и характера микрофлоры были разделены на 4 типа (табл. 1). При этом число лейкоцитов до 10 в поле зрения считали нормальным, а его превышение расценивали как признак воспаления.
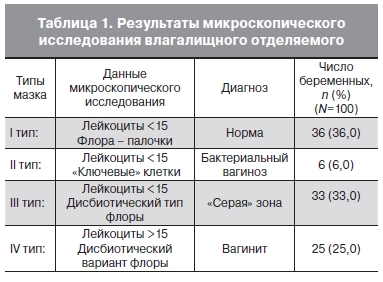
Полученные данные, таким образом, существенно расходились с субъективной оценкой беременных. Наибольшие трудности, вызвала интерпретация данных микроскопии III типа, когда при нормальном количестве лейкоцитов наблюдался дисбиотический характер микрофлоры влагалища: кокковая или смешанная флора, отсутствие флоры, дрожжи. Такое состояние биоценоза наблюдалось практически у каждой третьей обследованной беременной, что потребовало применения более информативных
методов исследования.
обследованных (52,0%) диагностировали относительный нормоценоз – вариант биоценоза влагалища, при котором на фоне сохраненной лактофлоры в диагностическом титре выявлено 104 геном-эквивалента (ГЭ) условно-патогенных микроорганизмов, таких как Ureaplasma spp., Mycoplasma spp., Candida spp. У 15,0% женщин был выявлен анаэробный дисбаланс и у 11,0% – умеренный анаэробный дисбаланс.
С целью снижения риска инфекционных осложнений 31 пациентке с установленными диагнозами вульвовагинит и бактериальный вагиноз на этапе подготовки к прерыванию беременности проводили санацию влагалища флуомизином в течение 6 дней. После завершения курса терапии флуомизином жалоб пациентки не предъявляли. Объективно у всех пациенток отмечены слизистые выделения, в скудном количестве — у 93,5% и умеренные — у 6,5% пациенток. Повторное исследование мазка влагалищного содержимого показало динамику снижения числа лейкоцитов по сравнению с показателями, которые были до начала лечения (табл. 2).
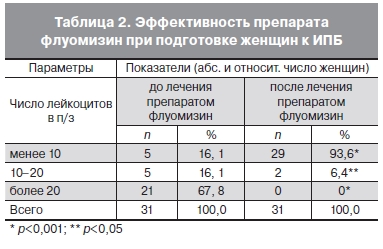
Анализ результатов клинической эффективности показал, что использование флуомизина привело к улучшению объективных и лабораторных показателей: у пациенток отсутствовали характерные жалобы, при микроскопическом исследовании – ключевые клетки. Полученные данные свидетельствуют о необходимости и эффективности терапии флуомизином в программе предабортной подготовки.
При выполнении искусственного аборта частота осложнений была низкой вне зависимости от способа ИПБ: вакуум-аспирации (n=70) или медикаментозного аборта (n=30) и составила 8,6 и 6,7% соответственно. Различия между группами были связаны с развитием эндометрита после вакуум-аспирации у 1,4% пациенток и отсутствием этого осложнения в группе с медикаментозным абортом.
Мы провели анализ изменений влагалищного микробиоценоза в зависимости от способа прерывания беременности. Известно, что влагалище представляет собой микроэкосистему, особенности которой определяются анатомическим строением, гистологической структурой слизистой оболочки, биологическими свойствами влагалищной жидкости, вагинальной микрофлорой. Функционирование и слаженное взаимодействие всех звеньев этой микроэкосистемы обеспечивается деятельностью иммунной, эндокринной систем и зависит от факторов как внутренней, так и внешней среды [1, 2, 8].
При повторном исследовании влагалищного содержимого после прерывания беременности картина микрофлоры влагалища менялась по-разному. В большей степени эти изменения наблюдались у пациенток, перенесших аборт методом вакуум-аспирации. Так, отклонения в биоценозе были диагностированы практически у каждой третьей (28,6%) пациентки; при этом дисбиоз наблюдался у 11,4% обследуемых, признаки вагинита были выявлены у 4,3% женщин; нормоценоз был определен только у каждой пятой (20,0%), промежуточный тип биоценоза – у 21,4% пациенток. У женщин, перенесших медикаментозный аборт, микробиоценоз влагалища изменялся в меньшей степени. Признаки вагинита не обнаружены ни у одной из пациенток, дисбиоз выявлен у 6,7% женщин, что достоверно ниже (p 0
Читайте также:


