Современная терапия ревматических заболеваний
Представлены данные по применению лекарственных средств для локального использования при ревматических заболеваниях, включая метод трансдермальной терапии. Приведены результаты проспективных рандомизированных многоцентровых плацебо-контролируемых исследов
The data on application of drugs for local therapy in rheumatic diseases, including transdermal therapy method were presented. The results of prospective randomized multi-center placebo-controlled studies were given.
Болезни костно-мышечной системы широко распространены во всем мире. При этом остеоартроз (OA) занимает лидирующее место среди всех заболеваний данной группы и является основной причиной временной нетрудоспособности. В среднем OA страдают почти 10% всего населения и почти 50% из них имеют возраст старше 50 лет.
По данным Министерства здравоохранения РФ за период с 2015 по 2016 г. в России было 3646,3 больного ОА на 100 тыс. населения. Первичная заболеваемость ОА составляет 683,4 случая на 100 тыс. населения. В России насчитывается 4 285 464 человека с установленным диагнозом ОА [1, 2].
Основные клинические симптомы OA — это боли в суставах разной интенсивности, что ограничивает не только функциональную активность, но и приводит к полной потере трудоспособности. У пожилых пациентов продолжительность жизни в большей степени зависит от интенсивности боли, чем от сопутствующих заболеваний [3].
Ревматоидный артрит (РА) — аутоиммунное ревматическое заболевание неясной этиологии, которое характеризуется хроническим эрозивным артритом (синовитом) с полиартикулярным поражением и вовлечением внутренних органов. Распространенность РА в популяции — от 0,2% до 1%. Заболевание встречается во всех возрастных категориях. Только в России по статистике за 2015–2016 гг. официально зарегистрирован 298 221 пациент с РА, а по данным эпидемиологического исследования — около 800 000 пациентов [2, 4]. Первичная заболеваемость РА в России — 253,7 случая на 100 тыс. взрослого населения. Причина повышенного внимания к заболеванию в том, что уже в течение первых 3–5 лет от его начала у половины пациентов развивается стойкая нетрудоспособность с существенным сокращением продолжительности жизни [5].
Хроническая боль в области позвоночника — одна из наиболее актуальных медицинских проблем. Наиболее частый вариант — боль в нижней части спины (БНЧС). Она встречается у 9,4% населения земного шара [6]. В Западной Европе ее частота достигает 15%. В США этот показатель с 1992 г. до 2006 г. увеличился с 3,2% до 10,2% [7]. БНЧС нередко возникает как в пожилом, так и в молодом возрасте. У пожилых людей частота БНЧС, по данным разных авторов, колеблется от 15% до 50% [8].
Также несомненный интерес врачей вызывает патология периартикулярных структур, которая может быть самостоятельной нозологической формой или развиваться в рамках других ревматических заболеваний (OA и РА). В основе этих нарушений лежит поражение сухожильно-связочного аппарата, приводящее к возникновению локальных болевых синдромов. До 60% первых визитов к ревматологу составляют обращения по поводу поражения внесуставных мягких тканей [9].
В связи с вышеизложенным задача терапии ревматических заболеваний состоит в минимизация болей и воспаления в суставах и восстановлении их функций.
Нестероидные противовоспалительные препараты (НПВП) — наиболее часто используемые лекарственные средства при лечении заболеваний опорно-двигательного аппарата. Применение классических НПВП, подавляющих выработку как провоспалительных, так и физиологических простагландинов, сопряжено с высоким риском развития серьезных осложнений со стороны желудочно-кишечного тракта (НПВП-гастропатии, эрозии, язва желудка и двенадцатиперстной кишки, желудочно-кишечные кровотечения), сердечно-сосудистой системы (артериальная гипертензия, инфаркт миокарда), почек (лекарственная нефропатия) и др. [10, 11].
Несмотря на значительный прогресс, достигнутый в последние годы в лечении ревматических болезней, проблема безопасности применяемых лекарственных средств, особенно у больных пожилого возраста, выходит на первый план. Наряду с системной фармакотерапией, в ревматологии широко используются средства локального воздействия на болевые зоны, а появление новых лекарственных средств местной аналгезии вызывает законный интерес.
Далее представлен перечень ревматических заболеваний, при которых рекомендуется назначение локальной терапии:
- синовиты (ОА, реактивный артрит, болезнь Бехтерева, псориатическая артропатия, кристаллическая артропатия, травматический синовит);
- боли в нижней части спины;
- теносиновиты, тендовагиниты, эпикондилиты;
- миозиты;
- периартриты;
- флебиты;
- посттравматические болевые синдромы;
- непереносимость перорального приема НПВП.
Местно применяемые НПВП в виде мазей, кремов и гелей должны обладать быстрым и длительным обезболиванием, выраженным терапевтическим действием, ощущением охлаждения или согревания. Препарат для локального использования также должен иметь приятный запах, быстро всасываться, не оставлять следов после применения и не требовать согревания.
Традиционно в состав локальных лекарственных форм входят разные НПВП, часто используемые в клинической практике, — ибупрофен, диклофенак, пироксикам, кетопрофен в концентрации от 0,5% до 5%. В отдельные лекарственные препараты для местного применения к НПВП добавляют ментол, метилсалицилат, капсаицин (табл. 1).
Топические НПВП можно использовать в качестве дополнения к основному режиму терапии у пациентов с базовой фармакологической терапией SYSADOA больных с ОА и иммуносупрессивным лечением препаратами метотрексата, аравой и др. Топические НПВП рекомендуют раньше пероральных НПВП. Из-за меньшей системной абсорбции и лучшего профиля переносимости они могут быть предпочтительным методом лечения, особенно в возрасте ≥ 75 лет, а также у пациентов с сопутствующими заболеваниями или повышенным риском нежелательных лекарственных реакций (НЛР) со стороны желудочно-кишечного тракта (ЖКТ), сердечно-сосудистой системы (ССС) или почек. Выбор топических НПВП может быть принципиальным, поскольку хорошая адсорбция через кожу и накопление активного агента в ткани мишени важны для повышения эффективности, а низкий уровень в плазме — для минимизации системных НЛР и улучшения переносимости препарата [12].
Локальные НПВП широко применяются при ОА, однако риск развития системных (желудочно-кишечных и кардиоваскулярных) нежелательных явлений достаточно высок [13]. В связи с этим поиск средств для локальной анальгезии продолжается, поскольку оптимальный лекарственный препарат (или метод) ни прямо, ни косвенно не должен представлять опасность для пациента и требовать постоянного медицинского наблюдения.
Особый интерес представляют лечебные пластыри, созданные на основе нанотехнологий, в частности Нанопласт форте (НФ), который содержит магнитный слой из редкоземельных металлов и нанопорошок — индуктор длинноволнового инфракрасного излучения и обладает болеутоляющим, миорелаксирующим действием.
В связи с этим целью работы была оценка эффективности системной и локальной переносимости НФ в сопоставлении с пластырем-плацебо (ПЛ) у больных остеоартрозом коленных суставов (ОА КС).
Суммарная эффективность НФ оценивалась на 14-й день раздельно врачом и больным по следующим градациям: 1 — значительное улучшение, 2 — улучшение, 3 — отсутствие эффекта, 4 — ухудшение. Потребность в приеме НПВП контролировалась на протяжении всего исследования: рассчитывалась суточная доза, фиксировалось уменьшение дозы или полная отмена НПВП в связи с уменьшением интенсивности болевого синдрома.
Переносимость НФ и ПЛ оценивалась по частоте и выраженности (в баллах от 1 до 3) локальных и/или системных нежелательных явлений. Статистическая обработка полученных результатов проведена с использованием прикладных программ Statistica.
В исследование в соответствии с кодом рандомизации включено 120 пациентов с ОА КС, по 60 больных в обеих группах. По возрасту, продолжительности ОА, длительности обострения, индексу массы тела (ИМТ), интенсивности боли в коленных суставах, другим клиническим параметрам и общей активности болезни обе группы были полностью сопоставимы (табл. 2).
В целом в анализируемых группах преобладали женщины (97 больных) с ОА КС II–III стадии (93,3%), продолжительностью ОА — 7,7 года и длительностью обострения — 8,9 недели. Среднее значение ИМТ составило 29,5 кг/м 2 . У 55 (73%) больных диагностирован двухсторонний ОА КС. Из сопутствующих заболеваний наиболее часто (57,5%) отмечалась артериальная гипертензия.
Частота достижения 50%-го уменьшения боли (подшкала А индекса WOMAC) в группе активного НФ была достоверно выше, чем в группе ПЛ (38,2% и 16,7% соответственно, р = 0,013; точный критерий Фишера). Интенсивность боли при ходьбе уменьшилась только при использовании активного НФ (р = 0,05; двухфакторный анализ ANOVA), причем достоверное уменьшение боли было отмечено уже на 4-й день применения НФ (рис. 1).
Суммарный показатель боли по индексу WOMAC в основной группе также достоверно уменьшился с 237,0 до 149,4 мм, что свидетельствует о выраженном анальгетическом эффекте НФ (рис. 2). На фоне лечения в основной группе достоверно уменьшилась утренняя скованность (рис. 3) и увеличилась функциональная активность (рис. 4).
Общее состояние больных по субъективной оценке (р = 0,05) и оценке врача (р = 0,01) улучшилось статистически значимо. Отмена и уменьшение дозы НПВП происходили достоверно (р = 0,007; точный критерий Фишера) чаще в группе больных, применявших активный НФ, чем в группе ПЛ: у 23 и 7 пациентов соответственно, т. е. почти у половины больных.
При общей оценке эффективности НФ в основной группе у 82% пациентов отмечалось значительное улучшение. На фоне применения ПЛ в 52% случаев эффекта от лечения не было, 5% больных оценили свое состояние как ухудшившееся. На фоне проводимой терапии в основной группе снижение дозы НПВП зарегистрировано у 41 пациента (68,3%), в группе сравнения — только у 18 (30%).
Результаты применения НФ при БНЧС представлены в открытом проспективном рандомизированном двойном слепом контролируемом сравнительном исследовании в параллельных группах по оценке эффективности и безопасности пластыря НФ и пластыря ПЛ для купирования болевого синдрома. В исследование включено 60 больных с БНЧС, разделенных на две группы: 30 основная, 30 — группа плацебо. Аппликация пластыря обеих форм проводилась один раз в день на 12 часов. Курс терапии составил 9 дней.
Критерии включения:
- острый/обострившийся хронический первичный болевой синдром в нижней части спины, имеющий рентгенологическое подтверждение диагноза;
- пациенты обоего пола в возрасте от 20 до 65 лет;
- небеременные, некормящие;
- понимание устной и письменной речи;
- интенсивность боли в спине по ВАШ при движении ≥ 50 мм;
- подписанное пациентом информированное согласие.
Методы оценки эффективности:
- оценка интенсивности болевого синдрома в спине по ВАШ в покое, мм;
- оценка интенсивности болевого синдрома в спине по ВАШ при движении, мм.
Критерии эффективности:
- изменение боли в спине не менее чем на 50% от исходного уровня по шкале ВАШ в покое и при движении;
- доля пациентов, у которых удалось купировать болевой синдром после курсового применения пластыря;
- доля пациентов, у которых удалось снизить интенсивность болевых ощущений после курсового применения пластыря;
- доля пациентов, которым потребовалось/не потребовалось дополнительное назначение НПВП для снижения интенсивности болевых ощущений после курсового применения пластыря.
Оценка безопасности:
- оценивалась частота и выраженность локальных и системных НЛР;
- оценка переносимости локальной терапии пластырем Нанопласт форте/Нанопласт форте плацебо по градации переносимости: очень хороший эффект, хороший эффект, удовлетворительный эффект, отсутствие эффекта;
- суммарная оценка эффекта лечения по следующим градациям: значительное улучшение, улучшение, отсутствие эффекта.
Статистика
Для количественных переменных проводился тест на соответствие распределения нормальному закону с использованием критериев Колмогорова–Смирнова и Шапиро–Уилка.
Для оценки динамики изменения данных, выраженных количественными показателями, использованы методы статистического анализа: непарный t-критерий Стьюдента, непараметрические критерии Манна–Уитни и Вилкоксона, критерий χ 2 Пирсона.
Результаты исследования
В исследовании участвовало 60 больных БНС, по 30 пациентов в обеих группах. Сравнительная характеристика больных представлена в табл. 3, из которой следует, что по основным демографическим и клиническим параметрам обе группы были сопоставимы.
В целом в анализируемых группах преобладали женщины (70% больных) в среднем возрасте 49 лет с медианой продолжительности болевого эпизода — 4 дня. Среднее значение ИМТ составило 29 кг/м 2 .
Сравнительный анализ эффективности
Уменьшение боли в спине более чем на 50% в покое было выше в группе НФ, чем в группе ПЛ: 96,6% и 23,3% соответственно (р = 0,001, критерий Пирсона χ 2 ). Частота достижения не менее чем 50% уменьшения боли в спине при движении выше в группе НФ, чем в группе ПЛ — 93,3% и 40% соответственно (р = 0,001, критерий Пирсона χ 2 ).
При общей оценке эффективности лечения пациентом в группе НФ у 36,7% больных отмечался очень хороший эффект и у 56,7% — хороший эффект, у 6,6% — удовлетворительный. При общей оценке эффективности лечения пациентом в группе ПЛ только у 13,3% больных отмечался очень хороший эффект и у 30% хороший эффект, у 40% — удовлетворительный, 16,7% больных не отмечали эффекта. Согласно критерию Пирсона χ 2 группы НФ и ПЛ имели статистически значимые различия (р = 0,001).
При общей оценке эффективности лечения врачом в группе НФ у 40% больных отмечался очень хороший и у 60% — хороший эффект. Соответственно в группе ПЛ у 6,7% больных эффект был очень хороший, у 46,7% — хороший, у 33,3% — удовлетворительный, а 13,3% пациентов не отмечали эффекта. Согласно критерию Пирсона χ 2 группы НФ и ПЛ имели статистически значимые различия (р = 0,001).
Интенсивность боли при ходьбе статистически значимо уменьшилась к 10-му дню в группе НФ и в группе ПЛ до медиан 20 и 40 баллов по шкале ВАШ соответственно (p 2 ).
Нежелательных явлений не отмечалось как в основной группе, так и в группе сравнения.
Результаты проведенных исследований показали, что НФ обладает выраженным анальгезирующим эффектом и способствует улучшению функциональной активности у пациентов с болями в суставах и позвоночнике. На фоне использования пластыря статистически значительно снизилась суточная потребность в НПВП.
Отмечалась отличная и хорошая переносимость пластыря при отсутствии в его составе лекарственных компонентов, потенциально способных вызывать системные нежелательные явления, по сравнению с пластырями, содержащими анестетики и НПВП. НФ оказался эффективным и безопасным средством в комплексной терапии болезней суставов и позвоночника, в особенности для пожилых пациентов, имеющих факторы риска развития нежелательных явлений со стороны ССС и ЖКТ и противопоказания для применения НПВП.
Литература
- Балабанова Р. М., Эрдес Ш. Ф. Распространенность ревматических заболеваний в России в 2012-2013 гг. // Научно-практическая ревматология. 2015; 53 (2): 120–124.
- Балабанова Р. М., Дубинина Т. В., Дёмина А. Б., Кричевская О. А. Заболеваемость болезнями костно-мышечной системы в Российской Федерации за 2015–2016 гг. // Научно-практическая ревматология. 2018; 56 (1): 15–21.
- Денисов Л. Н., Цветкова Е. С., Голубев Г. Ш. и др. Алгоритм лечения остеоартроза коленного сустава Европейского общества по клиническим и экономическим аспектам остеоартроза и остеоартрита // Научно-практическая ревматология. 2016; 54 (6): 641–653.
- Галушко Е. А., Большакова Т. В., Виноградова И. Б. и др. Структура ревматических заболеваний среди взрослого населения России по данным эпидемиологического исследования (предварительные данные) // Научно-практическая ревматология. 2018; 56 (Прил. 1): 1–29.
- Насонов Е. Л., Каратеев Д. Е. Ревматоидный артрит. В кн.: Российские клинические рекомендации. Ревматология. М.: Стар-Медиа, 2017. С.17–57.
- Hoy D., March L., Brooks P. et al. The global burden of low back pain: estimates from the Global Burden of Disease 2010 study // Ann Rheum Dis. 2014, Jun, 73 (6): 968–974.
- Freburger J. K., Holmes G. M., Agans R. P. et al. The rising prevalence of chronic low back pain // Ann Intern Med. 2009, Feb 9; 189 (3): 251–258.
- Leopoldino A. A., Diz J. B., Martins V. T. et al. Prevalence of low back pain in older Brazilians: a systematic review with meta-analysis // Rev Bras Rheumatol Engl Ed. 2016, May-Jun; 56 (3): 258–269.
- Олюнин Ю. А. Заболевания внесуставных мягких тканей — патогенез, клиника, лечение // РМЖ. 2007; 15 (26): 1–5.
- Каратеев А. Е., Алексеева Л. И., Филатова Е. Г. и др. Обезболивающие препараты в терапевтической практике. М.: ИМА ПРЕСС; 2013. С. 136.
- Каратеев А. Е., Насонов Е. Л., Ивашкин В. Т. и др. Рациональное использование нестероидных противовоспалительных препаратов. Клинические рекомендации // Научно-практическая ревматология. 2018; 56 (Прил. 1): 1–29.
- Evans J. M., MacDonald T. M. Tolerability of topical NSAIDs in the elderly: do they really convey a safety advantage? // Drugs Aging. 1996. V. 9. P. 101–108.
- Lin J., Zhang W., Jones A., Doherty M. Efficacy of topical NON-Steroidal anti-inflammatory drugs in the treatment of osteoarthritis: meta-analysis of randomized controlled trials // Drugs Aging. 1996. V. 9. P. 101–108.
Л. Н. Денисов* , 1 , доктор медицинских наук
Е. С. Цветкова, кандидат медицинских наук
Н. А. Шостак**, доктор медицинских наук, профессор
Е. И. Шмидт***, кандидат медицинских наук
* ФГБНУ НИИР им. В. А. Насоновой, Москва
** ФГАОУ ВО РНИМУ им. Н. И. Пирогова, Москва
*** ГКБ № 1 им. Н. И. Пирогова, Москва
Современная локальная терапия ревматических заболеваний/ Л. Н. Денисов, Е. С. Цветкова, Н. А. Шостак, Е. И. Шмидт
Для цитирования: Лечащий врач № 4/2020; Номера страниц в выпуске: 22-27
Теги: ревматические заболевания, трансдермальная терапия, болевой синдром
Все лекарственные препараты, которые используются для лечения системных ревматологических заболеваний можно достаточно условно разделить на две группы: актуальную и патогенетическую (базисную) терапию.
Актуальная терапия в ревматологии:
К препаратам первой группы (актуальная терапия) прежде всего относятся различные лекарственные формы (таблетки, мази, свечи) нестероидных противовоспалительных препаратов (НПВП). К НПВП относятся такие лекарства как диклофенак, ксефокам, найз, мовалис, аркоксиа и некоторые другие. Основной функцией актуальной терапии является уменьшение болевого синдрома при ревматологических заболеваниях. Важно отметить два момента, которые необходимо учитывать при назначении препаратов этой группы:
- препарат необходимо принимать именно в той дозе, которая рекомендована лечащим врачом;
- запрещено принимать внутрь одновременно два препарата из группы НПВП, так как это может привести к тяжелому поражению почек.
При назначении НПВП- содержащих мазей их важно использовать в адекватной дозе. Так, на средние суставы (лучезапястный, голеностопный, локтевой) наносится не менее 3-4 см мази, на крупные суставы (плечевой, коленный) необходимо наносить 5-6 см. Такие мазевые формы НПВП допустимо комбинировать с таблетками и свечами.
Чувствительность к НПВП весьма различна, то есть для каждого больного оптимальным по обезболивающему эффекту является определенный препарат. Поэтому, как правило, врачу-ревматологу приходится заниматься подбором и препарата, и его оптимальной дозировки. Особо отметим, что слишком частая смена препаратов и быстрое увеличение дозы нецелесообразны, так как максимальный эффект достигается через 7-10 дней.
Базисная терапия в ревматологии:
Основные эффекты базисной (патогенетической) терапии связаны преимущественно с подавлением иммунитета, так как основной механизм данной группы заболеваний связан с развитием в организме неконтролируемого воспаления. Основными препаратами, которые используются в ревматологии для базисной терапии, являются производные 5-аминосалициловой кислоты (сульфосалазин), аминохинолиновые препараты (делагил, плаквенил), цитотоксические препараты (метотрексат, азатиоприн, циклофосфан, лефлюномид, миокфенолат мофетил), глюкокортикостероиды.
Все эти препараты токсичны и могут использоваться только после назначения их врачом-ревматологом. При этом в связи с их высокой токсичностью, проводится постоянный мониторинг состояния системы крови, почек и печени. С этой целью все больные, получающие базисную терапию, должны регулярно (не реже 2-х раз в месяц) сдавать клинический анализ крови, общий анализ мочи, трансаминазы (АЛТ, АСТ) с тем, чтобы при необходимости своевременно прервать прием препарата.
Другой существенной особенностью базисной терапии является её вторичная резистентность. Иначе говоря, в том случае если прием препарата необоснованно прекращается на длительный срок, при возобновлении приема эффективность препарата значительно снижается, а в ряде случаев возобновление терапии не приносит желаемого результата.
Интенсификация лечения системных ревматологических заболеваний:
Современное течение системных ревматических заболеваний характеризуется высокой, длительно сохраняющейся активностью и быстрой генерализацией процесса.
В связи с этим часто необходима интенсификация лечения данной группы заболеваний. На сегодня существуют два принципиальных метода подобной интенсификации: применение антицитокиновой терапии и проведение пульс-терапии.
Антицитокиновая терапия заключается в том, что больному вводятся специальные препараты белковой природы, которые подавляют выработку цитокинов (молекул, осуществляющих межклеточное взаимодействие), в результате чего резко подавляется воспалительный процесс. К препаратам данной группы относятся такие лекарства, как инфликсимаб, энберл, хумира, голимумаб, устекинумаб и некоторые другие. Однако данная терапия проводится только в специальных центрах и осуществляется по квотам в связи с очень высокой стоимостью подобного лечения.
Пульс-терапия - второй и более доступный метод интенсификации лечения ревматологических заболеваний. Пульс-терапия представляет собой введение очень высоких доз (мега-доз) преднизолона в течение 3-х дней подряд, в ряде случаев в сочетании с противоопухолевыми препаратами. Преимуществами пульс-терапии являются быстрое наступление эффекта, её хорошая переносимость и относительно невысокая стоимость. Положительный эффект от пульс-терапии наступает уже во время лечения и сохраняется до 3-х месяцев. Курсы пульс-терапии с краткосрочной госпитализацией проводятся в нашей клинике "АБИА".
В ряде случаев подобная интенсификация лечения (особенно при таких заболеваниях как системная красная волчанка, болезнь Бехтерева, системные васкулиты) проводится достаточно регулярно до достижения ремиссии.
Несмотря на то, что системные ревматологические заболевания протекают тяжело, с поражением многих органов и систем, современная терапия при своевременном и раннем обращении к ревматологу, как правило, способна контролировать течение заболевания, позволяя больному сохранять работоспособность и способность к самообслуживанию на долгие годы.
Болезни суставов беспокоят человечество с древнейших времен. Есть доказательства того, что с артритами часто приходилось сталкиваться и древнекитайским, и древнеегипетским врачам, и отцу медицины Гиппократу.
В древности ревматизмом называли практически любые боли в суставах. Считалось, что мозг человека вырабатывает некую ядовитую жидкость — она-то и приводит к артритам. Позже, по мере развития медицинской науки, оказалось, что причин намного больше.
Почему возникает ревматизм?
Острый ревматизм возникает после ангины, вызванной β-гемолитическим стрептококком группы A. Во время болезни микроорганизм выделяет в кровь вещества, которые распознаются иммунной системой как антигены, против них вырабатываются антитела. Антигены с антителами образуют соединения — иммунные комплексы. В норме они должны выводиться из организма, но у некоторых людей оседают в сердце, суставах, других органах. В ответ на них снова возникает иммунная реакция, развивается воспаление.
К ревматизму более склонны люди, которые живут в неблагоприятных условиях, плохо питаются. Отмечена и генетическая предрасположенность — известны семьи, в которых болеют практически все.
Симптомы заболевания
Обычно симптомы острого ревматизма возникают спустя 1–2 недели после перенесенной ангины. У большинства людей болезнь проявляется в виде ревмокардита — воспаления внутренней оболочки и мышц сердца. Повышается температура тела, беспокоят слабые боли или дискомфорт в области сердца, ощущение усиленного сердцебиения. В более тяжелых случаях возникает одышка, отеки, тяжесть в правом подреберье.
Через 1–2 года или позже ревмокардит приводит к пороку сердца — наиболее тяжелому осложнению ревматизма.
Другое возможное проявление ревматизма — артрит — воспаление в суставах, чаще всего коленных. Они отекают, возникает боль, нарушается движение. Эти симптомы быстро проходят после приема противовоспалительных препаратов и не приводят к стойкой деформации сустава.
Редкие проявления:
- Ревмохорея — поражение сосудов головного мозга. Проявляется в виде насильственных движений, гримасничанья, нарушения координации движений, слабости мышц, психических расстройств.
- Кольцевая эритема — поражение кожи. Появляются безболезненные кольца бледно-розового цвета.
- Пневмония и плеврит. Проявляются в виде болей в груди, кашля, одышки.
- Перитонит — воспаление в брюшной полости. Возникают боли в животе, тошнота, рвота, запоры, поносы.
Современные методы диагностики
Симптомы ревматизма сильно напоминают проявления других заболеваний. Установить правильный диагноз сможет врач-ревматолог после сбора анамнеза и осмотра, обследования.
Обследование обычно включает следующие методы:
- общий, биохимический, иммунологические анализы крови
- электрокардиографию (ЭКГ)
- рентгенографию грудной клетки
- ЭХО-кардиографию (УЗИ сердца)
Как протекает ревматизм? Каков прогноз?
Выделяют пять видов течения заболевания:
Чем дольше протекает заболевание, тем сложнее его лечить.
Современные методы лечения ревматизма
Больного острой формой госпитализируют в стационар. Лечение включает:
- Постельный режим в течение 2-3-х недель.
- Полноценное питание с ограничением соли.
- Антибактериальную терапию — для борьбы со стрептококковой инфекцией.
- Нестероидные противовоспалительные средства, например, диклофенак, для уменьшения воспаления.
- В тяжелых случаях — глюкокортикостероиды (препараты гормонов коры надпочечников, которые подавляют иммунитет и обладают мощным противовоспалительным эффектом).
- После выписки нужно наблюдаться и продолжить лечение у ревматолога в поликлинике. Длительный прием противовоспалительных препаратов и антибиотиков помогает предотвратить рецидив. Врач может направить на реабилитацию в специализированный санаторий.
Ревматизм — заболевание, как правило, не опасное для жизни. Его наиболее тяжелое осложнение — порок сердца, может потребоваться хирургическое лечение.
Лекарства последнего поколения, разработанные по современным технологиям фармацевтики, облегчают страдания человека, снижают риск дальнейших осложнений. Что же такое ревматоидный артрит, каковы причины, симптомы, какие методы лечения возможны?
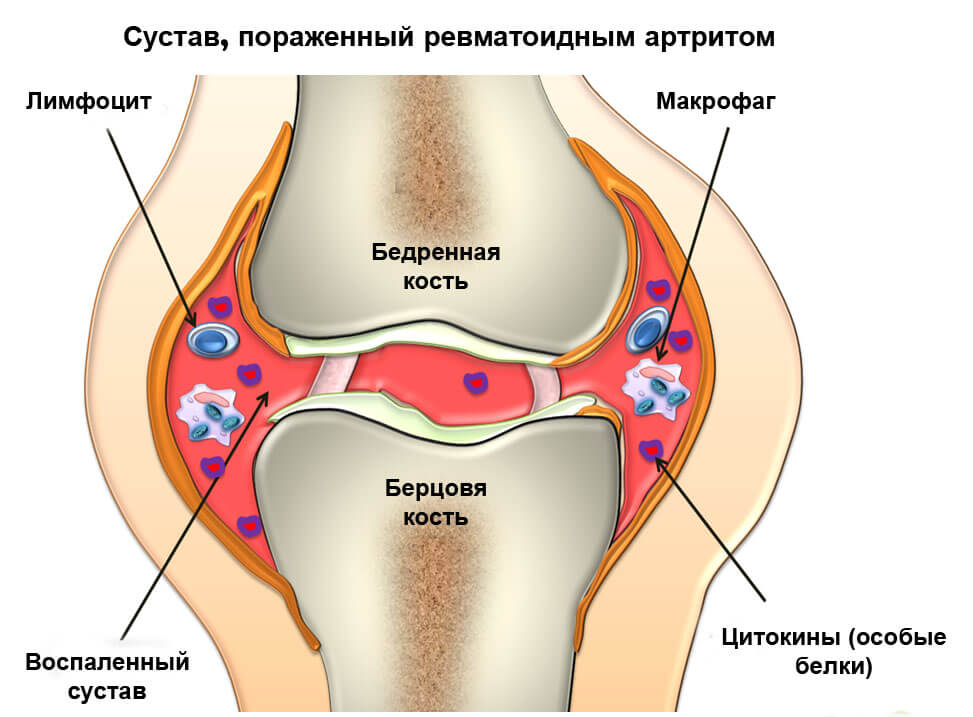
Что собой представляет болезнь?
Важно знать! Врачи в шоке: "Эффективное и доступное средство от боли в суставах существует. " Читать далее.
Это системная неврологическая патология, связанная с воспалением хрящевой ткани в суставном сочленении. Причинно-следственные связи клинического состояния различны. Однако все они обусловлены проблемами в работе защитной иммунной организации человека. Наиболее вероятный провоцирующий фактор – инфекционное поражение.

Реакция на воспалительный процесс инфицирования – это медленное разрушение соединительных тканей, связанное с их дегенеративно-дистрофической реорганизацией.
Если вовремя не провести адекватное лечение, то следующим этапом дегенерации станет деформация суставной поверхности. Это влечет значительное ограничение подвижности костно-суставных сегментов ОДА нижней конечности.
Возможные причины возникновения неврологической патологии:
- генетическая зависимость;
- воздействие хронических заболеваний на суставные сегменты;
- действие пусковых факторов: переохлаждение, интоксикация, реакция костно-суставной системы на мутагенные лекарственные средства.
При ревматоидном артрите симптомы заболевания без медикаментозной терапии могут сохраняться длительное время и выражаться в следующих проявлениях:
- боли в суставах различной степени интенсивности, даже при незначительных нагрузках;
- присутствие отечности, покраснения в месте поражения;
- нарушение температурного режима, как результат воспалительной реакции в соединительной ткани.
Такие симптоматические признаки возможны при любых воспалительных реакциях. Поэтому перед тем как проводить лечение ревматоидного артрита, необходимо идентифицировать диагностические признаки заболевания.

Человеку необходимо обратиться к врачу, который на основе собранного анамнеза, диагностического лабораторного исследования (УЗИ, рентген, МРТ, КТ), других уточняющих процедур диагностики определит степень выраженности неврологической патологии. Он установит причинно-следственную связь воспалительной реакции, назначит медикаментозное лечение.
При лечении обязательна двигательная активность суставных сегментов. С этой целью консультирующий специалист назначает физиотерапевтические процедуры, лечебный массаж, гимнастические упражнения, мануальные методы воздействия на суставную патологию.
Подробное видео о природе заболевания:
Системная медикаментозная терапия
Лечебная терапевтическая реакция предусматривает применение пяти групп фармакологических лекарственных средств.
| № п/п | Фармакологические комбинации | Назначение лекарственных средств |
| 1 | Нестероидные противовоспалительные (НПВП) | Устранение симптомов |
| 2 | Базисные противоревматические группы | Уменьшение воспалительной активности, смягчение костно-суставной деструкции |
| 3 | Глюкокортикостероиды | Нормализация обменных функций, восстановление активного кровообращения |
| 4 | Биологические средства лечения | Устранение ферментативного разрушения близлежащих тканевых соединений суставной поверхности |
| 5 | Миорелаксанты | Для расслабления скелетной мускулатуры при значительном снижении двигательной активности |
Нестероидные противовоспалительные
При обезболивании и устранении воспалительной реакции врачи назначают наиболее известные препараты нестероидной противовоспалительной активности – Диклофенак®, Ибупрофен® или Парацетамол®.
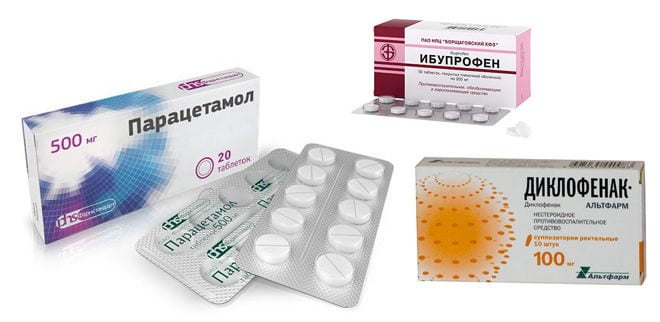
Однако существуют более действенные средства лечения из нестероидной противовоспалительной группы с наименьшим эффектом побочного воздействия, связанным с органами мочеполовой, желудочно-кишечной систем.
Среди нестероидных противовоспалительных комбинаций выделяется Дексалгин® 25 немецкого производителя – компании BERLIN-CHEMIE/MENARINI PHARMA GmbH. Выпускается в виде таблеток с активным действующим веществом декскетопрофеном, отпускаемый в аптечной сети только по рецептурному назначению врача. Благодаря активному компоненту и вспомогательным веществам (кукурузный крахмал, микрокристаллическая целлюлоза и т. д.) нестероидная лекарственная форма оказывает анальгезирующее, противовоспалительное и жаропонижающее действие.
После приема фармацевтического средства основные симптомы ревматоидного артрита — боль, отечность, покраснение – исчезают через 30-40 минут. Однако длительность обезболивания составляет 4-5 часов – и наступает новый виток болевых приступов. Дозировка и курс лечения определяется лечащим специалистом с учетом возрастных, половых, индивидуальных особенностей пациента.
Препарат не назначается беременным женщинам, детям до 12 лет, больным людям с хроническими дыхательными патологиями, почечной и печеночной недостаточностью. Лекарство не предназначено для длительного применения. Курс лечения не должен превышать 5-7 дней.
Даже "запущенные" проблемы с суставами можно вылечить дома! Просто не забывайте раз в день мазать этим.
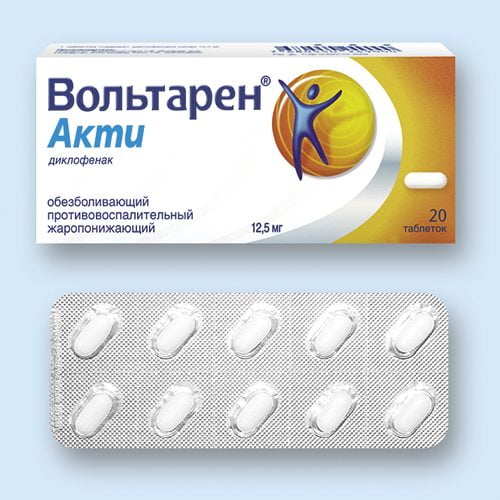
Вольтарен® акти обладает всеми свойствами фармакологических средств нестероидной противовоспалительной активности – жаропонижающим, болеутоляющим. Лечебный эффект наступает после 15-20 минут, что делает эффективным применение препарата для скорейшего купирования болевого приступа и урегулирования температурного режима. Курс лечения лекарственным средством не должен превышать 5 дней. Противопоказания: язвенная болезнь желудка, дети до 14 лет, почечная, печеночная или сердечная недостаточность. Принимать его не рекомендуют людям с хронической патологией органов дыхания.
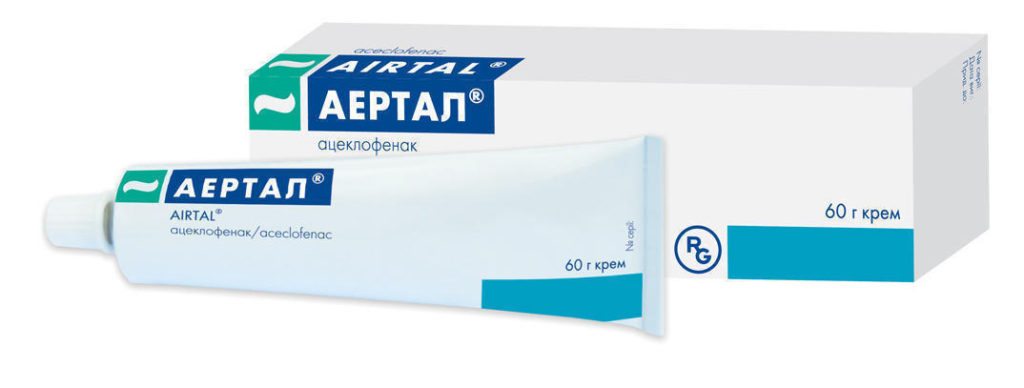
Благодаря активному действующему веществу – ацеклофенаку — применение лекарственной формы целесообразно при воспалении в суставе, других костно-мышечных, суставных сегментах опорно-двигательного аппарата.
Исключения – заболевания кожного покрова в месте предполагаемого проведения терапевтических действий, индивидуальная непереносимость фармакологического продукта.
Базисные противоревматические препараты
Среди интересных модифицирующих антиревматических продуктов фармацевтического рынка:
Как и чем лечить болезнь, решает лечащий врач. Данная группа лекарственных препаратов обладает очень медленным терапевтическим эффектом. Рекомендуется применять базисные средства лечения совместно с прочими фармакологическими группами – нестероидными противовоспалительными препаратами, глюкокортикостероидами.
Глюкокортикостероиды
Этот вид фармакологических препаратов представляет собой стероидный гормон, синтезируемый корой надпочечников, обладающий разносторонним физиологическим действием:
- противовоспалительным;
- антиаллергическим;
- иммунорегулирующим;
- антишоковым;
- противострессовым.
Среди назначаемых фармакологических средств последнего поколения наиболее эффективны:
Являясь мощнейшим контринсулярным гормоном, глюкокортикостероиды практически не назначаются пациентам с сахарным диабетом.
Биологические средства лечения
При ревматоидном артрите происходит ферментация синовиальной оболочки в суставной полости, которая приводит к разрушению дисульфидных связок в близлежащих костно-суставных тканях и хрящах. Это влечет каскадную реакцию, усугубляет клиническую симптоматику неврологического заболевания. Организм отвечает воспалительной реакцией, сопровождающейся выработкой цитокинов, наиболее опасен ФНО – фактор некроза опухоли. Такое состояние может обеспечить пациенту значительное снижение подвижной активности суставов и физическую нетрудоспособность.
Поэтому в комплексное лечение вводятся специальные блокаторы (ингибиторы ФНО) или антицитоновые препараты:
Миорелаксанты
Медицинский термин происходит от латинского myorelaxantia, где myo – это мускул, relaxantis – расслабляющий. Цель их назначения – это снижение мышечного тонуса в зоне неврологического повреждения. Классифицируется лекарственная форма следующим образом (смотреть таблицу).
| Деполяризующие миорелаксанты | Не деполяризующие миорелаксанты | ||
| Ультракороткого действия | Короткого действия | Среднего действия | Длительного действия |
| Дитилин® – деполяризующий миорелаксант короткого действия | Мивакрон® – для кратковременного угнетения нервно-мышечной передачи | Тракриум® – лекарственная форма периферического действия конкурентного типа. Основной компонент – атрикурия безилат снижает чувствительность холинорецепторов, обеспечивая невозможность возбуждения и сокращения мышечного волокна | Павулон® – недеполяризующий миорелаксант продолжительной активности, обеспечивающий релаксацию скелетной мускулатуры |
Доклад на тему медикаментозного лечения:
Прогноз
Обязательным условием для скорейшего выздоровления является не только применение медикаментозных фармацевтических комбинаций. В комплексную терапию необходимо включать физиотерапевтические процедуры, специальные упражнения, лечебный массаж, санаторно-курортное оздоровление.
В случае неэффективности перечисленных методов терапии или при прогрессировании болевой симптоматики в костно-суставном сегменте предусмотрено хирургическое вмешательство:
- артродез;
- синовэктомия;
- эндопротезирование.
Медицинские эксперты отмечают, что продолжительность жизни пациентов с ревматоидной патологией сокращает жизнь человека в среднем на 5-10 лет.
По лабораторным исследованиям американской Клиники Мэйо (США, Миннесота), проведенным в 2005 году, риск сердечно-сосудистых патологий в 2 раза выше у пациентов, страдающих ревматическими и артрологическими заболеваниями. Эта неутешительная статистика в наибольшей степени объясняется хронической стадией ревматоидного артрита опорно-двигательной системы.
Уменьшить риск хронических патологий и увеличить продолжительность жизни поможет назначение биофармацевтических средств лечения. Они активно воздействуют на жизненно важные биологические объекты – кровь, клеточную структуру и соединительные ткани.
Читайте также:






