Субхондральная кость при остеоартрозе
Медицинский эксперт статьи


Костная ткань постоянно обновляется. Этот динамичный процесс, который называется ремоделированием костной ткани, представляет собой сложную последовательность процессов резорбции и минерализации. Остеокласты резорбируют костную ткань, а остеобласты секретируют белки, формирующие основной органический компонент для минерализации. Образование и резорбция кости неслучайно происходят по всему скелету, это - запрограммированный процесс, происходящий в различных участках скелета, называемый единицами костного ремоделирования. В начале цикла остеокласты появляются на неактивной поверхности; в течение 2 нед они образуют туннель в кортикальном слое кости или лакуну на поверхности трабекулярной кости. Частота активации новых единиц костного ремоделирования определяет степень обновления костной ткани. У здорового молодого человека процессы формирования и резорбции костной ткани уравновешены, поддерживается нормальная масса костной ткани. В гормональной регуляции резорбции костной ткани, по крайней мере ПТГ и ПГЕ2, принимают участие не только остеокласты, но и остеобласты, так как под действием этих гормонов высвобождаются факторы, стимулирующие резорбцию кости остеокластами. В настоящее время известно более 12 локальных и системных регуляторов роста костной ткани, влияющих на ее ремоделирование, в частности ПТГ, 1,25(OH)2D3, кальцитонин, гормон роста, глюкокортикоиды, гормоны щитовидной железы, инсулин, ИФР (1 и 2), эстрогены, ПГЕ2, андрогены.
Костные клетки высвобождают ряд белков и цитокинов, которые осуществляют эндокринную регуляцию и передачу сигнала. Вырабатываемые остеобластами белки включают белки костного матрикса, такие, как коллаген, остеопонтин, остеокальцин, костные сиалопротеины. Кроме того, эти клетки высвобождают протеазы как в активной, так и в латентной форме, которые принимают участие в процесее ремоделирования костной ткани - ММП, компоненты системы активатор плазминогена (АП)/плазмин. Высвобождаемые остеобластами цитокины могут действовать как посредством аутокринных механизмов, так и паракринным путем на местные клетки (другие остеобласты, остеокласты).
Пока неизвестно, каким путем регулируются эти сигналы - механическим стрессом или другими химическими сигналами, индуцированными механическим стрессом. Однако известно, что повторяющийся механический стресс вызывает локальную пролиферацию костных клеток и/или белков. В условиях in vivo механическая нагрузка способна активировать остеобласты, повышать уровень циклических нуклеотидов, продукцию простагландинов, а также вызывать морфологические изменения, ассоциированные с ремоделированием костной ткани. В условиях in vitro механический стресс вызывает пролиферацию культуры остеобластов, экспрессию мРНК костных белков, принимающих участие в образовании остеоида и в процессе минерализации, высвобождение локальных факторов роста, таких, как ИФР-1 и ИФР-2 и молекул адгезии. Передача сигнала механического стресса может осуществляться посредством механочувствительных ионных каналов.
Существуют косвенные доказательства нарушения функции остеобластов при остеоартрозе. G. Gevers и J. Dequeker (1987) продемонстрировали повышение уровня сывороточного остеокальцина у женщин с остеоартрозом суставов кистей, а также в эксплантатах кортикальной зоны кости, что свидетельствует о том, что патология костной ткани может выступать частью остеоартроза. При аутопсии обнаружено не только утолщение субхондральной кости, но и аномально низкую минерализацию головки бедренной кости. У морских свинок с хирургически индуцированным остеоартрозом с помощью компьютерной томографии обнаружено значительное утолщение костной фракции в субхондральной зоне. Дисбаланс между коллагеновыми и неколлагеновыми (остеокальцин и др.) белками может привести к увеличению объема костной ткани, но не влияет на ее минеральную плотность. По данным М. Shimizu и соавторов (1993), прогрессирование дегенеративных изменений суставного хряща ассоциируется с более интенсивным ремоделированием субхондральной кости и повышением ее жесткости, что также указывает на дефект клеток костной ткани при остеоартрозе. Согласно предложенной В. Lee и М. Aspden (1997) гипотезе, пролиферация дефектных костных клеток может привести к повышению жесткости костной ткани, но не вызывает повышения ее минеральной плотности.
C.I. Westacott и соавторы (1997) выдвинули гипотезу о том, что аномальные остеобласты непосредственно влияют на метаболизм хрящевой ткани. Культивируя остеобласты пациентов с остеоартрозом с хондроцитами людей, у которых не было болезней суставов, авторы наблюдали значительное изменение высвобождения гликозаминогликанов нормальной хрящевой тканью in vitro, однако уровень высвобождения цитокинов оставался неизмененным. G. Hilal и соавторы (1998) показали, что культура остеобластов субхондральной кости больных с остеоартрозом in vitro имеет измененный метаболизм - активность системы АП/плазмин и уровень ИФР-1 в этих клетках повышены. Наблюдение C.I. Westacott и соавторов (1997) можно объяснить повышением активности протеаз клетками субхондральной кости.
Остается неизвестным, инициируют ли остеоартроз изменения в субхондральной кости или способствуют его прогрессированию? D.K. Dedrick и соавторы (1993) продемонстрировали, что у собак с хирургически индуцированным остеоартрозом утолщение субхондральной кости не является необходимым условием для развития остеоартрозподобных изменений суставного хряща, однако способствует прогрессированию дегенеративных процессов в хряще. Результаты исследования A. Sa'ied и соавторов (1997) противоречат данным предыдущего исследования. Используя 50 МГц эхографию для оценки начальных морфологических изменений и их прогрессирования в суставном хряще и кости при экспериментальном остеоартрозе, индуцированном инъекциями монойодуксусной кислоты в коленный сустав крыс, авторы продемонстрировали одновременный процесс изменений в кости и хряще в течение первых трех дней после инъекции.
ТФР-b, ИФР, КМП и цитокины, продуцируемые остеобластами в субхондральной кости, могут влиять на продукцию коллагеназы и других протеолитических ферментов в хряще, что в свою очередь, может способствовать ремоделированию/деградации хрящевого матрикса. Остается неясным, вырабатывают ли остеобласты при ОА меньше макрофагального колониестимулирующего фактора (М-КСФ - стимулятор костной резорбции), чем нормальные клетки. Результаты исследований A. G. Uitterlinden и соавторов (1997) показали, что определенную роль в образовании остеофитов могут играть рецепторы витамина D, которые экспрессируются остеобластами и регулируют экспрессию ряда факторов, синтезируемых этими клетками, что частично объясняет роль остеобластов в патогенезе этого заболевания.
Учитывая результаты вышеприведенных исследований, G. Hilal и соавторы (1998), J. Martel-Pelletier и соавторы (1997) предложили следующую рабочую гипотезу взаимоотношений ремоделирования субхондральной кости и надлежащего суставного хряща при остеоартрозе. На ранней или развернутой стадии патогенеза ОА интенсифицируется процесс ремоделирования костной ткани в субхондральной кости. Одновременно повторяющаяся нагрузка ведет к локальным микропереломам и/или появлению дисбаланса системы ИФР/ИФР-связываюший белок (ИФРСБ) вследствие аномального ответа остеобластов субхондральной кости, что способствует ее склерозу. Последнее в свою очередь может способствовать появлению микропереломов надлежащего хряща и повреждению его матрикса.
В нормальных условиях это повреждение устраняется путем локального синтеза и высвобождения ИФР-1 и ИФР-связывающего белка, которые стимулируют образование ВКМ суставного хряща. В то же время ФР-система способствует росту клеток субхондральной кости и формированию костного матрикса. Анаболическая активность ИФР-системы повышена в субхондральной кости больных остеоартрозом, тогда как локальная активация системы АП/плазмин (местный регулятор ИФР-системы) в суставном хряще обусловливает его локальные изменения. В остеобластах при остеоартрозе ИФР-1 нарушает регуляцию АП плазмином по типу положительной обратной связи, следовательно, может сдерживать ремоделирование в костной ткани, что в итоге приводит к субхондральному склерозу. Таким образом, в костной и хрящевой ткани локальная индукция ИФР-1 ипротеаз ведет, с одной стороны, к повреждению хряща, с другой - к утолщению субхондральной кости, последнее в свою очередь способствует дальнейшему повреждению хряща. Дисбаланс между повреждением хряща, связанным с субхондральным склерозом, и его репаративными способностями ведет к прогрессирующему изменению ВКМ хряща и к развитию остеоартроза. По мнению авторов, эта гипотеза также объясняет медленное прогрессирование болезни.
В этой статье мы рассмотрим такую болезнь как остеоартроз, расскажем, что это такое и как его лечить, как проявляется заболевание в зависимости от место локализации, разберем какие методы терапии эффективны на сегодняшний день.
- Что такое остеоартроз?
- Причины артроза
- Классификация остеоартроза
- Эпидемиология
- Симптомы и признаки артроза
- Признаки локализованного остеоартроза
- Другие места артроза
- Диагностика
- Как лечить остеоартроз
- Фармакологическая терапия
- Физиотерапия
- Хирургическая терапия
- Профилактика и рекомендации
Что такое остеоартроз?
Артроз или остеоартроз — это болезнь суставов с хронической и прогрессирующей динамикой, которое поражает, в частности, определенные суставы, вызывая дегенеративные нарушения.
Чаще всего поражаются следующие суставы: позвоночника, тазобедренный, коленный, суставы рук и ног.
Дегенеративные нарушения затрагивают всю структуру сустава, включая хрящ, кость под суставом (субхондрально), сухожильные вставки, мышцы и связки.
Суставы представляют собой сложные системы связи между сегментами кости; они являются частью артикуляции: суставной хрящ, который покрывает костные головки, синовиальная мембрана, которая покрывает полость, синовиальная жидкость, присутствующая в полости, которая оказывает смазывающее и питательное действие, уменьшая трение и способствуя скольжению суставной капсуле, которая окружает сустав.
В суставе могут присутствовать вспомогательные структуры, такие как мениски, синовиальные сумки, сухожилия, внутри- и внекапсульные связки.
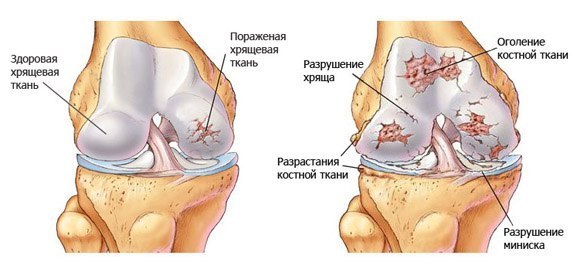
Дегенеративный процесс остеоартроза проявляется прогрессирующим ухудшением состояния суставного хряща, который организм не может восстановить, и повреждением кости с вторичной его деформацией, а также образованием наростов кости (остеофитов), которые препятствуют движению.
В субхондральной кости также имеются сферические полости с четкими краями и жидким содержимым, связывающимися с суставами (геодезами). Хрящ изнашивается настолько, что оставляет основную кость непокрытой и вызывает воспаление суставов (артрит); в результате этих повреждений капсула может выделять излишнюю жидкость, вызывая выпот и отек суставов; после воспалительных явлений суставная капсула утолщается и сковывается, что ограничивает подвижность суставов.
При артрозе могут также затрагиваться мышцы, вызывая болезненное сокращение и прогрессирующую атрофию; связки, которые обычно помогают поддерживать стабильность сустава, имеют тенденцию ослабевать.>
Причины артроза
Существует множество факторов, которые могут изменить баланс суставов и привести к развитию остеоартроза.
Классификация остеоартроза
Остеоартроз (артроз) можно разделить на:
- Первичный артроз, когда оно проявляется как изолированное заболевание, без сопутствующих болезней, на генетической основе.
- Вторичный артроз, когда возможно выявить конкретную причину, вызвавшую повреждение суставов, такую как травма, дисморфизм сустава, метаболические заболевания (например, заболевания с накоплением метаболитов в суставах).
Другая возможная классификация отличает:
Локализованный остеоартроз:
- рук (в частности, дистальные межфаланговые и запястно-пястные суставы 1-го пальца — ризартроз);
- артроз ног и коленного сустава (гонартроз);
- артроз тазобедренного сустава (коксартроз)
- позвоночного столба (особенно шейный и поясничного отдела позвоночника — спондилоартрит)
Широко распространённый остеоартроз:
- большие + малые суставы;
- малые + позвоночные суставы;
- большие + позвоночные суставы;
- малые + большие + позвоночные суставы.
Эпидемиология
Артроз в настоящее время является наиболее частым и распространенным ревматическим заболеванием, а также первой причиной инвалидности у пожилых людей.
Частота заболевания прогрессивно увеличивается с возрастом; из-за постепенного удлинения средней продолжительности жизни можно предположить, что его распространение будет расти в ближайшие десятилетия. По оценкам, в России более 5 миллионов человек страдают от симптоматического артрита, расстройства, которое является одним из случаев, когда чаще обращаются к врачу общей практики.
Эпидемиологические исследования, основанные на лучевой диагностике в Италии, показывают, что распространенность заболевания составляет около 50% среди их населения в возрасте от 15 до 79 лет, впрочем, как и во всем мире.
В частности, возможно, заболеваемость выше среди работающих мужчин в возрасте до 45 лет, в то время как после 55 лет остеоартроз поражает чаще женщин.
Артроз коленного сустава был наиболее распространенной формой, с распространенностью 26% у женщин и 12% у мужчин; 21% женщин и 16% мужчин имели остеоартроз кистей, а 14% женщин и 8% мужчин имели артроз бедра.
Эпидемиологическое исследование было проведено в Италии на 3000 субъектах старше 65 лет (1854 женщины и 1245 мужчин).
Симптомы и признаки артроза
Симптомы артроза возникают не одновременно с первыми поражениями хряща, а позже.
На ранних стадиях заболевания это выраженная боль, проявляется после интенсивной деятельности сустава; впоследствии боль также возникает при минимальных движениях или сохранении некоторых поз (например, в вертикальном положении в течение длительного периода). По мере прогрессирования заболевания боль может проявляться ночью и в покое.
Скованность суставов может быть более или менее связана с болью: это ощущение затруднения при движении пораженного сустава, особенно утром или после длительного периода бездействия, она кратковременна, обычно длиться менее 30 минут.
На поздних стадиях остеоартроза также имеется функциональное ограничение сустава, то есть затруднение выполнения движений.
Для артрозного сустава характерен хруст, который сам пациент испытывает в случае активной или пассивной мобилизации сустава; она обусловлена трением, вызванным натиранием суставных головок.
Кроме того, может наблюдаться гипотрофия и жесткость околосуставных мышц, особенно явные признаки наблюдаются в случае остеоартроза тазобедренного и коленного сустава.
Артроз тазобедренного сустава (коксартроз).

Тазобедренный сустав часто страдает от артроза, а поскольку это несущий нагрузку сустав, то вызывает частичную или полную нетрудоспособность (инвалидность).
Коксартроз чаще бывает односторонним и поражает пациентов в возрасте от 40 до 60 лет. Вторичная форма коррелирует с врожденными или приобретенными дефектами, например, врожденной дисплазией бедра или переломами, и возраст начала заболевания варьируется.
В клинической картине преобладает боль, которая возникает во время ходьбы или после долгого сидения и отступает в горизонтальном положении. Боль наблюдается в паху и/или передней части бедра; нередко боль может поражать внутреннюю сторону бедра при отдавать в колено.
Артроз коленного сустава (гонартроз).
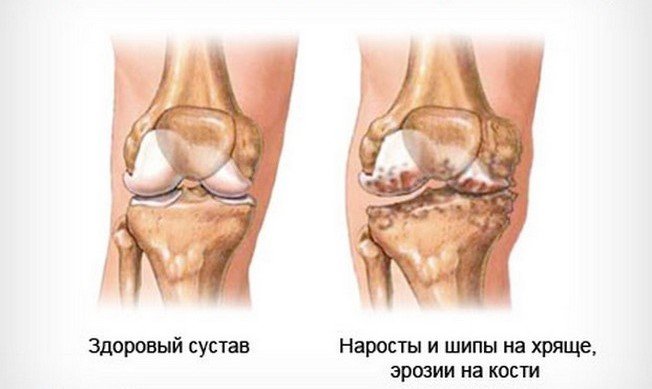
Эта локализация болезни особенно сильно сказывается на субъектах женского пола. Боль затрагивает передний или передне-медиальный сустав колено; это проявляется, в частности, при пробуждении или после периода продолжительного бездействия (длительного сидения), длиться боль недолго и отступает при движении.
Боль также может быть вызвана некоторыми особыми положениями, такими как приседание или определенные движения, такие как спуск по лестнице.
Пальпация (прощупывание) провоцирует болезненность в околосуставных областях.
На поздних стадиях заболевания боль затрагивает весь сустав и может также возникать в часы ночного отдыха.
Артроз позвоночника (спондилоартроз).
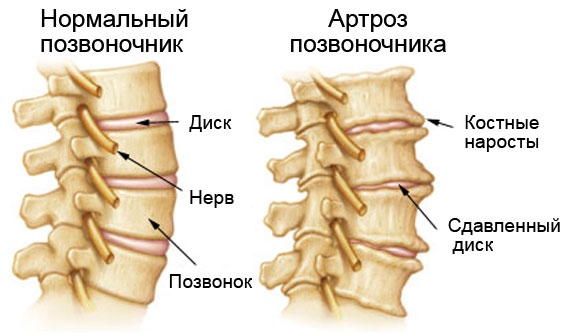
Шейный и поясничный области наиболее подвержены артрозу.
На уровне цервикального отдела сжатие, которое остеофиты оказывают на структуры, проходящие через внутрипозвоночное отверстие, вызывает боль в шее и руке, связанную с покалыванием или парестезиями (изменения чувствительности кожи). Эти расстройства возникают только с одной стороны и распространяются на область иннервации пораженного нервного корешка (чаще корешков С5, С6, С7).
Поясничный отдел также часто участвует при артрозе, вызывая люмбаго (острая боль, прострел) в пояснице; поскольку эта часть позвоночника часто участвует в контрактурах и дископатиях мышц, важно провести тщательную дифференциальную диагностику.
Артроз кистевого сустава.
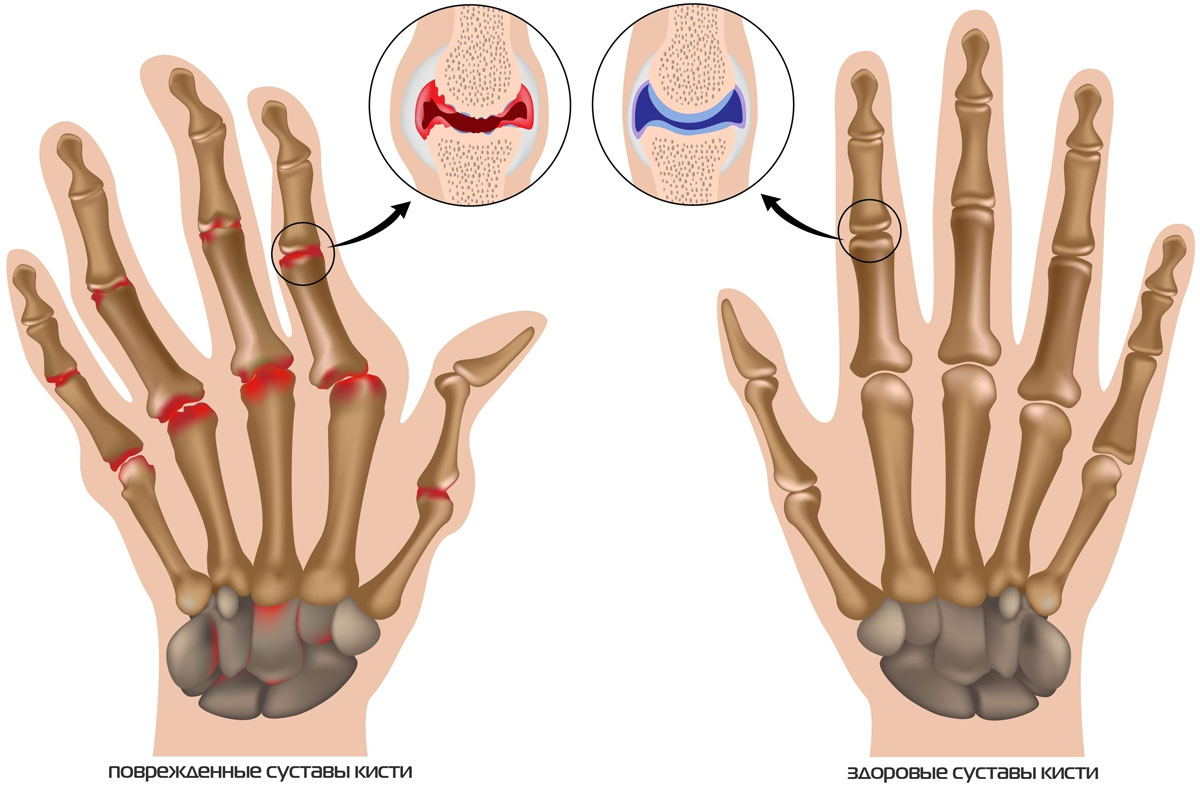
Эти суставы (особенно проксимальные межфаланговые) могут привести к деформациям, поставив под угрозу функциональность кисти. Как правило, пястно-фаланговые суставы защищены от первичного артроза, но могут пострадать в случае травматической работы или занятий спортом.
Артроз сустава большого пальца руки (ризартроз) проявляется болью в основании большого пальца; позже, по мере прогрессирования заболевания возникает опухание у основания большого пальца, прогрессирующим снижением функции захвата. Иногда требуется операция, чтобы уменьшить боль и восстановить функцию захвата.
Особой формой артроза кистей рук является эрозионный остеоартроз, который обычно поражает женщин в климактерический период. Это воспалительный вариант, часто поражающий дистальные межфаланговые суставы. Начало может быть очень болезненным; при данная форме артроза происходит быстрое и массивное разрушение суставного хряща и кости, что вызывает заметные осевые отклонения, ставящие под угрозу функциональность кисти.
Стопа также может поражаться артрозом, в частности, в первом плюсне-фаланговом суставе и вызывать значительную боль, особенно если она связана вальгусной деформацией стопы. Есть редкий артроза голеностопного сустава и локтя, вторичный по отношению к травме или трудовой деятельности.
Височно-нижнечелюстной сустав также может быть вовлечен в артротические процессы, особенно у пациентов с нарушением прикуса.
Диагностика
Врач примет к сведению признаки и симптомы заболевания, а также сбор общей и семейной истории, чтобы выявить любые факторы риска или формы вторичного остеоартроза (метаболические и эндокринные заболевания, травматизм, наследственные заболевания соединительной ткани, артрит).
Объективное обследование:
Врач смотрит на нарушение ориентации конечности, смещение, деформацию и отек суставов.
При пальпация сустава возникнет боль, в частности, давление на суставные линии; активная и пассивная мобилизация может привести к появлению трещин или даже царапин на суставах. При ходьбе можно выявить хромоту.
Анализ крови:
Особых изменений в анализах крови нет, а также показатели воспаления (скорость оседания эритроцитов, С-реактивный белок) в норме. Тем не менее, врач назначит анализы крови для выявления любых вторичных форм эндокринно-метаболических нарушений или артрита.
Обследование синовиальной жидкости:
При артроцентезе (эвакуации выпота в суставах) необходимо приступить к его анализу.
Инструментальные анализы:
Рентгенологическое исследование показывает наиболее характерные аспекты артроза:
- сужение суставов;
- склероз субхондральной кости;
- геодезии (округлые остеолитические зоны);
- остеофиты (маргинальная остеокартилагиновая пролиферация).
Ультразвук (УЗИ) позволяет морфологически изучать хрящ и выделять прерывание или неровность хондросиновиального края, остео-хрящевого края, изменение эхоструктуры хряща и уменьшение его толщины.
Остеофиты также на УЗИ проявляются в виде гиперэрогенных структур с задним теневым конусом, который изменяет регулярность суставного костного профиля.
ПЭТ и МРТ — это не плановые обследования, которые должны проводиться в соответствии с четкими инструкциями специалиста.
Как лечить остеоартроз
Врач, принимая во внимание клиническую картину пациента с артрозом, может прописать терапию, которая может быть фармакологической, нефармакологической (физиотерапия) и хирургической.

Препараты, используемые при остеоартрозе, можно разделить на симптоматические, быстродействующие, такие как анальгетики, нестероидные противовоспалительные препараты (традиционные НПВП — это анальгин, диклофенак, ибупрофен, кетопрофен, напраксен, пироксикам, мелоксикам, нимесулид) или препараты, избирательно действующие на циклооксигеназу (ЦОГ)-1, (ЦОГ)-2, либо рецептурные опиоидные анальгетики.
При выборе терапии специалисты руководствуются прежде всего критерием безопасности для здоровья пациента. Так, Амелотекс является селективным НПВС, имеющим высокий профиль безопасности. Широкая линейка разнообразных форм выпуска позволяет проводить ступенчатую терапию — быстро купировать боль с помощью инъекций, продолжая лечение в удобной для человека таблетированной форме. Амелотекс обладает высокой противовоспалительной и анальгетической эффективностью и хорошо переносится.
Такие препараты, как Кортизон или гиалуронические препараты на основе кислот, могут использоваться при локальных инфильтрациях.
При данной болезни будут полезными следующие методы физиотерапии:
- электротерапия;
- термотерапия;
- ультразвуковая терапия;
- лазеротерапия;
- тепловая терапия;
- рефлексотерапия.
Хирургия представляет собой терапевтическую помощь в случаях тяжелого и прогрессирующего артроза; применяются такие методы, как:
- корригирующие остеотомии (операция, направленная на устранение деформации или улучшение работы опорно-двигательного аппарата путем искусственного перелома кости);
- артродез (хирургическая операция, направленная на восстановление опорной способности конечности);
- эндопротезирование тазобедренного и коленного суставов;
- артроскопия коленного сустава (малотравматичная операция на коленном суставе).
Профилактика и рекомендации
Для предотвращения остеоартроза необходимо:
- физические упражнения, чтобы способствовать развитию хорошей мышечной массы вокруг сустава, избегая чрезмерной нагрузки при несоответствующих или травмирующих видах спорта;
- избегать неправильного положения суставов и неправильных поз;
- избегать игровых или спортивных занятий, которые могут вызвать травму суставов;
- проверить вес тела: хорошо известно, что снижение веса является хорошей профилактикой артроза; на самом деле, в случае избыточного веса снижение веса на 5 кг показало на 50% снижение риска развития симптоматического гонартроза.
Для предотвращения обострения заболевания у людей с артрозом, необходимо поддерживать нормальный вес тела, делать физические упражнения и растяжку. Врач может комбинировать эти меры с хондрозащитной и вязкоуправляющей терапией, чтобы ограничить ухудшение структурных повреждений.
Остеоартроз — хроническое невоспалительное заболевание суставов неизвестной этиологии, характеризующееся прогрессирующей дегенерацией суставного хряща, структурными изменениями субхондральной кости и сопутствующим реактивным синовитом
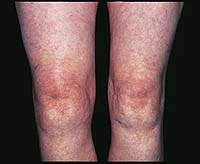 |
| Рисунок 1. Синовит (припухлость, гиперемия, локальное повышение температуры) правого коленного сустава при ОА |
При прогрессировании ОА в результате происходящих дегенеративных процессов хрящ размягчается, разрыхляется. В нем появляются трещины, простирающиеся до кости.
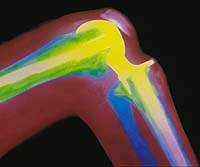 |
| Рисунок 2. Эндопротез коленного сустава. Рентгенограмма |
Особая роль в патогенезе ОА отводится синовиту, морфологически характеризующемуся умеренно выраженными пролиферативными и экссудативными реакциями (гиперплазией синовиальной оболочки и ее мононуклеарной инфильтрацией), наиболее выраженными в местах прикрепления синовии к хрящу с последующим исходом в склероз и липоматоз. В субхондральной кости выявляются микропереломы, утолщение костных трабекул и остеофитоз. Экссудативно-пролиферативные реакции как в субхондральной кости, так и в синовиальной оболочке протекают на фоне нарушений региональной гемодинамики и микроциркуляции с развитием тканевой гипоксии. В последующем прогрессирование болезни принимает, по сути, необратимый характер.
Боль, деформация и тугоподвижность сустава являются основными клиническими проявлениями ОА.
Боль в суставе — наиболее частый и выраженный симптом при ОА, носит неоднородный характер. Причинами ее могут быть деструктивные процессы в хрящевых и субхондральных структурах, нарушения микроциркуляции, особенно при затруднении венозного кровотока в спонгиозной части кости, фиброз капсулы сустава, воспалительный процесс в мягких околосуставных тканях, спазм близлежащих мышц и реактивный синовит.
В целом для заболевания характерен механический ритм болей — возникновение боли под влиянием дневной физической нагрузки и стихание за период ночного отдыха, что связано со снижением амортизационных способностей хряща и костных подхрящевых структур к нагрузкам. При этом происходит прогибание костных балок в сторону спонгиозной кости.
Возможны непрерывные тупые ночные боли, связанные с венозным стазом в субхондральной спонгиозной части кости и повышением внутрикостного давления.
Рефлекторный спазм близлежащих мышц, а также развитие реактивного синовита вызывают постоянные боли.
Реактивный синовит и воспалительный отек параартикулярных тканей усугубляют клиническую картину. При наличии синовита, помимо боли в суставе как при движении, так и в покое, характерны утреннняя скованность, припухлость сустава, локальное повышение кожной температуры. С прогрессированием заболевания рецидивы синовита учащаются.
Обычно ОА развивается медленно и начинается как моноартикулярное заболевание, но через некоторое время в патологический процесс включаются и другие суставы, чаще всего те, которые компенсаторно брали на себя повышенную механическую нагрузку, чтобы разгрузить первоначально заболевший сустав.
Клинически значимыми и инвалидизирующими формами ОА являются гонартроз и коксартроз. Клиническая картина ОА определяется конкретным суставом и группой суставов, вовлеченных в патологический процесс.
Среди неинвазивных методов диагностики гонартроза ведущее место по информативности занимает ультразвуковое двумерное сканирование коленных суставов, которое используют для объективизации и детализации характеристики вторичного синовита, являющегося прогностически неблагоприятным фактором, усугубляющим процессы дегенерации хряща. Наряду с диагностикой наличия синовиальной жидкости можно определить ее характер, особенно над bursa suprapatellaris и появлением жидкости над мыщелками бедренной кости, толщину и характер синовиальной оболочки; при этом ее утолщение при 0,4 см и более, а также контуры суставных поверхностей с учетом однородности контуров хряща на мыщелках бедренной кости и толщину хряща принимают за патологию. Ультразвуковое исследование суставов позволяет также уточнить характер и степень воспалительного процесса для выработки адекватного лечения.
Артроскопия в артрологии для диагностики воспалительных и дегенеративных заболеваний суставов, к сожалению, применяется недостаточно широко и, более того, не выявляет качественных отличий от воспаления синовии при других артритах. Существенно расширяет диагностические возможности артроскопии использование прицельной биопсии, а визуальный контроль позволяет получить фрагмент синовиальной ткани или хряща, наиболее адекватно отражающих развивающийся в суставе патологический процесс, но при этом данная процедура редко показывает распространенность патологического процесса. Артроскопия используется и с лечебной целью — с целью промывания полоски коленного сустава, при которой удаляется хрящевой детрит, а также фрагменты мениска, утолщенной и воспалительной синовии; выполняется аброзивная артропластика при гонартрозе. При коксартрозе ультразвуковое исследование отмечает, наряду с наличием и характером синовиальной жидкости, эхоуплотнение капсулы синовиальной оболочки, хрящевой губы, остеофиты. Однако следует сказать, что как ультразвуковые, так и эндоскопические признаки не могут считаться специфическими при гонартрозе и коксартрозе, поскольку они встречаются и при других заболеваниях суставов, как воспалительного, так и дегенеративного характера.
Основными целями терапии ОА являются: замедление прогрессирования дегенерации хряща и максимально возможное сохранение функции сустава. Терапевтическая тактика при ОА состоит из трех компонентов:
- механическая разгрузка пораженных суставов;
- купирование синовита;
- предотвращение прогрессирования заболевания.
Задачи, которые ставятся при составлении комплекса лечебных мероприятий, можно решать с учетом следующей шкалы приоритетов: болевой синдром, синовит, нарушение трофики суставов и местного кровотока, гипотрофия и гипотония мышц, контрактура.
Режим. Механическая разгрузка сустава является определяющим фактором как в уменьшении болевого синдрома, так и в лечении ОА в целом. Сюда входят рекомендации по исключению длительного пребывания в фиксированной позе, долгого стояния на ногах, длительной ходьбы, повторяющихся стереотипных движений, переноса больших тяжестей, ведущих к механической перегрузке определенных зон суставов. В далеко зашедших стадиях заболевания пациенту полезно ходить с тростью, костылями. При выраженных болях в фазу обострения может быть назначен полупостельный режим.
Диета. Четких патогенетических рекомендаций по диете ОА на настоящий момент не существует. Важным условием в лечении ОА коленных суставов является снижение избыточной массы тела. В последнее время рекомендуются пищевые добавки (глюкозамин, хондроитин и др.), но эффективность их требует клинических подтверждений.
В терапии ОА наиболее часто применяются обезболивающие препараты, нестероидные противовоспалительные препараты (НПВП) и средства с хондропротективными свойствами.
В терапии ОА, который сопровождается болевым и воспалительным синдромами, широко применяются НПВП. В настоящее время известно около 100 НПВП различных классов, но поиск новых лекарственных средств этой группы продолжается. Это связано с потребностью в медикаменте, имеющем оптимальное соотношение обезболивающего и противовоспалительного действия и характеризующемся высокой степенью безопасности. В этом плане большой интерес представляет появившийся на российском рынке препарат ксефокам.
Ксефокам — новый НПВП класса оксикамов.
Подобно другим НПВП, ксефокам обладает обезболивающей и противовоспалительной активностью, связанной с подавлением синтеза простагландинов посредством ингибирования циклооксигеназы (ЦОГ).
Так как большинство НПВП подавляют, как правило, и ЦОГ-1 и ЦОГ-2, то развитие гастропатий, а также нарушение функции почек и агрегации тромбоцитов являются запрограммированным фармакологическим эффектом этих препаратов.
Существует достоверная связь между приемом НПВП и развитием патологии верхних отделов ЖКТ: геморрагий, эрозий, язв в желудке (гастропатий), а также эзофагопатий и дуоденопатий, что проявляется болями или чувством тяжести в эпигастральной области, тошнотой, иногда рвотой, изжогой, дисфагией, метеоризмом, диареей и др. Возможно бессимптомное течение гастропатий, в связи с чем увеличивается риск развития таких серьезных осложнений, как кровотечение и перфорация, нередко ведущих к летальному исходу. Кроме того, длительный прием НПВП вызывает энтеропатии и колонопатии с последующим развитием железодефицитной анемии и гипоальбуминемии.
К образованию эрозий и язв приводит подавление НПВП синтеза простагландинов слизистой ЖКТ, что вызывает:
- уменьшение секреции слизистого геля;
- снижение секреции бикарбонатов;
- ухудшение кровотока в слизистой ЖКТ.
Высокий риск возникновения язв ЖКТ отмечается при продолжительной терапии НПВП, но максимален в первый месяц приема препарата. Снижение риска в дальнейшем объясняется, по-видимому, адаптационными механизмами, благодаря которым гастродуоденальная слизистая приобретает способность противостоять повреждающему действию НПВП.
Полагают, что при приеме НПВП нарушается репарация хряща и субхондральной кости за счет угнетения синтеза простагландинов, в частности в зонах микропереломов, с образованием очагов деструкции и кист. При этом, купируя болевой синдром и явления синовита, НПВП не задерживают дегенеративно-дистрофических изменений в суставных тканях пациента.
Установлено, что селективное ингибирование ЦОГ-2 оказывает незначительный эффект при острой боли. В то же время при острой боли концентрация ЦОГ-1 увеличивается в три-четыре раза, поэтому для анальгетического эффекта может иметь значение ингибирование именно этого изофермента. Таким образом, оптимальным сочетанием анальгетического и противовоспалительного эффекта обладают препараты, ингибирующие как ЦОГ-1, так и ЦОГ-2. Ксефокам является наиболее мощным ингибитором обоих изоферментов. Эта способность ксефокама в 100-200 раз превышает таковую у эталонных НПВП, например у диклофенака и пироксикама. При этом соотношение ингибиторной активности ксефокама в отношении ЦОГ-1 и ЦОГ-2 (мера селективности) занимает срединное положение по сравнению с аналогичными показателями других НПВП, что и обеспечивает баланс анальгетической и противовоспалительной активности ксефокама.
Ксефокам угнетает высвобождение свободных радикалов кислорода из активированных лейкоцитов, что усиливает его анальгетическую и противовоспалительную активность.
Обезболивающий эффект ксефокама отчасти связан с его влиянием на центральную нервную систему. Это подтверждается тем, что внутривенное введение лорноксикама (ксефокама) больным с болями в пояснице повышало уровень эндогенных морфинов при одновременном улучшении состояния. Активация системы нейропептидных опиоидов может быть одним из путей реализации анальгетического эффекта ксефокама. По анальгетическому эффекту ксефокам приравнивается к 20 мг морфина, при этом он не оказывает опиатоподобного действия на ЦНС и не вызывает лекарственной зависимости.
Исследования показали, что в терапевтических дозах ксефокам стимулирует синтез протеогликанов, предотвращая дегенерацию суставного хряща. Эта важная особенность ксефокама делает его препаратом выбора при ОА, поскольку известно, что многие НПВП, напротив, отрицательно влияют на хрящ.
Ксефокам практически весь (на 99%) связывается с белками плазмы, тем не менее он активно проникает в суставные полости, где длительное время (10-12 часов) сохраняется в достаточной терапевтической концентрации — даже когда в плазме его концентрация снижается. Это позволяет принимать препарат всего лишь два раза в день. Благодаря короткому периоду полувыведения из плазмы крови (примерно 4 часа) прием ксефокама сопровождается меньшей выраженностью побочных эффектов, так как в период между введениями доз возможно восстановление протекторных физиологических уровней простагландинов, необходимых для защиты слизистой желудка и поддержания нормального кровотока в почках.
Ксефокам полностью метаболизируется в печени, при этом одна треть его неактивных метаболитов выводится почками, а две трети — печенью и кишечником. Такой двойной путь экскреции снижает нагрузку на данные органы и улучшает переносимость ксефокама. После многократного введения ксефокама не наблюдается его кумуляция в плазме, что снижает риск побочных эффектов по сравнению с НПВП, имеющими более длительный период полувыведения. Фармакокинетика ксефокама примерно одинакова у пожилых людей и лиц молодого или зрелого возраста, поэтому не требуется какой-либо коррекции дозы препарата у пожилых.
Клинические испытания подтвердили высокую эффективность и хорошую переносимость ксефокама у больных ОА. В результате месячного приема лекарства в суточной дозе 16 мг уменьшались боль, длительность утренней скованности, улучшалась функция суставов.
К средствам, модифицирующим течение ОА, относятся препараты, в основе действия которых лежат:
- активация анаболических процессов в матриксе хряща
- подавление активности лизосомальных ферментов
- стимуляция синтетических функций хондроцитов.
Традиционно для лечения ОА использовались парентеральные гликозаминогликаны, однако в последнее время предпочтение отдается пероральным препаратам, а именно глюкозаминсульфату и хондроитинсульфату.
При некупируемом реактивном синовите показана пункция сустава, удаление синовиальной жидкости и внутрисуставное введение глюкокортикоидов, которые ингибируют синтез интерлейкина-1 и фактора некроза опухоли-α, участвующих в воспалении и деградации хряща. Широко используются при этом гидрокортизон, метипред, кеналог и дипроспан. Последние препараты характеризуются более выраженным и пролонгированным лечебным действием. Вместе с глюкокортикоидами возможно введение анестетиков (новокаина, лидокаина), действие которых при этом потенцируется. Введение ингибиторов медиаторов воспаления — контрикала (трасилола) или гордокса — благотворно влияет на метаболизм хряща.
В настоящее время рассматривается вопрос о широком внедрении в практику для подавления локального воспаления внутрисуставного введения ксефокама.
Широко применяемые для восстановительного лечения ОА физиотерапевтические методы уменьшают болевой синдром, а также воспалительные процессы и мышечный спазм, улучшают микроциркуляцию, благоприятно воздействуют на метаболические процессы в тканях сустава. При этом используются ультрафиолетовое облучение, электрические токи, переменные магнитные поля, электрофорез и фонофорез лекарственных средств на суставы. При пролиферативных явлениях, вазотрофических расстройствах и контрактурах показаны тепловые процедуры, включая аппликации парафина, озокерита, иловой и торфяной грязи. При отсутствии синовита эффективны морские, радоновые, сульфидные, бишофитные и йодобромные ванны. Для укрепления мышц рекомендуется применение электромиостимуляции.
При выполнении лечебного массажа больным ОА следует избегать механического раздражения суставной капсулы, обращая особое внимание на работу с прилегающими к суставу мышцами. Тогда снижается болевой мышечный спазм, повышается тонус ослабленных групп мышц, усиливается трофика пораженных суставов и улучшаются функциональные способности больного.
При выраженном длительном болевом синдроме, не купируемом традиционными средствами, а также при значительных нарушениях функции сустава применяется хирургическое лечение чаще всего на коленных и тазобедренных суставах. Кардинальной операцией является эндопротезирование сустава. Хорошо зарекомендовали себя эндопротезы, в которых узел скольжения состоит из пары металл–полиэтилен.
Важную роль в профилактике ОА играет выявление и своевременная ортопедическая коррекция врожденных аномалий: вывиха бедра, варусной и вальгусной установки голеней, плоскостопия и др. В профессиональной деятельности необходимо исключить длительные статические и стереотипные механические перегрузки суставов. Существенным условием профилактики ОА коленных суставов является нормализация избыточной массы тела.
Читайте также:


