Сустав морфология клиника диагностика лечение
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Согласно современным представлениям остеоартроз (ОА) – это гетерогенная группа заболеваний различной этиологии со сходными биологическими, морфологическими и клиническими проявлениями, при которых в патологический процесс вовлекаются все структуры сустава: хрящ, субхондральная кость, связки, суставная капсула, синовиальная оболочка и периартикулярные мышцы [1].
По данным статистики, в Российской Федерации распространенность ОА за последние годы возросла на 48%, а ежегодная первичная заболеваемость – более чем на 20%, что связано с глобальным старением населения [2]. ОА встречается у каждого третьего пациента в возрасте от 45 до 64 лет и у 60–70% – старше 65 лет, при этом соотношение мужчин и женщин составляет 1:3, а при ОА тазобедренных суставов – 1:7 [3]. По данным ВОЗ, ОА коленных суставов находится на 4-м месте среди основных причин нетрудоспособности у женщин и на 8-м месте у мужчин.
Различают первичный и вторичный ОА. Первичный, или идиопатический, ОА имеет 2 формы: локальную и генерализованную. Локальная форма характеризуется поражением 1-го или 2-х суставов (ОА суставов кистей, стоп, коленного, тазобедренного суставов, ОА позвоночника); для генерализованной формы (полиостеоартроз) характерно поражение 3-х и более суставов или группы суставов. Особые формы первичного генерализованного ОА – узловой и эрозивный ОА. Среди локальных форм наиболее часто встречаются ОА коленных (гонартроз) и тазобедренных (коксартроз) суставов.
Вторичный ОА развивается в результате травмы, врожденной дисплазии опорно-двигательного аппарата, эндокринных заболеваний (акромегалия, гиперпаратиреоз, сахарный диабет), метаболических нарушений (охроноз, гемохроматоз, подагра) и других заболеваний костей и суставов (ревматоидный артрит, инфекционные артриты, асептические некрозы костей).
В настоящее время ОА рассматривается как мультифакториальное заболевание, развитию которого способствуют генетические, приобретенные и внешнесредовые факторы риска (табл. 1).
Большое значение в развитии ОА придается метаболическим нарушениям. Установлено, что метаболический синдром независимо от индекса массы тела (ИМТ) повышает риск развития тяжелого гонартроза, но не коксартроза, а уровень адипокинов в крови прямо коррелирует с развитием ОА кистей [4].
В развитии ОА ключевую роль играют нарушения метаболизма хряща, воспаление и изменения субхондральной кости. Воспалительный процесс затрагивает практически все структуры сустава с формированием хондрита, синовита и остеита. Хронический воспалительный процесс в синовиальной оболочке способствует изменению метаболизма хондроцитов и нарушению баланса между анаболическими и катаболическими процессами с преобладанием последних.
В основе нарушения метаболизма хряща лежат количественные и качественные изменения протеогликанов – белково-полисахаридных комплексов, обеспечивающих стабильность структуры коллагеновой сети, которая является основой хрящевого матрикса. При ОА концентрация протеогликанов снижается. Имеют значение активация матричных протеиназ (коллагеназы, фосфолипазы А2), гиперэкспрессия провоспалительных цитокинов (интерлейкин (ИЛ) -1, фактор некроза опухоли-α) и дефицит противовоспалительных цитокинов, например, трансформирующего фактора роста-β и ингибитора плазминогена-1, которые усиливают катаболические процессы в пораженном хряще [5]. Кроме того, цитокины способны тормозить синтез ингибиторов энзимов, что приводит к увеличению активности протеаз. Избыточное накопление ферментов в матриксе хряща запускает лизосомальный путь клеточного повреждения, разрушение коллагеновых волокон II типа и деградацию протеогликановых макромолекул, что ведет к дальнейшей деградации матрикса хряща.
Один из механизмов деструктивных процессов в суставах связан с гиперэкспрессией изоформы синтетазы оксида азота (NO) – фермента, регулирующего образование NO под действием ИЛ-1. Повышение уровня NO приводит к развитию резистентности хондроцитов к действию факторов роста, что подавляет синтез компонентов хрящевого матрикса, а также индуцирует апоптоз хондроцитов. Однако в настоящее время уделяется большое внимание состоянию субхондральной кости как фактору риска и прогрессирования ОА. Большую роль в патогенезе ОА отводят супероксидным радикалам, уменьшению синтеза синовиоцитами гиалуроновой кислоты, а также гиперпродукции простагландина Е2, который стимулирует активность остеобластов и индуцирует фибропластическую дегенерацию хряща [6].
Как известно, при ОА наиболее выраженные патоморфологические изменения происходят в хрящевом матриксе. Хрящ из прочного и эластичного превращается в сухой и тусклый, с шероховатой поверхностью. Ранняя стадия ОА характеризуется набуханием и разволокнением коллагенового каркаса. Далее в хряще нарастают процессы деградации с разрушением протеогликанов протеазами, что приводит к истончению и размягчению хряща в местах максимальной нагрузки. На поздних стадиях происходит фрагментация хряща с образованием в нем вертикальных трещин. Местами хрящ обызвествляется. Растрескивание хряща приводит к его изъязвлению с обнажением подлежащей субхондральной кости и отделением фрагментов, которые поступают в полость сустава в виде детрита. При истонченном хрящевом покрове распределение давления между суставными поверхностями становится неравномерным. Это ведет к локальным перегрузкам, появлению участков остеосклероза, субхондральных кист и возникновению остеофитов [7].
Основные клинические проявления ОА – это боль, деформация и тугоподвижность суставов. Боль носит неоднородный характер и имеет разнообразные механизмы возникновения:
При наличии синовита, помимо боли в суставе, отмечаются утренняя скованность, припухлость сустава и гипертермия над ним. По мере прогрессирования заболевания рецидивы синовита учащаются. Постепенно развиваются деформация и тугоподвижность суставов за счет развития фиброзно-склеротических и гипотрофических изменений периартикулярных тканей. При прогрессировании заболевания на снижение объема движений влияют сухожильно-мышечные контрактуры, остеофиты и нарушение конгруэнтности суставных поверхностей.
К основным факторам риска прогрессирования гонартроза относят хроническую микротравматизацию хряща, возраст пациентов, ожирение, избыточную нагрузку на суставы, врожденные или приобретенные дефекты опорно-двигательного аппарата, наследственную предрасположенность (узелки Гебердена встречаются в 2 раза чаще у матерей и в 3 раза чаще у сестер больного ОА), выраженный болевой синдром, рецидивирующий синовит коленных суставов.
Диагностика ОА основывается на классификационных критериях Американской коллегии ревматологов и базируется на оценке клинических проявлений, лабораторных и рентгенологических признаков поражения суставов в зависимости от локализации процесса.
Классификационные критерии ОА суставов кистей [8]
Боль или скованность в суставах кистей при наличии не менее 3-х из 4-х критериев:
1) костные разрастания 2-х и более суставов из 10 оцениваемых*;
2) менее 2-х припухших пястно-фаланговых суставов;
3) костные разрастания, включающие 2 и более дистальных межфаланговых суставов;
4) деформация 1-го и более суставов кисти из 10-ти оцениваемых*.
Чувствительность – 94%, специфичность – 87%.
Классификационные критерии ОА тазобедренных
Боль в тазобедренном суставе в течение большинства дней предыдущего месяца и не менее 2-х из следующих 3-х критериев:
2) наличие остеофитов на рентгенограмме;
3) выявление сужения суставной щели на рентгенограмме.
Чувствительность – 89%, специфичность – 91%.
Классификационные критерии ОА коленных суставов
Боль в колене в течение большинства дней предыдущего месяца, наличие остеофитов на рентгенограмме плюс 1 из следующих 3-х критериев:
1) возраст >50 лет;
2) утренняя скованность Литература
- Клинические рекомендации. Ревматология / под ред. акад. Е.Л. Насонова. М.: ГЭОТАР-Медиа, 2011. С. 326–345.
- Фоломеева О.М., Эрдес Ш.Ф. Распространенность и социальная значимость ревматических заболеваний в Российской Федерации // Доктор (ревматология). 2007. № 10. С. 3–12.
- Arden N., Nevitt M.C. Osteoarthritis: Epidemiology // Best Practice & Research Clinical Rheumatology. 2006. Vol. 20 (1). Р. 3–25.
- Yusuf E. Metabolic factors in osteoarthritis: obese people do not walk on their hands // Arthritis Research & Therapy. 2012. Vol. 14. Р. 123.
- Goldriring M.B. The role of the chondrocyte in osteoarthritis // Arthritis Rheum. 2000. Vol. 43 (9). Р. 1916–1926.
- Mastbergen S.C., Bijlsma J.W.J., Lafeber F.P.J.G. PROTEOGLYCAN SYNTHESIS AND RELEASE OF HUMAN ARTICULAR CARTILAGE DEPEND ON DIFFERENT PATHWAYS // Ann Rheum Dis. 2006. Vol. 65. Р. 120.
- Cустав: морфология, клиника, диагностика, лечение / под ред. В.Н. Павловой, Г.Г. Павлова, Н.А. Шостак, Л.И. Слуцкого. М.: Медицинское информационное агентство, 2011. С. 374–397.
- Altman R., Alarcon G., Appelrouth D. et al. The American College of Rheumatology criteria for the classification and reporting of osteoarthritis of the hand // Arthritis Rheum. 1990. Vol. 33. Р. 1601–1610.
- Altman R., Alarcon G., Appelrouth D. et al. The American College of Rheumatology criteria for the classification and reporting of osteoarthritis of the hip // Arthr. Rheum. 1991. Vol. 34. Р. 505–514.
- Zhang W., Doherty M., Peat G. et al. EULAR evidence-based recommendations for the diagnosis of knee osteoarthritis // Ann Rheum Dis. 2010. Vol. 69 (3). Р. 483–489.
- Шостак Н.А. Остеоартроз-2013 – новые направления в лечении // Фарматека. 2013. № 7 (260). С. 17–22.
- Tan Pham, Cornea A., Blick K.E. et al. Oral Glucosamine in Doses Used to Treat Osteoarthritis Worsens Insulin Resistance // Am J Med Sci. 2007. Vol. 333 (6). Р. 333–339.
- Ronca F., Palmieri L., Panicucci P., Ronca G. Antiinflammatory activity of chondroitin sulfate // Osteoarthritis Cartilage. 1998. Vol. 6. Р. 14–21.
- Алексеева Л.И., Аникин С.Г., Зайцева Е.М. и др. Исследование эффективности, переносимости и безопасности препарата хондрогард у пациентов с остеоартрозом // Фарматека. 2013. № 7. С. 60–64.
- Пешехонова Л.К., Пешехонов Д.В. Современные тенденции патогенетической терапии остеоартроза // РМЖ. 2012. № 30. С. 1500–1503.
Только для зарегистрированных пользователей
Остеоартроз — хроническое невоспалительное заболевание суставов неизвестной этиологии, характеризующееся прогрессирующей дегенерацией суставного хряща, структурными изменениями субхондральной кости и сопутствующим реактивным синовитом
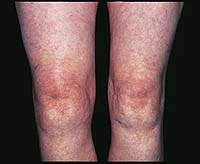 |
| Рисунок 1. Синовит (припухлость, гиперемия, локальное повышение температуры) правого коленного сустава при ОА |
При прогрессировании ОА в результате происходящих дегенеративных процессов хрящ размягчается, разрыхляется. В нем появляются трещины, простирающиеся до кости.
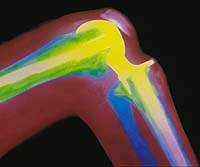 |
| Рисунок 2. Эндопротез коленного сустава. Рентгенограмма |
Особая роль в патогенезе ОА отводится синовиту, морфологически характеризующемуся умеренно выраженными пролиферативными и экссудативными реакциями (гиперплазией синовиальной оболочки и ее мононуклеарной инфильтрацией), наиболее выраженными в местах прикрепления синовии к хрящу с последующим исходом в склероз и липоматоз. В субхондральной кости выявляются микропереломы, утолщение костных трабекул и остеофитоз. Экссудативно-пролиферативные реакции как в субхондральной кости, так и в синовиальной оболочке протекают на фоне нарушений региональной гемодинамики и микроциркуляции с развитием тканевой гипоксии. В последующем прогрессирование болезни принимает, по сути, необратимый характер.
Боль, деформация и тугоподвижность сустава являются основными клиническими проявлениями ОА.
Боль в суставе — наиболее частый и выраженный симптом при ОА, носит неоднородный характер. Причинами ее могут быть деструктивные процессы в хрящевых и субхондральных структурах, нарушения микроциркуляции, особенно при затруднении венозного кровотока в спонгиозной части кости, фиброз капсулы сустава, воспалительный процесс в мягких околосуставных тканях, спазм близлежащих мышц и реактивный синовит.
В целом для заболевания характерен механический ритм болей — возникновение боли под влиянием дневной физической нагрузки и стихание за период ночного отдыха, что связано со снижением амортизационных способностей хряща и костных подхрящевых структур к нагрузкам. При этом происходит прогибание костных балок в сторону спонгиозной кости.
Возможны непрерывные тупые ночные боли, связанные с венозным стазом в субхондральной спонгиозной части кости и повышением внутрикостного давления.
Рефлекторный спазм близлежащих мышц, а также развитие реактивного синовита вызывают постоянные боли.
Реактивный синовит и воспалительный отек параартикулярных тканей усугубляют клиническую картину. При наличии синовита, помимо боли в суставе как при движении, так и в покое, характерны утреннняя скованность, припухлость сустава, локальное повышение кожной температуры. С прогрессированием заболевания рецидивы синовита учащаются.
Обычно ОА развивается медленно и начинается как моноартикулярное заболевание, но через некоторое время в патологический процесс включаются и другие суставы, чаще всего те, которые компенсаторно брали на себя повышенную механическую нагрузку, чтобы разгрузить первоначально заболевший сустав.
Клинически значимыми и инвалидизирующими формами ОА являются гонартроз и коксартроз. Клиническая картина ОА определяется конкретным суставом и группой суставов, вовлеченных в патологический процесс.
Среди неинвазивных методов диагностики гонартроза ведущее место по информативности занимает ультразвуковое двумерное сканирование коленных суставов, которое используют для объективизации и детализации характеристики вторичного синовита, являющегося прогностически неблагоприятным фактором, усугубляющим процессы дегенерации хряща. Наряду с диагностикой наличия синовиальной жидкости можно определить ее характер, особенно над bursa suprapatellaris и появлением жидкости над мыщелками бедренной кости, толщину и характер синовиальной оболочки; при этом ее утолщение при 0,4 см и более, а также контуры суставных поверхностей с учетом однородности контуров хряща на мыщелках бедренной кости и толщину хряща принимают за патологию. Ультразвуковое исследование суставов позволяет также уточнить характер и степень воспалительного процесса для выработки адекватного лечения.
Артроскопия в артрологии для диагностики воспалительных и дегенеративных заболеваний суставов, к сожалению, применяется недостаточно широко и, более того, не выявляет качественных отличий от воспаления синовии при других артритах. Существенно расширяет диагностические возможности артроскопии использование прицельной биопсии, а визуальный контроль позволяет получить фрагмент синовиальной ткани или хряща, наиболее адекватно отражающих развивающийся в суставе патологический процесс, но при этом данная процедура редко показывает распространенность патологического процесса. Артроскопия используется и с лечебной целью — с целью промывания полоски коленного сустава, при которой удаляется хрящевой детрит, а также фрагменты мениска, утолщенной и воспалительной синовии; выполняется аброзивная артропластика при гонартрозе. При коксартрозе ультразвуковое исследование отмечает, наряду с наличием и характером синовиальной жидкости, эхоуплотнение капсулы синовиальной оболочки, хрящевой губы, остеофиты. Однако следует сказать, что как ультразвуковые, так и эндоскопические признаки не могут считаться специфическими при гонартрозе и коксартрозе, поскольку они встречаются и при других заболеваниях суставов, как воспалительного, так и дегенеративного характера.
Основными целями терапии ОА являются: замедление прогрессирования дегенерации хряща и максимально возможное сохранение функции сустава. Терапевтическая тактика при ОА состоит из трех компонентов:
- механическая разгрузка пораженных суставов;
- купирование синовита;
- предотвращение прогрессирования заболевания.
Задачи, которые ставятся при составлении комплекса лечебных мероприятий, можно решать с учетом следующей шкалы приоритетов: болевой синдром, синовит, нарушение трофики суставов и местного кровотока, гипотрофия и гипотония мышц, контрактура.
Режим. Механическая разгрузка сустава является определяющим фактором как в уменьшении болевого синдрома, так и в лечении ОА в целом. Сюда входят рекомендации по исключению длительного пребывания в фиксированной позе, долгого стояния на ногах, длительной ходьбы, повторяющихся стереотипных движений, переноса больших тяжестей, ведущих к механической перегрузке определенных зон суставов. В далеко зашедших стадиях заболевания пациенту полезно ходить с тростью, костылями. При выраженных болях в фазу обострения может быть назначен полупостельный режим.
Диета. Четких патогенетических рекомендаций по диете ОА на настоящий момент не существует. Важным условием в лечении ОА коленных суставов является снижение избыточной массы тела. В последнее время рекомендуются пищевые добавки (глюкозамин, хондроитин и др.), но эффективность их требует клинических подтверждений.
В терапии ОА наиболее часто применяются обезболивающие препараты, нестероидные противовоспалительные препараты (НПВП) и средства с хондропротективными свойствами.
В терапии ОА, который сопровождается болевым и воспалительным синдромами, широко применяются НПВП. В настоящее время известно около 100 НПВП различных классов, но поиск новых лекарственных средств этой группы продолжается. Это связано с потребностью в медикаменте, имеющем оптимальное соотношение обезболивающего и противовоспалительного действия и характеризующемся высокой степенью безопасности. В этом плане большой интерес представляет появившийся на российском рынке препарат ксефокам.
Ксефокам — новый НПВП класса оксикамов.
Подобно другим НПВП, ксефокам обладает обезболивающей и противовоспалительной активностью, связанной с подавлением синтеза простагландинов посредством ингибирования циклооксигеназы (ЦОГ).
Так как большинство НПВП подавляют, как правило, и ЦОГ-1 и ЦОГ-2, то развитие гастропатий, а также нарушение функции почек и агрегации тромбоцитов являются запрограммированным фармакологическим эффектом этих препаратов.
Существует достоверная связь между приемом НПВП и развитием патологии верхних отделов ЖКТ: геморрагий, эрозий, язв в желудке (гастропатий), а также эзофагопатий и дуоденопатий, что проявляется болями или чувством тяжести в эпигастральной области, тошнотой, иногда рвотой, изжогой, дисфагией, метеоризмом, диареей и др. Возможно бессимптомное течение гастропатий, в связи с чем увеличивается риск развития таких серьезных осложнений, как кровотечение и перфорация, нередко ведущих к летальному исходу. Кроме того, длительный прием НПВП вызывает энтеропатии и колонопатии с последующим развитием железодефицитной анемии и гипоальбуминемии.
К образованию эрозий и язв приводит подавление НПВП синтеза простагландинов слизистой ЖКТ, что вызывает:
- уменьшение секреции слизистого геля;
- снижение секреции бикарбонатов;
- ухудшение кровотока в слизистой ЖКТ.
Высокий риск возникновения язв ЖКТ отмечается при продолжительной терапии НПВП, но максимален в первый месяц приема препарата. Снижение риска в дальнейшем объясняется, по-видимому, адаптационными механизмами, благодаря которым гастродуоденальная слизистая приобретает способность противостоять повреждающему действию НПВП.
Полагают, что при приеме НПВП нарушается репарация хряща и субхондральной кости за счет угнетения синтеза простагландинов, в частности в зонах микропереломов, с образованием очагов деструкции и кист. При этом, купируя болевой синдром и явления синовита, НПВП не задерживают дегенеративно-дистрофических изменений в суставных тканях пациента.
Установлено, что селективное ингибирование ЦОГ-2 оказывает незначительный эффект при острой боли. В то же время при острой боли концентрация ЦОГ-1 увеличивается в три-четыре раза, поэтому для анальгетического эффекта может иметь значение ингибирование именно этого изофермента. Таким образом, оптимальным сочетанием анальгетического и противовоспалительного эффекта обладают препараты, ингибирующие как ЦОГ-1, так и ЦОГ-2. Ксефокам является наиболее мощным ингибитором обоих изоферментов. Эта способность ксефокама в 100-200 раз превышает таковую у эталонных НПВП, например у диклофенака и пироксикама. При этом соотношение ингибиторной активности ксефокама в отношении ЦОГ-1 и ЦОГ-2 (мера селективности) занимает срединное положение по сравнению с аналогичными показателями других НПВП, что и обеспечивает баланс анальгетической и противовоспалительной активности ксефокама.
Ксефокам угнетает высвобождение свободных радикалов кислорода из активированных лейкоцитов, что усиливает его анальгетическую и противовоспалительную активность.
Обезболивающий эффект ксефокама отчасти связан с его влиянием на центральную нервную систему. Это подтверждается тем, что внутривенное введение лорноксикама (ксефокама) больным с болями в пояснице повышало уровень эндогенных морфинов при одновременном улучшении состояния. Активация системы нейропептидных опиоидов может быть одним из путей реализации анальгетического эффекта ксефокама. По анальгетическому эффекту ксефокам приравнивается к 20 мг морфина, при этом он не оказывает опиатоподобного действия на ЦНС и не вызывает лекарственной зависимости.
Исследования показали, что в терапевтических дозах ксефокам стимулирует синтез протеогликанов, предотвращая дегенерацию суставного хряща. Эта важная особенность ксефокама делает его препаратом выбора при ОА, поскольку известно, что многие НПВП, напротив, отрицательно влияют на хрящ.
Ксефокам практически весь (на 99%) связывается с белками плазмы, тем не менее он активно проникает в суставные полости, где длительное время (10-12 часов) сохраняется в достаточной терапевтической концентрации — даже когда в плазме его концентрация снижается. Это позволяет принимать препарат всего лишь два раза в день. Благодаря короткому периоду полувыведения из плазмы крови (примерно 4 часа) прием ксефокама сопровождается меньшей выраженностью побочных эффектов, так как в период между введениями доз возможно восстановление протекторных физиологических уровней простагландинов, необходимых для защиты слизистой желудка и поддержания нормального кровотока в почках.
Ксефокам полностью метаболизируется в печени, при этом одна треть его неактивных метаболитов выводится почками, а две трети — печенью и кишечником. Такой двойной путь экскреции снижает нагрузку на данные органы и улучшает переносимость ксефокама. После многократного введения ксефокама не наблюдается его кумуляция в плазме, что снижает риск побочных эффектов по сравнению с НПВП, имеющими более длительный период полувыведения. Фармакокинетика ксефокама примерно одинакова у пожилых людей и лиц молодого или зрелого возраста, поэтому не требуется какой-либо коррекции дозы препарата у пожилых.
Клинические испытания подтвердили высокую эффективность и хорошую переносимость ксефокама у больных ОА. В результате месячного приема лекарства в суточной дозе 16 мг уменьшались боль, длительность утренней скованности, улучшалась функция суставов.
К средствам, модифицирующим течение ОА, относятся препараты, в основе действия которых лежат:
- активация анаболических процессов в матриксе хряща
- подавление активности лизосомальных ферментов
- стимуляция синтетических функций хондроцитов.
Традиционно для лечения ОА использовались парентеральные гликозаминогликаны, однако в последнее время предпочтение отдается пероральным препаратам, а именно глюкозаминсульфату и хондроитинсульфату.
При некупируемом реактивном синовите показана пункция сустава, удаление синовиальной жидкости и внутрисуставное введение глюкокортикоидов, которые ингибируют синтез интерлейкина-1 и фактора некроза опухоли-α, участвующих в воспалении и деградации хряща. Широко используются при этом гидрокортизон, метипред, кеналог и дипроспан. Последние препараты характеризуются более выраженным и пролонгированным лечебным действием. Вместе с глюкокортикоидами возможно введение анестетиков (новокаина, лидокаина), действие которых при этом потенцируется. Введение ингибиторов медиаторов воспаления — контрикала (трасилола) или гордокса — благотворно влияет на метаболизм хряща.
В настоящее время рассматривается вопрос о широком внедрении в практику для подавления локального воспаления внутрисуставного введения ксефокама.
Широко применяемые для восстановительного лечения ОА физиотерапевтические методы уменьшают болевой синдром, а также воспалительные процессы и мышечный спазм, улучшают микроциркуляцию, благоприятно воздействуют на метаболические процессы в тканях сустава. При этом используются ультрафиолетовое облучение, электрические токи, переменные магнитные поля, электрофорез и фонофорез лекарственных средств на суставы. При пролиферативных явлениях, вазотрофических расстройствах и контрактурах показаны тепловые процедуры, включая аппликации парафина, озокерита, иловой и торфяной грязи. При отсутствии синовита эффективны морские, радоновые, сульфидные, бишофитные и йодобромные ванны. Для укрепления мышц рекомендуется применение электромиостимуляции.
При выполнении лечебного массажа больным ОА следует избегать механического раздражения суставной капсулы, обращая особое внимание на работу с прилегающими к суставу мышцами. Тогда снижается болевой мышечный спазм, повышается тонус ослабленных групп мышц, усиливается трофика пораженных суставов и улучшаются функциональные способности больного.
При выраженном длительном болевом синдроме, не купируемом традиционными средствами, а также при значительных нарушениях функции сустава применяется хирургическое лечение чаще всего на коленных и тазобедренных суставах. Кардинальной операцией является эндопротезирование сустава. Хорошо зарекомендовали себя эндопротезы, в которых узел скольжения состоит из пары металл–полиэтилен.
Важную роль в профилактике ОА играет выявление и своевременная ортопедическая коррекция врожденных аномалий: вывиха бедра, варусной и вальгусной установки голеней, плоскостопия и др. В профессиональной деятельности необходимо исключить длительные статические и стереотипные механические перегрузки суставов. Существенным условием профилактики ОА коленных суставов является нормализация избыточной массы тела.
Согласно современным представлениям остеоартроз (ОА) – это гетерогенная группа заболеваний различной этиологии со сходными биологическими, морфологическими и клиническими проявлениями, при которых в патологический процесс вовлекаются все структуры сустава: хрящ, субхондральная кость, связки, суставная капсула, синовиальная оболочка и периартикулярные мышцы [1].
По данным статистики, в Российской Федерации распространенность ОА за последние годы возросла на 48%, а ежегодная первичная заболеваемость – более чем на 20%, что связано с глобальным старением населения [2]. ОА встречается у каждого третьего пациента в возрасте от 45 до 64 лет и у 60–70% – старше 65 лет, при этом соотношение мужчин и женщин составляет 1:3, а при ОА тазобедренных суставов – 1:7 [3]. По данным ВОЗ, ОА коленных суставов находится на 4-м месте среди основных причин нетрудоспособности у женщин и на 8-м месте у мужчин.
Классификация
Различают первичный и вторичный ОА. Первичный, или идиопатический, ОА имеет 2 формы: локальную и генерализованную. Локальная форма характеризуется поражением 1-го или 2-х суставов (ОА суставов кистей, стоп, коленного, тазобедренного суставов, ОА позвоночника); для генерализованной формы (полиостеоартроз) характерно поражение 3-х и более суставов или группы суставов. Особые формы первичного генерализованного ОА – узловой и эрозивный ОА. Среди локальных форм наиболее часто встречаются ОА коленных (гонартроз) и тазобедренных (коксартроз) суставов.
Вторичный ОА развивается в результате травмы, врожденной дисплазии опорно-двигательного аппарата, эндокринных заболеваний (акромегалия, гиперпаратиреоз, сахарный диабет), метаболических нарушений (охроноз, гемохроматоз, подагра) и других заболеваний костей и суставов (ревматоидный артрит, инфекционные артриты, асептические некрозы костей).
Факторы риска
В настоящее время ОА рассматривается как мультифакториальное заболевание, развитию которого способствуют генетические, приобретенные и внешнесредовые факторы риска (табл. 1).
Таблица 1. Факторы риска ОА
| Генетические | Женский пол, дефекты (синдром Стиклера) и мутации (COL2A1) гена коллагена II типа, этническая принадлежность, другая наследственная патология костей и суставов |
| Приобретенные | Пожилой возраст, избыточная масса тела, снижение уровня женских половых гормонов, нарушения развития или приобретенные заболевания костей и суставов, хирургическое вмешательство на суставах |
| Факторы внешней среды | Профессиональные особенности и физические нагрузки на суставы, травма суставов, занятия спортом |
Большое значение в развитии ОА придается метаболическим нарушениям. Установлено, что метаболический синдром независимо от индекса массы тела (ИМТ) повышает риск развития тяжелого гонартроза, но не коксартроза, а уровень адипокинов в крови прямо коррелирует с развитием ОА кистей [4].
Патогенез
В развитии ОА ключевую роль играют нарушения метаболизма хряща, воспаление и изменения субхондральной кости. Воспалительный процесс затрагивает практически все структуры сустава с формированием хондрита, синовита и остеита. Хронический воспалительный процесс в синовиальной оболочке способствует изменению метаболизма хондроцитов и нарушению баланса между анаболическими и катаболическими процессами с преобладанием последних.
В основе нарушения метаболизма хряща лежат количественные и качественные изменения протеогликанов – белково-полисахаридных комплексов, обеспечивающих стабильность структуры коллагеновой сети, которая является основой хрящевого матрикса. При ОА концентрация протеогликанов снижается. Имеют значение активация матричных протеиназ (коллагеназы, фосфолипазы А2), гиперэкспрессия провоспалительных цитокинов (интерлейкин (ИЛ) -1, фактор некроза опухоли-α) и дефицит противовоспалительных цитокинов, например, трансформирующего фактора роста-β и ингибитора плазминогена-1, которые усиливают катаболические процессы в пораженном хряще [5]. Кроме того, цитокины способны тормозить синтез ингибиторов энзимов, что приводит к увеличению активности протеаз. Избыточное накопление ферментов в матриксе хряща запускает лизосомальный путь клеточного повреждения, разрушение коллагеновых волокон II типа и деградацию протеогликановых макромолекул, что ведет к дальнейшей деградации матрикса хряща.
Один из механизмов деструктивных процессов в суставах связан с гиперэкспрессией изоформы синтетазы оксида азота (NO) – фермента, регулирующего образование NO под действием ИЛ-1. Повышение уровня NO приводит к развитию резистентности хондроцитов к действию факторов роста, что подавляет синтез компонентов хрящевого матрикса, а также индуцирует апоптоз хондроцитов. Однако в настоящее время уделяется большое внимание состоянию субхондральной кости как фактору риска и прогрессирования ОА. Большую роль в патогенезе ОА отводят супероксидным радикалам, уменьшению синтеза синовиоцитами гиалуроновой кислоты, а также гиперпродукции простагландина Е2, который стимулирует активность остеобластов и индуцирует фибропластическую дегенерацию хряща [6].
Состояние хряща при ОА
Как известно, при ОА наиболее выраженные патоморфологические изменения происходят в хрящевом матриксе. Хрящ из прочного и эластичного превращается в сухой и тусклый с шероховатой поверхностью. Ранняя стадия ОА характеризуется набуханием и разволокнением коллагенового каркаса. Далее в хряще нарастают процессы деградации с разрушением протеогликанов протеазами, что приводит к истончению и размягчению хряща в местах максимальной нагрузки. На поздних стадиях происходит фрагментация хряща с образованием в нем вертикальных трещин. Местами хрящ обызвествляется. Растрескивание хряща приводит к его изъязвлению с обнажением подлежащей субхондральной кости и отделением фрагментов, которые поступают в полость сустава в виде детрита. При истонченном хрящевом покрове распределение давления между суставными поверхностями становится неравномерным. Это ведет к локальным перегрузкам, появлению участков остеосклероза, субхондральных кист и возникновению остеофитов [7].
Клиника
Основные клинические проявления ОА – это боль, деформация и тугоподвижность суставов. Боль носит неоднородный характер и имеет разнообразные механизмы возникновения:
При наличии синовита, помимо боли в суставе, отмечаются утренняя скованность, припухлость сустава и гипертермия над ним. По мере прогрессирования заболевания рецидивы синовита учащаются. Постепенно развиваются деформация и тугоподвижность суставов за счет развития фиброзно-склеротических и гипотрофических изменений периартикулярных тканей. При прогрессировании заболевания на снижение объема движений влияют сухожильно-мышечные контрактуры, остеофиты и нарушение конгруэнтности суставных поверхностей.
К основным факторам риска прогрессирования гонартроза относят хроническую микротравматизацию хряща, возраст пациентов, ожирение, избыточную нагрузку на суставы, врожденные или приобретенные дефекты опорно-двигательного аппарата, наследственную предрасположенность (узелки Гебердена встречаются в 2 раза чаще у матерей и в 3 раза чаще у сестер больного ОА), выраженный болевой синдром, рецидивирующий синовит коленных суставов.
Диагностика
Диагностика ОА основывается на классификационных критериях Американской коллегии ревматологов и базируется на оценке клинических проявлений, лабораторных и рентгенологических признаков поражения суставов в зависимости от локализации процесса.
Классификационные критерии ОА суставов кистей [8]
Боль или скованность в суставах кистей при наличии не менее 3-х из 4-х критериев:
1) костные разрастания 2-х и более суставов из 10 оцениваемых*;
2) менее 2-х припухших пястно-фаланговых суставов;
3) костные разрастания, включающие 2 и более дистальных межфаланговых суставов;
4) деформация 1-го и более суставов кисти из 10-ти оцениваемых*
* Второй и третий дистальные межфаланговые суставы, второй и третий проксимальные межфаланговые суставы и первый запястно-пястный сустав обеих кистей.
Чувствительность – 94%, специфичность – 87%.
Классификационные критерии ОА тазобедренных суставов [9]
Боль в тазобедренном суставе в течение большинства дней предыдущего месяца и не менее 2-х из следующих 3-х критериев:
1) СОЭ >20 мм/ч;
2) наличие остеофитов на рентгенограмме;
3) выявление сужения суставной щели на рентгенограмме.
Чувствительность – 89%, специфичность – 91%.
Классификационные критерии ОА коленных суставов
Боль в колене в течение большинства дней предыдущего месяца, наличие остеофитов на рентгенограмме плюс 1 из следующих 3-х критериев:
1) возраст >50 лет;
2) утренняя скованность 3) крепитация при активном движении. Чувствительность критериев – 91%, специфичность – 86%.
В соответствии с последними рекомендациями EULAR (2010) для диагностики ОА коленного сустава рекомендуется учитывать следующие критерии [10]:
Лечение
Комплексное лечение ОА на современном этапе требует комбинированного использования нефармакологических, фармакологических и, при необходимости, хирургических методов.
Немедикаментозная терапия включает обучение больных в ревмошколе, физические нагрузки (аэробные, плавание), коррекцию массы тела, применение специальных приспособлений, ортезов (наколенников, ортопедических стелек и др.). В качестве дополнительных методов терапии используют физиотерапию, иглорефлексотерапию, массаж, бальнеотерапию (сульфидные, радоновые ванны и т. д.).
Фармакотерапия включает применение симптоматических препаратов быстрого действия (анальгетиков, например парацетамола, нестероидных противовоспалительных препаратов (НПВП)) и симптоматических препаратов замедленного действия (СПЗД).
Для лечения ОА активно используют локальные (топические) средства, такие как НПВП, капсаицин, а также внутрисуставное введение глюкокортикоидов при развитии реактивного синовита.
В качестве анальгетического средства при слабом и умеренном болевом синдроме назначается парацетамол в суточной дозе до 4 г/сут, даже при отсутствии признаков воспаления. НПВП более эффективны, чем парацетамол, и показаны при ОА в случае его неэффективности, а также при наличии признаков воспаления. При назначении НПВП необходимо тщательно оценивать кардиоваскулярные и гастроинтестинальные факторы риска. Опиоидные анальгетики (трамадол) применяются коротким курсом при неэффективности и/или плохой переносимости НПВП: в первые дни – по 50 мг/сут с постепенным увеличением дозы до 200–300 мг/сут [1].
СПЗД (хондроитин сульфат (ХС) и глюкозамин) являются базисной терапией ОА, позволяющей замедлить прогрессирование заболевания. Данный эффект объясняется тем, что СПЗД способны стимулировать синтез хрящевого матрикса, тем самым угнетая его деструкцию. Показано, что адекватное количество ХС в хрящевой ткани жизненно необходимо для поддержания регенерации хрящевых поверхностей суставов при их повреждении. ХС – естественный глюкозамингликан, который расположен в экстрацеллюлярном матриксе суставного хряща, способен ингибировать свободные радикалы, угнетать активность ферментов, вызывающих поражение хрящевой ткани, а также участвовать в синтезе глюкозаминогликанов и увеличивать продукцию внутрисуставной жидкости.
Препаратом выбора для лечения ОА считается ХС, который по уровню безопасности вошел в пятерку препаратов, рекомендованных Европейской антиревматической лигой (EULAR, 2008). ХС отнесен к группе болезнь-модифицирующих препаратов для лечения ОА как препарат с потенциальным структурно-модифицирующим действием. В эту же группу включены и препараты, находящиеся на стадии доклинических исследований: ингибиторы аггреканазы, ликофенол (ингибитор циклооксигеназы (ЦОГ) и липооксигеназы-5), ЦОГ-2 ингибиторы, ингибитор синтетазы NO, ингибитор митоген-активирующего протеина, ингибиторы металлопротеиназ (матриксные металлопротеиназы (ММР), в т. ч. тканевый ингибитор MMP), стронция ранелат [11]. В свете недавно появившихся работ по возможному отрицательному влиянию глюкозамина на инсулинорезистентность [12] использование ХС является более предпочтительным у больных диабетической остеоартропатией.
В настоящее время в терапии ОА используют различные лекарственные формы ХС. Широкое применение нашел препарат Хондрогард, представляющий собой раствор ХС натрия для в/м применения. Хондрогард, как и другие препараты ХС, подавляет активность ферментов, вызывающих деградацию суставного хряща, стимулирует выработку хондроцитами протеогликанов, усиливает метаболические процессы в хряще и субхондральной кости.
Преимуществом в/м введения препарата ХС является быстрое всасывание в системный кровоток с накоплением в синовиальной жидкости через 15 мин, а в хрящевой ткани – через 30 мин. Максимальная концентрация ХС в суставном хряще достигается через 48 ч [13]. Кроме того, в/м способ введения ХС увеличивает биодоступность и долю нативных молекул в системном кровотоке, что приводит к повышению эффективности проводимой терапии и более быстрому развитию симптоматического эффекта [14].
Применяется Хондрогард в/м, по 100 мг через сутки. При хорошей переносимости с 4-й инъекции разовую дозу увеличивают до 200 мг. Курс лечения – 25–30 инъекций, повторный курс – через 6 мес. С осторожностью следует применять при склонности к кровоточивости, тромбофлебитах. Возможно усиление действия непрямых антикоагулянтов, антиагрегантов, фибринолитиков, что требует более частого контроля показателей свертываемости крови при совместном применении.
В ряде исследований были продемонстрированы высокая эффективность и безопасность препарата Хондрогард у больных с клинически выраженным гонартрозом и коксартрозом [14, 15]. На фоне лечения было выявлено значимое уменьшение боли, скованности, функциональной недостаточности суставов, а также индекса WOMAC [14]. Из побочных проявлений отмечены небольшие гематомы в месте введения препарата у 8 (11%) пациентов, кожный зуд и папулезная сыпь – у 4 (6%), болезненные уплотнения в месте инъекции – у 2 (3%); чувство жара после инъекции – у 1 (1%); тошнота, диарея – у 1 (1%) пациента [14]. Серьезные нежелательные явления отсутствовали. Ни в одном из проведенных клинических исследований не было выявлено каких-либо значимых побочных эффектов Хондрогарда, в т. ч. и при длительном применении.
Таким образом, новый отечественный препарат Хондрогард является доступным, эффективным и безопасным средством для базисной терапии больных ОА, в т. ч. с сопутствующими нарушениями углеводного обмена. Своевременное назначение препарата позволит улучшить ближайшие и отдаленные исходы, замедлить прогрессирование болезни.
Читайте также:


