Тест-система для диагностики аденовирусной инфекции
На: Тест для выявления аденовируса в респираторных выделениях
Краткая информация
Аденовирус размножается в эпителиальных клетках верхних дыхательных путей, слизистой оболочки глаз, вызывая респираторные заболевания. Также аденовирус может быть причиной других заболеваний: гастроэнтерит, конъюктивит, цистит, сыпь, в зависимости от типа аденовируса, вызвавшего инфицирование. Симптомы респираторного заболевания, вызванного аденовирусом, могут развиваться от синдромов обычной простуды до сильного кашля, бронхита и пневмонии. Пациенты с ослабленной иммунной системой особенно подвержены тяжелым осложнениям от инфицирования аденовирусом. Различные типы аденовируса передаются через прямой контакт, фекально-оральным путем и через воду. Инкубационный период 6-9 дней.
Принцип метода
Определение основано на принципе иммунохроматографического анализа. Анализируемый образец жидкого биологического материала абсорбируется поглощающим участком тест-полоски. При наличии в образце респираторного аденовируса он вступает в реакцию с нанесенными на стартовую зону специфическими моноклональными антителами против респираторного аденовируса, меченными окрашенными частицами, и продолжает движение с током жидкости. В аналитической зоне тест-полоски происходит взаимодействие со специфическими моноклональными антителами против респираторного аденовируса, иммобилизованными на поверхности мембраны, с образованием окрашенных иммунных комплексов.
В контрольной зоне тест-полоски специфический окрашенный иммунный комплекс образуется независимо от наличия в тестируемом биологическом материале респираторного аденовируса.
В том случае, если в анализируемом образце присутствует респираторный аденовирус, на тест-полоске образуются две параллельные окрашенные линии (синяя аналитическая, обозначенная буквой Т, и зеленая контрольная, обозначенная буквой С), что указывает на положительный результат анализа. В случае отсутствия в анализируемом образце респираторного аденовируса на тест-полоске образуется одна зеленая контрольная линия (С), что указывает на отрицательный результат анализа.
Состав
Кассеты с тест-полосками и одноразовые пластиковые пипетки упакованы в индивидуальные вакуумные упаковки из фольги алюминиевой, содержащие пакетики с силикагелем.
Необходимые оборудование и материалы, не входящие в состав набора
- одноразовые резиновые или пластиковые перчатки;
- часы или таймер.
Аналитические характеристики
Меры предосторожности
При проведении определения следует надевать одноразовые резиновые или пластиковые перчатки, т.к. исследуемые образцы биологического материала следует рассматривать как потенциально инфицированные.
Использованные тесты и остатки биологического материала должны быть помещены в специальный контейнер для санитарных отходов.
Анализируемые образцы
Свежесобранный биологический материал (респираторные выделения из носовой полости человека), не содержащий консерванты.
Образцы респираторных выделений из носовой полости до определения можно хранить при температуре 2–4°С не более 8 ч.
Перед анализом образцы респираторных выделений должны быть доведены до комнатной температуры.
Подготовка образцов
1. Ввести стерильный ватный тампон на зонде приблизительно на 3 см в одну ноздрю и, вращая его, взять мазок со стенок носового хода (рис. 1-1).
2. Внести в одноразовую пластиковую пробирку из флакона с крышкой-капельницей 15 капель буфера для растворения образца (рис. 1-2).
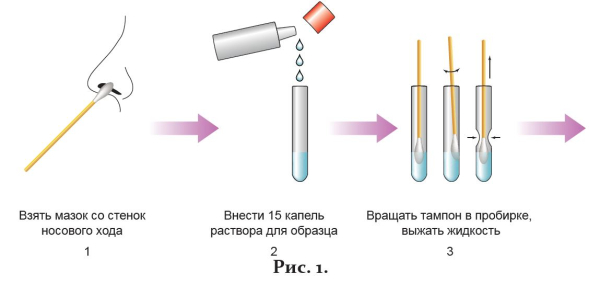
3. Поместить тампон с образцом в пробирку. Смыть образец, вращая тампон по стенкам пробирки минимум 10 раз. Выдавить жидкость из тампона, сдавливая его стенками пробирки (рис. 1-3). Выбросить тампон.
Проведение анализа
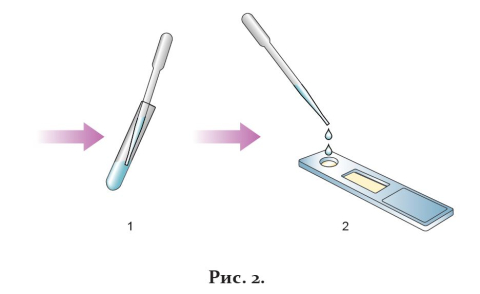
5. С помощью одноразовой пластиковой пипетки внести 4 капли (примерно 100 мкл) жидкого образца в круглое окошко кассеты, обозначенное буквой S (рис. 2).
6. Через 10 мин визуально оценить результат реакции.
Интерпретация результатов
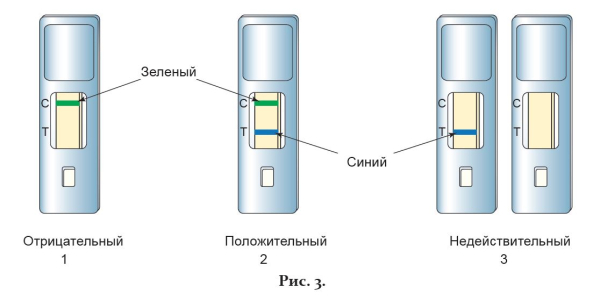
Выявление в тестовом окошке кассеты одной зеленой контрольной линии (С) свидетельствует об отрицательном результате анализа, т.е. указывает на отсутствие в анализируемом образце респираторных выделений респираторного аденовируса (рис. 3-1).
Выявление в тестовом окошке кассеты двух параллельных окрашенных линий (зеленой и синей) свидетельствует о положительном результате анализа, т.е. указывает на наличие в анализируемом образце респираторных выделений респираторного аденовируса (рис. 3-2). Интенсивность синей аналитической линии (Т) в тестовом окошке кассеты может меняться в зависимости от концентрации респираторного аденовируса в образце.
Условия хранения и эксплуатации
Аннотация научной статьи по фундаментальной медицине, автор научной работы — Амосова Ирина Викторовна, Соминина А. А., Смирнова Т. Д., Суховецкая В. Ф., Бузицкая Ж. В.
Похожие темы научных работ по фундаментальной медицине , автор научной работы — Амосова Ирина Викторовна, Соминина А. А., Смирнова Т. Д., Суховецкая В. Ф., Бузицкая Ж. В.
New monoclonal kits for the diagnosis of the adenoviral infection
Diagnostic properties of new monoclonal antibodies (MAbs) to hexon adenovirus antigen (AB) monoclonal ELISA kit for early diagnosis of adenoviral infection were tested. Developed ELISA kit and FITC-conjugate of new monoclonal antibodies for immunofluorescent analysis were used for detection of different types of adenoviruses in clinical materials. The availability of their use in clinical and epidemiological practice was validated.
• эффективность детекции ВКЭ обоими методами не зависит от пола, вида и степени насыщенности зараженного клеща;
• метод ИФА менее чувствительный, чем ПЦР-РВ;
• отмечена зависимость чувствительности ИФА от субтипа ВКЭ;
Исследования, представленные в работе, поддержаны грантом РФФИ № 14-04-31716-мол_а.
2. Kozlovskaya L.I., Osolodkin D.I., Shevtsova A.S., Romanova L.Iu., Rogova Y.V., Dzhivanian T.I. et al. GAG-binding variants of tickborne encephalitis virus. Virology. 2010; 398: 262-72.
3. Romanova L.Iu., Gmyl A.P., Dzhivanian T.I., Bakhmutov D.V., Lukashev A.N., Gmyl L.V. et al. Microevolution of tick-borne encephalitis virus in course of host alternation. Virology. 2007; 362: 75-84.
4. Belova O.A., Burenkova L.A., Karganova G.G. Different tick-borne encephalitis virus (TBEV) prevalences in unfed versus partially en-
gorged ixodid ticks - Evidence of virus replication and changes in tick behavior. Ticks Tick Borne Dis. 2012; 3(4): 240-6.
5. Белова О.А., Козловская Л.И., Романова Л.Ю., Шевцова А.С., Буренкова Л.А. Сравнительный анализ эффективности различных методов заражения иксодовых клещей вирусом клещевого энцефалита. В кн.: Медицинская вирусология. Труды ИПВЭ им. М.П. Чумакова РАМН. М.; 2008; т. 25: 47-52.
2. Kozlovskaya L.I., Osolodkin D.I., Shevtsova A.S., Romanova L.Iu., Rogova Y.V., Dzhivanian T.I. et al. GAG-binding variants of tickborne encephalitis virus. Virology. 2010; 398: 262-72.
3. Romanova L.Iu., Gmyl A.P., Dzhivanian T.I., Bakhmutov D.V., Lukashev A.N., Gmyl L.V. et al. Microevolution of tick-borne encephalitis virus in course of host alternation. Virology. 2007; 362: 75-84.
4. Belova O.A., Burenkova L.A., Karganova G.G. Different tick-borne encephalitis virus (TBEV) prevalences in unfed versus partially engorged ixodid ticks - Evidence of virus replication and changes in tick behavior. Ticks Tick Borne Dis. 2012; 3: 240-6.
5. Belova O.A., Kozlovskaya L.I., Romanova L.Yu., Shevtsova A.S., Burenkova L.A. Comparative analysis of the effectiveness of different ixodid ticks' infection methods with TBEV. In: Meditsinskaya virusologiya: Trudy IPVE imeni M.P. Chumakova. Moscow; 2008; vol. 25: 47-52. (in Russian)
В ПОМОЩЬ ВИРУСОЛОГУ
АмосоваИ.В., Соминина А.А., Смирнова Т.Д., СуховецкаяВ.Ф., БузицкаяЖ.В., Войцеховская Е.М.,
Новые моноклональные тест-системы для диагностики
Ключевые слова: аденовирус; моноклональные антитела; диагностические тест-системы.
New monoclonal kits for the diagnosis of the adenoviral infection
Amosova I. V., Sominina A. A., Smirnova T. D., Sukhovetskaya V. F., Buzitskaya Zh. V., Voitsehovskaya E. M.,| Sirotkin A. K. |
Research Institute of Influenza, Ministry of Health of the Russian Federation, 197376, St. Petersburg, Russia
Diagnostic properties of new monoclonal antibodies (MAbs) to hexon adenovirus antigen (AB) monoclonal ELisA kit for early diagnosis of adenoviral infection were tested. developed ELIsA kit and FiTc-conjugate of new monoclonal antibodies for immunofluorescent analysis were used for detection of different types of adenoviruses in clinical materials. The availability of their use in clinical and epidemiological practice was validated.
Key words: adenovirus; monoclonal antibodies; diagnostic kits.
Аденовирусы (АВ) представляют собой обширное семейство вирусов (Adenoviridae), патогенных для человека, млекопитающих и птиц. По своей распространенности они занимают третье место после гриппа и респираторно-синцитиальной инфекции. В отличие от эпидемий гриппа, имеющих выраженную сезонность, АВ-инфекции регистрируются на протяжении всего года, вызывая подъем уровня заболеваемости в основном среди детских групп населения [1, 2]. АВ провоцируют тяжелые поражения не только верхних, но и нижних отделов дыхательного тракта в виде пневмоний, бронхитов и бронхиолитов, являются причиной вспышек кератоконъюнктивитов и нозокомиальных заболеваний. Они являются также причиной лимфоаденопатий, острых и хронических тонзиллитов, отитов, фарингитов, протекающих с явлениями интоксикации и гипертермии, поражений печени и миокарда. Отдельные серотипы (31, 40, 41) АВ вызывают вспышки гастроэнтеритов [3]. Тяжелое генерализованное течение АВ-инфекций нередко развивается у пациентов с иммуносупрессией, которым осуществляется трансплантация органов или костного мозга [4]. Создание современных средств химиотерапии определяет необходимость разработки эффективных средств ранней диагностики АВ-инфекции. При создании высокоспецифичных иммунологических тестов, как правило, используют антивирусные моноклональные антитела (МКА), способные обеспечить необходимый уровень стандартизации полученных препаратов [5].
Материалы и методы
Клеточные культуры и вирусы. В работе использовали АВ серотипов 3, 4, 6, 7, 14, 19 и 21. Для контроля специфичности реагирования полученных МКА использовали вирусы гриппа А и В, парагриппа и респираторно-синцитиальный вирус (РСВ), а также лизаты клеток HeLa. Накопление биомассы вирусов, очистку и концентрацию вирусов проводили ультрацентрифугированием в градиенте плотности сахарозы согласно [6].
Гексонный антиген (ГА) АВ. АВ 6-го типа осаждали из осветленной вируссодержащей жидкости одновременным добавлением 10% раствора сернокислой меди и 10% раствора бикарбоната натрия. Очистку от солей производили с помощью гель-фильтрации с использованием сефадекса G-25 (Sigma, США). Полученный раствор антигена диализовали против 0,5 моль/л ацетатного буфера (рН 4,6), после чего переносили в колбу и оставляли при температуре 4°С на 2 нед до образования кристаллов ГА в форме тетраэдров, отчетливо видимых при малом увеличении микроскопа (х100).
Выделение аденовирусов в культуре клеток. Для изоляции АВ использовали культуры клеток Hep2 и Vero, которые на 1-2-е сутки роста в среде Игла с добавлением 5% фетальной сыворотки инфицировали материалами от больных ОРВИ, взятыми не позднее 4 сут от начала заболевания. Зараженные клеточные культуры инкубировали при 36±1°С. Образцы ежедневно просматривали в течение 2 нед для выявления цитопатического эффекта с еженедельной заменой поддерживающей среды. Серотип изолята определяли в реакции нейтрализации с использованием типоспецифических сывороток к АВ.
Иммуноферментный анализ (ИФА). Для определения специфической активности МКА и их пероксидазных конъ-югатов (МКА-ПХ) планшеты сенсибилизировали очищенными вирусными концентратами АВ 3, 6 и 21-го типов, а также ГА в концентрации 2,5-5 мкг/мл. Для контроля специфичности взаимодействия использовали лизат нормальных,
не инфицированных клеток HeLa и гетерологичные вирусы (грипп, парагрипп, РСВ). Исследуемые МКА (или МКА-ПХ) разводили в 0,01 М ФСБ-Т (рН 7,2) с 10"1 до 10"7 и вносили по 100 мкл в планшеты, трижды отмытые от несвязавшегося антигена с помощью ФСБ-Т, содержащего 5% желатина. По завершении инкубации (2 ч для МКА и 45 мин для МКА-ПХ при 37°С) и отмывания ФСБ-Т в лунки вносили по 100 мкл 3,3',5,5'-тетраметилбензидина в концентрации 0,1 мг/мл на ацетат-цитратном буфере (рН 5,5), содержащем 0,005 % Н2О2. Реакцию останавливали через 10-15 мин добавлением 50 мкл 1М H2SO4. Результаты ИФА учитывали на иммуно-ферментном анализаторе фирмы Anthos (Австрия) при длине волны 450 нм. Титром антител считали последнее разведение, при котором сигнал ОП 450 МКА в 2,5 раза превышал ОП 450 контрольных образцов (ФСБ-Т).
Для индикации вирусных антигенов и определения лимита чувствительности иммуноферментных тест-систем (ИФТС) планшеты сенсибилизировали МКА, разведенными на 0,01 М карбонатно-бикарбонатном буфере (рН 9,5) до концентрации (2,5-5 мкг/мл). После инкубации 18 ч при 4°С в отмытые планшеты вносили разведения исследуемых вирусов, контрольные образцы или материалы от больных. После инкубации в течение ночи при 4°С и 4-кратного отмывания ФСБ-Т связанные вирусные антигены выявляли с помощью МКА-ПХ.
Электронно-микроскопический (ЭМ) анализ. В работе использовали метод просвечивающей электронной микроскопии (микроскоп JEM-10-11, Япония).
Подготовка клинических образцов. Взятие носоглоточных мазков и подготовку препаратов для МИФ проводили согласно [10], образцы фекалий подготавливали, как описано [11].
Определение чувствительности и специфичности разработанных тест-систем. Оценку показателей качества разработанных препаратов проводили в сравнении с методами выделения вируса в культуре клеток, МИФ, ПЦР, а также определяли прирост специфических антител в сыворотках переболевших с помощью ИФА. Расчет показателей чувствительности и специфичности проводили, как описано [12].
Характеристика МКА к гексонному антигену АВ. С учетом имеющихся литературных данных о высоком консерватизме ГА АВ, общего для разных подродов АВ [13], этот антиген избрали в качестве иммуногена при получении МКА. В работе использовали гибридных мышей линии SJL/J, у которых отмечают ослабленный контроль экспансии В-лимфоцитов, что предполагает синтез более широкого репертуара антител, чем у животных других инбредных линий [14].
Для иммунизации мышей в целях получения гибридом использовали кристаллический ГА АВ 6-го типа, который содержал антигенные детерминанты, общие для разных серо-типов аденовирусов. В результате слияния клеток миеломы мышей Рх8Ag.653 с иммунными спленоцитами и их последующего клонирования отобрали семь стабильных клонов гибридом (№ 2, 3, 6, 9, 10, 11, 14), секретирующих антитела к ГА. По показателям специфической активности, оцененной в ИФА и МИФ, из панели МКА для последующих работ по
результатами других методов)
Группа обследованных с симптомами ОРВИ Кол-во обследованных больных Частота выявления, % Диагностические параметры ИФТС "Аденовир" в сравнении с результатами комплекса методов, %*
ИФТС "Аденовир" МИФ чувствительность | специфичность
Госпитализированные взрослые Госпитализированные дети Вспышка ОРВИ
Примечание. * - МИФ, выделение вирусов в культуре клеток, ИФТС-IgG-АД.
конструированию диагностических тест-систем выбрали МКА 6, которые выгодно отличались от других МКА более широким спектром реагирования в отношении различных серотипов АВ (типы 3, 6, 14, 19, 21), а также высоким уровнем специфической активности в ИФА (титр -10-6) и МИФ (титр в непрямом МИФ 10-3).
Специфическую направленность МКА 6 и МКА 7F1 оценивали в конкурентном ИФА. При исследовании систем МКА 6 - конъюгат ПХ-МКА 7F1 и МКА 7F1 - конъюгат ПХ-МКА 6 показано, что немеченые МКА 6 не влияли на связывание с антигеном конъюгатов ПХ-МКА 7F1, а реакцию конъюгатов ПХ-МКА 6 не подавляли МКА 7F1, т.е. они имели разную эпитопную направленность. Показано, что МКА 6 не обладали перекрестной реактивностью с другими возбудителями ОРВИ (вирусами гриппа А и В, РС-вирусом, парагриппа) и антигенами клеток хозяина, хорошо выдерживали процедуры конъюгации с пероксидазой хрена и ФИТЦ, а также лио-филизации.
Характеристика спектра реагирования препарата ФИТЦ-МКА 6. Опытные серии ФИТЦ-конъюгатов МКА 6 исследовали на модели клеточных культур, зараженных АВ 6, 3 и 21-го серотипов, а также клеточных культур, инфицированных материалами от больных, среди которых выявлены современные штаммы АВ 2 типа и эпидемически значимых 3, 4 и 7-го типов, принадлежащих, как известно, к различным группам АВ (В, С, Е). Все перечисленные се-ротипы АВ выявляли при окраске ФИТЦ-МКА 6 в виде яркой флюоресценции в ядрах и цитоплазме инфицированных клеток. Клинико-лабораторную апробацию ФИТЦ-МКА 6 провели в сравнении с поликлональным препаратом ИДФАГ (ООО ППДП, Санкт-Петербург) с использованием клинических материалов от 120 детей, госпитализированных по поводу ОРВИ. Чувствительность и специфичность МИФ при использовании ФИТЦ-МКА 6 в сравнении с препаратом ИДФАГ составили 96,7 и 90% соответственно, общее совпадение результатов 95%.
Актуальность простых и быстрых тестов лабораторной диагностики АВ-заболеваний определяется необходимостью назначения ранней этиотропной противовирусной терапии и профилактики АВ-инфекций. Разработка современных диагностических подходов осуществляется по двум основным направлениям, первое из которых связано с совершенствованием иммунологических тестов детекции вирусных антигенов или антител, а другое - с выявлением специфических последовательностей вирусного генома в материале от больных. К перспективным иммунологическим тестам относятся ИФА и МИФ, базирующиеся на использовании высокоспецифичной и стандартизованной реагентики моноклонально-го типа [3].
Разработаны моноклональные тест-системы для диагностики АВ-инфекций, базирующиеся на использовании им-мунофлюоресцентного анализа и ИФА, которые обладали достаточно высокой чувствительностью и специфичностью, сопоставимой с зарубежными аналогами.
Достоинством разработанных МКА и тест-систем на их основе оказалась возможность выявления АВ, принадлежащих к различным подгруппам семейства Adenoviridae.
1. Амосова И.В. Разработка и усовершенствование средств и методов иммунодиагностики аденовирусной инфекции: Автореф. дисс. . канд. биол. наук. СПб; 2009.
2. Соминина А.А., Киселев О.И., Маринич И.Г., Карпова Л.С., Смородинцева Е.А., Коновалова Н.И. и др. Этиологический мониторинг за гриппом и другими ОРЗ в России в сезон 2003-2004 годов. Эпидемиология и вакцинопрофилактика. 2004; 6: 5-11.
3. Киселев О.И., Жилинская И.Н., ред. Вопросы общей вирусологии: учебное пособие. СПб: СПбГМА им. И.И. Мечникова; 2007.
4. Zheng X. Identification of adenoviruses in specimens from high-risk pediatric stem cell transplant recipients and controls. J. Clin. Microbiol. 2008; 46: 317-20.
5. Qijek C., Gulen F. Comparison of the assay with the combination of shell vial cell culture and immunofluorescence antibody test for the detection of respiratory viruses. J. Virol. Methods. 2007; 143: 161-8.
6. Монаенков А.О., Сологуб В.К., Соминина А.А., Амосова И.В., Липина Н.В., Милькинт К.К. и др. Получение и характеристика моноклональных антител к аденовирусу в иммуноферментных и иммунофлуоресцентных реакциях. Вопросы вирусологии. 2000; 5: 30-3.
7. Фридляндская И.И. Получение моноклональных антител (гибри-домная клеточная технология): сборник научных трудов. Л.; 1988.
8. Nakane P.K., Kawaoi A. Peroxidase labeled antibody. A new method of conjugation. J. Histochem. Cytochem. 1974; 22: 1084-91.
9. Mc Kinney P.M. Fluorecein diacetate as a reference color standard fluorescent antibody stadies. Anal. Biochem. 1964; 9 (4): 474-6.
10. Соминина А.А., Милькинт К.К., Амосова И.В. Быстрая диагностика гриппа и других ОРВИ иммунофлуоресцентным методом: методические рекомендации. СПб: ГУ НИИ гриппа РАМН; 2006.
11. Doane F.W. Electron microscopy for the detection of gastroenteritis viruses. In: Kapikian A.Z., ed. Viral infections of the gastrointestinal tract. 2nd ed New York: Marcel Dekker; 1994: 101-30.
12. Chomel J.J., Remilleux M.F., Marchand P., Aymard M. Rapid diagnosis of influenza A. Comparison with ELISA immunocapture and culture. J. Virol. Methods. 1992; 37: 337-44.
13. Echavarria M. Adenoviruses in immunocompromised hosts. Clin. Microbiol. 2008; 21: 704-15.
14. Климович В.Б. Моноклональные антитела против иммуноглобулинов человека: Автореф. дисс. . д-ра мед. наук. СПб; 1996.
1. Amosova I.V. Development andimprovement of means andmethods of immunoassay adenovirusinfection [Razrabotka i usovershenstvovanie sredstv i metodov immunodiagnostiki adenovirusnoy infektsii]. Diss. boil. sci. St Petersburg; 2009. (in Russian)
2. Sominina A.A., Kiselev O.I., Marinich I.G., Karpova L.S., Smorodintseva E.A., Konovalova N.I. et al. Etiological monitoring of influenza and other acute respiratory infections in Russia in 20032004 season. Epidemiologiya i vaktsinoprofilaktika. 2004; 6: 5-11. (in Russian)
3. Kiselev O.I., Zhilinskaya I.N., ed. Questions of general virology: a training manual (Voprosy obshchey virusologii: uchebnoe posobie). St Petersburg: SPbGMA im. I.I. Mechnikova; 2007. (in Russian)
4. Zheng X. Identification of adenoviruses in specimens from high-risk pediatric stem cell transplant recipients and controls. J. Clin. Microbiol. 2008; 46: 317-20.
5. Qijek C., Gulen F. Comparison of the assay with the combination of shell vial cell culture and immunofluorescence antibody test for the detection of respiratory viruses. J. Virol. Methods. 2007; 143: 161-8.
6. Monaenkov A.O., Sologub V.K., Sominina A.A., Amosova I.V., Lipina N.V., Mil'kint K.K. et al. Preparation and characterization of monoclonal antibodies to adenovirus in immunoassays and immunofluorescence reactions. Voprosy virusologii. 2000; 5: 30-3. (in Russian)
7. Fridlyandskaya I.I. Preparation of monoclonal antibody (hybridoma cell technology) [Polychenie monoklonal'nykh antitel (gibridomnaya kletochnaya tekhnologiya]. Leningrad; 1988. (in Russian)
8. Nakane P.K., Kawaoi A. Peroxidase labeled antibody. A new method of conjugation. J. Histochem. Cytochem. 1974; 22: 1084-91.
9. Mc Kinney P.M. Fluorecein diacetate as a reference color standard fluorescent antibody stadies. Anal. Biochem. 1964; 9 (4): 474-6.
10. Sominina A.A., Mil'kint K.K., Amosova I.V. Rapid diagnosis of influenza and other acute respiratory viral infection by immunofluo-rescence: methodological recommendations [Bystraya diagnostika grippa i drugikh ORVI immynofluorectsentnym metodom: metodi-cheskie rekomendatsii]. St Petersburg: GU NII grippa RAMN; 2006. (in Russian)
11. Doane F.W. Electron microscopy for the detection of gastroenteritis viruses. In: Kapikian A.Z. ed Viral infections of the gastrointestinal tract. 2nd ed New York: Marcel Dekker; 1994: 101-30.
12. Chomel J.J., Remilleux M.F., Marchand P., Aymard M. Rapid diagnosis of influenza A. Comparison with ELISA immunocapture and culture. J. Virol. Methods. 1992; 37: 337-44.
13. Echavarria M. Adenoviruses in immunocompromised hosts. Clin. Microbiol. 2008; 21: 704-15.
14. Klimovich V.B. Monoclonal antibodies against human immunoglobulins [Monoklonal'nye antitela protiv immunoglobulinov]. Diss. St Petersburg; 1996. (in Russian)
Подписные индексы на журнал "Вопросы вирусологии"
Индекс 71416 Индекс 27875
для индивидуальных подписчиков, для индивидуальных подписчиков,
предприятий и организаций предприятий и организаций
| Стоимость услуги: | 860 руб.* 1720 руб. Заказать Срочно |
Условия подготовки определяются лечащим врачом.
Нельзя собирать кал из памперсов, после клизмы, после введения ректальных свечей или приема медикаментов, влияющих на перистальтику кишечника, с примесями мочи или выделений из половых органов.
Кал собирается после естественной дефекации на чистый лист бумаги или в чистую ёмкость (ёмкость предварительно вымыть с мылом, обдать кипятком, и высушить). Нельзя отбирать пробу из унитаза. Испражнения собираются специальной лопаточкой из разных мест, вмонтированной в крышку контейнера, в объёме примерно с грецкий орех.
Для исследований предпочтительно использовать утреннюю порцию фекалий. Следует избегать попадания кусочков непереваренной пищи и мочи. Крышку контейнера плотно закрутить.
Доставка в лабораторию в день взятия биоматериала.
Метод исследования: иммунохроматографический экспресс-тест.
Аденовирусы (Adenovirus) из семейства Аденовирусов (Adenoviridae) занимает второе место после ротавирусов, как причина появления острой диареи. Заболеть могут не только маленькие дети от 6 месяцев до 5 лет, но и взрослые. Больной человек, выделяющий вирусные частицы с носовой и носоглоточной слизью, является источником инфекции во время разгара, в более поздние сроки заболевания вирус выделяется с фекалиями. Вирусоносители принимают меньшее участие в распространении болезни. Заражение преимущественно происходит воздушно-капельным путем, фекально-оральным путем заражается небольшой процент людей. Известно более 90 сероваров вируса, этиологическое значение имеют только вызывающие инфекционное поражение глаз, органов дыхания, ЖКТ. Аденовирусная инфекция имеет выраженный полиморфизм клинических симптомов. Типичным проявлением является конъюнктивит с односторонним поражением, увеличение лимфатических узлов. Интоксикация и лихорадка протекают длительно, температура повышается до 38-39 °С и держится от 5 до 7 дней. Стул становиться водянистым, частота достигает 5-7 раз в сутки, может отмечаться рвота в первые дни заболевания. В острый период течение вирусных инфекций имеет сходную клиническую картину, на основании которой трудно провести дифференциальную диагностику между гастроэнтеритами (энтеритами), вызванными аденовирусами, ротавирусами, норовирусами, пациентов всегда необходимо проверять на наличие нескольких патогенов.
Чувствительность и специфичность.
- Специфичность >99%;
- Чувствительность >90%.
Показания к исследованию
- первичная диагностика инфекции, особенно среди детей с наличием диарейного синдрома;
- скрининговое исследование в местах вспышек ОКИ;
- обследование взрослых с диарейным синдромом.
Интерпретация результатов
Пример результата (вариант нормы):
| Параметр | Референсные значения |
|---|---|
| Аденовирус (Adenovirus), качественное определение антигена (иммунохроматографический экспресс-метод) | Не обнаружено |
Интерпретация проводится врачом с учетом клинических проявлений.
" ["serv_cost"]=> string(3) "860" ["cito_price"]=> string(4) "1720" ["parent"]=> string(2) "25" [10]=> string(1) "1" ["limit"]=> NULL ["bmats"]=> array(1) < [0]=>array(3) < ["cito"]=>string(1) "Y" ["own_bmat"]=> string(2) "12" ["name"]=> string(6) "Кал" > > >
| Тип | В офисе |
|---|---|
| Кал |
Условия подготовки определяются лечащим врачом.
Нельзя собирать кал из памперсов, после клизмы, после введения ректальных свечей или приема медикаментов, влияющих на перистальтику кишечника, с примесями мочи или выделений из половых органов.
Кал собирается после естественной дефекации на чистый лист бумаги или в чистую ёмкость (ёмкость предварительно вымыть с мылом, обдать кипятком, и высушить). Нельзя отбирать пробу из унитаза. Испражнения собираются специальной лопаточкой из разных мест, вмонтированной в крышку контейнера, в объёме примерно с грецкий орех.
Для исследований предпочтительно использовать утреннюю порцию фекалий. Следует избегать попадания кусочков непереваренной пищи и мочи. Крышку контейнера плотно закрутить.
Доставка в лабораторию в день взятия биоматериала.
Метод исследования: иммунохроматографический экспресс-тест.
Аденовирусы (Adenovirus) из семейства Аденовирусов (Adenoviridae) занимает второе место после ротавирусов, как причина появления острой диареи. Заболеть могут не только маленькие дети от 6 месяцев до 5 лет, но и взрослые. Больной человек, выделяющий вирусные частицы с носовой и носоглоточной слизью, является источником инфекции во время разгара, в более поздние сроки заболевания вирус выделяется с фекалиями. Вирусоносители принимают меньшее участие в распространении болезни. Заражение преимущественно происходит воздушно-капельным путем, фекально-оральным путем заражается небольшой процент людей. Известно более 90 сероваров вируса, этиологическое значение имеют только вызывающие инфекционное поражение глаз, органов дыхания, ЖКТ. Аденовирусная инфекция имеет выраженный полиморфизм клинических симптомов. Типичным проявлением является конъюнктивит с односторонним поражением, увеличение лимфатических узлов. Интоксикация и лихорадка протекают длительно, температура повышается до 38-39 °С и держится от 5 до 7 дней. Стул становиться водянистым, частота достигает 5-7 раз в сутки, может отмечаться рвота в первые дни заболевания. В острый период течение вирусных инфекций имеет сходную клиническую картину, на основании которой трудно провести дифференциальную диагностику между гастроэнтеритами (энтеритами), вызванными аденовирусами, ротавирусами, норовирусами, пациентов всегда необходимо проверять на наличие нескольких патогенов.
Чувствительность и специфичность.
- Специфичность >99%;
- Чувствительность >90%.
Показания к исследованию
- первичная диагностика инфекции, особенно среди детей с наличием диарейного синдрома;
- скрининговое исследование в местах вспышек ОКИ;
- обследование взрослых с диарейным синдромом.
Интерпретация результатов
Пример результата (вариант нормы):
| Параметр | Референсные значения |
|---|---|
| Аденовирус (Adenovirus), качественное определение антигена (иммунохроматографический экспресс-метод) | Не обнаружено |
Интерпретация проводится врачом с учетом клинических проявлений.
Продолжая использовать наш сайт, вы даете согласие на обработку файлов cookie, пользовательских данных (сведения о местоположении; тип и версия ОС; тип и версия Браузера; тип устройства и разрешение его экрана; источник откуда пришел на сайт пользователь; с какого сайта или по какой рекламе; язык ОС и Браузера; какие страницы открывает и на какие кнопки нажимает пользователь; ip-адрес) в целях функционирования сайта, проведения ретаргетинга и проведения статистических исследований и обзоров. Если вы не хотите, чтобы ваши данные обрабатывались, покиньте сайт.
Copyright ФБУН Центральный НИИ Эпидемиологии Роспотребнадзора, 1998 - 2020

! Продолжая использовать наш сайт, вы даете согласие на обработку файлов cookie, пользовательских данных (сведения о местоположении; тип и версия ОС; тип и версия Браузера; тип устройства и разрешение его экрана; источник откуда пришел на сайт пользователь; с какого сайта или по какой рекламе; язык ОС и Браузера; какие страницы открывает и на какие кнопки нажимает пользователь; ip-адрес) в целях функционирования сайта, проведения ретаргетинга и проведения статистических исследований и обзоров. Если вы не хотите, чтобы ваши данные обрабатывались, покиньте сайт.
Читайте также:
- Ботулизм реферат инфекционные болезни
- Лекарство от инфекции гепатита с
- Памятка для родителей клещевой энцефалит в детском саду
- Глазные капли от инфекции глаз для детей
- Презентация грипп и другие инфекции


