Ворошилова м к энтеровирусные инфекции человека
Понятие, классификация и состав энтеровирусов. Способы проникновения вируса в организм и заболевания им вызываемые. Типы возбудителей полиомиелита. Принципы лабораторной диагностики энтеровирусов. Препараты для специфической профилактики полиомиелита.
| Рубрика | Биология и естествознание |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 18.02.2012 |
1. Общая характеристика энтеровирусов
2. Принципы лабораторной диагностики энтеровирусов
3. Препараты для специфической профилактики полиомиелита
Список использованной литературы
Это семейство вирусов включает в себя пять родов: риновирусы (rhinovirus) - возбудители обычной простуды; кардиовирусы (cardiovirus) - возбудители энцефаломиокардита; афтовирусы (apthovirus) - возбудители ящура; гепатовирусы (hepatovirus) - возбудители Гепатита А и, собственно, энтеровирусы (enterovirus).
1. Общая характеристика энтеровирусов
Энтеровирусы - это маленькие (20-30 нм в диаметре, 1 нм = 10-9м) двадцатигранные вирусы, не имеющие мембранной оболочки с одной спиралью РНК, способные довольно длительное время выживать в сточных водах и даже в хлорированной воде. Это довольно большая группа вирусов, которые обнаруживаются не только у человека, но и выделяются от разных животных (обезьян, свиней, птиц и др.). При этом надо заметить, что вирусы, способные поражать человека не обнаруживаются у животных-носителей Григорьева Л.В. Энтеровирусы во внешней среде. - М.: Медицина, 1968. - С.217-256..
Точный состав группы энтеровирусов, способных вызывать заболевание у человека, постоянно уточняется за счет вновь открываемых представителей. энтеровирус профилактика полиомиелит
Классификация энтеровирусов неоднократно подвергалась пересмотру. Так, ранее в эту группу относили вирус гепатита А, но позднее он был исключен из нее в силу значительных генетических отличий. На данный момент известно не менее 67 серологических типов, поделенных на четыре группы: полиовирусы (poliovirus) - вирусы полиомиелита; вирусы Коксаки А и В (Сoxsackie A и B), названные так по имени города в штате Нью-Йорк (США), где были впервые обнаружены; вирусы ЕСНО (echovirus) и прочие (в основном недавно открытые) энтеровирусы.
От других вирусов семейства Picornaviridae энтеровирусы отличаются более высокой устойчивостью к кислой среде - они сохраняют способность вызывать инфекцию при рН от 3 до 10. Энтеровирусы вообще отличаются довольно высокой устойчивостью. Так, полиовирусы в фекалиях, на овощах, в молоке выживают до 3-4 мес.
Энтеровирусы довольно быстро погибают при температурах свыше 500 С ( при 600 С - за 6-8 мин., при 650 С - за 2,5 мин., при 800 С - за 0,5 мин., при 1000 С - мгновенно). И это при том, что при температуре 370 С вирус сохраняет жизнеспособность в течение 50-65 дней. Энтеровирусы устойчивы к моющим средствам (детергентам), но инактивируются по воздействием обычных дезинфекантов, ультрафиолетового излучения. Не переносят высушивания.
Энтеровирусы способны вызывать у человека целый ряд заболеваний, объединяемых общим термином энтеровирусные инфекции. Наиболее подвержены энтеровирусным инфекциям дети.
Самым тяжелым из энтеровирусных заболеваний, несомненно, является полиомиелит (возбудитель - полиовирус). Болеют им, как правило, дети, хотя известны и исключения. Заболевание полиомиелитом может протекать очень тяжело с довольно высокой смертностью, сопровождаясь парезами и даже параличами различных групп мышц, что даже у выздоровевших пациентов часто приводит к инвалидности. Вирус был открыт в 1945 году. Существует 3 возбудителя полиомиелита Грачёв В.П. Полиомиелит. В кн. Эволюция инфекционных болезней в России в ХХ веке. - М.: Медицина, 2003. - С.63-83. :
1. Серотип Брунгинда;
2. Серотип Лансинга;
Серотип Брунгинда отличается наибольшей нейровирулентностью, наиболее патогенен для человека и в эксперименте для обезьян, выделяется в 80% случаях полиомиелита, чаще всего дает паралитические формы (1 случай на 1 на 100-1000 бессимптомных форм). Серотип Лансинга менее нейровирулентен, патогенен для человека, и в эксперименте для хлопковых крыс, и вызывает 1 острый случай на 1000-10000 бессимптомных форм. Серотип Леон наименее вирулентен, встречается реже всех, патогенен для человека и обезьян. Вирусы устойчивы во внешней среде и действию различных неблагоприятных факторов: устойчивы ко всем известным антибиотиками, химиопрепаратам, выдерживают действие 70% спирта, 5% лизола, поэтому их относят к самым устойчивым вирусам.
Инкубационный период 7-14 дней. Полиомиелит - очень высококонтагиозное заболевание, источник - больной человек бессимптомной формой, основной путь передачи - фекально-оральный. У больного паралитической формой полиомиелита в 1 грамме фекалий содержится 1 млн. инфицирующих доз для обезьян. Фекально-оральный путь передачи является основным в странах с высоко развитой санитарной обстановкой. В странах с высокоразвитой санитарной культурой ведущим путем передачи является воздушно-капельный. В первую неделю заболевания вирус может поселиться в окологлоточных лимфатических узлах и со слизью зева при кашле, чихании может выделяться в окружающую среду, заражая окружающих
Возбудитель проникает через рот часто через грязные руки, посуду, воду. В определенном числе случае вирус проникает через кишечный барьер, попадает в кровь, возникает виремия. В ряде случаев вирус проникает через гематоэнцефалический барьер и попадает в спинной мозг, вызывая повреждение двигательной иннервации. Возбудитель полиомиелита может вызывать следующие заболевания:
Бессимптомные формы (инапарантная форма), когда вирус находится в кишечнике, не проникая в кровь;
Абортивная форма (малая болезнь). Вирус проникает в кровь, но через гематоэнцефалический барьер проникнуть не может. Клинически такая болезнь проявляется ангиной, катаром верхних дыхательных путей;
У небольшого числа детей вирус проникает через гематоэнцефалический барьер и вызывает поражение двигательных нейронов передних рогов спинного мозга так называемая паралитическая форма. Летальность при паралитической форме 10% и у более половины детей возникают стойкие параличи.
Иммунитет при полиомиелите пожизненный, типоспецифический. Механизм иммунитета определяется 2-мя основными моментами:
1. Гуморальный общий иммунитет, обеспечивается циркулирующими в крови иммуноглобулинами класса М и G2;
2. Местный иммунитет возникает в ткани кишечника и носоглотки, глотки, обеспечивая устойчивость этих тканей наличием секреторных иммуноглобулинов класса А.
Инфекции, вызываемые энтеровирусами вида Коксаки А, В и ECHO-вирусами не столь опасны, однако тоже могут привести к очень неприятным заболеваниям, среди которых можно выделить серозный асептический менингит, энцефалит и менингоэнцефалит, болезнь Борнхольма (плевродиния), миокардит, геморрагический конъюнктивит, а также ОРЗ и энтеровирусную диарею Черкасский Б.Л. Инфекционные и паразитарные болезни человека. - М.: Медицинская газета, 1994. - С.272-276. .
В настоящее время энтеровирусы Коксаки и ЕСНО считаются основной причиной острых лихорадочных заболеваний у детей раннего возраста. Имеются данные, что около 60% грудных детей, госпитализированных с подозрением на сепсис, оказались инфицированными энтеровирусами.
Деление вирусов Коксаки на 2 подгруппы (А и В) связано с их способностью по - разному поражать ткани новорожденных мышей.
Вирусы Коксаки подгруппы А вызывают вялые параличи, а подгруппы В - спастические параличи. Заболевания, которые вызывают вирусы Коксаки: асептический менингит, ангина, лихорадочные заболевания с сыпью.
Вирусы Коксаки чаще всего вызывают энцефаломиокардит новорожденных.
Вирусы ЕСНО ( Е- enteric , C - cytopatogenetic, O - orpham, H - human). В процессе изучение энтеровирусов были обнаружены вирусы, которые не могли быть отнесены к энтеровирусам, так как они во-первых не реагировали с полиомиелитной поливалентной сывороткой, во-вторых они не были способны вызывать заболевания у мышей-сосунков, поэтому они не могли быть отнесены к вирусам Коксаки. Сначала их назвали orphans- сиротки. Затем ЕСНО. Вирусы ЕСНО вызывают асептический менингит, гастроэнтерит у детей, лихорадочные заболевания с летней сезонностью.
Энтеровирусы достаточно широко распространены в природе и избежать столкновения с ними практически невозможно. При этом совсем не обязательно, что все люди, в организм которых проникли вирусы этого типа заболевают. Скорее наоборот - они могут стать вирусоносителями, сами не испытывая каких либо признаков болезни, либо перенеся ее быстро и в легкой форме. Энтеровирусы, которые инфицируют человека не встречаются у животных и наоборот, энтеровирусы домашних или диких животных не передаются человеку Ворошилова М.К. Актуальные вопросы вирусологии. - М.: Медицина, 1965. - С.229..
Поэтому заражение энтеровирусами возможно либо опосредованно - фекально-оральным путем (то есть через загрязненные продукты питания и воду), либо бытовым путем при непосредственном контакте с вируносителем или через обсемененные предметы домашнего обихода. Достаточно важным является и воздушно-капельный механизм передачи энтеровирусов (ведь они являются довольно близкими родственниками вирусов-возбудителей простуды).
К счастью, большинство энтеровирусных инфекций протекает достаточно легко и не приводит к серьезным последствиям (не более, чем обычная простуда). Более того, не всякий случай заражения приводит к заболеванию. Так, даже если говорить о самой серьезной энтеровирусной инфекции - полиомиелите, то у инфицированных детей одно выраженное заболевание приходится на несколько сот (до тысячи) случаев бессимптомного носительства.
Энтеровирусные инфекции случаются в течение всего года, но имеют пик заболеваемости в период с июня по октябрь (для стран с умеренным климатом). По данным FDA - Управления по Пищевым Продуктам и Лекарствам США - энтеровирусы (в частности вирус Коксаки) вызывает в США до 20 миллионов заболеваний ежегодно.
Метод борьбы с этими вирусами по сути дела один - соблюдение гигиены. В случае полиомиелита - это еще и вакцинация детей. Мировым сообществом полиомиелит назван второй болезнью (после оспы), которой объявлена беспощадная война до полного ее уничтожения на всей Земле Пяткин К.Д., Кривошеий Ю.С. Микробиология: Учебник для мед. институтов. - М: Медицина, 1981.- С.285. .
2. Принципы лабораторной диагностики энтеровирусов
Лабораторную диагностику нужно вести одновременно на все вирусы, так как они вызывают однотипные заболевания Тимаков В.Д., Левашев В. Борисов Л.Б. Микробиология: Учебник для мед. институтов. - М: Медицина, 1983. - С.281..
Вирусологический метод: заражают хлопковых мышей (на вирус Коксаки) выращивают вирус на культуре ткани, заражают новорожденных мышей, и если они погибают, то ищут вирус. На культуре ткани определяют присутствие вируса по наличию цитопатического действия, цветной пробе Солка. Идентификация вируса осуществляется в иммунологических реакциях, построенных по принципу антиген-антитело: в реакции нейтрализации. Положительный результат реакции нейтрализации будет определяться по отсутствию феноменов цитопатического действия, цветной пробы и т.д.
Серологический метод. Определяют нарастание титра антител в парных сыворотках. Берется известный антиген, известный вирус соединяются с сывороткой больного и ищем будут ли нейтрализовать вирус и опять исчезнут все феномены его присутствия в культуре ткани или не лабораторном животном.
Диагноз также ставится на основе классической картины полиомиелита, путем выделения вируса из фекалий, а также четырехкратным нарастанием титра антител в реакции нейтрализации.
3. Препараты для специфической профилактики полиомиелита
Специфического лечения полиомиелита нет. Нет и химиопрепаратов, антибиотиков которые могут помочь при паралитической форме. Возможны симптоматические, общеукрепляющие мероприятия Пяткин К.Д. Микробиология. - М.: Медицина, 1971. - С.127..
Существуют 2 вакцины:
Вакцина Солка разработанная в 1956 году и названная инактивированная полиомиелитная вакцина (ИПВ). Это убитая вакцина, она дает общий гуморальный иммунитет, но не защищает кишечник. Человек, который привит этой вакциной не заболеет сам, но если у этого ребенка в кишечнике поселится вирус, он может стать переносчиком вируса и заражать других.
В 1961 году был разработана ОПВ - ослабленная полиомиелитная вакцина. Эта вакцина является более надежной, так как она обеспечивает и местный и общий иммунитет. Содержит вирусы, которые живут в кишечнике, не давая вирулентным вирусам полиомиелита в нем заселяться. Недостатком этой вакцины является то, что при вакцинировании бывают осложнения. В первом случае на 1-10 млн. сам вакцинный штамм вызывает полиомиелит у очень ослабленных детей с нарушением гематоэнцефалического барьера.
Можно сказать, что с помощью этих 2-х вакцин проблема полиомиелита решена и дело только в проведении достаточных организационных мероприятий.
Профилактика инфекций состоит в изоляции больных в среднем на 14 дней (по С.Д. Носову 7-8 дней), уборке помещений с использованием дезинфицирующих средств, проветривании помещений.
Работники родильных домов и детских учреждений, имевшие контакт с больным энтеровирусной инфекцией, переводятся на 14 дней на другую работу. Детям, контактировавшим с больным, рекомендуется введение человеческого иммуноглобулина из расчета 0,3-0,5 мл/кг Генкель П.А. Микробиология с основами вирусологии. - М.: Просвещение, 1974. - С.93..
Род энтеровирусов относится к семейству пикорнавирусов. К семейству пикорнавирусов относятся, как явствует из названия маленькие РНК-содержащие вирусы. Семейство включает в себя 4 рода, из которых особо важен род энтеровирусов. Основное место обитания энтеровирусов в природе - это организм человека, а точнее кишечник, отсюда название. Кишечник является единственным резервуаром многих энтеровирусов, откуда вирусы попадают в кровь, во внутренние органы, ЦНС.
В род энтеровирусов входят:
возбудители полиомиелита, их 3 серологических типа, то есть 3 антигенных разновидностей, на которые нет перекрестного иммунитета;
Вирусы Коксаки делят на подгруппы А и В, в подгруппу А входят 23 серотипа, в подгруппу В - 6 серотипов;
Вирусы ЕСНО. Известно 32 серотипа этих вирусов;
Вирусы гепатита А.
Энтеровирусы характеризуются следующими показателями:
1. Это РНКовые вирусы;
2. Имеют малые размеры 20-30 нм;
3. Небольшое число капсомеров, не окруженных какой-либо оболочкой;
4. Тип симметрии капсида - кубический;
6. Устойчивы к эфиру, к кислой среде, благодаря чему вирусы проходят через желудок, устойчивы к желчи, пищеварительным сокам.
Основные эпидемиологические характеристики энтеровирусов:
Естественная локализация - кишечник человека;
Основной путь распространения - фекально-оральный;
Широкое распространение в природе;
Преимущественная циркуляция в летне-осенний период времени;
Широкое вирусоносительство у практически здоровых людей;
Заболевание чаще встречается в детском возрасте, болеют чаще всего дети 6-12 лет, еще чаще дети первых 5 лет жизни.
Список использованной литературы
1. Ворошилова М.К. Актуальные вопросы вирусологии. - М.: Медицина, 1965. - 288 с.
2. Генкель П.А. Микробиология с основами вирусологии. - М.: Просвещение, 1974. -259 с.
3. Германов Н.И. Микробиология. - М.: Просвещение, 1967. -381с.
4. Грачёв В.П. Полиомиелит. В кн. Эволюция инфекционных болезней в России в ХХ веке. - М.: Медицина, 2003. - 118 с.
5. Григорьева Л.В. Энтеровирусы во внешней среде. - М.: Медицина, 1968. - 318 с.
6. Пяткин К.Д. Микробиология. - М.: Медицина, 1971. - 352 с.
7. Пяткин К.Д., Кривошеий Ю.С. Микробиология: Учебник для мед. институтов. - М: Медицина, 1981.- 512 с.
8. Тимаков В.Д., Левашев В. Борисов Л.Б. Микробиология: Учебник для мед. институтов. - М: Медицина, 1983. - 512 с.
9. Черкасский Б.Л. Инфекционные и паразитарные болезни человека. - М.: Медицинская газета, 1994. - 442 с.
Латенция и вирогения как типы взаимодействия вируса с клеткой. Процесс адсорбции вируса и его проникновения в клетку, синтез вирусных белков. Этапы созревания дочерних вирусных частиц, способы их выхода из клетки, общие принципы сборки вирионов.
реферат [18,6 K], добавлен 29.09.2009
Характеристика бактерий группы риккетсий. Описание свойств возбудителей ку–лихорадки, эпидемического и эндемического сыпного тифа. Эпидемиология данных заболеваний. Особенности лабораторной диагностики риккетсий провацека; основные методы исследования.
презентация [397,3 K], добавлен 20.09.2015
Общая характеристика инвазионных заболеваний животных. Изучение путей проникновения в организм возбудителей и особенностей протекания бабезиоза собак. Инкубационный период при заражении. Описание клинических признаков токсоплазмоза у собак и кошек.
реферат [24,4 K], добавлен 07.12.2015
Организация лабораторной микробиологической службы. Принципы микробиологической диагностики инфекционных заболеваний. Методы выделения и идентификации бактерий, вирусов, грибковых инфекций, простейших.
реферат [3,8 M], добавлен 05.05.2006
Отрицательная роль вирусов в жизни человека как возбудителей ряда опасных заболеваний: оспы, гепатита, энцефалита, краснухи, кори, бешенства, гриппа. "Индикаторы жизни": происхождение и природа вирусов, их строение. Взаимодействие вируса с клеткой.
реферат [164,7 K], добавлен 01.04.2009
Особенности поведения и опасность клещей. Правила поведения в случае обнаружения укуса клеща, первая помощь, последствия, способы защиты от нападения. Что такое клещевой энцефалит, формы протекания заболевания, типы вируса, профилактика энцефалита.
реферат [710,7 K], добавлен 20.04.2010
История змеиных ядов как целительного средства. Основные виды ядовитых змей, яды которых используются в медицине, и получение яда. Свойства ядов змей, их состав и классификация. Действие яда змеи на организм человека. Важнейшие препараты ядов змей.
курсовая работа [47,9 K], добавлен 14.05.2012
Исследование понятия и основных особенностей ДНК-геномных вирусов. Изучение жизненного цикла вируса. Характеристика вируса папилломы человека. Описание болезней, вызываемых вирусом папилломы человека. Лабораторная диагностика папилломавирусной инфекции.
реферат [94,2 K], добавлен 17.03.2014
Анализ патогенных бактерий, пути их попадания в организм. Роль бактериофагов в борьбе с ними. Классификация поражений по месту локализации. Болезни, вызываемые патогенными микроорганизмами, передаваемыми через молоко. Бактерии–возбудители болезней.
презентация [1,8 M], добавлен 20.11.2014
Понятие и общее описание механизма рекомбинации генов, классификация и типы форм его реализации: общей и сайт-специфической. Особенности взаимодействий, обусловленных спариванием оснований между комплементарными цепями гомологичных спиралей ДНК.
курсовая работа [37,4 K], добавлен 18.10.2013
По-видимому, есть вирусы, которые паразитируют на человеке, размножаясь ограниченно в группах клеток и не причиняя видимого вреда своему хозяину. Однако при определенных условиях они могут мутировать с образованием более патогенных вариантов. В этом случае возникает острая вирусная инфекция, которая заканчивается, когда в организме сформируется специфический иммунитет к патогену.
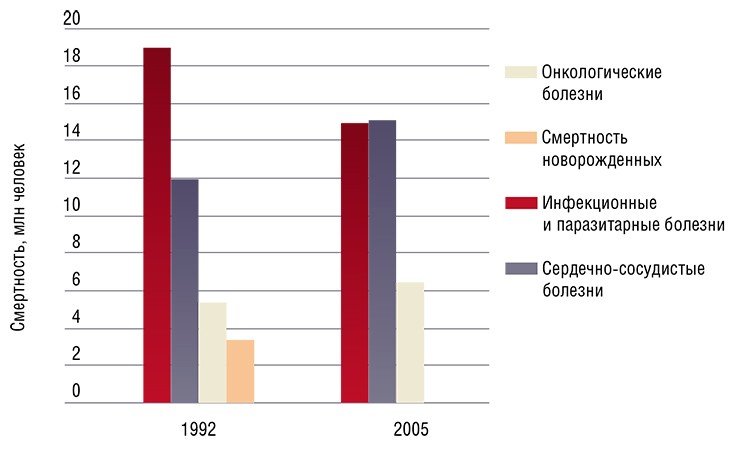
Но несмотря на относительно слабую изученность вирусного сообщества человека, практически сразу после открытия вирусов был обнаружен удивительный факт: у онкобольных вирусная инфекция может повлиять на протекание злокачественного процесса. Были зафиксированы случаи улучшения состояния таких пациентов и даже наступление длительной ремиссии после перенесенного вирусного заболевания либо вакцинации.
На основе этой информации еще в начале XX в. родилась идея использовать вирусы в борьбе с раковыми заболеваниями человека.
Взлеты и падения
Возможность создания принципиально новой формы терапии онкологических заболеваний, основанной на присущей вирусам способности убивать клетки, в которых он размножается, была впервые показана в середине прошлого века на примере рака шейки матки (Newman, 1954).
В результате удалось выделить и типировать ряд непатогенных для людей энтеровирусов, на основе которых были созданы живые энтеровирусные вакцины для профилактики сезонных вирусных заболеваний. При этом в ряде случаев удалось наблюдать положительный клинический эффект и в отношении злокачественных заболеваний, вплоть до полного исчезновения первичной опухоли и метастазов.

В ходе дальнейших исследований вакцинотерапию получили более полутора тысяч больных на поздних стадиях опухолевого процесса, и у части из них было отмечено улучшение состояния (Ворошилова, Ваганова, 1969; Ворошилова и др., 1977; Ворошилова, 1988).
Но уже в начале 1990-х гг. онколитические вирусы вновь стали объектом пристального внимания исследователей после публикации работы, посвященной лечению глиобластомы модифицированным вирусом простого герпеса (Martuza, 1991).
За последующие десятилетия благодаря выдающимся достижениям в молекулярной биологии и генетике и стремительному развитию биотехнологических методов исследования удалось проделать огромную экспериментальную работу по описанию специфических взаимодействий онколитических вирусов с раковымм клетками и выявить перспективные для терапии вирусные штаммы и типы опухолей, которые они могут поражать.
Почему же вирусы – и не какая-нибудь специфическая группа, а все в целом – поражают в первую очередь именно опухолевую ткань? Причин этому несколько.
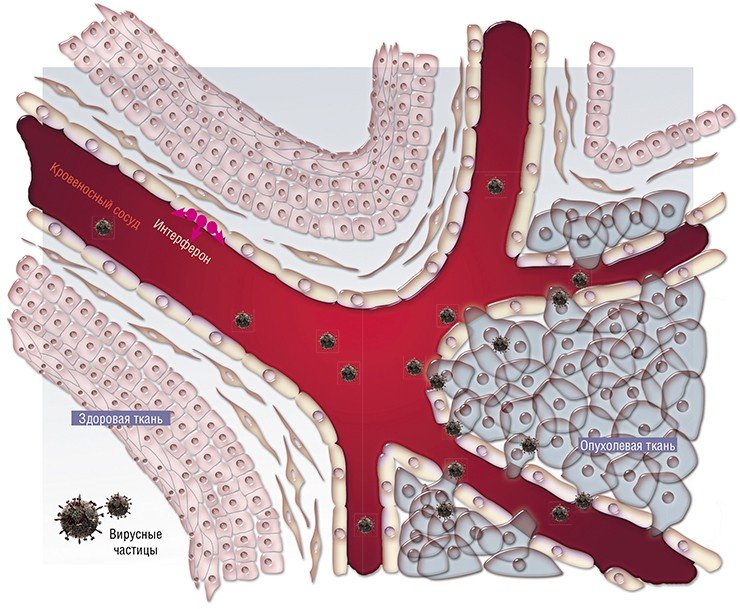
Таким образом, первая причина высокой чувствительности раковых клеток к вирусам – их физическая доступность.
Вторая причина связана со способами размножения самих инфекционных агентов. Дело в том, что вирусы в этом смысле не самодостаточны и используют для размножения ресурсы зараженной клетки. Обычно это происходит тогда, когда клетка сама находится в процессе деления и в ней присутствуют все ферменты, необходимые для репликации генетического материала и синтеза белков.
Некоторые вирусы имеют специальные механизмы, которые позволяют перевести клетку из покоящегося состояния в делящееся (к ним относятся и так называемые онкогенные вирусы, например, вирус папилломы, который вызывает рак шейки матки именно за счет стимуляции клеточного деления). Однако очень многие вирусы могут размножаться только в уже активно делящихся клетках, например, клетках слизистой (которая, как известно, в первую очередь поражается при сезонных вирусных инфекциях). И в этом смысле раковые клетки, главное занятие которых – деление, особенно беззащитны перед вирусной интервенцией.
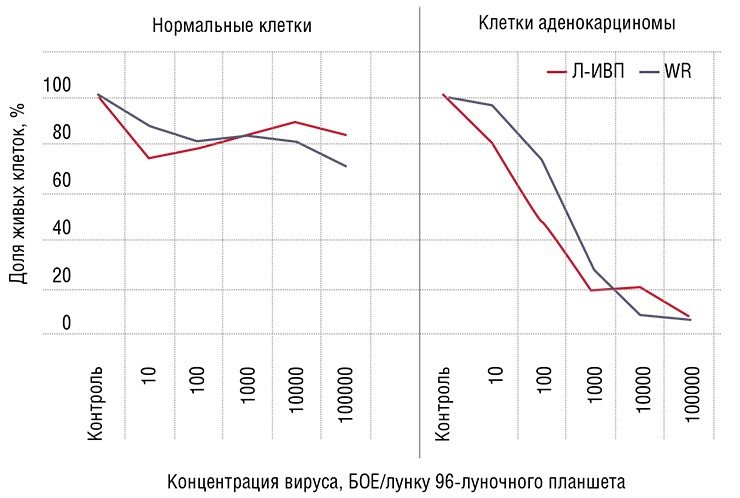
Здоровые – в безопасности
Таким образом, раковые клетки по милости самой природы служат готовой мишенью для вирусов. С использованием современных биотехнологий сегодня можно создавать вирусные препараты, которые будут специфически поражать и уничтожать только раковые клетки, не затрагивая здоровые.
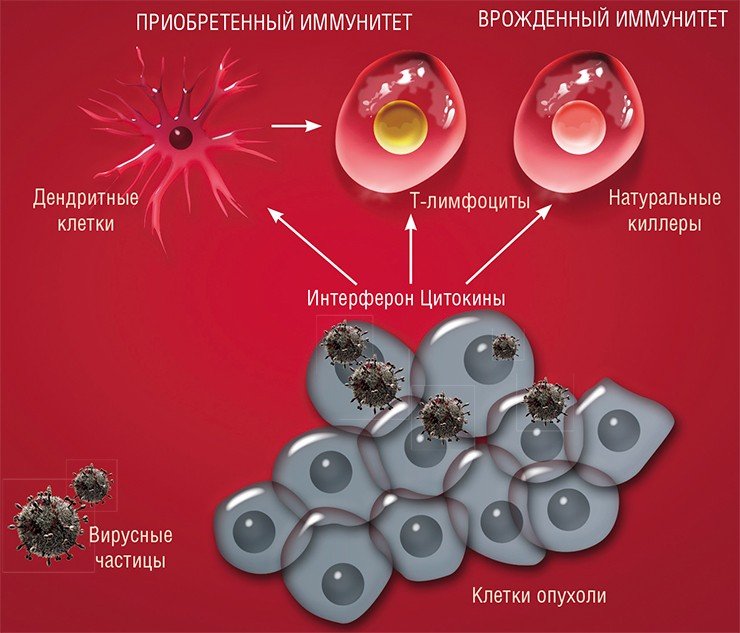
Поэтому мишенью вируса должны стать хаотичные скопища активно делящихся клеток. При этом в первую очередь будут поражаться наименее дифференцированные, наиболее злокачественные клетки. Здоровые же дифференцированные клетки будут защищены от проникновения такого дефектного вируса механизмами противовирусной защиты.
Персональный подход
Для решения этой задачи, в частности, проводится селекция вирусов на их способность размножаться в различных культурах раковых клеток. На основе анализа генетической структуры таких вирусов можно определить, какие из приобретенных вирусом мутаций делают его наиболее действенным в отношении определенного типа опухолевых клеток.
Имея панель таких онколитических вирусов, можно будет, взяв биопсию опухоли от конкретного пациента, подобрать для него наиболее эффективный набор вирусных штаммов. Причем эту процедуру можно повторять по мере лечения, поскольку сама опухоль может меняться, ускользая от действия онковируса. В таком случае сможет помочь уже другой вариант вируса, а так как он будет отличаться по антигенной структуре от предыдущего, то не уничтожится под действием механизмов противовирусного иммунитета, сформировавшегося в ходе предыдущего лечения.
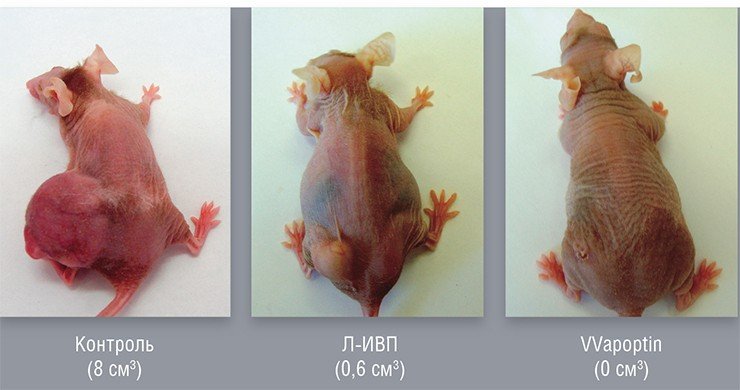
Онколитические вирусы можно дополнительно вооружить и генами, продуцирующими в раковой клетке белки, опасные лишь для этих клеток. Например, белок апоптин, выделенный из вируса птичьей анемии, по еще не совсем понятному механизму вызывает самоубийство исключительно только раковых клеток. На основе вируса осповакцины генно-инженерным способом уже создан такой штамм, способный эффективно уничтожать клетки опухоли человека, подсаженные лабораторным мышам.
Еще одна проблема терапии с помощью онколитических вирусов связана с разработкой наиболее эффективных способов их введения в организм. Ведь на пути вируса в организме встает много барьеров. К примеру, та же печень, являющаяся своего рода мощнейшим антивирусным фильтром.
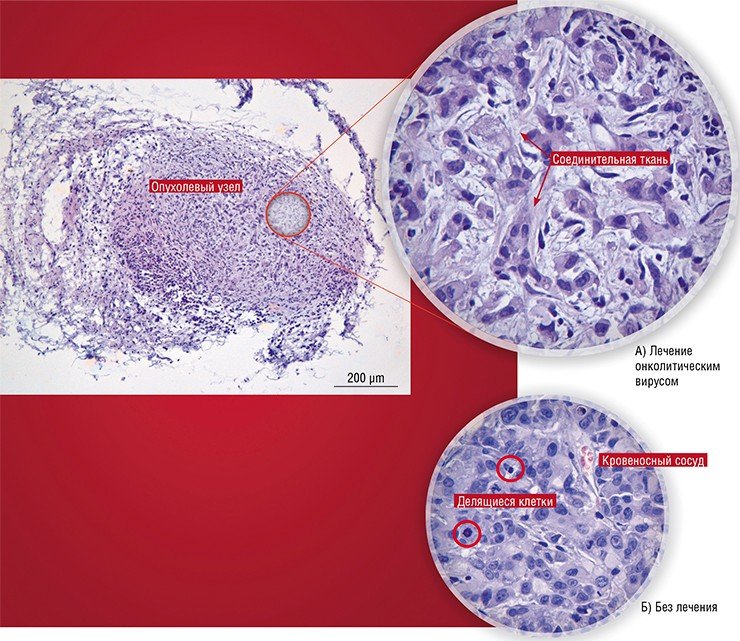
За и против
В настоящее время, несмотря на все успехи в изучении онколитических свойств вирусов, их применение в онкотерапии является, скорее, исключением, чем правилом.
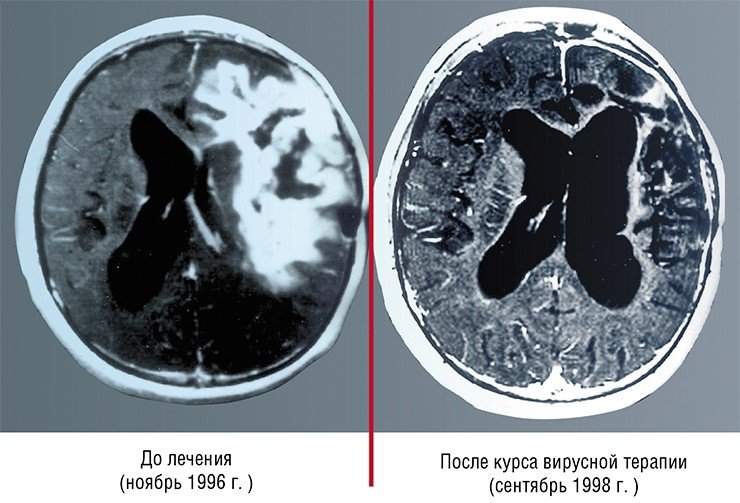
Так, разработанный в США препарат сегодня применяется с согласия пациента при лечении глиобластомы в качестве дополнительной терапии. В Китае лицензирован и успешно применяется для терапии карцином один из штаммов аденовируса, несущий две генетические делеции (Yu, 2007).
В Латвии после распада СССР были продолжены работы по изучению онколитических вирусов, начатые в рамках противополиомиелитных исследований. В результате на основе одного из энтеровирусов был создан и сегодня используется на практике препарат Ригвир, направленный против меланом, который можно вводить непосредственно в кровяное русло.
Всего же сегодня в мире проходят клинические испытания свыше тридцати разнообразных онколитических вирусных препаратов. И основная проблема здесь не столько научная, сколько экономическая. Дело в том, что терапия рака (в первую очередь химиотерапия) – это большие деньги. В условиях сложившегося и процветающего рынка химиотерапевтических препаратов применение новых, пусть даже и более безопасных биотерапевтических средств потребует весьма дорогостоящей перестройки всей системы лечения. А это не может не затронуть интересы крупных фармацевтических компаний.
Стратегия таких компаний в отношении нарождающихся разработок в области онколитических вирусов неоднозначна. Так, права на один из первых онколитических препаратов ONYX-015 вместе с самой компанией-разработчиком были приобретены одной известной фармацевтической фирмой, после чего исследования по этой теме были закрыты. С другой стороны, по¬скольку полностью остановить прогресс в этой области невозможно, уже сегодня во многих фармацевтических компаниях создаются подразделения, занимающиеся изучением вирусных онколитиков. Оптимизма добавляет и тот факт, что за последние пятнадцать лет число работ по этой тематике растет как снежный ком.
Одновременно с прогрессом в создании вирусных противораковых средств в обществе, как и в случае пресловутых генетически модифицированных организмов (ГМО), возникают разнообразные фобии и слухи. Они во многом базируются на недостаточной осведомленности широкой общественности в сути дела и раздуваются благодаря действиям некоторых заинтересованных компаний.
Действительно, вопрос о безвредности тех или иных вирусов пока изучен не до конца. Поэтому приходится мириться с тем, что на пути к широкому внедрению этих очень перспективных методов лечения рака будут вставать многие преграды. В любом случае, исследователи должны действовать очень обдуманно, осторожно взвешивая все возможные последствия.
Но, как учит история науки, подобные проблемы всегда вставали на пути любого нового перспективного метода лечения и, как правило, успешно преодолевались.
Сейчас крепнет уверенность, что знания, накапливающиеся в области вирусологии, иммунологии, биологии клетки и других смежных дисциплин, позволят (и уже позволяют!) создавать такие варианты вирусов, которые будут не только эффективно и избирательно уничтожать раковые клетки, не затрагивая нормальные, но еще и стимулировать в организме естественные механизмы противоопухолевой защиты.
В будущем основой для терапии рака могут стать искусственные вирусы. Уже сейчас дальней целью разработок московских и новосибирских специалистов является создание модульной вирусной системы (в будущем – полностью синтетической) – своего рода молекулярного конструктора, из которого исследователь по желанию сможет собрать из отдельных генетических компонентов нужный вариант онколитического вируса.
Такие синтетические вирусы не должны структурно напоминать природные. Это важно потому, что схожие вирусы способны рекомбинировать друг с другом, обмениваясь участками своего генома, благодаря чему терапевтический вирус может приобрести неполезные гены и, соответственно, нежелательные, опасные свойства. Можно разработать такой синтетический вирус, который по функциям и общему плану строения будет похож на природный, но по нуклеотидной последовательности будет настолько от него отличаться, что утратит способность к рекомбинации со своими природными собратьями.
Ворошилова М. К. Полезные для организма непатогенные штаммы энтеровирусов: профилактическое и лечебное их применение. М.,1988. С. 24–29.
Качко А. В. и др. Рекомбинантная плазмидная ДНК pAd5 f, несущая фрагмент генома аденовируса 5 типа с делецией в гене Е 1 В 55 К, и штамм мутантного аденовируса Adel2, обладающий селективной противоопухолевой активностью. Патент РФ № 2194755 (467) 05.03.01.
Качко А. В. и др. Варианты аденовируса типа 5 с делениями в ранних генах: способность к селективной репликации в р53 дефектных опухолевых клетках человека // Молекулярная биология. 2003. № 37 (5). С. 868–875.
Martuza R. L.et al. Experimental therapy of human glioma by means of a genetically engineered virus mutant//Science. 1991. V. 252. P. 854–856.
Первый за Уралом
Победители первого конкурса научных мегагрантов Правительства РФ, направленных на поддержку исследований под руководством ведущих ученых в российских вузах, были названы в октябре 2010 г. Всего на конкурс подавалось 507 заявок, которые были рассмотрены международными экспертами и утверждены Советом по грантам. Победители, среди которых оказался и Новосибирский национальный исследовательский государственный университет, получили финансирование в размере 150 млн рублей
Новосибирский национальный исследовательский государственный университет (НГУ) получил в 2010 г. три мегагранта правительства РФ, один из которых под руководством д.б.н., профессора П. М. Чумакова, предназначался для создания университетской лаборатории по исследованию онколитических вирусов.

В 2010—2012 гг. за счет средств мегагранта и софинансирования в НГУ реконструированы помещения для проведения практических занятий по микробиологии и частично – по аналитической химии. На этой базе был создан исследовательский комплекс из лаборатории микробиологии и вирусологии (руководитель П. М. Чумаков) и лаборатории бионанотехнологий (руководитель – проректор по научной работе НГУ, д.б.н., профессор С. В. Нетесов).
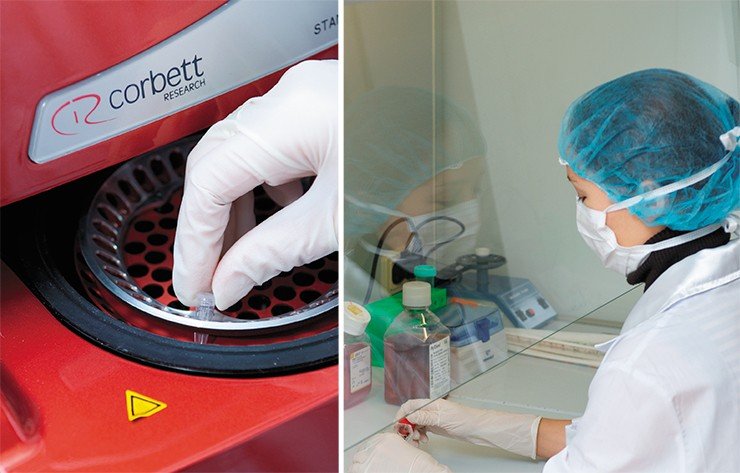
В вирусологическом боксе, оснащенном всем необходимым современным оборудованием для высокопроизводительной работы с непатогенными вирусами и их геномами, могут одновременно проводить исследования три сотрудника. Весной 2013 г. заканчивается реконструкция помещений для генно-инженерных работ, секвенирования геномов, а также биоинформационных и биотехнологических исследований.

В штат лабораторий вошли на долговременной основе несколько специалистов – докторов и кандидатов наук, а также аспиранты и студенты, ориентированные на научные исследования и разработки в самых современных областях микробиологии и молекулярной биологии. Во-первых, это изучение молекулярного разнообразия геномов вирусных возбудителей желудочно-кишечных и респираторных заболеваний человека и животных на территории азиатской части России. Во-вторых – создание онколитических рекомбинантных вирусов, а также бактерий, производящих рекомбинантные биологически активные белки человека, которые на сегодня признаются одними из самых перспективных противораковых препаратов.
Таким образом, принимая во внимание наличие в Научно-образовательном комплексе по наноматериалам и наносистемам НГУ нескольких суперсовременных электронных микроскопов, можно с утверждать, что в университете вступил в строй первый за Уралом современный лабораторный мини-комплекс по изучению микроорганизмов и разработке на их основе новых биомедицинских приложений.
Работы по этой тематике планируется проводить в сотрудничестве с передовыми биотехнологическими компаниями Новосибирской области и всего Сибирского федерального округа, а также, в случае взаимной заинтересованности, и с ведущими зарубежными предприятиями аналогичного профиля.
* Этот уровень биологической безопасности, по зарубежной классификации, используется для работы с возбудителями заболеваний человека, представляющими умеренную опасность для персонала и окружающей среды
Читайте также:


